CASO CLÍNICO
Se trata de un hombre de 54 años que presentaba como antecedentes personales asma bronquial extrínseco y estaba diagnosticado desde hacía 4 años por eco-transtorácico (ETT) de miocardiopatía hipertrófica no obstructiva, con insuficiencia mitral leve-moderada. Realizaba vida activa encontrándose en grado funcional I.
Acudió a Urgencias por presentar un cuadro de dolor precordial tras realizar un esfuerzo con aparición posterior de palpitaciones. En un primer electrocardiograma (ECG) se apreció una taquicardia regular con QRS ancho a 210 lpm, que no respondió al tratamiento con adenosina ni a maniobras vagales. Se procedió a realizar una cardioversión eléctrica con 100 J que derivó en fibrilación ventricular (FV) revertida con dos choques de 360 J. Se inició tratamiento con amiodarona intravenosa, pero fue preciso suspenderla poco después por la aparición de disfunción sinusal, con ritmo de la unión a 40 latidos/ minuto. Se le administró de forma empírica sulfato de magnesio y el paciente ingresó en la Unidad Coronaria.
En la exploración física destacaba una presión arterial sistémica de 130/70 mmHg. Se auscultaba un soplo sistólico, en ápex y borde esternal izquierdo, y no presentaba signos de congestión pulmonar. En el ECG se apreciaba disfunción sinusal, QRS ancho con morfología de bloqueo completo de rama izquierda e intervalo QT normal. En la analítica a las 30 horas de evolución de los síntomas destacaba una CPK total de 2.657 U/l y una troponina I de 2,21 ng/ml. Los iones séricos fueron normales.
En el ecocardiograma realizado al ingreso con un equipo portátil se apreció un ventrículo izquierdo (VI) muy dilatado y globalmente hipoquinético, con el miocardio muy hipertrófico, con trabeculaciones.
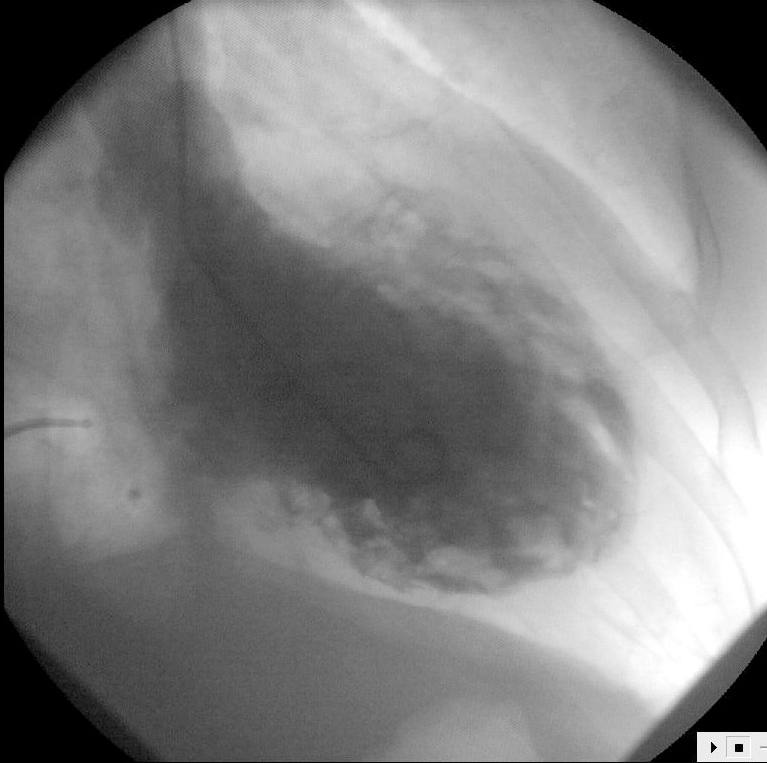
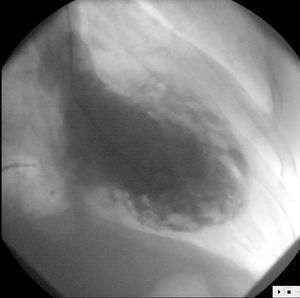
Como parte del protocolo de estudio de las taquicardias ventriculares (TV), con sospecha clínica de miocardiopatía dilatada, se le realizó un estudio hemodinámico. La ventriculografía izquierda mostró un ventrículo con fracción de eyección (FE) del 20%, con defectos generalizados de la contractilidad y con una imagen de importante trabeculación que sugirió el diagnóstico de miocardiopatía no compactada (MNC) o miocardiopatía espongiforme (ME) (fig. 1). No se detectó insuficiencia mitral angiográficamente significativa. En el cateterismo derecho las presiones fueron: aurícula derecha (AD) 10 mmHg, ventrículo derecho (VD) 70/4 mmHg, arteria pulmonar (AP) 70/15 mmHg, enclavamiento capilar pulmonar (PECP) 15 mmHg. Índice cardíaco 2 litros/minuto/m2; presión telediastólica VI (PTDVI) 30 mmHg; gradiente mitral invertido (PTDVI > PECP). La coronariografía mostró unas arterias epicárdicas angiográficamente normales.
Figura 1. Ventriculografía izquierda (proyección oblicua anterior derecha) que muestra en diástole una cámara dilatada con un llamativo aspecto esponjoso del miocardio ventricular.
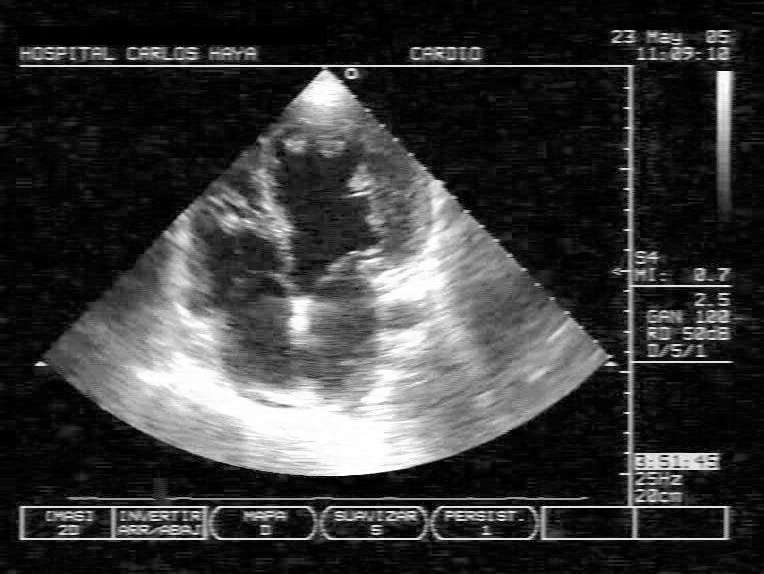
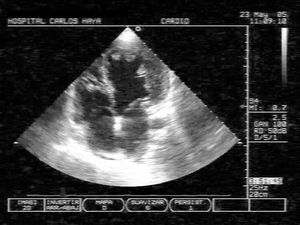
Con la sospecha diagnóstica de MNC al paciente se le realizó una segunda ecocardiografía por personal especializado. La ecocardiografía-2D confirmó la presencia de marcada trabeculación del VI, localizada en ápex y segmentos medios de la pared lateral e inferior, con una relación telesistólica de 2,5 entre la gruesa capa interna de miocardio no compactado (NC) y la fina capa externa de miocardio compactado (NC/C > 2) (fig. 2). Con doppler color se visualizó el flujo de sangre en comunicación entre los profundos recesos intertrabeculares y la cavidad ventricular. El flujo diastólico mitral mostró un patrón restrictivo. El VI tenía morfología esferoidal y medía en telediástole 70 mm, la aurícula izquierda 47 mm y el VD 30 mm. Un flujo de regurgitación mitral fue valorado como insuficiencia mitral moderada, y la presencia de insuficiencia tricuspídea permitió calcular un gradiente AD-VD de 55 mmHg, estimándose una presión de AP de 65 mmHg. No se detectaron anomalías valvulares estructurales. No se consideró necesario realizar una ecocardiografía con contraste dada la buena calidad de las imágenes de la bidimensional1.
Figura 2. Ecocardiograma transtorácico bidimensional en proyección apical de 4-cámaras, que muestra numerosas trabeculaciones prominentes y recesos intertrabeculares (miocardio no compactado) localizados en el ápex y pared lateral de un ventrículo izquierdo remodelado con morfología esferoidal. La relación entre la capa interna de miocardio no compactado y la capa externa de miocardio compactado es mayor de 2 en telesístole.
Con estos hallazgos ecocardiográficos se realizó el diagnóstico de MNC según los criterios de Jenni, por ausencia de compactación del miocardio ventricular izquierdo sin otras anomalías cardíacas asociadas2,3. Aunque hubiera sido interesante una cardiorresonancia, no se pudo realizar por no disponer de esta técnica en nuestro hospital4,5.
DISCUSIÓN
La MNC o miocardiopatía espongiforme es una enfermedad congénita, genéticamente heterogénea, incluida entre las miocardiopatías «no clasificadas» por la Organización Mundial de la Salud. Aunque es relativamente infrecuente, su diagnóstico se está incrementando en los últimos años coincidiendo con un mejor conocimiento de esta entidad. En niños es la tercera causa de miocardiopatía6.
Se cree que es el resultado de una detención intrauterina del proceso normal de compactación del miocardio, en ausencia de otras anomalías cardíacas. Durante este proceso, la red de fibras miocárdicas se condensa desde el epicardio al endocardio y de la base al ápex. Los profundos recesos intertrabeculares que comunican con el endocardio ventricular son convertidos en capilares3.
El primer caso fue descrito en 1984 como persistencia de sinusoides en el VI7. En 1990 Chin publicó la primera serie de 8 niños con MNC8 y en 1997 se publicó la primera serie en adultos, con 17 casos de MNC entre 37.555 estudios de ETT (prevalencia del 0,014%)9. Hasta el momento la serie más larga incluye 34 pacientes adultos10.
Han sido descritas formas esporádicas y familiares de MNC. Desde el punto de vista genético, en la mayoría de los casos de presentación neonatal existe relación con una mutación del gen G 4,5 codificado por taffazina (TAZ), localizado en el cromosoma Xq28. Este gen está implicado también en el síndrome de Barth y miopatías, y se asocia con frecuencia a dismorfia facial y al síndrome de Wolff-Parkinson-White (WPW)11. También se han visto asociado a mutaciones otros genes: α-dystrobrevin (DTNA), Cypher/ZASP y lamin A/C, y a deleción de 1q43-q4312. La MNC en adultos es una entidad genéticamente distinta, transmitida probablemente de forma autosómica dominante y sin manifestaciones extracardíacas. Se ha relacionado con el locus 11p1513. Recientemente se ha descrito una gran variabilidad fenotípica entre los casos de MNC de una misma familia y con un curso clínico relativamente benigno, incluso con ausencia de síntomas14.
A pesar de su presentación desde el nacimiento, sus manifestaciones suelen ser tardías y dependen de la progresión de la disfunción sistólica del VI que se ha relacionado con una alteración de la microcirculación coronaria15. En todos los casos hay afectación del VI. El VD está afectado en el 50% de los casos9,10. Suele haber también una disfunción ventricular diastólica. La tríada clínica típica es similar en niños y adultos e incluye síntomas de insuficiencia cardíaca, arritmias y fenómenos embólicos2, pudiendo presentarse como muerte súbita. La anomalía electrocardiográfica más frecuente en adultos es el bloqueo completo de rama. La principal diferencia con la población pediátrica es la ausencia de dismorfia facial y de síndrome de WPW10.
La ecocardiografía es actualmente la principal prueba diagnóstica. Para realizar el diagnóstico es preciso que se cumplan los 4 criterios ecocardiográficos de Jenni:
1. Ausencia de otras anomalías cardíacas.
2. Miocardio ventricular con una estructura de dos capas: una gruesa capa interna endocárdica no compactada (NC), con una malla de múltiples trabeculaciones y recesos intramiocárdicos, y otra fina externa, epicárdica, compactada (C), con una relación de espesor telesistólico mayor a dos (NC/C > 2).
3. La localización predominante de los segmentos no compactados en el ápex y la zona media ventricular de la pared lateral e inferior.
4. Evidencia con ecocardiografía-doppler color de flujo de sangre a través de los profundos recesos intertrabeculares (sin comunicación con la circulación coronaria)2,3.
La resonancia magnética cardíaca (RMC) está demostrando un valor potencial para el diagnóstico (aún no trasladable a la práctica clínica en la mayoría de los casos), sobre todo en los pacientes en los que no se consiguen imágenes ecocardiográficas de calidad4,5. En estos casos también puede ser útil la realización de una ecocardiografía con contraste1,16,17. Otras pruebas que pueden servir de ayuda en el diagnóstico son la ventriculografía y la tomografía axial computarizada (TAC)3.
El diagnóstico diferencial se debe realizar con la miocardiopatía hipertrófica, la miocardiopatía dilatada y con la hipertrabeculación del VI asociada a otras malformaciones cardíacas1,4,16,17,18. Dada la existencia de asociación familiar se debe realizar una ecocardiografía a los familiares de primer grado. También hay que considerar el estudio genético. El tratamiento es similar al de la insuficiencia cardíaca, haciendo especial hincapié en la necesidad de anticoagulación y en las medidas antiarrítmicas; se recomienda la implantación precoz de desfibriladores. En los pacientes sintomáticos hay que considerar su inclusión en lista de trasplantes3,19.
Aunque el pronóstico de los pacientes con MNC varía, en general es malo. Un 60% de los pacientes descritos en largas series fallecieron o se sometieron a trasplante cardíaco a los 6 años del diagnóstico9. Datos clínicos relacionados con una evolución desfavorable son: un mayor diámetro telediastólico VI, la clase funcional III-IV, la fibrilación auricular crónica y el bloqueo completo de rama. Recientemente, por los datos derivados del diagnóstico ecocardiográfico en familiares, se ha sugerido que el pronóstico puede ser más benigno14. La evolución clínica de nuestro paciente fue favorable, tratándose con inhibidores de la enzima de conversión de la angiotensina (ECA), carvedilol y anticoagulación. Se mantuvo estable hemodinámicamente y en ritmo sinusal y se le colocó un desfibrilador automático implantable. En los 6 meses siguientes a su implantación el paciente sufrió una desfibrilación. Un año después del diagnóstico de MNC el paciente se encontraba en grado funcional II, pero no había reanudado su actividad laboral. Se aconsejó el estudio familiar, y en sus dos hijos, de 12 y 14 años, la ecocardiografía descartó enfermedad cardíaca estructural. Un hermano gemelo no accedió a ser estudiado y otro hermano, con antecedente de accidente cerebrovascular isquémico, aún no había sido estudiado. El padre falleció joven de muerte súbita.
La miocardiopatía no compactada es una entidad a tener en cuenta en el diagnóstico diferencial de aquellos pacientes que ingresan en una Unidad de Cuidados Intensivos por insuficiencia cardíaca y/o taquiarritmias. Algunos, como en nuestro caso, pueden haber sido diagnosticados previamente de miocardiopatía hipertrófica o de miocardiopatía dilatada1,17.
Probablemente esta entidad, fácilmente diagnosticable por ecocardiografía, sigue siendo infradiagnosticada por ser aún poco conocida. Hay que considerarla siempre en el diagnóstico diferencial de la miocardiopatía hipertrófica o dilatada.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
Correspondencia: Dra. M.D. Fernández-Zamora.
Servicio de Medicina Intensiva.
Hospital Regional Carlos Haya.
Avda. Carlos Haya, s/n.
29010 Málaga.
Correo electrónico: lolaferza@yahoo.es
Manuscrito aceptado el 22-XI-2006.