El artículo destaca los avances en ecografía, especialmente en su aplicación clínica para pacientes críticos.
La inteligencia artificial (IA) juega un papel crucial al automatizar la interpretación de imágenes, mejorando la precisión y eficiencia. Se han desarrollado softwares que facilitan la realización de exámenes ecográficos precisos a pie de cama, incluso para personal sin experiencia previa, con la optimización de la imagen de manera automática. Además, existen aplicaciones que identifican estructuras cardíacas, planimetran la onda Doppler y miden el tamaño de vasos, que son especialmente útiles en la monitorización hemodinámica y en su registro continuo. Los parámetros «strain» y «strain rate» evalúan la función ventricular, mientras que el «auto strain» automatiza su cálculo desde imágenes a pie de cama. Estos avances, junto con la determinación automática del volumen ventricular, hace que la monitorización con ultrasonidos sea más precisa y rápida. El siguiente paso es la monitorización continua por dispositivos geles adheridos a la piel.
The present study highlights the advances in ultrasound, especially regarding its clinical applications to critically ill patients.
Artificial intelligence (AI) is crucial in automating image interpretation, improving accuracy and efficiency. Software has been developed to make it easier to perform accurate bedside ultrasound examinations, even by professionals lacking prior experience, with automatic image optimization. In addition, some applications identify cardiac structures, perform planimetry of the Doppler wave, and measure the size of vessels, which is especially useful in hemodynamic monitoring and continuous recording. The «strain» and «strain rate» parameters evaluate ventricular function, while «auto strain» automates its calculation from bedside images. These advances, and the automatic determination of ventricular volume, make ultrasound monitoring more precise and faster. The next step is continuous monitoring using gel devices attached to the skin.
En este artículo, examinaremos los avances más notables en ecocardiografía, centrándonos especialmente en sus aplicaciones clínicas. A menudo, vemos cómo las mejoras y los avances tecnológicos en ecografía y ultrasonidos, en general en el análisis de imágenes, no se traducen de manera efectiva en el cuidado de pacientes críticos. Por lo tanto, nos concentramos en aquellas evoluciones que realmente aporten un valor añadido en nuestro campo y a pie de cama, descartando aquellos avances que requieren un análisis off-line.
La ecocardiografía tiene limitaciones importantes que influyen en su uso y precisión, como la óptima adquisición de imágenes, la variabilidad entre diferentes operadores, su utilidad como herramienta de monitorización hemodinámica y la medición precisa de la estructura y función cardíaca1,2. Estos factores son cruciales para su aplicabilidad y fiabilidad en la práctica clínica, y será en ellos donde presentaremos los avances que más nos pueden ayudar3–5.
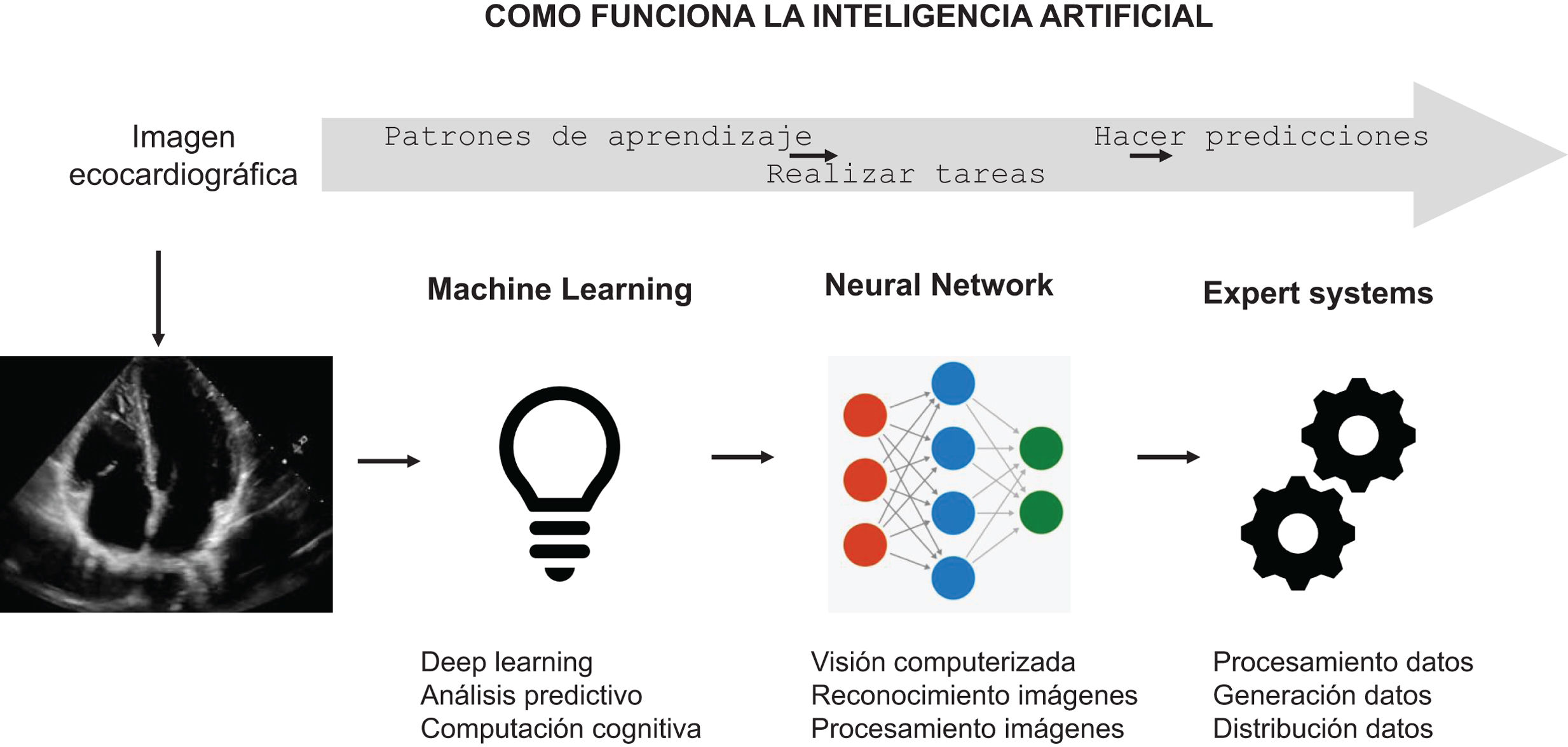
Es innegable que la inteligencia artificial (IA) aporta una ayuda fundamental6,7 (fig. 1). La automatización de las imágenes ahorra tiempo y recursos, pero los algoritmos de deep learning como redes convolucionales y transformers han demostrado un alto potencial para extraer las características más importantes de las imágenes y su interpretación8,9. El procesamiento de imágenes médicas incluye la limpieza del ruido de fondo, ajuste de brillo y contraste, homogenizando el tamaño y normalización de las intensidades de píxel. La interpretación, a través de la IA, es algo más complejo y requiere que se ajuste el objeto del problema, ya sea la clasificación de las imágenes, su segmentación o la detección de objetos de las mismas, para enfocarse en los aspectos relevantes y sujetos al análisis en sí mismo10,11 (tabla 1).
La inteligencia artificial (IA) puede utilizar imágenes/vídeos de ecocardiografía sin procesar para proporcionar automáticamente mediciones estructurales o funcionales, pero también para identificar estados patológicos. El procesamiento de imágenes surge de análisis profundos desde el píxel de una manera repetida. Esto también implica analizar y mejorar la calidad de la imagen para extraer información.
Aspectos técnicos del procesamiento de imágenes y aprendizaje automático por inteligencia artificial (IA)
| La adquisición de imágenes generadas en el estudio ecocardiográfico son digitales y se almacenan así para su análisis |
| El preprocesamiento se realiza para mejorar la calidad de las mismas; esto incluye la eliminación de ruido, corrección de la ganancia y la normalización de las imágenes para garantizar una calidad uniforme |
| La segmentación implica identificar y delinear las estructuras de interés en el corazón, como el endocardio de las cavidades cardíacas, las válvulas y las paredes del corazón |
| La extracción de características implica que una vez que las estructuras de interés están identificadas, la IA extrae características relevantes de las imágenes (incluye mediciones de dimensiones, velocidades del flujo sanguíneo y métricas) |
| El aprendizaje automático utiliza redes neuronales convolucionales (CNN) o algoritmos de clasificación, para analizar las características extraídas y tomar decisiones basadas en patrones conocidos previos |
| El diagnóstico y recomendaciones implica que, según el análisis de las imágenes ecocardiográficas, la IA proporciona diagnósticos preliminares, identifica anomalías, y mide parámetros cardíacos para generar recomendaciones en el tratamiento o el seguimiento |
| El entrenamiento continuo hace que la IA se beneficie del mismo con grandes conjuntos de datos de exámenes ecocardiográficos y retroalimentación de expertos médicos para mejorar su precisión con el tiempo |
Nos centraremos, no en el cómo sino en la evolución en sí misma, que ha revolucionado los ultrasonidos en el paciente crítico.
Adquisición y reconocimiento de la imagen cardíacaLa adquisición de una imagen ecocardiográfica óptima y reproducible en intensivos es un reto. No solo la colocación del paciente, sino una colaboración limitada, la interposición de apósitos quirúrgicos y la ventilación asistida hace que conseguir una ventana óptima en varios ciclos cardíacos, donde realizar medidas, sea en ocasiones una utopía, que limita la precisión y el diagnóstico.
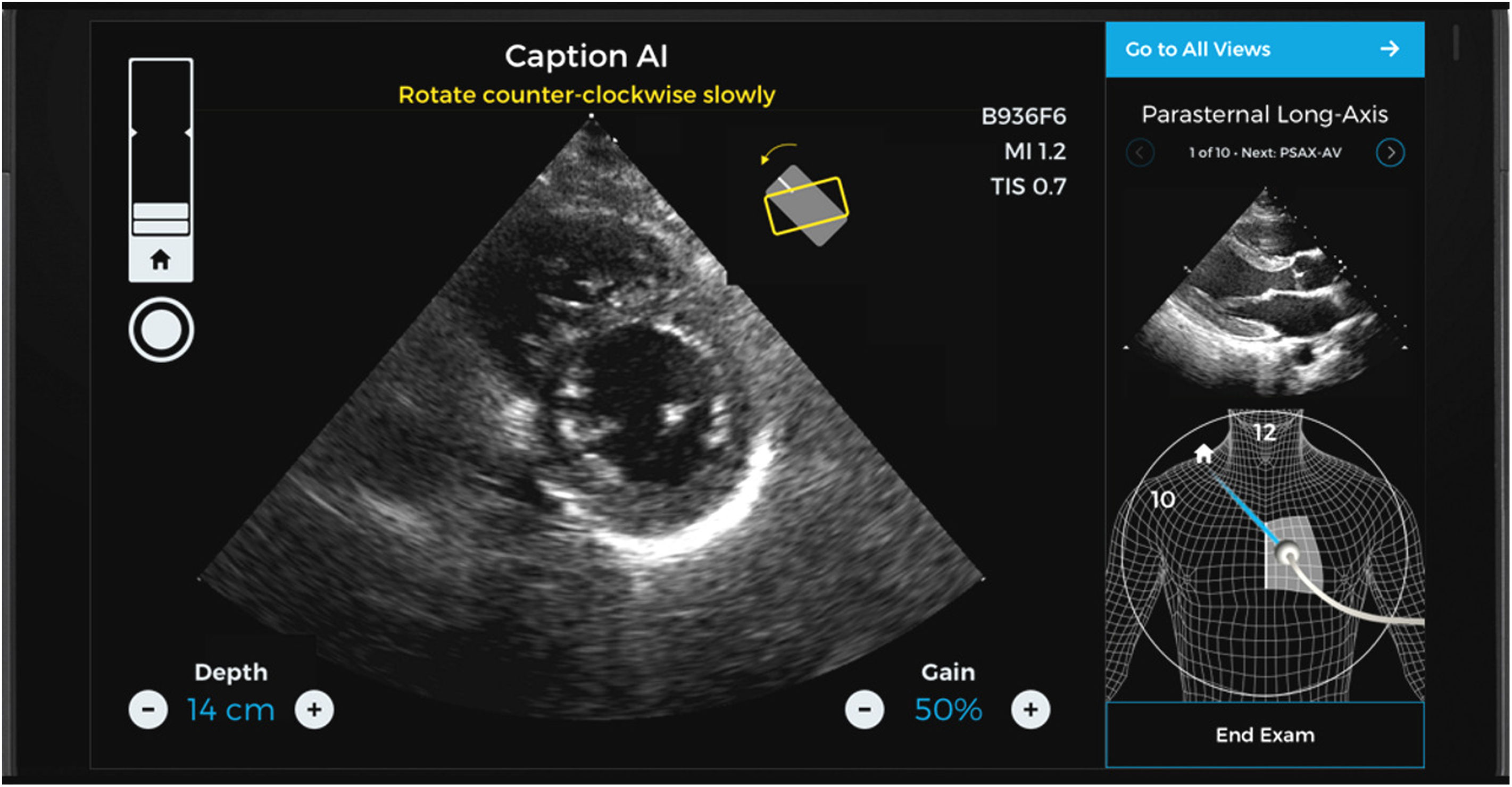
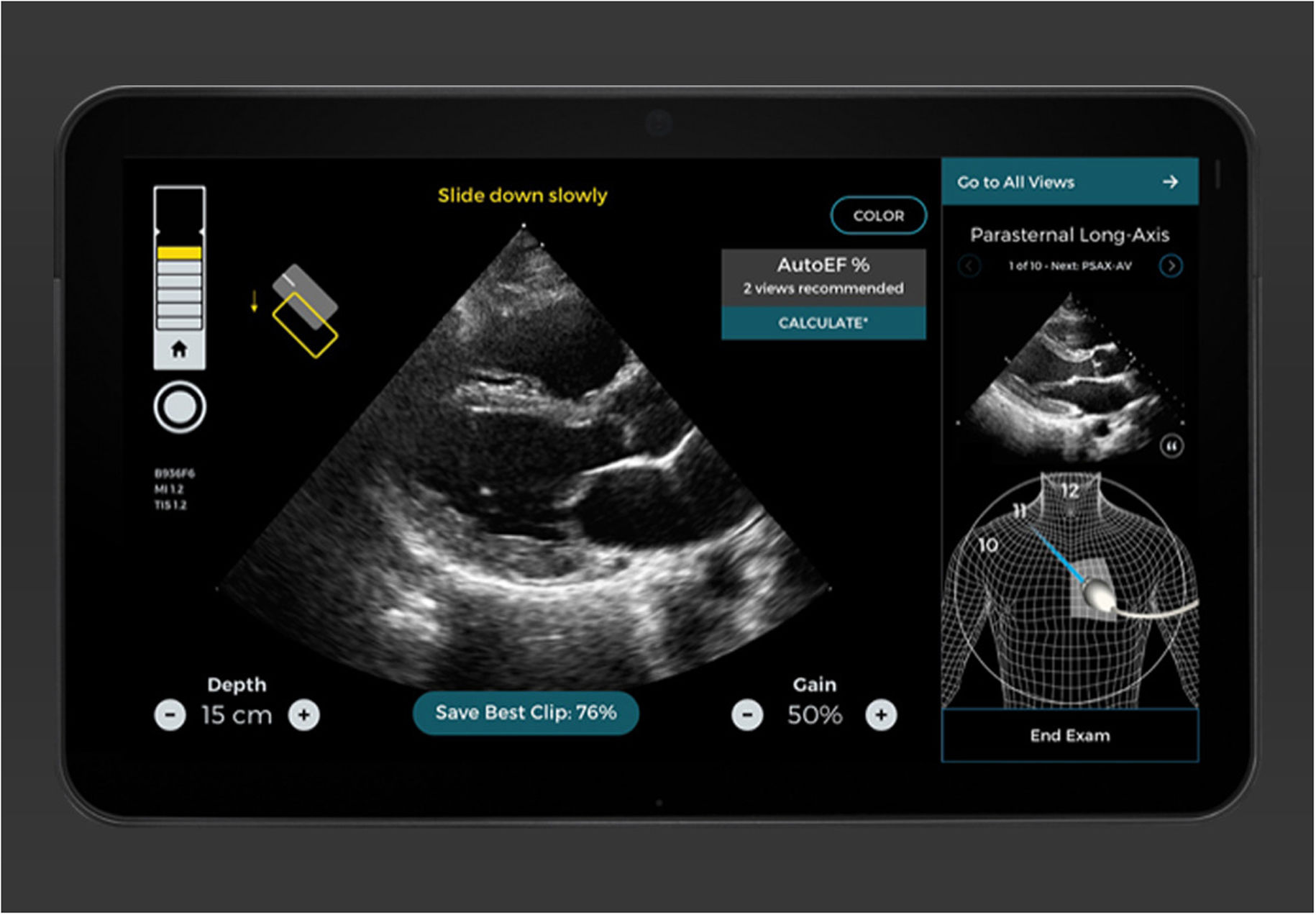
Caption AI© y Caption Guidance© son un nuevo software que permite a los intensivistas, incluso aquellos sin experiencia previa en ultrasonidos, la capacidad de realizar exámenes ecocardiográficos de manera rápida, precisa, y a pie de cama12–14. Esta nueva aplicación combina una información inmediata sobre la orientación e inclinación del transductor para optimizar la imagen y al mismo tiempo evalúa de manera automatizada la calidad de la misma, aumentando la capacidad de una interpretación inteligente (figs. 2 y 3)15,16.
Pantallas de 2 planos de un estudio realizado con la ayuda y guía de Caption AI© y Caption Guidance©. Se observa cómo hay diversos ítems de ayuda que hacen guiar el transductor hasta reconocer y conseguir un plano óptimo (que incluso clasifica su grado de optimización). De manera automática graba el mejor loop y proporciona las medidas que de él pueden obtenerse.
Caption AI© es el software que reconoce las estructuras a través de la inteligencia artificial y Caption Guidance© proporciona la orientación precisa del transductor a pie de cama durante el examen. Ambos softwares realizan una retroalimentación en tiempo real sobre la calidad de la imagen, para permitir una captura de gran calidad y de una manera automática17–19. Esta tecnología realiza un seguimiento continuo de las mejores imágenes vistas durante cada escaneo para que se capture automáticamente la imagen de mayor precisión de cada ventana, hay una revisión automática de los clips, los clasifica según la calidad de la imagen y selecciona los mejores para calcular parámetros básicos. El usuario tiene la libertad de explorar cada plano con la seguridad de que siempre podrá acceder al mejor clip de dos segundos de su examen con solo tocar un botón (vídeo 1, material adicional)20.
La fiabilidad ha sido aprobada por la FDA (Food and Drug Administration), y en los estudios antes referenciados, se analizaron más de 4.000.000 imágenes de exámenes de médicos sin experiencia, donde el cálculo de la fracción de eyección (FE) y su algoritmo se comprobó que era tan preciso y fiable incluso en pacientes obesos con función cardíaca afectada o normal.
Aplicación clínica en críticos:
- -
Optimización de imágenes ecográficas.
- -
Disminución de la variabilidad intra- e interoperador.
- -
Automatización del guardado de imágenes.
En el paciente crítico no sólo es importante la identificación y reconocimiento de imágenes. En estos pacientes donde se acumulan pruebas y estudios, por una lógica muy útil, es importante su capacidad de almacenarlas para un análisis sucesivo y continuo. Esto es un aspecto clave, ya que constantemente, en la UCI, la información inmediata se compara con la previa, por esto la facilidad de una consulta repetida y agrupada de los datos de un mismo paciente implica una ayuda inestimable para analizar su evolución.
En la actualidad existen diversos softwares de varias casas comerciales que permiten identificar de forma automática estructuras cardíacas, vasculares y pulmonares, así como delimitar ondas Doppler, desde un aspecto hemodinámico muy orientado al paciente crítico21,22.
- -
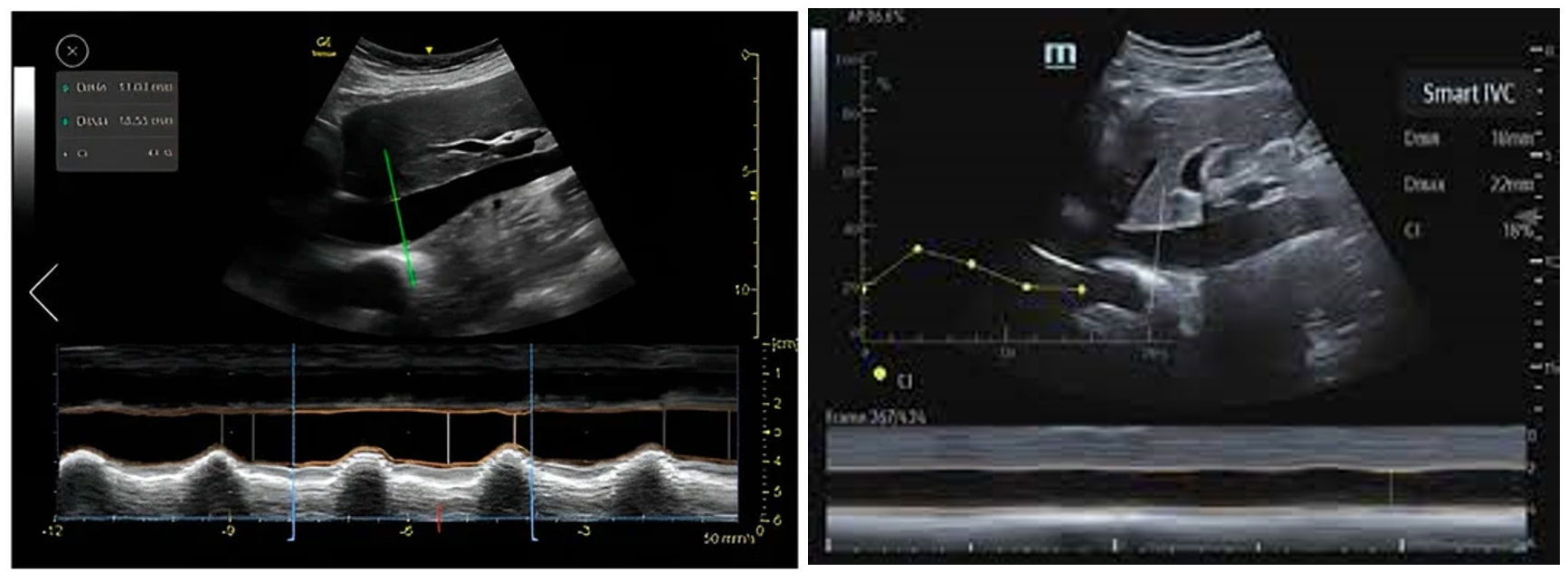
La valoración automática de la vena cava inferior (VCI) como un parámetro subrogado a la precarga y la respuesta a volumen permite un reconocimiento óptimo de la misma, en sus diámetros más amplios, y medir la colapsabilidad o distensibilidad de forma precisa y automática (fig. 4)23. Su fiabilidad equivale a la capacidad de un experto el 87% de los casos24–27.
Figura 4.Detención automática de los bordes de la vena cava inferior (VCI) con software Venue GE© y Smart Fluid Mindray© desde el plano subcostal con seguimiento continuo del mismo; hasta que el plano se optimiza no sale el contorno en color verde y al congelar la imagen, mide automáticamente los diámetros máximos y mínimos para aplicar la fórmula de la colapsabilidad de la VCI.
- -
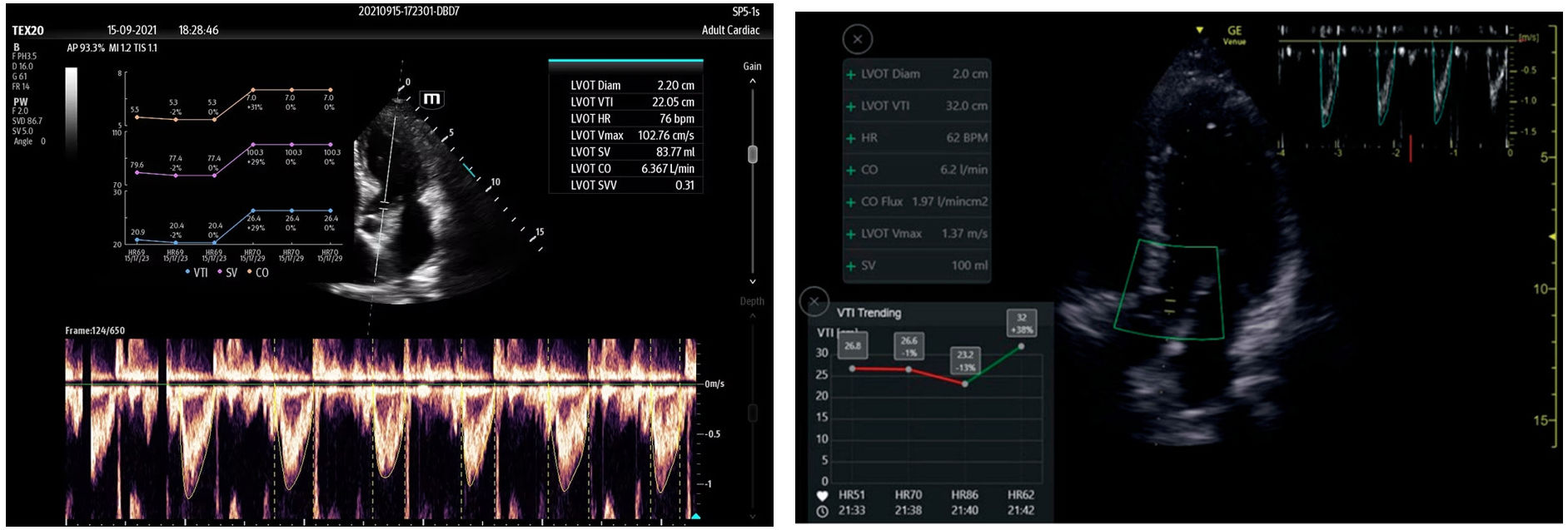
La valoración automática de la integral velocidad-tiempo (IVT) en el tracto de salida del ventrículo izquierdo (TSVI), como parámetro subrogado al gasto cardíaco, y su variabilidad en ventilación mecánica es usado para predecir la respuesta a volumen. Identifica el contorno de la onda Doppler pulsado más amplia y nítida, así como su variación respiratoria. Su registro puede guardarse, generando una gráfica de su tendencia, que implica una ayuda a la hora de visualizar rápidamente la evolución, transformándose en una monitorización (fig. 5)28. Su fiabilidad equivale a la capacidad de un experto el 82% de los casos29–31.
Figura 5.Detección automática de la integral velocidad tiempo (IVT) en el tracto de salida del ventrículo izquierdo (TSVI) software Venue GE© y Smart Fluid Mindray©. Se detecta y planimetría de manera automática la onda de Doppler pulsado cuando su trazado es el más nítido y su área es mayor, analizando su variabilidad en varios ciclos respiratorios. Su tendencia queda grabada con el valor del volumen sistólico y gasto cardíaco durante su ingreso.
- -
La valoración automática de las líneas B en los campos pulmonares, como parámetro de la congestión pulmonar. Este software ayuda a calcular el número, la consistencia y el grosor de las líneas B, almacenando esta información por segmentos torácicos explorados y por exámenes realizados, para posteriormente poder ver la evolución de una manera seriada32–34. El software LungSweep© ayuda a un barrido en la exploración torácica por espacio costal y segmento pulmonar examinado (figura S1, material adicional)35. Su registro genera un mapa pulmonar a primera vista de la aireación pulmonar, siendo útil en el diagnóstico de neumonía. La exploración por segmentos pulmonares hace que pueda identificarse el número, el grosor y la consistencia de las líneas B pulmonares (figura S2, material adicional)36. Su fiabilidad equivale a la capacidad de un experto el 86% de los casos37–39.
Aplicación clínica en críticos:
- -
Valoración de la precarga, volemia y respuesta a carga de fluidos.
- -
Valoración y tendencia del gasto cardíaco.
- -
Valoración de la congestión pulmonar.
- -
Agregación y análisis de datos ecográficos (tendencias hemodinámicas).
El «strain» y el «strain rate» son dos parámetros recientes, que necesitaban una edición off-line en la estación de trabajo de imagen, sin embargo, recientemente se ha incorporado un software que permite que algunos equipos lo calculen automáticamente a pie de cama. Su información es importante ya que aporta mayor fiabilidad para evaluar la función sistólica intrínseca ventricular y del mismo modo se puede usar para valorar la función diastólica con el análisis de la contracción auricular izquierda.
El «strain» o deformación se refiere a la medida de la deformación de las fibras musculares ventriculares durante la sístole. Cuando el corazón se contrae, las fibras musculares se acortan en ciertas direcciones y se alargan en otras. El «strain» es una medida cuantitativa de esta deformación y se expresa en porcentaje. Un valor de «strain» negativo indica acortamiento, mientras que un valor positivo indica alargamiento. El «strain» en la ecocardiografía se obtiene utilizando técnicas avanzadas como el «speckle tracking» (rastreo de partículas o puntos) que siguen el movimiento de pequeños puntos en el miocardio de lo ventrículos y de la aurícula izquierda fundamentalmente. El «strain rate» (velocidad de deformación) se refiere a la velocidad a la que ocurre la deformación de las fibras musculares ventriculares y mide cómo cambia el «strain» por unidad del tiempo. El «strain rate» se expresa en unidades de longitud por unidad de tiempo (por ejemplo, 1/s) y proporciona información adicional sobre la contracción cardíaca en comparación con el «strain» estático40–42 (figura S3, material adicional)43.
En la aurícula izquierda también podemos usar el «strain». La deformidad de esta cavidad está en relación directa con la función diastólica del ventrículo izquierdo (VI). Los valores normales del «strain» de la aurícula izquierda pueden variar, sin embargo, a modo de referencia, los valores típicos del «strain» de la aurícula izquierda suelen estar en el rango de -20% a -30%44–47.
El «auto strain» es un software que es capaz de que algunos equipos calculen automáticamente el «strain» miocárdico a partir de las imágenes a pie de cama, sin necesidad de que el operador realice mediciones manuales. El dispositivo únicamente necesita una imagen apical optimizada al máximo posible, en los planos 4 cámaras, 2 cámaras y 3 cámaras. Esta función de automatización se ha vuelto más común con la incorporación de tecnologías de procesamiento de imágenes y análisis de flujo de trabajo en la ecocardiografía 48–51 (vídeo 252, vídeo 353 y vídeo 454, en material adicional).
La generación del «auto strain» es un paso más en la automatización de ciertas variables en los ultrasonidos. Como ya hemos visto el «strain» es un valor superior y más fiable que la fracción de eyección, que se artefacta por innumerables variables como la precarga, la poscarga y las características propias de la distensibilidad del miocardio. Este parámetro es extremadamente útil en la exploración del ventrículo derecho (VD), que es sumamente difícil y cambiante en el paciente crítico bajo ventilación mecánica. Este software, de manera automática, provee una información que está llamada a aumentar su precisión y cambiar los términos de la valoración sistólica de ambos ventrículos.
Aplicación clínica en críticos:
- -
Valoración fiable de la función ventricular.
- -
Valoración de la función diastólica y de las presiones intraventriculares.
El área y el volumen ventricular se pueden evaluar de varias maneras. El método más habitual es el método biplano, consta en la suma de discos (regla de Simpson modificada) a partir de imágenes ecocardiográficas bidimensionales (áreas). El análisis de áreas permite determinar volúmenes, siendo valores que sirven para el cálculo de la fracción de eyección, el volumen sistólico, el volumen de llenado o telediastólico y el gasto cardíaco. Las limitaciones del método biplano son múltiples, como la visión nítida del endocardio, el corte en un plano longitudinal perfecto, la alineación del ápex o la mala visualización en los planos apicales de dos y cuatro cámaras para la estimación del volumen.
El «autovolumen 3D» en ecocardiografía es un software que hace posible la capacidad de los equipos de ecocardiografía para generar automáticamente un volumen tridimensional (3D) del corazón sin que el operador tenga que realizar mediciones manuales55–57. Esta función es una característica avanzada que permite obtener una representación tridimensional del corazón que puede ser útil para una evaluación más detallada de la anatomía y la función cardíaca (figura S4, material adicional)58 (vídeo 559, material adicional).
El reto clínico más relevante, por su morfología, es el VD. La identificación de su volumen telediastólico, simplemente, no es posible con un sistema de discos, donde se asume una morfología regular que hace posible calcular un volumen a partir de áreas, como se hace en el VI. La determinación del volumen de esta cavidad puede aportar gran valor en el paciente crítico ya que, como sabemos, el VD es la cavidad que se adapta y cambia ante el aumento de las presiones o de volumen, por lo que en un paciente de UCI en ventilación mecánica su valoración continua puede ser muy relevante y mejorar el manejo ventilatorio del mismo60–62. (figura S5, material adicional)63 (vídeo 664, material adicional).
Aplicación clínica en críticos:
- -
Valoración de la precarga (volumen telediastólico del VI).
- -
Valoración del volumen sistólico y gasto cardíaco.
- -
Valoración de la repercusión de la ventilación mecánica sobre el VD.
La monitorización hemodinámica a través de los ultrasonidos ha tenido diversos límites para su implantación como herramienta que pueda competir con los dispositivos de termodilución o de onda de pulso. Actualmente, no podemos considerarla un dispositivo de monitorización continua, pero sí un complemento imprescindible. Existen en el mercado dispositivos de ecocardiografía transesofágica tan pequeños como una sonda nasogástrica que pueden mantenerse hasta 72h ofreciendo un registro continuo de índices como la respuesta a volumen a través de la distensibilidad de la vena cava superior (VCS) y la función ventricular de modo visual65,66 (figura S6, material adicional)67.
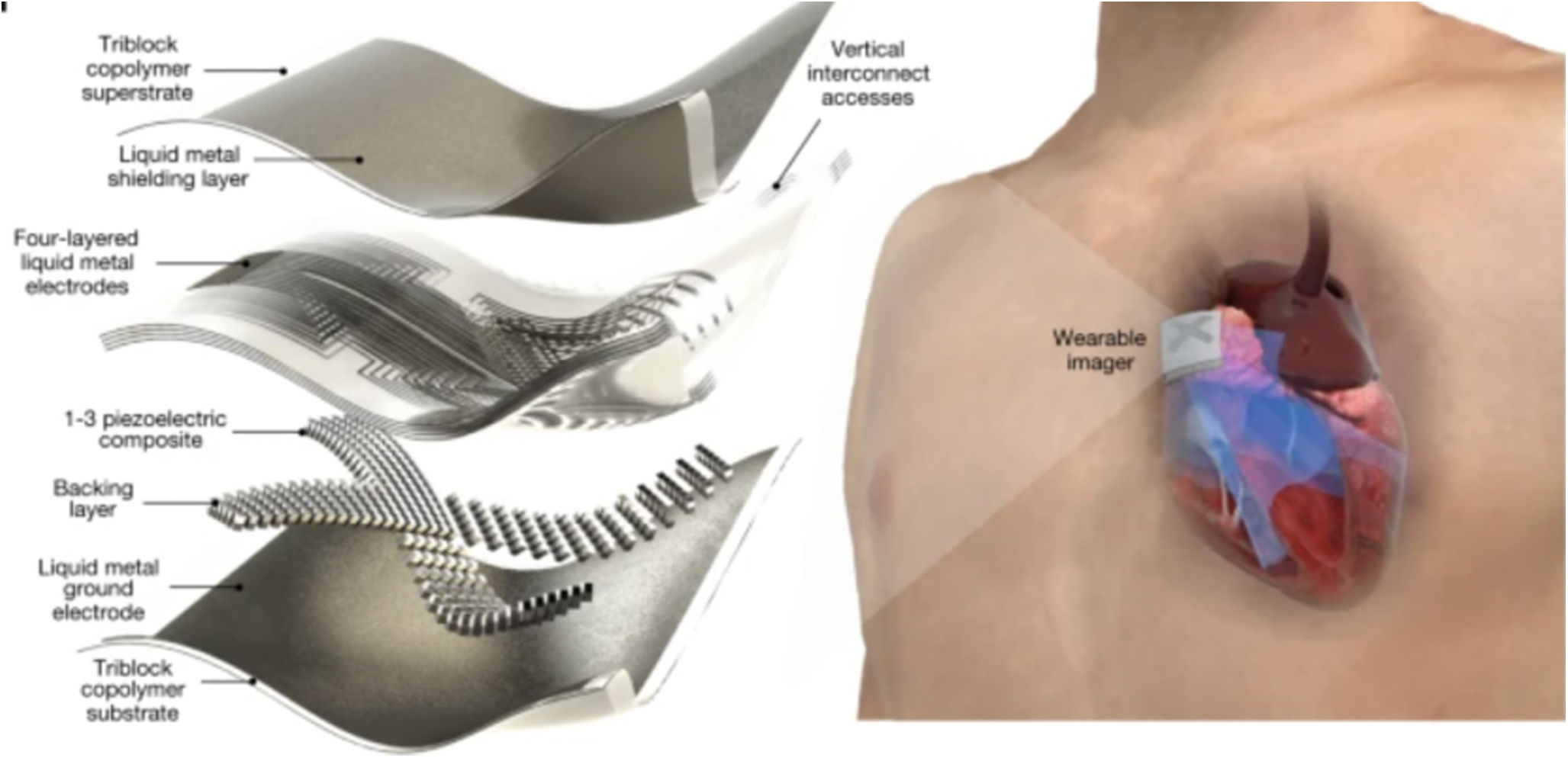
El futuro podría ser una pegatina adherida a la piel que pueda transmitir imágenes de forma constante durante 48h. Una línea de investigación en el Instituto Tecnológico de Massachusetts (MIT) ha creado un dispositivo del tamaño de un sello postal que crea imágenes en vivo de alta resolución68–71. La pegatina, de aproximadamente 4cm de anchura y alrededor de medio centímetro de espesor (fig. 6)72, podría ser un sustituto del voluminoso equipo de ultrasonidos. Estos dispositivos captan, a través de impulso de ultrasonido, imágenes de alta resolución del flujo arterial y de las cavidades cardíacas transmitiendo la señal de manera inalámbrica. En los diferentes estudios y pruebas en voluntarios sanos, los parches se adhirieron bien a la piel, lo que permitió capturar imágenes incluso si los voluntarios pasaban de estar sentados a de pie, trotar o andar en bicicleta.
Este dispositivo adherido de ultrasonidos produce imágenes de mayor resolución al combinar una capa adhesiva elástica con una serie rígida de transductores (que convierten la energía de una forma a otra). En el medio hay un hidrogel sólido que transmite ondas sonoras y la capa adhesiva está formada por dos finas capas de elastómero, que previene la deshidratación del hidrogel durante un tiempo determinado.
En las diversas pruebas las pegatinas se han usado en varias áreas, incluidos el cuello, el pecho, el abdomen y los brazos (figura S7, material adicional)73. Las imágenes obtenidas de manera continua fueron claras de las estructuras subyacentes, incluido el diámetro y áreas cambiantes de los vasos sanguíneos y cavidades cardíacas, durante hasta 48h74–77.
Este software no solo se basa en la inteligencia artificial, donde se puede interpretar mejor las imágenes ecográficas sino en la investigación de materiales y geles trasmisores de frecuencia y ondas ultrasonográficas, y pese a que su futuro e implantación todavía es cuestionable, es una línea de investigación muy prometedora en el paciente crítico.
ConclusionesLa IA es una herramienta aplicada a la ecografía que ya es una realidad. Su evolución en los próximos años hará que el proceso de aprendizaje sea más corto, permitiendo a su vez una mayor rapidez y automatización de la técnica, suponiendo un diagnóstico ecocardiográfico y una monitorización más precisa.
Su incorporación progresiva a los distintos equipos va a ser más rápida de lo esperado. Ello supondrá que el intensivista tenga una información fundamental, más veraz de forma inmediata y con menor tiempo de aprendizaje. De igual modo, el desarrollo de nuevos softwares nos hará más comprensible la verdadera fisiología cardiovascular.
Para terminar los autores quieren plantear una reflexión. Esta continua mejora del software de nuestros dispositivos y de la fiabilidad de los mismos es saber si el medico asistencial será capaz de aplicarlos con rapidez en su práctica diaria y cómo los nuevos índices cambiarán nuestro lenguaje clínico. El futuro, sin duda, es ya apasionante.
FinanciaciónNo ha sido financiado de ninguna manera.
Contribución de los autoresFernando Clau Terré ha elaborado el primer draft del manuscrito que posteriormente ha sido modificado por el resto de autores. Fernando Clau Terré ha proporcionado los vídeos editados y las imágenes y ha solicitado los permisos de reproducción.
Conflicto de interesesLos autores confirman que no tienen conflictos de intereses con las casas comerciales que se comentan en el artículo ni han recibido compensaciones de ningún tipo.
Queremos agradecer a los autores que han autorizado el uso de las imágenes para divulgación y las compañías que se citan en el artículo que han autorizado el material didáctico para mostrar y hacer entender los avances.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en doi:10.1016/j.ram.2024.05.006.