El beneficio de la nutrición enteral en el paciente crítico ha sido demostrado en varios estudios, especialmente si esta es iniciada precozmente, en las primeras 24-48h de ingreso en la Unidad de Cuidados Intensivos, y en la actualidad esta práctica es recomendada por las principales guías de práctica clínica. El inicio de nutrición enteral en el paciente crítico con inestabilidad hemodinámica es una decisión controvertida, fundamentalmente debido al potencial riesgo de isquemia intestinal asociado a su empleo. Sin embargo, existen datos procedentes de estudios animales y de estudios observacionales en humanos que permiten plantear la hipótesis sobre su efecto beneficioso y seguridad. Son necesarios ensayos clínicos de intervención que establezcan una relación causa-efecto.
The benefit of enteral nutrition in critically ill patients has been demonstrated by several studies, especially when it is started early, in the first 24-48h of stay in the Intensive Care Unit, and this practice is currently advised by the main clinical guidelines. The start of enteral nutrition is controversial in patients with hemodynamic failure, since it may trigger intestinal ischemia. However, there are data from experimental studies in animals, as well as from observational studies in humans that allow for hypotheses regarding its beneficial effect and safety. Interventional clinical trials are needed to confirm these findings.
- 1.
Comprender la fisiopatología del tracto gastrointestinal del paciente crítico con inestabilidad hemodinámica y el potencial beneficio de la nutrición enteral (NE).
- 2.
Revisar la evidencia disponible hasta la fecha sobre los beneficios y riesgos de la NE en este tipo de pacientes.
- 3.
Resumir las recomendaciones de las principales guías de práctica clínica.
- 4.
Aportar ideas prácticas y el punto de vista de un grupo investigador en este campo.
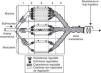
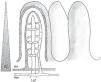
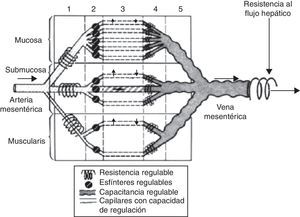
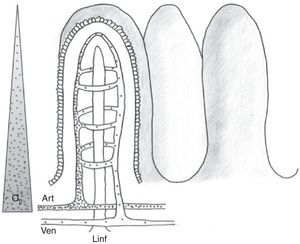
La fisiología de la circulación esplácnica es compleja, aunque conocida desde hace varios años, y su conocimiento básico es fundamental para comprender las alteraciones que se producen en el paciente crítico con inestabilidad hemodinámica. En situación de reposo y en condiciones normales, el 20-25% del gasto cardíaco se encuentra en la circulación esplácnica. La actividad metabólica a este nivel es responsable del 30% del consumo corporal de oxígeno. Durante la alimentación, el flujo sanguíneo esplácnico puede llegar a duplicarse a través de un fenómeno conocido como respuesta hiperémica posprandial. Esta respuesta está mediada fundamentalmente por factores locales, dando lugar a una vasodilatación esplácnica marcada1,2. La disposición anatómica de la microvascularización intestinal es compleja, con plexos arteriales y venosos a nivel de mucosa, submucosa y muscular propia, con capacidad de redistribución del flujo en caso de disminución del volumen intravascular a nivel de la circulación sistémica. Esto permite que el flujo sanguíneo esplácnico pueda ser regulado de forma precisa (fig. 1). A nivel de la vellosidad intestinal, la vascularización se dispone de tal manera que la arteria y la vena discurren paralelas, pero con flujos en sentido contrario. Esta disposición anatómica permite el paso de moléculas de bajo peso molecular (como el oxígeno) de forma directa desde la arteria hasta la vena (mecanismo de intercambio «contracorriente»), que en condiciones fisiológicas no es relevante, pero que en caso de hipoperfusión genera un gradiente descendente de presión tisular de oxígeno desde la base a la punta de la vellosidad (fig. 2). Así, la punta de la vellosidad es especialmente sensible a la hipoxia tisular.
La microvascularización intestinal (i).
Esquema de la distribución anatómica de la microvascularización intestinal. Existe la posibilidad de regulación a varios niveles (precapilar, capilar y poscapilar), lo que permite la redistribución del flujo.
Figura reproducida a partir del artículo publicado por Folkow3, con permiso.
La microvascularización intestinal (ii).
Esquema de la distribución anatómica de la microvascularización intestinal (arteria, vena y vaso linfático) a nivel de la vellosidad. Se ilustra el paso de moléculas de pequeño peso molecular con puntos, así como el mecanismo de contracorriente. El triángulo de la izquierda representa el gradiente de concentración de oxígeno desde la base hasta la punta de la vellosidad.
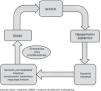
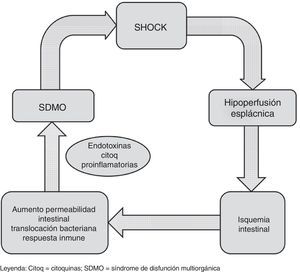
En situación de shock se produce una redistribución de flujo con vasoconstricción a nivel de la circulación esplácnica y tejidos periféricos en un intento de mantener la perfusión cerebral y coronaria4. Esto puede condicionar un disbalance en la relación aporte/demanda de oxígeno a nivel intestinal, con la consiguiente isquemia. Esta situación conduce a una depleción de los depósitos celulares de ATP, con rotura de las uniones estrechas entre células epiteliales. En consecuencia, los gradientes de concentración de solutos entre los compartimentos apical y basolateral se pierden, produciéndose edema intracelular, necrosis y apoptosis. La consecuencia final de esta alteración de la microcirculación intestinal es la rotura de la barrera epitelial intestinal, favoreciendo fenómenos de traslocación bacteriana. Esta afectación persistente de la microcirculación en el paciente en shock5 puede perpetuar la respuesta proinflamatoria y favorecer la evolución hacia el síndrome de disfunción multiorgánica, que a su vez condiciona una mayor hipoperfusión esplácnica, cerrando un círculo vicioso que aumenta la probabilidad de muerte del paciente (fig. 3). Además, en este complejo escenario, diversas intervenciones realizadas sobre el paciente, como el soporte vasoactivo e inotrópico6, la ventilación mecánica o los dispositivos de soporte hemodinámico, actúan sobre la circulación esplácnica con efectos difícilmente predecibles. Considerando lo anterior, el soporte nutricional en estos pacientes supone un auténtico reto. Desde un punto de vista conceptual y fisiopatológico, la NE administrada al paciente crítico con inestabilidad hemodinámica induciría un aumento tanto en los requerimientos de oxígeno a nivel intestinal como en el flujo sanguíneo esplácnico por vasodilatación a este nivel. Así, en caso de predominar el primer efecto podría predisponer a la isquemia intestinal, mientras que en el segundo caso aumentaría la perfusión esplácnica y podría contrarrestar la alteración a nivel de la microcirculación presente en el paciente en shock2,7.
Beneficios de la nutrición enteral en el paciente inestableEn los últimos 15 años se han ido conociendo datos derivados de modelos experimentales animales, así como de estudios clínicos en humanos, a favor de un efecto beneficioso asociado al empleo de NE en el paciente crítico con inestabilidad hemodinámica.
Modelos animalesLa información existente es amplia, con modelos de shock hemorrágico, séptico, quemado e isquemia-reperfusión2. En la mayoría de estos estudios se reproducen resultados similares en cuanto a las alteraciones a nivel de la microcirculación intestinal inducidas en situación de inestabilidad hemodinámica, y el efecto producido por la NE. Estas alteraciones persisten a pesar de la normalización de parámetros hemodinámicos «clásicos», como la presión arterial media, tras la reanimación inicial. La explicación para este fenómeno es múltiple: aumento en los niveles de sustancias vasoconstrictoras endógenas, como la endotelina i o la angiotensina ii, disminución de vasodilatadores como el óxido nítrico, y lesión de isquemia-reperfusión a nivel de la microcirculación8. Se ha demostrado que esta reducción del flujo sanguíneo esplácnico se asocia a lesión isquémica de la mucosa intestinal, traslocación bacteriana y disfunción multiorgánica9,10. La gran mayoría de estos estudios experimentales reproducen resultados en la misma línea: la NE es adecuadamente tolerada, sin desencadenarse la temida isquemia intestinal. De hecho, debido a la respuesta hiperémica inducida por la NE, esta es capaz de revertir la isquemia esplácnica11,12 e, incluso, disminuir los fenómenos de traslocación bacteriana13,14. Como contrapartida, existen estudios en los que tras inducir una hipoperfusión extrema a nivel intestinal (obstrucción completa de la arteria mesentérica superior), el inicio de NE puede agravar la isquemia esplácnica15.
Todos estos estudios han permitido conocer con detalle la fisiopatología de la circulación esplácnica en el paciente en shock, y plantear la hipótesis del efecto beneficioso asociado a la NE. Sin embargo, existen limitaciones metodológicas y de aplicabilidad clínica que restringen la utilidad de los mismos y la extrapolación de conclusiones.
Estudios clínicos en pacientesComo norma general, debe señalarse que la inmensa mayoría de ellos son observacionales y realizados en pacientes posoperados de cirugía cardíaca. Esto condiciona la interpretación que puede realizarse de sus resultados, que permite establecer asociaciones, pero no causalidad. La tabla 1 resume los hallazgos más importantes de los principales estudios clínicos publicados hasta la fecha sobre soporte nutricional enteral en el paciente crítico inestable hemodinámicamente. En la presente revisión, solo se comentarán los estudios considerados más relevantes. En el año 2005, el grupo del Dr. Chiolero publicó su experiencia con la utilización de NE en 70 pacientes posoperados de cirugía cardíaca, mediante un estudio observacional prospectivo16. Todos ellos presentaban inestabilidad hemodinámica y en 18 fue necesaria, además, la implantación de un sistema de soporte mecánico como el balón de contrapulsación intraaórtico. Basándose en estudios previos sobre requerimientos energéticos en este tipo de pacientes por medio de calorimetría indirecta, se estableció un objetivo calórico de 25Kcal/kg de peso y día a alcanzar en 4-6 días. La NE, iniciada en los 2-3 primeros días de ingreso en la UCI y de acuerdo con un protocolo previamente establecido, con un incremento prudente y progresivo del aporte energético en los primeros días de NE, no se asoció a complicaciones graves como isquemia intestinal. Sin embargo, el aporte energético fue variable (promedio 1.360±620Kcal/día), lo que correspondió al 70±35% del objetivo calórico. De hecho, los balances energéticos fueron claramente negativos. Otro hallazgo interesante fue que el aporte energético disminuyó a medida que se incrementaban las dosis de noradrenalina y dopamina. Las principales conclusiones de este estudio han sido reproducidas recientemente por un grupo investigador independiente17, que ha evaluado prospectivamente la NE precoz (iniciada en las primeras 48h de ingreso en UCI y de acuerdo con un protocolo de NE previamente establecido) en 37 pacientes críticos posoperados de cirugía cardíaca con inestabilidad hemodinámica. Todos los pacientes incluidos requirieron soporte vasoactivo en las primeras 48h de ingreso, y 11 precisaron soporte mecánico circulatorio con balón de contrapulsación intraaórtico, asistencia mecánica circulatoria y/u oxigenación de membrana extracorpórea venoarterial por shock cardiogénico refractario. El objetivo energético fue de 25Kcal/kg/día a alcanzar progresivamente el cuarto día de NE. Las conclusiones fueron superponibles a las del grupo de Chiolero: la NE precoz fue factible en estos pacientes, no se asoció a complicaciones graves, pero difícilmente alcanzó los objetivos nutricionales por sí sola. El objetivo energético planteado solo se alcanzó en el 40% de los pacientes, y los balances energéticos acumulados, especialmente a partir de los 7 días de estancia en UCI, fueron francamente negativos. Estas observaciones permiten plantearse la potencial indicación de la nutrición parenteral complementaria en estos pacientes. A diferencia del estudio de Chiolero, no se demostró una clara asociación entre el aporte energético por vía enteral y la dosis de fármacos vasoactivos. En cuanto a las complicaciones, cabe destacar que, aunque no se detectó ningún caso de isquemia intestinal, la frecuencia de complicaciones asociadas a la NE fue elevada (62% de los pacientes), siendo la complicación más frecuente el estreñimiento (46%), seguido de la diarrea (27%). La mayor parte de estas complicaciones fue leve y solamente en el 24% de los pacientes fue necesario suspender transitoriamente la NE. En ambos estudios se destaca que es imprescindible la aplicación de un protocolo de NE, una monitorización cuidadosa del aporte y del balance energético, así como una monitorización estrecha de los signos de alarma de isquemia intestinal.
Resumen de los principales estudios en pacientes críticos con nutrición enteral precoz e inestabilidad hemodinámica
| Autor | Año | Diseño | n | Pacientes incluidos | Principales conclusiones | Complicaciones |
|---|---|---|---|---|---|---|
| Berger et al.40 | 2000 | Observacional, prospectivo | 45 | POQC (23 con inestabilidad hemodinámica). Seis controles sanos | El intestino mantiene su funcionalidad y capacidad absortiva | No descritas |
| Revelly et al.41 | 2001 | Observacional, prospectivo | 9 | POQC. Todos requirieron fármacos vasoactivos (dosis no descritas) | Mejoría hemodinámica tras inicio de NE precoz | No descritas |
| Kesek et al.42 | 2002 | Observacional, prospectivo | 73 | POQC o torácica. Situación hemodinámica no descrita | La NE precoz ajustada individualmente es factible, con escasas complicaciones | No se detectan complicaciones graves |
| Berger et al.16 | 2005 | Observacional, prospectivo | 70 | POQC. Todos inestables hemodinámicamente. Dieciocho precisaron BCIAo | La NE fue posible, pero habitualmente los aportes fueron insuficientes | No se detectan complicaciones graves |
| Lukas et al.43 | 2010 | Observacional, retrospectivo | 48 | Pacientes con ECMO (35 VA y 13 VV por fallo respiratorio). Treinta y nueve con inestabilidad hemodinámica | La NE fue posible en pacientes con ECMO. Solo se alcanza el 55% del objetivo nutricional | No se detectan complicaciones graves |
| Khalid et al.18 | 2010 | Observacional, retrospectivo | 1.174 | Pacientes médicos con necesidad de vasopresores | Menor mortalidad en el grupo de NE precoz. Mayor efecto a mayor gravedad y número de vasopresores | No descritas |
| Rai et al.44 | 2010 | Observacional, retrospectivo | 43 | Pacientes sépticos. Treinta y tres con shock séptico. APACHE II 20±8. Dosis de fármacos vasoactivos no descritas | A pesar del enlentecimiento en el vaciamiento gástrico, la NE según protocolo debería considerarse en el shock séptico | No descritas |
| Umezawa Makikado et al.20 | 2013 | Observacional, prospectivo | 7 | POQC con fallo hemodinámico grave y necesidad de ECMO VA | La NE precoz es factible y segura, bajo supervisión médica adecuada | No se detectan complicaciones graves |
| Ferrie et al.19 | 2013 | Observacional, retrospectivo | 86 | 31 pacientes con ECMO VA. Cincuenta y cinco pacientes con ECMO VV | Alcanzado el 79,7% de los objetivos energéticos. Dieciocho pacientes requieren NP complementaria | No se describen complicaciones graves |
| Flordelís Lasierra et al.17 | 2013 | Observacional, prospectivo | 37 | POQC con inestabilidad hemodinámica | La NE precoz es factible. El alcance del objetivo nutricional es difícil | No se detectan complicaciones graves |
| Mancl y Muzevich27 | 2013 | Observacional, retrospectivo | 259 | 48% shock séptico, 23% shock cardiogénico | La mayor parte de los pacientes que reciben NE y vasopresores toleran la NE | 3 casos (0,9%) de perforación/isquemia intestinal |
APACHE: Acute Physiology and Chronic Health Evaluation; BCIAo: balón de contrapulsación intraaórtico; ECMO: oxigenación de membrana extracorpórea; NE: nutrición enteral; NP: nutrición parenteral; POQC: posoperatorio de cirugía cardíaca; SDRA: síndrome de distrés respiratorio agudo; SNG: sonda nasogástrica; VA: venoarterial; VV: venovenoso.
En el año 2010, Khalid et al. publicaron un estudio18 en el que se realizó un análisis retrospectivo a partir de una amplia base de datos de la Society of Critical Care Medicine (IMPACT Project). Estos datos fueron incluidos de forma prospectiva y multicéntrica. Se incluyeron 1.174 pacientes críticos con ventilación mecánica al menos 48h y con inestabilidad hemodinámica que requirió el inicio de fármacos vasoactivos. La causa más frecuente de ingreso fue la insuficiencia respiratoria grave en ambos grupos, seguida de la sepsis. Se dividió a los pacientes en 2 grupos: grupo de NE precoz (dentro de las primeras 48h del inicio de la ventilación mecánica) y grupo de NE tardía. Se excluyeron aquellos pacientes con contraindicación absoluta o relativa para la NE en el momento del ingreso: obstrucción o sangrado GI, íleo, gastroparesia, pancreatitis aguda, peritonitis, colitis isquémica o rotura esofágica. También se excluyeron aquellos pacientes que recibieron nutrición parenteral antes de ser intubados. Se realizó un análisis estadístico multivariante, ajustando por variables de confusión. Se realizó, asimismo, un análisis de supervivencia para evaluar el efecto de la NE en la mortalidad. El grupo de NE precoz presentó de forma significativa una menor mortalidad y estancia en UCI que el grupo de NE tardía, habiendo ajustado por variables como los scores de gravedad o la edad en el análisis multivariante. El efecto fue superior en aquellos pacientes con mayor inestabilidad hemodinámica, entendida esta como mayor requerimiento de vasopresores en cuanto al número de los mismos y en cuanto a la duración del tratamiento vasopresor. El diseño del estudio (observacional, retrospectivo y sin asignación aleatorizada a cada grupo de estudio) no permite extraer conclusiones de causalidad del mismo y obliga a una interpretación cautelosa de los resultados.
En el último año se han publicado 2 series de casos, una de ellas retrospectiva, con 31 pacientes, y otra prospectiva, con 7 pacientes, donde se describe la utilización de NE precoz, entendida como la iniciada en las primeras 24-48h de ingreso en UCI, en pacientes críticos con shock cardiogénico refractario y necesidad de asistencia mecánica con oxigenación de membrana extracorpórea venoarterial como puente al trasplante cardíaco o como puente a la recuperación19,20. Una vez más, la NE se administró de acuerdo con un protocolo conocido por el equipo asistencial. En ambas series se llega a la conclusión de que la NE precoz es posible y no se asocia a complicaciones graves.
Todos estos estudios son observacionales y esto conlleva limitaciones de diseño que obligan a interpretar sus resultados con cautela. Es necesario un ensayo clínico de intervención que evalúe la eficacia y seguridad de la NE administrada a pacientes críticos con inestabilidad hemodinámica para confirmar las hipótesis planteadas hasta la fecha.
Riesgos de la nutrición enteral precozLa complicación más temida del soporte nutricional enteral en el paciente inestable hemodinámicamente, producida como consecuencia del aumento del consumo de oxígeno en una proporción no adecuada al aumento del flujo sanguíneo esplácnico, con la consiguiente alteración de la relación aporte/demanda a nivel de la mucosa intestinal, es la isquemia intestinal, especialmente de tipo no oclusivo. Se trata de una complicación poco descrita, aunque con una alta mortalidad asociada: entre el 11 y el 27% en el posoperatorio de cirugía cardíaca21. Su frecuencia es escasamente conocida. En un estudio retrospectivo realizado a partir de un registro de 4.311 pacientes críticos con enfermedad traumática22, se describió una incidencia del 0,3%, con una mortalidad asociada del 44%, y se detectó con mayor frecuencia en la segunda semana de ingreso en UCI. Tratando de identificar un «perfil de riesgo» para su desarrollo, los autores evaluaron variables clínicas y analíticas que pudieran predecir su aparición, llegando a la conclusión de que ninguna de ellas era lo suficientemente específica, y algunas, como la distensión abdominal, fueron de aparición tardía. El 31% de los casos presentó lesión traumática abdominal significativa. En el estudio no se especifica en qué momento preciso se inició la NE: únicamente se señala que esta comenzó una vez finalizada la fase de reanimación inicial. Tampoco se definió si esta se administró de acuerdo con un protocolo establecido en todos los casos, ni la situación hemodinámica de los pacientes en el momento de iniciar el soporte nutricional enteral.
En los últimos años se han comunicado casos de isquemia intestinal no oclusiva tras NE, especialmente tras el empleo de sondas de alimentación pospilóricas y con la utilización de fórmulas nutricionales ricas en fibra no fermentable23. Sin embargo, en la mayoría de estos estudios la NE no fue administrada de forma precoz, y se desconocen detalles importantes como la situación hemodinámica de los pacientes al iniciar el soporte nutricional o la forma de administrarlo, así como el seguimiento diario de la situación clínica de los pacientes24.
La monitorización diaria y minuciosa de los posibles signos de alarma de isquemia intestinal en estos pacientes de alto riesgo resulta de vital importancia. Estos signos pueden clasificarse en clínicos, analíticos o radiológicos (tabla 2). Ninguno de ellos es lo suficientemente sensible o específico para establecer un diagnóstico de certeza, pero su presencia debe conducir a valorar la suspensión transitoria del soporte nutricional enteral hasta poder descartar esta grave complicación. Signos clínicos como el aumento del residuo gástrico, la distensión abdominal, el aumento de la presión intraabdominal por encima de 15mmHg, especialmente si se asocia a oliguria reciente, o el deterioro brusco en la situación hemodinámica del paciente se deben interpretar como posibles indicadores de una situación de isquemia intestinal. Determinaciones de laboratorio como la lactacidemia o la leucocitosis pueden ser de utilidad, aunque su aparición suele ser tardía en caso de isquemia intestinal. En cuanto a las pruebas de imagen, la presencia de asas intestinales dilatadas y engrosadas en la radiografía de abdomen, la neumatosis intestinal o la presencia de aire en la vena porta o en la cavidad peritoneal deben hacer sospechar esta complicación. Técnicas como la ecografía doppler, la angiorresonancia magnética y la arteriografía son de gran utilidad en el diagnóstico de la isquemia intestinal oclusiva, aunque su papel en la isquemia intestinal no oclusiva, más prevalente en el paciente crítico con inestabilidad hemodinámica, es más limitado25. La disponibilidad de nuevos sistemas de tomografía computarizada multidetector puede ayudar a confirmar el diagnóstico26.
Signos de alarma de isquemia intestinal
| Clasificación | Signos | Comentarios |
|---|---|---|
| Clínicos | Residuo gástrico>500cc | |
| Distensión abdominal | ||
| Dolor abdominal intenso | Menos fiable en pacientes sedados | |
| Presión intraabdominal>15mmHg | ||
| Íleo | No específico, tardío | |
| Oliguria | No específico, tardío | |
| Shock | ||
| Analíticos | Hiperlactacidemia | Todos inespecíficos, y con frecuencia, tardíos |
| Acidosis metabólica | ||
| Leucocitosis | ||
| Radiológicos | Sin alteraciones significativas (20-25%) | Todos inespecíficos. Pueden requerir el transporte del paciente fuera de la UCI. La CT multidetector puede ser de utilidad para el diagnóstico. La angio-RM, el ecodoppler y la angiografía aportan información en la isquemia oclusiva. Menos utilidad en la isquemia intestinal no oclusiva |
| Neumatosis intestinal | ||
| Líquido libre | ||
| Asas intestinales dilatadas y engrosadas | ||
| Aire en vena porta o neumoperitoneo |
CT: tomografía computarizada; RM: resonancia magnética; UCI: Unidad de Cuidados Intensivos.
Tabla modificada a partir del capítulo del libro publicado por Umezawa Makikado et al.45.
Mancl y Muzevich27 han publicado recientemente un estudio donde se realizó un análisis retrospectivo de 259 pacientes críticos con necesidad de fármacos vasoactivos y administración concomitante de NE. A pesar de llegar a conclusiones positivas acerca de la tolerancia a la NE en los pacientes, describen 3 casos de isquemia mesentérica/perforación intestinal. Esta frecuencia (0,9%) es considerada similar a la de perforación intestinal espontánea descrita en el paciente crítico que recibe NE. La descripción de estos 3 casos clínicos puede ser de utilidad para conocer las características clínicas asociadas al desarrollo de isquemia mesentérica no oclusiva o necrosis intestinal asociada a la NE. En el estudio se señala que no se aplicó un protocolo específico de NE en todas las unidades, sino que se realizó un manejo multidisciplinar de acuerdo con las actuales guías de práctica clínica. Esto puede condicionar una variabilidad entre diferentes profesionales a la hora de iniciar el soporte nutricional y de monitorizar su eficacia y seguridad. De hecho, se aprecian diferencias sustanciales en cuanto al modo de suministrar la NE entre los diferentes pacientes. Tampoco se describen la definición de las diferentes complicaciones ni los parámetros clínicos monitorizados, así como la frecuencia con la que se monitorizaron. Por otro lado, los mismos autores, en el apartado de Discusión, señalan la necesidad de poner en funcionamiento un protocolo específico de NE en su centro. Como datos para tener especialmente en consideración, señalaremos que en el primer caso descrito de isquemia intestinal no oclusiva se inició la NE a dosis plena, y que, tras detectarse distensión abdominal, no se interrumpió la misma. Debe recordarse que la distensión abdominal en estos pacientes debe ser interpretada como un signo de alarma, especialmente si se acompaña de cifras de presión intraabdominal mayores de 15mmHg. Esto debería haber conducido a una suspensión de la NE. Además, dadas todas las circunstancias de alto riesgo descritas con anterioridad, el soporte NE, en consonancia con los estudios prospectivos citados previamente16,17, debería iniciarse de forma progresiva y escalonada, permitiendo de esta manera monitorizar de forma más estrecha la tolerancia del paciente a la NE y su interrupción inmediata en caso de detectarse algún signo de alarma. En el segundo caso clínico descrito resulta llamativo que a pesar del deterioro brusco y significativo en la situación hemodinámica del paciente tras una buena tolerancia inicial a la NE, no se interrumpiera el soporte nutricional.
En conclusión, el diagnóstico de la isquemia intestinal no oclusiva es complejo y debe basarse en la combinación de una alta sospecha clínica con hallazgos de laboratorio y pruebas de imagen28.
Revisión de las guías de práctica clínicaLas guías de práctica clínica disponibles hasta la fecha no abordan con la suficiente claridad el inicio de la NE en el paciente crítico con inestabilidad hemodinámica. Las guías publicadas por la Sociedad Americana de Nutrición Parenteral y Enteral29, así como las publicadas por la Sociedad Europea de Nutrición Parenteral y Enteral30, establecen que «la NE no debería iniciarse en pacientes con inestabilidad hemodinámica hasta que se encuentren completamente reanimados y/o estables hemodinámicamente». Estas recomendaciones están basadas en resultados de estudios clínicos no aleatorizados, estudios con controles históricos, series de casos y opiniones de expertos. Además, la definición de estabilidad hemodinámica no es abordada en profundidad, lo que resta aplicabilidad práctica a dichas recomendaciones. Por su parte, las guías canadienses31 recomiendan el inicio de NE precoz en el paciente crítico, hacen referencia al estudio publicado por Khalid et al. en 201018, pero no especifican con claridad la actitud a seguir en el paciente inestable hemodinámicamente.
Las guías publicadas por la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias y por la Sociedad Española de Nutrición Parenteral y Enteral dan un paso más en sus recomendaciones respecto al resto de guías. Estas guías recomiendan iniciar la NE en el paciente séptico32 tras la reanimación o, al menos, cuando se haya alcanzado una fase de «shock estable» con una adecuada presión de perfusión (dosis de fármacos vasoactivos estabilizadas, acidosis metabólica y lactato estabilizados y/o en descenso, presión arterial media mayor o igual a 60mmHg). Señalan, además, que es necesario un control estrecho de los signos de intolerancia intestinal. En cuanto al paciente cardíaco33, establecen que cuando la función cardíaca esté profundamente comprometida, la NE es posible y su inicio, por motivos de prudencia ante el riesgo de isquemia intestinal, habitualmente se demora más allá de las 24-48h. En ambos casos, las recomendaciones están basadas principalmente en la opinión de expertos.
Al margen de las principales guías de práctica clínica descritas con anterioridad, debe señalarse la revisión publicada en el año 2009 por Turza et al.34, que trata de realizar una aproximación práctica al soporte nutricional enteral en este tipo de pacientes siguiendo 4 pasos: evaluación de la historia médica y nutricional previa del paciente, evaluación de la situación fisiológica actual del paciente, organización de la logística para iniciar la NE, y monitorización clínica una vez iniciada la misma. Del mismo modo, muy recientemente se ha publicado una revisión sobre el soporte nutricional enteral en el paciente con oxigenación de membrana extracorpórea35.
Aspectos prácticosBasándose en la experiencia acumulada en sus diferentes estudios llevados a cabo, los autores de la presente revisión consideran oportuno describir el modo en que se inició el soporte nutricional enteral en sus pacientes posoperados de cirugía cardíaca, así como la monitorización de su eficacia y seguridad, con el objetivo de aportar un punto de partida orientativo al lector. Se siguió el protocolo de NE del Servicio de Medicina Intensiva de nuestro centro, debiendo este ser conocido por el personal médico, de enfermería y auxiliares. En él se especificó el modo de iniciar la NE, así como la monitorización diaria de las diferentes complicaciones asociadas a ella. Remitimos al lector a los algoritmos de intervención nutricional en el paciente crítico publicados por la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias para una mayor información36.
¿Por qué vía iniciar la nutrición enteral?El soporte nutricional enteral se administró por vía nasogástrica como norma general.
¿Qué objetivo calórico establecer?Basado en estudios previos, se estableció un objetivo calórico de 25Kcal/kg de peso y día. Sin embargo, para pacientes con un índice de masa corporal menor a 20kg/m2, se calculó como 25Kcal/kg de peso ideal. Para pacientes con índice de masa corporal superior a 30Kg/m2, se estableció como 25Kcal/kg de peso ideal más un 30%37.
¿Cómo iniciar la nutrición enteral?La NE se inició después de comprobar la tolerancia del paciente a líquidos. Para ello, se administraron 100cc de agua por sonda nasogástrica a intervalos de 3h. En caso de presentar un débito gástrico menor a 200cc en 2 intentos consecutivos, se consideró que la tolerancia a líquidos era positiva. A continuación, se inició una fórmula de NE estándar, con aumentos progresivos del aporte en un 25%, hasta llegar al 100% del objetivo el cuarto día de NE. El volumen de residuo gástrico se monitorizó cada 6h el primer día de NE, cada 12h el segundo día y diariamente los días siguientes. Para minimizar la posibilidad de aspiración y neumonía relacionada con la ventilación mecánica se mantuvo el cabecero elevado más de 30° durante la administración de NE.
¿Cuándo iniciar la nutrición enteral?De acuerdo con las últimas guías publicadas por la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias32, debe iniciarse cuando tras la fase de reanimación del paciente se consiga una estabilización en la dosis de fármacos vasoactivos e inotrópicos, así como de los signos de hipoperfusión.
¿Cómo monitorizar la eficacia de la nutrición enteral?Como dato orientativo, y teniendo en cuenta lo amplio de este apartado, que excede los objetivos de la presente revisión, los autores utilizaron el balance energético, calculado como la diferencia entre las calorías aportadas y las calorías objetivo, de forma diaria y acumulada a lo largo de la estancia. Asimismo, se calculó la tolerancia nutricional como el cociente entre las calorías aportadas y las calorías objetivo. A partir de estos resultados de eficacia, debería valorarse de forma individualizada la indicación de nutrición parenteral complementaria.
¿Cómo monitorizar la seguridad de la nutrición enteral?Debe realizarse una definición protocolizada de las principales complicaciones asociadas a la NE: aumento del residuo gástrico, distensión abdominal, diarrea asociada a la NE, aspiración de la dieta, etc. Debe hacerse hincapié en la monitorización de los signos de alarma de isquemia intestinal.
- -
En el momento actual, la indicación de soporte nutricional enteral precoz en el paciente crítico con inestabilidad hemodinámica es controvertida38.
- -
Existe evidencia procedente de estudios experimentales en animales y de estudios observacionales en humanos (la mayor parte de ellos en posoperados de cirugía cardíaca) que permite plantear la hipótesis sobre su efecto beneficioso, tolerancia y seguridad37.
- -
Hasta la fecha, no existen estudios de intervención en humanos que permitan determinar una relación causa-efecto.
- -
Debido a sus características fisiopatológicas, el paciente crítico inestable hemodinámicamente presenta un alto riesgo para isquemia intestinal. Esta complicación es grave y muestra una alta mortalidad asociada.
- -
Resulta fundamental la aplicación de protocolos de NE, el inicio prudente y progresivo de los aportes energéticos y la monitorización estrecha de los signos de alarma (clínicos, analíticos, radiológicos) de isquemia intestinal.
- -
El alcance de las necesidades nutricionales solo con NE en este tipo de pacientes es francamente difícil. Por ello, la monitorización diaria del aporte calórico y el balance energético es de suma importancia. El papel de la nutrición parenteral complementaria39 en estos pacientes no ha sido definido hasta la fecha.
Los autores declaran no tener ningún conflicto de intereses. Se han tenido en cuenta las instrucciones para los autores y las responsabilidades éticas.
Al personal de la UCI Cardiológica del Servicio de Medicina Intensiva en el Hospital 12 de Octubre. A Aurora Ruiz por su ayuda en la elaboración de la figura 2.