INTRODUCCIÓN
La reanimación cardiopulmonar (RCP) constituye una ciencia que estudia la epidemiología, la fisiopatología, los mecanismos y el tratamiento de las dolencias o lesiones de aparición súbita y que impiden o dificultan el aporte de oxígeno, dando lugar a un grave compromiso en las funciones cardiopulmonar y cerebral, y a estados fisiopatológicos de deprivación de oxígeno en todo el organismo1,2.
El principal objetivo de la RCP y cerebral es restablecer la circulación espontánea3, tratando de conseguir que el paciente tenga unas funciones cerebrales similares a las previas a la RCP. La interrupción de la circulación durante 10 s provoca una pérdida de conocimiento por falta de suministro de oxígeno al cerebro. A los 2-4 min hay pérdida de los depósitos cerebrales de glucosa y glucógeno, y a los 4-5 min se agota el adenosín trifosfato (ATP)4.
Aunque la supervivencia tras la parada cardíaca es baja, muchos supervivientes tienen una aceptable calidad de vida, por lo que no se deben abandonar los esfuerzos para mejorar los sistemas de respuesta ante una parada cardíaca súbita5.
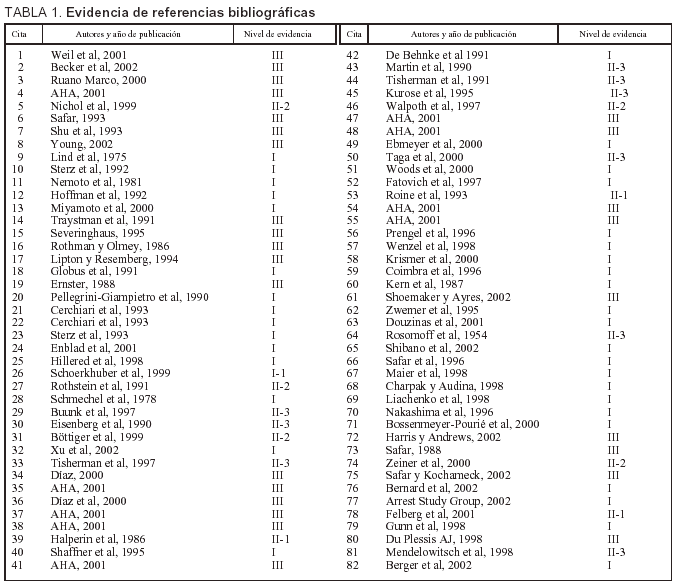
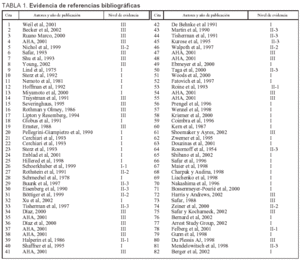
En la revisión bibliográfica realizada se lleva a cabo un análisis de la evidencia científica de los distintos artículos referentes a la utilidad de la neuroprotección en los estados postanóxicos (tabla 1).
Fisiopatología
La parada cardiorrespiratoria (PCR), que causa isquemia cerebral global, puede ocurrir de manera instantánea, como resultado de una fibrilación ventricular (FV), puede tardar en establecerse unos minutos, como en la asfixia, o tardar varias horas, como resultado de shock o de una hipoxemia6.
Durante la PCR hay una ausencia completa del flujo sanguíneo, lo que da lugar a la isquemia cerebral global. Con el inicio de las maniobras de RCP, esta isquemia pasa a ser parcial, de amplitud variable en función de la eficacia del soporte vital3.
Tras la isquemia, sin flujo cerebral de 10 a 20 min de duración, y con restablecimiento de la circulación espontánea (RECE) con la reperfusión, se inicia el síndrome de posreanimación, con sus tres componentes:
1. Fallo de la reperfusión cerebral, que se relaciona con un período transitorio de hiperemia cerebral. En esta fase se produce una elevación de los valores de catecolaminas, con elevación concomitante de la glucemia7.
2. Cascada química, durante la isquemia, y la reoxigenación.
3. Fallo visceral extracerebral.
Fallo de la reperfusión cerebral
En condiciones normales, el cerebro mantiene un flujo cerebral global de unos 50 ml/100 g de tejido/min, con presiones de perfusión cerebral entre 50 y 150 mmHg. Es un órgano que puede tolerar bien presiones de perfusión cerebral tan bajas como 30 mmHg, flujos menores de 15 ml/100 g/min, y presión parcial de oxígeno en sangre venosa cerebral de 20 mmHg.
Tras la PCR, una vez iniciada la RCP, hay un período transitorio de hiperemia cerebral, con aumento del flujo sanguíneo cerebral global (unas 2 veces por encima de la normalidad), con zonas de tejido nervioso mejor y peor perfundidas. En esta fase, hay un aumento transitorio de la presión intracraneal de 30 a 60 min de duración, que parece modulado por receptores simpaticomiméticos αy β. Este período de flujo supranormal se continúa con una fase de rápida declinación, cuando alcanza valores por debajo de la normalidad, con una duración entre 1 y 12 h. Ello se acompaña de un consumo de oxígeno aumentado (de 2 a 3 veces). Todos los parámetros alcanzan la normalidad a las 24-48 h post-PCR6,8-11. Probablemente, los valores elevados de catecolaminas (epinefrina y norepinefrina) secundarios a la estimulación de los receptores neuronales β-adrenérgicos durante los minutos iniciales de isquemia (30 primeros min), con elevación concomitante de la glucemia, sean los responsables de un peor pronóstico de recuperación neuronal tras el accidente isquémico7. Durante estos minutos iniciales de la isquemia, se comprueba que la estimulación de los neurorreceptores inotrópicos N-metil-D-aspartato (NMDA) produce liberación de catecolaminas, por lo que el bloqueo con antagonistas no competitivos de sus receptores (ketamina) es capaz de mejorar la recuperación neuronal tras la isquemia12.
Cascada química cerebral
La hipoxia aislada no produce lesión cerebral permanente (lisis neuronal), aunque a valores críticos (presión parcial arterial de O2 [PaO2] < de 25 mmHg) durante unos minutos es capaz de producir PCR por deterioro de la función cardíaca. La hipoxia no lesiona el soma neuronal, pero sí selectivamente la sinapsis, con deficiencia de receptores GABAérgicos. El tiempo de recuperación tras un coma puramente hipóxico dependerá del tiempo de regeneración sináptica, del orden de unas 2 semanas. Sin embargo, la hipoxia es capaz de aumentar la necrosis neuronal por isquemia, sobre todo en el neocórtex, más sensible a la hipoxemia. En este caso, una PaO2 próxima a 200 mmHg podría mitigar las lesiones cerebrales corticales producidas por el doble accidente de isquemia e hipoxia13.
Durante la isquemia de las células cerebrales o anoxia neuronal, el adenosín trifosfato (ATP) disminuye hasta casi cero en todos los tejidos a diferente velocidad. Ello depende de sus reservas y de los sustratos; más rápido en el cerebro que en el corazón. La disminución de ATP da un aumento del calcio (Ca) intracelular. Este Ca activa la fosfolipasa, rompiendo los fosfolípidos de la membrana celular en ácidos grasos libres (ácido araquidónico); ya a los 30 s del accidente isquémico se observa su aumento, y la activación de las enzimas proteolíticas. La hidrólisis de ATP en adenosín monofosfato (AMP) origina un acúmulo de nucleótidos, adenosina e hipoxantina, que tras deshidrogenación pasa a xantinaoxidasa, y favorece la aparición extracelular de radicales libres (superóxido, peróxido de hidrógeno e hidroxilo) y de aminoácidos neurotransmisores excitadores (glutamato [Glu] y aspartato). Estos aminoácidos aumentan el flujo de Ca en el interior de la célula, y producen una pérdida de potasio (K) intracelular y despolarización de la membrana6,14,15.
Si la reanimación tiene éxito, tras la isquemia hay una reoxigenación del tejido cerebral, que puede también provocar lesión añadida. La reoxigenación induce una serie de alteraciones químicas en cascada basadas en la sobrecarga celular de Ca. Permiten la aparición de hierro libre y de radicales libres, contribuyendo a la necrosis celular a través de la peroxidación de los lípidos de membrana. La recirculación facilita la utilización rápida de los ácidos grasos libres, en particular el ácido araquidónico, que se metaboliza vía ciclooxigenasa y lipooxigenasa, y da lugar a radicales libres, con rotura de membranas celulares, deterioro de la microcirculación, activación de neutrófilos y producción de prostaglandinas, leucotrienos, tromboxano y factores de permeabilidad vascular, que a su vez atraen a monocitos y macrófagos que segregarán proteasas (interleucina 8 y otras citocinas) que disuelven las membranas basales de los capilares y permiten la aparición de edema. La reoxigenación restablece los depósitos de ATP mediante la fosforilación oxidativa, que puede producir una entrada masiva de Ca en el interior de la mitocondria y provocar su destrucción. El aumento de Ca por sí mismo y a través de reacciones con radicales libres origina una peroxidación lipídica, con rotura de membranas y muerte celular.
El Glu derivado de la glutamina es un neurotransmisor presináptico. En la sinapsis glutaminoérgica, el Glu presináptico liberado actúa en los receptores de la dendrita postsináptica despolarizando la neurona al permitir la entrada de Ca, sodio (Na) y agua. Este Glu es bombeado de nuevo a la terminación axonal presináptica tras su conversión en glutamina en el interior del astrocito, con consumo de energía mediante la hidrólisis de ATP en adenosín difosfato (ADP). Esta acción excitadora normal del Glu se realiza en tres tipos de receptores postsinápticos (NMDA, AMPA y ácido caínico). En situaciones de isquemia, el Glu queda libre en la sinapsis, y su concentración extracelular aumenta hasta 25 veces tras 20 min de isquemia, lo que da lugar a una estimulación neuronal anómala (excitotoxicidad). Esta célula se hincha y luego facilita la generación de segundos mensajeros, con activación de cinasas y proteasas, llevando a una situación irreversible16-18. Sin embargo, el incremento de Glu intraisquémico por sí solo parece insuficiente para desarrollar el daño neuronal. La proporción de varios aminoácidos neurotransmisores (índice de excitotoxicidad), unos excitadores como el glicerol (Gli) y otros inhibidores como el ácido gamma aminobutírico (GABA), explicaría que ante elevaciones similares de Glu en el tejido neuronal, unas zonas fueran más sensibles a la isquemia (cuerpo estriado) que otras (tálamo)18.
Las células que respiran son capaces de reducir el oxígeno molecular (dioxígeno, O2) mediante la transferencia de 4 electrones por la vía del citocromo-C-oxidasa, ya que el citocromo-C está envuelto por 4 electrones, y produce H2O y ningún radical de oxígeno. Muchas células, sin embargo, son capaces de reducir el oxígeno molecular con 3 electrones, dando lugar al radical hidroxilo (OH) con 2 electrones, que formará el radical peróxido de hidrógeno (H2O2); y con 1 electrón, dando lugar al radical superóxido (O2). La cantidad producida es relativamente pequeña, menor del 2% del total de O2 consumido con la respiración. Su acción primaria es la de iniciar la peroxidación lipídica en presencia de hierro (Fe), produciendo la rotura de membranas, modificando las proteínas y los ácidos nucleicos (ADN). Como efectos secundarios se encuentran la alteración de la homeostasis del Ca, que aumenta, y la activación de las proteasas y fosfolipasas. Finalmente provoca la activación de enzimas tipo xantinaoxidasa, que a su vez produce un aumento de los radicales libres. Las células tienen mecanismos enzimáticos y no enzimáticos para eliminar o impedir la formación de estos radicales libres; entre los primeros están la superóxido dismutasa y la glutatión reductasa, localizadas en el citosol y las mitocondrias, que son capaces de eliminar el superóxido y el peróxido de hidrógeno. Entre los mecanismos no enzimáticos para eliminar radicales libres estarían los clásicos antioxidantes α-tocoferol, β-caroteno, retinol y ácido ascórbico. En la respiración celular normal mitocondrial, con transporte de electrones, la presencia de oxígeno al término de la cadena favorece el mantenimiento de todos los elementos del sistema de transporte en un estado oxidativo. Sin embargo, durante la isquemia, cuando el aporte de oxígeno está limitado, la cadena de transporte de electrones está muy reducida, lo que provoca la aparición de radicales libres14,19.
Probablemente existe un círculo vicioso de cooperación entre la formación de radicales libres y la liberación de aminoácidos excitadores, en la patogénesis del daño neuronal producido por la isquemia y la hipoxia. Los radicales libres formados del oxígeno con la isquemia o durante la reperfusión del cerebro promueven la liberación de aminoácidos excitadores, que desarrollan su efecto neurotóxico estimulando sus receptores específicos, lo que origina un aumento de la concentración intracelular de Ca, que a su vez provoca daño neuronal y aumento de la producción de radicales libres20.
El conocimiento fisiopatológico de las lesiones neuronales por isquemia y reperfusión ha permitido desarrollar líneas de tratamiento, con distintos grados de eficacia; unas ya abandonadas, como los barbitúricos para disminuir el consumo de oxígeno, o el empleo de 21-aminoesteroides (lazaroides) como inhibidores de la peroxidación lipídica, y otras en fase de estudio, tanto in vitro como in vivo, aunque sin resultados concluyentes. De ellas merecen reseñarse6,14,16,17,19,20:
Antagonistas del calcio.
Bloqueadores de los receptores NMDA.
Bloqueadores de los receptores no NMDA (AMPA, cainato).
Inhibidores o depuradores de radicales libres.
Fallo visceral extracerebral
El cerebro no es el único órgano afectado por la isquemia global. El hígado y el intestino cambian de metabolismo aeróbico a anaeróbico durante la isquemia. El corazón deteriora su función, al igual que se deterioran las funciones hematológica y visceral.
La disfunción observada tras PCR por FV en experimentación animal (arritmias ventriculares y depresión de la actividad contráctil) es proporcional al tiempo de parada cardíaca, con recuperación completa entre 7-15 min e irreversible con 30 min. Las lesiones de origen multifactorial son distintas para ambos ventrículos. En el ventrículo izquierdo (VI) comienza por el subendocardio y progresa transmuralmente hacia el subepicardio, y guarda correlación con el tiempo de isquemia. En el ventrículo derecho (VD) no sucede así, lo cual sugiere otros factores, como el masaje cardíaco externo al que es más vulnerable el VD por su posición más anterior, el empleo de choques eléctricos, dosis elevadas de catecolaminas, etc. Cuando el deterioro hemodinámico persiste, como resultado de una PCR prolongada, puede afectar negativamente a la recuperación neurológica. No se observa deterioro de la función pulmonar, probablemente por el mantenimiento de soporte vital avanzado respiratorio en el modelo de experimentación animal21. La función renal se recupera en 1 h tras la PCR. La oligoanuria es debida a una disminución de la presión de perfusión. Igualmente la alteración hepática (elevación de amoniemia y de aminoácidos aromáticos) es ligera y transitoria. Los cambios hematológicos observados de hipocoagulabilidad parecen corresponder a una coagulación intravascular diseminada transitoria. Se ha observado bacteriemia en experimentación animal en relación con la flora intestinal que no se acompaña de cuadro infeccioso. Todos estos trastornos no guardan ninguna correlación con la recuperación neurológica22.
Sobre la base de un hipotético paso de sustancias nocivas al torrente sanguíneo (bacterias, toxinas, aminoácidos aromáticos), que pudieran deteriorar la recuperación neurológica, se ha estudiado la respuesta a un tratamiento desintoxicante con el empleo de hemoperfusión en una serie de experimentación animal, sin mejoría en la recuperación23.
ALGUNOS MARCADORES PRONÓSTICOS METABÓLICOS
El éxito de la RCP viene determinado por el estado neurológico final del individuo. La gravedad de las lesiones cerebrales causadas por la PCR va desde una disfunción ligera hasta un estado vegetativo persistente o una muerte encefálica.
La decisión de continuar, limitar o retirar las medidas de soporte vital es un gran problema, con implicaciones éticas y socioeconómicas, presentes en la práctica clínica diaria. Por lo tanto, es importante tener una estimación, lo más temprana posible, de la gravedad del daño cerebral.
Microdiálisis cerebral
La microdiálisis cerebral consiste en la implantación de uno o más catéteres en la superficie de la corteza cerebral, provistos de una membrana semipermeable, que perfundidos con un líquido cefalorraquídeo (LCR) artificial estéril permiten la toma de muestras de dializado extracelular para analizar distintos marcadores metabólicos, tanto en clínica humana como en experimentación animal18,24,25. Elevaciones del Gli se relacionan con la hipoxia y la isquemia25. El Gli es un producto final de la hidrólisis de los fosfolípidos de la membrana celular, mediada por la pérdida de la homeostasis del Ca intracelular, del fallo energético y de los radicales libres en la hipoxia-isquemia cerebral. La relación lactato (L)/piruvato (P) es la prueba que muestra una mayor sensibilidad y especificidad en la isquemia aguda. En la práctica clínica una elevación brusca de la relación L/P se puede interpretar como un accidente isquémico, y dependiendo de si el pico es pequeño y retorna a sus valores basales o si es alto y además hay una segunda elevación, será indicador de una zona de penumbra con recuperación del tejido cerebral o de un infarto, respectivamente. No ocurre lo mismo con el Gli, que muestra un pico elevado con la oclusión arterial, tanto si hay o no reperfusión, mientras que en la zona de penumbra retorna a los valores basales24. También se puede definir el "índice de excitoxicidad" con la relación entre la concentración de Glu × Gli/concentración de GABA. Este índice aumenta significativamente en situaciones de isquemia, pero no lo hace de forma uniforme por todo el tejido cerebral18.
Análisis del líquido cefalorraquídeo
La PCR origina una isquemia cerebral global, que permite la salida de una serie de marcadores intraneuronales al líquido cefalorraquídeo (LCR) y al plasma, con una elevación que suele ser proporcional a la extensión del daño cerebral26,27,28.
La enolasa neuronal específica es una enzima que está casi exclusivamente localizada en las neuronas y otras células de origen neuroectodermal de los mamíferos, y sus cantidades en sangre periférica son indetectables. Es la proteína soluble más abundante en extractos de cerebro, de 12.000 a 16.000 ng/mg de proteína soluble. Esta enzima aumenta en el LCR y en la sangre periférica cuando se produce daño celular neuronal, como infarto y hemorragia cerebral, y tras la isquemia cerebral secundaria a una PCR26,28. Para evitar un pronóstico pesimista falso, los tests empleados en cuidados críticos para evaluar el pronóstico requieren una alta especificidad, que es más importante que una alta sensibilidad. Los valores más elevados de enolasa neuronal específica en el plasma, como predictor de mal pronóstico a los 6 meses de la PCR, suelen detectarse a las 72 h del RECE, con una especificidad del 100% y una sensibilidad del 70%. Sin embargo, se considera la necesidad de realizar más estudios con series más amplias de pacientes26.
La fracción BB de la creatincinasa (CK-BB) en el LCR también ha sido estudiada. Esta enzima se eleva significativamente en pacientes de mal pronóstico (fallecimiento), pero es un marcador de baja especificidad27.
Saturación del bulbo de la yugular y diferencia arteriovenosa de lactato
La monitorización de la saturación de O2 en el bulbo de la yugular puede ser beneficiosa para ajustar la ventilación mecánica en los pacientes recuperados de una PCR. Sin embargo, no se encontraron diferencias entre supervivientes y no supervivientes con respecto a la reactividad vascular cerebral29.
PROCEDIMIENTOS DE MEJORA DEL SOPORTE VITAL AVANZADO
Calidad de la reanimación cardiopulmonar
A pesar de los avances en la organización de la asistencia a la PCR y su tratamiento, el éxito de la RCP medido en función de la recuperación a largo plazo continúa siendo escaso, y se mantuvo en el mismo lugar en la última década. El principal problema en esta falta de resultados está relacionado con los retrasos en la aplicación de la RCP, y que esta aplicación sea de calidad subóptima. La posibilidad de sobrevivir a una PCR disminuye entre un 7 y un 10% por cada min en que no hay flujo sanguíneo, de manera que con paros cardíacos mayores de 12 min sólo del 2 al 5% de los pacientes sobreviven a largo plazo. Tanto la organización en la asistencia de la PCR como los retrasos en la aplicación de la RCP y su calidad influyen en la supervivencia de calidad a largo plazo30-32. Los mejores resultados de supervivencia, relacionados con los tiempos de respuesta, se obtienen con la combinación del doble escalón aplicando secuencialmente el soporte vital básico domiciliario (SVBD) seguido del soporte vital avanzado (SVA). A pesar de todo, hay amplias variaciones en los resultados que han de relacionarse con otros condicionantes, como pueden ser la calidad del programa, la demografía y las características de cada comunidad, la uniformidad en el registro de los datos que permitirá o no comparaciones entre poblaciones, etc.30. Estudios más recientes demuestran que los resultados son mejores si se añade el desfibrilador al primer eslabón del SVBD y la presencia de un médico en el SVA31.
Aunque en la PCR la duración en la situación de falta de flujo es indudablemente un factor importante, la calidad en la RCP tiene igual o incluso más importancia en la predicción de la supervivencia. Se demuestra en experimentación animal, con un control preciso de los tiempos de falta de flujo y de RCP, que una reanimación eficaz, incluso con tiempos prolongados de falta de flujo, permite una mejor recuperación. En contraste, una resucitación inadecuada, incluso tras cortos períodos de ausencia de flujo, determina una peor recuperación en términos de supervivencia32.
Mecanismos generadores de flujo
La RCP estándar frecuentemente produce presiones de perfusión demasiado bajas, que son inadecuadas para conseguir el RECE y mantener la vida del individuo y su integridad neurológica. Por esta razón se han desarrollado mecanismos generadores de flujo circulatorio que, más allá de las técnicas convencionales de SVA, permitan mantener la función de órganos vitales mientras se recupera la función cardíaca33. Existen diversos métodos.
No invasivos
Cardiocompresor mecánico de pistón. Este dispositivo mecánico no es un sustituto del masaje cardíaco externo (MCE), sino un accesorio utilizado por personal entrenado para optimizar la compresión cardíaca y la ventilación cuando hay dificultades para las compresiones manuales, como transporte del paciente, RCP prolongadas, escaso número de reanimadores o agotamiento de ellos. No se ha demostrado su eficacia en lactantes y en niños, por lo que su uso se debe limitar a adultos. Este dispositivo mecánico tiene las ventajas de que el ritmo y la profundidad de las compresiones son uniformes, y las desventajas de su coste, tamaño, peso, y la posibilidad de fractura esternal o de ineficacia si está mal colocado. Hasta ahora los datos clínicos de que se dispone son limitados, y no han demostrado que el pronóstico de supervivencia sea mayor con el cardiocompresor de pistón que con el MCE estándar (recomendación clase IIb)34,35.
Compresión-descompresión activa. Se trata de un dispositivo de ayuda mecánica manual para la compresión torácica, provisto de una ventosa que, colocada sobre el esternón, eleva activamente el tórax durante la descompresión. Con ello se consigue una disminución de la presión intratorácica durante la fase de descompresión del MCE, que aumente el retorno venoso y, por lo tanto, cebe la bomba cardíaca para la siguiente compresión. Aunque no presenta muchas complicaciones, su empleo es más complejo y agotador que con el MCE. Los datos clínicos y experimentales de los que se dispone actualmente no son concluyentes y sugieren que la ejecución de la técnica por personal entrenado es fundamental para mejorar el flujo (recomendación clase IIb)36,37.
Válvula inspiratoria de umbral de impedancia. Es un dispositivo que se introduce en un circuito estándar de ventilación con tubo traqueal provisto de manguito, e impide que haya inspiración durante la fase de descompresión torácica del MCE, lo que origina una presión intratorácica más negativa y aumenta el retorno venoso al tórax. Este dispositivo no está concebido para una RCP estándar y los estudios en animales y en seres humanos mostraron una mejoría hemodinámica cuando se empleó junto a la compresión-descompresión activa; aunque no se detectaron complicaciones, no se observó tampoco mejor pronóstico a corto y largo plazo (recomendación clase IIb)38.
Chaleco neumático. Es un dispositivo neumático que se ajusta al tórax, como una faja, se hincha y deshincha rítmicamente, a frecuencias de hasta 100/min, comprimiendo toda la pared torácica. La base teórica de su funcionamiento es la de aprovechar el mecanismo de bomba torácica, como generador de flujo circulatorio. El chaleco neumático presenta las desventajas de su tamaño, peso y consumo de energía eléctrica. Puede ser considerado una alternativa a la RCP estándar en el hospital o durante el traslado en ambulancia cuando haya un número suficiente de personal entrenado. (recomendación clase IIb)39-41.
Invasivos
Bypass cardiopulmonar a tórax cerrado. Se ha propugnado la circulación extracorpórea de emergencia (CEE) como tratamiento circulatorio coadyuvante para pacientes en paro cardíaco prolongado por causas específicas potencialmente reversibles (intoxicaciones, medicamentos, drogas e hipotermia), en los que no se consigue un RECE. La bomba de circulación extracorpórea se puede aplicar utilizando la vena y arteria femorales, sin necesidad de toracotomía. La CEE consigue restablecer con rapidez la presión arterial normal, la temperatura y la composición de la sangre, tanto en experimentación animal42 como en series de pacientes33,43-46. Aunque la CEE se ha mostrado eficaz en situaciones especiales de PCR por medicamentos, drogas e hipotermia, se debe emplear sólo en determinados centros hospitalarios (recomendación clase IIb)47.
Masaje cardíaco por toracotomía. Es una técnica especial que puede generar una perfusión cerebral y cardíaca casi normal; en series experimentales y clínicas se demostró que puede mejorar la supervivencia de la PCR cuando se emplea tempranamente, después de un breve período de RCP a tórax cerrado (< 25 min de tiempo total de PCR). El masaje cardíaco directo es superior a la compresión esternal porque ésta origina una presión en la aurícula derecha tan alta como la arterial, lo que disminuye la perfusión coronaria y cerebral, mientras que el masaje directo sobre los ventrículos aumenta significativamente la presión arterial y no la de la aurícula derecha, con lo que aumentan los flujos cerebral y coronario33. Las indicaciones específicas del masaje cardíaco directo a tórax abierto, en pacientes que sufren PCR, serían traumatismo torácico penetrante; PCR causada por hipotermia, embolia pulmonar o taponamiento cardíaco; deformidad torácica en la que la RCP a tórax cerrado es ineficaz y traumatismo abdominal penetrante con deterioro y PCR. No se debería emplear como medida tardía de último recurso (recomendación clase IIb)48. Una variación del masaje cardíaco directo a tórax abierto consiste en la realización de una pequeña incisión intercostal, paraesternal izquierda, por la que se introduce un émbolo de tamaño de bolsillo, que libera una copa alrededor del corazón que, al ser activada manualmente, realiza un masaje mecánico directo; ha sido empleada dentro y fuera de los hospitales33.
Medicamentos
El conocimiento de la fisiopatología del coma postanóxico ha permitido el ensayo de numerosas intervenciones, como el bloqueo de la entrada del Ca en la célula, la inhibición de la liberación de radicales libres, la disminución del metabolismo cerebral, etc. La mayoría de estas intervenciones no están suficientemente comprobadas7,11-14,16,17,19,20. Sin embargo, más de 20 años de experimentación animal y humana por distintos grupos han fallado en encontrar un único medicamento, que como una "bala mágica" mejore el pronóstico de la encefalopatía hipóxico-isquémica, y ello probablemente se deba a la propia naturaleza multifactorial de su patogenia, que requeriría igualmente una multiterapia49.
Tiopental
La administración de tiopental en modelos de isquemia cerebral global o parcial se ha explorado desde los años setenta, en modelos animales (monos, perros y ratas) y humanos, por su efecto en la disminución del metabolismo cerebral, del consumo de O2 por el cerebro, de la liberación de radicales libres, del edema cerebral, de la presión intracraneal, etc. Se obtuvieron efectos más beneficiosos en experimentación animal que en la clínica humana, al tener efectos colaterales importantes, como la depresión cardiovascular, el edema pulmonar y la necesidad de un mayor requerimiento en el empleo de sustancias vasoactivas para mantener una presión arterial normal, complicaciones que se presentan sobre todo con dosis elevadas (90 mg/kg)49,50.
Adenosina
Se ha comprobado en experimentación animal y humana que la adenosina es capaz de proteger a diferentes órganos (cerebro, corazón, intestinos, pulmones) de la isquemia-reperfusión, actuando a través de los receptores A1, A2, A3. Los receptores A1 median en la apertura de los canales del K, permitiendo una hiperpolarización de la membrana celular, e inhibiendo los canales del Ca, lo que disminuye la liberación de aminoácidos excitadores. Los receptores A2 inhiben la interacción neutrófilo-endotelio y la activación de las plaquetas, y producen vasodilatación. Los receptores A3 estimulan la actividad de las enzimas antioxidantes. La adenosina se distribuye en el cerebro igual que la glucosa y tiene una vida media en sangre < 1 s. A pesar de sus bondades, en un trabajo reciente en experimentación animal (perros) no elimina por completo la lesión histológica cerebral51.
Magnesio
Su empleo en la PCR extrahospitalaria se ha basado en la elevada incidencia de FV en adultos, y el efecto beneficioso que en ella tiene el empleo de sulfato de magnesio. Sin embargo, el empleo de dosis altas de sulfato de magnesio (5 g) como primera medicación en pacientes que habían desarrollado una PCR extrahospitalaria no se ha asociado con un aumento en la supervivencia; la desfibrilación temprana se mantiene como el tratamiento más eficaz de la FV52.
Nimodipino
El nimodipino, agente bloqueador de los canales del Ca, fue sometido a varios ensayos aleatorizados y controlados en el tratamiento de pacientes que habían sufrido un accidente cerebrovascular, pero no se ha demostrado beneficio alguno. Su empleo en la isquemia global por PCR no ha demostrado tampoco mejoría en la recuperación, aunque parece señalarse una disminución de la presión intracraneal y prevenir la aparición de edema cerebral, por lo que su uso en la reanimación no está justificado53.
Epinefrina o adrenalina
La epinefrina es una amina simpaticomimética que estimula los receptores adrenérgicos, encargados de regular el tono del músculo cardíaco, vascular, bronquial e intestinal. Estos receptores son de 3 tipos, alfa adrenérgicos (α), beta adrenérgicos (β) y dopaminérgicos. Los α, a su vez se subdividen en α1, cuya estimulación tiene un efecto inotrópico positivo y cronotrópico negativo en el corazón, y un efecto vasoconstrictor en los vasos; y en α2, cuya estimulación tiene en los vasos un efecto vasodilatador, contrarregulando el efecto vasoconstrictor de los receptores α1. Igualmente los receptores βse subdividen en β1, cuya estimulación produce un efecto inotrópico y cronotrópico positivo en el corazón, y en β2, cuya estimulación produce vasodilatación y relajación de la musculatura lisa bronquial, uterina y gastrointestinal. La estimulación de los receptores dopaminérgicos produce vasodilatación renal y mesentérica. La epinefrina aumenta la contractilidad miocárdica por sus efectos adrenérgicos β1, en tanto que sus potentes efectos adrenérgicos α1 producen vasoconstricción arterial y venosa. Durante la RCP se ha comprobado que aumenta el flujo sanguíneo miocárdico y cerebral, empleándose a dosis de 1 mg por vía intravenosa cada 3 min. Durante la década de los ochenta se postuló el empleo de dosis altas (5 veces mayores), pero que no han demostrado ninguna mejoría en la tasa de supervivencia al alta hospitalaria. La epinefrina tiene una buena biodisponibilidad tras su administración por vía intratraqueal si se administra en dosis de 2-3 mg diluida en 10 ml de agua estéril. No se recomienda la inyección por vía intracardíaca por el riesgo de laceración de las arterias coronarias, taponamiento cardíaco o neumotórax, por lo que sólo se recurrirá a esta vía en caso de masaje cardíaco a tórax abierto o cuando no se disponga de otras vías de administración54.
Vasopresina
La vasopresina es la hormona antidiurética que, en dosis mucho más altas que las necesarias para conseguir su efecto antidiurético, actúa como un vasoconstrictor periférico no adrenérgico por estimulación directa de los receptores V1 del músculo liso. Provoca intensa vasoconstricción periférica en la piel, el músculo esquelético, intestino y tejido adiposo y, con menor intensidad, en los lechos vasculares coronario y renal. Posee acción vasodilatadora cerebral. La vida media de la vasopresina es de 10 a 20 min, más prolongada que la de la epinefrina, y tras la RCP se ha comprobado que los valores endógenos están más elevados en los pacientes que sobreviven que en los que no presentan un RECE. La dosis empleada de 40 U por vía intravenosa ha mostrado efectos beneficiosos, pero no una mayor supervivencia al alta hospitalaria, por lo que aún no se dispone de datos suficientes para recomendar su empleo sistemático en la RCP55. En series de experimentación animal en cerdos en situación de PCR por FV, la vasopresina mejoró la oxigenación y el flujo sanguíneo cerebral con respecto a la epinefrina56; sin embargo, cuando en una preparación experimental similar a la anterior se administró conjuntamente vasopresina y epinefrina, el flujo sanguíneo cerebral disminuyó y el miocárdico se mantuvo, con respecto a la administración aislada de vasopresina57. Tanto la epinefrina como la vasopresina han resultado beneficiosas cuando se emplean en una serie experimental de cerdos en PCR secundaria a hipotermia (26 °C), en la presión de perfusión coronaria, con respecto a un grupo control58.
Antiinflamatorios y antipiréticos
En experimentación animal (ratas) se comprueba que a pesar del efecto neuroprotector de la hipotermia éste no se mantiene en el tiempo, probablemente porque la degeneración neuronal se desarrolla progresivamente. Cuando se añade un antiinflamatorio no esteroideo o un antipirético del tipo de la dipirona, se consigue mantener el efecto beneficioso inicial de la hipotermia, al mismo tiempo que se controla el efecto deletéreo del aumento de la temperatura durante los primeros días tras la isquemia59.
Neuroprotección física
A diferencia de los resultados farmacológicos, se han documentado beneficios con métodos físicos para la reanimación cerebral.
Reperfusión hipertensiva
Este método tiene como objetivo la preservación del FSC, que disminuye durante la fase de hipoperfusión tardía tras el RECE, que comienza 1-2 h tras la reperfusión y puede durar 12 h. Se observó en experimentación animal y humana que, elevando la presión arterial media en este período crítico, no sólo mejora el FSC, sino también la recuperación neurológica. Por contra, una reperfusión hipotensiva se asocia con una peor recuperación, por lo cual se debería conseguir un breve lapso hipertensivo después del RECE. A pesar de todo, estudios controlados no han demostrado que la producción de hipertensión sea beneficiosa3,6,9,10,32,60,61.
Reperfusión hipoxémica
Ante algunas observaciones clínicas en pacientes con PCR prolongada (15-32 min) que, aunque permanecen severamente hipoxémicos (PaO2 de 42 a 55 mmHg) por diversas razones (hemotórax, síndrome de distrés respiratorio agudo), presentan una buena recuperación neurológica, y otras experimentales, como la baja producción de anión superóxido por los neutrófilos cuando están expuestos a la hipoxia, se ha construido la hipótesis de que la ventilación con fracción inspirada de O2 (FiO2) baja durante la RCP puede disminuir la lesión neurológica al reducir los sustratos necesarios para producir un aumento de radicales libres, que dan lugar a una lesión por oxidación durante la reperfusión. Los ensayos experimentales para corroborar esta teoría han mostrado resultados contradictorios62,63. Últimamente, se ha demostrado (en ratas) que la hipoxia sin isquemia no origina necrosis cerebral, pero que la hipoxia aumenta la necrosis producida por la isquemia. Mientras que la hiperoxia disminuye poderosamente la necrosis en el modelo oclusivo de arteria cerebral media, especialmente en el neocórtex13.
Reperfusión hipotérmica
RCP e hipotermia. Desde los años cincuenta, la hipotermia moderada y profunda se ha empleado para procedimientos quirúrgicos especiales, pero la investigación para mostrar que la hipotermia puede ayudar a revertir la lesión cerebral producida por una PCR en situación de normotermia ha permanecido dormida durante 20 años. En los años cincuenta se creía que el beneficio de la hipotermia era debido a una reducción en los requerimientos de oxígeno, ya que en experimentos con perros sumergidos en un baño de agua y hielo se observó una correlación lineal entre el descenso de la temperatura interna (de 35 a 25 °C) y el descenso simultáneo y paralelo del flujo sanguíneo cerebral (ml/100 g/min) y el consumo de oxígeno cerebral (ml/100 g/min), de tal manera que entre 35 y 25 °C, por cada grado de disminución de temperatura, el FSC disminuye un 6,7% de la situación basal64; sin embargo, como la disminución de la temperatura corporal en 1 o 2 grados sólo disminuye el metabolismo cerebral entre un 7 y un 14%, parece razonable que la hipotermia tenga otros grados de actuación65. En experimentación con perros, en los que se provocaba una PCR normotérmica por FV durante 11 min de ausencia de flujo, seguido de 2 min de reperfusión con circulación extracorpórea con bajo flujo y baja PaO2, se comprueba una mejoría funcional y una disminución en la necrosis cerebral en el grupo de hipotermia suave con respecto al control, de manera que a las 96 h de la PCR el 88% de los perros se había recuperado, mientras que el 100% del grupo control presentaba discapacidad severa o coma66. Se han comunicado efectos beneficiosos funcionales y lesionales con el empleo de hipotermia en experimentación con ratas67, en otros experimentos bien diseñados, en que inadvertidamente se produce hipotermia68 o bien en un modelo de PCR por asfixia en ratas69.
Neuroprotección e hipotermia. Actualmente, la hipotermia es el tratamiento conocido más eficaz para proteger el cerebro contra la lesión isquémica. Mientras que la hipotermia profunda reduce el metabolismo cerebral de manera importante y retrasa el inicio del fallo energético, con la hipotermia ligera la reducción del metabolismo es escasa, por lo que esta "supresión metabólica" no debe ser el único mecanismo que explique su efecto beneficioso. Con la isquemia neuronal hay un aumento extracelular de los aminoácidos excitadores, por lo que un posible mecanismo de neuroprotección podría ser la disminución de la concentración de estos aminoácidos excitadores en el líquido intersticial. A pesar de todo, no queda claro el mecanismo por el cual pequeños cambios en la temperatura son capaces de disminuirlos, y pudiera ser por una disminución de su liberación o por un aumento de su eliminación; la primera hipótesis es más probable70. En estudios recientes in vitro con preparaciones neuronales aisladas sometidas a anoxia y reoxigenación para comprobar la protección de la hipotermia se observan mecanismos moleculares que implican la excitotoxicidad, disminución de la necrosis y de la apoptosis, etc.65. Probablemente la hipotermia, por su acción depresora de la actividad celular, impide el desarrollo de procesos activos, que son necesarios para que las células desarrollen apoptosis y posiblemente necrosis secundaria, en respuesta a la hipoxia y a la reoxigenación71.
Hipotermia en clínica humana. El cerebro humano crece en tamaño de la misma manera que sus venas emisarias, lo que soporta la teoría de que cuanto más crezca un cerebro más debe desarrollar una red venosa con capacidad para enfriarlo. El enfriamiento fisiológico del cerebro se realiza a través de 3 mecanismos: el enfriamiento de la sangre venosa y arterial cerebral a través de la piel, el enfriamiento de la cabeza a través del cráneo y el enfriamiento por pérdida de calor a través de la vía aérea superior. El enfriamiento de la cabeza a través del cráneo se realiza por un mecanismo de convección, debido a cambios en la dirección y en la velocidad del flujo sanguíneo venoso. La deshidratación inhibe la sudación en el cuerpo, pero no en la frente, ya que se necesita la evaporación para enfriar selectivamente el cerebro. El enfriamiento por pérdida de calor por la vía aérea superior se realiza a través de los senos sagital superior y cavernoso, que reciben sangre venosa de la nariz, que la enfría. La arteria carótida está próxima a la laringe y a la tráquea, por lo que la respiración también enfriará el flujo arterial. Se ha comprobado que el flujo sanguíneo de la mucosa nasal disminuye con el enfriamiento cutáneo y aumenta si la piel es calentada o aumenta la temperatura corporal, por lo que tiene el efecto de un radiador. Aunque el trabajo para respirar es mayor cuando se efectúa por la nariz que por la boca, todos los niños y el 85% de los adultos son respiradores nasales. Todo ello probablemente refleja la importancia que tiene en los mamíferos el enfriamiento cerebral a través de la respiración nasal, que se pierde con la intubación traqueal. El enfriamiento sistémico corporal y cerebral selectivo se ha empleado en experimentación animal y en clínica humana como neuroprotección tras una lesión cerebral. Sin embargo, tiene efectos colaterales, como la disminución de la respuesta inmunitaria y el aumento de las infecciones. Cuando se emplea el enfriamiento selectivo, se produce vasoconstricción cutánea, lo que disminuye el efecto fisiológico del enfriamiento; por eso parece razonable poner al paciente en decúbito supino, con la cabeza elevada y húmeda, y dirigiendo aire tibio a 30 °C sobre ésta; ello puede mejorar los mecanismos fisiológicos de enfriamiento cerebral72.
Investigación clínica en la RCP. Los ensayos clínicos en RCP tienen limitaciones por la necesidad de reunir un gran número de pacientes, por lo que deberían ser multicéntricos; porque beneficios menores a menudo no se detectan debido al "ruido estadístico" enorme generado por el gran número y la variabilidad de factores incontrolables que tienen repercusión en el resultado. Estos factores incluyen el tiempo y la calidad en la aplicación de las medidas de soporte vital, la organización de los servicios sanitarios, etc. que pueden ir más allá de los protocolos. El análisis de subgrupos podría disminuir la variabilidad, pero hacerlo tras la aleatorización no es realista y puede llevar a errores. Otras desventajas son su elevado coste y la necesidad de testar un nuevo tratamiento con otros tratamientos estándares, por lo que a veces se hace imposible detectar un efecto estadístico apreciable, a menos que sea demoledor, cosa que normalmente no sucede. Se ha propuesto un decálogo que cubra los requerimientos para investigación humana en RCP: 1) buena hipótesis; 2) criterios de selección y exclusión, y estimación de la muestra; 3) reclutamiento del personal investigador, hospitales, servicios de emergencias, transporte, etc., que tenga influencia en la cadena de supervivencia; 4) aprobación institucional del protocolo y obtención del consentimiento, aunque se inicie la RCP por consentimiento presunto; 5) valoración retrospectiva inmediata de los tiempos de PCR (sin flujo) y de RCP (con bajo flujo), tiempo de hipoxia (hipotensión) pre y post PCR; 6) protocolo de SVB y SVA y de la cadena de supervivencia; 7) monitorización temprana de la recuperación y el grado de coma; 8) monitorización de la recuperación a los 6 meses, con expresión de las categorías de recuperación funcional global y cerebral; 9) monitorización de los efectos colaterales, y 10) análisis global de los subgrupos, evaluación e interpretación6. La mejora de los resultados obtenidos con la RCP en la comunidad se pueden alcanzar tras su análisis, minimizando los tiempos de respuesta y aumentando los tiempos de PCR reversible. Para optimizar el resultado final en la PCR, se deberían recomendar investigaciones basadas en: a) fisiopatología, terapéutica, marcadores pronósticos; b) investigación básica celular, del órgano y del organismo; c) comunicación y consenso entre investigadores y centros; d) empleo de modelos de experimentación animal que orienten otros estudios en humanos; e) desarrollo de tratamientos específicos y etiológicos, y f) estudios epidemiológicos que abarquen a la comunidad y a ensayos clínicos aleatorizados73.
Tratamiento con hipotermia en la PCR. En contraste con la hipotermia accidental, en la hipotermia empleada con fines terapéuticos, por ejemplo neurocirugía, bypass cardiopulmonar, etc. esta disminución se produce de forma controlada en cuatro niveles diferentes: ligera (36-34 °C), moderada (33-28 °C), intensa (27-17 °C) y profunda (16-4 °C)74. En 1987, en experimentos de PCR prolongada en perros se observó que la hipotermia, provocada de una manera accidental, era beneficiosa, por lo que en investigaciones sucesivas en perros se comprobó que tras PCR sin flujo de 10 a 12 min de duración, el empleo de hipotermia ligera durante 12 h era capaz de mejorar la supervivencia e incluso impedir la lesión cerebral75. Tras una PCR sin flujo sanguíneo durante más de 5 min, la reperfusión cerebral se acompaña de un aumento del Glu intracelular, en la liberación presináptica de neurotransmisores excitadores, activación de canales iónicos complejos que originan un paso de Ca desde el exterior al interior celular, permitiendo el acúmulo de radicales libres, y de la activación de enzimas catabólicas. Sin embargo, no hay que olvidar que la hipotermia también tiene efectos adversos sobre la actividad cardíaca, la coagulación, el sistema inmunológico y equilibrio ácido-base76. En clínica humana la hipotermia se ha mostrado beneficiosa tanto en adultos74,76-78 como en niños79,80, e incluso en situaciones de hipotermia accidental producida sobre todo durante incidentes deportivos46. Estos resultados positivos no se alcanzaron en el pasado con cualquier otra intervención farmacológica. Por ello, aunque se necesitarán más estudios controlados sobre el beneficio de este procedimiento tras el RECE, "se recomienda el empleo de la hipotermia suave en supervivientes de un paro cardíaco, tan pronto como sea posible y al menos durante 12 h". Dos ensayos clínicos, uno realizado en Australia y otro en Europa, merecen un comentario más detallado: El primero de ellos se efectuó en 77 pacientes (43 en el grupo de hipotermia) y el segundo, en 275 pacientes (138 en el grupo de hipotermia). Los pacientes presentan características similares: PCR por FV prehospitalaria, normalmente presenciadas, y que tras alcanzar un RECE en menos de 60 min permanecen en coma. La hipotermia moderada alcanzada en ambos es similar (33 °C). El inicio de la hipotermia es por enfriamiento externo en ambos, aunque en diferentes escenarios (prehospitalario en el ensayo australiano y a la puerta de urgencias en el de europeo). Probablemente por ello el tiempo necesario para alcanzar la temperatura objetivo (33 °C) es menor en el primer ensayo (2 h) y mayor en el de segundo (8 h). Se mantiene también un tiempo diferente en la temperatura diana, 12 h en el estudio australiano y 24 en el europeo. Sin embargo, las diferencias son más acentuadas en los resultados. En el grupo de hipotermia la supervivencia alcanzada en el ensayo australiano es del 49% y en el europeo del 59% (10 puntos porcentuales por encima). Asimismo, la recuperación funcional es buena, del 49% y del 55%, respectivamente (6 puntos porcentuales por encima). En el grupo de normotermia, la supervivencia alcanzada en el ensayo australiano es del 32% y del 45% en el europeo (13 puntos porcentuales por encima). La recuperación funcional es buena, del 26% en el primer grupo y del 39% en el segundo (13 puntos porcentuales por encima). Se concluye que por variables no controladas en los presentes ensayos clínicos, en el grupo que recibe tratamiento estándar, la supervivencia y la recuperación funcional buena (categoría cerebral funcional según clasificación de Utstein 1 o 2) son un 13% mayor en el ensayo europeo que en el australiano; sin embargo, esta mejoría observada no se traslada por completo al grupo en el que además del tratamiento estándar se añade la hipotermia, que presenta una mejoría media sólo del 8% mayor en el ensayo europeo que en el australiano, lo que podría ser debido a un retraso en la aplicación de las medidas de enfriamiento observadas en el ensayo europeo con respecto al australiano.
Hipotermia y microdiálisis. Cada vez hay más evidencias en clínica humana de los cambios en el metabolismo cerebral con el empleo de hipotermia, tanto en situación de PCR81 como en accidente cerebrovascular agudo82. Las determinaciones mediante microdiálisis de las concentraciones en la corteza cerebral de aminoácidos excitadores (Glu), marcadores de lesión por isquemia e indicadores de cambio a metabolismo anaerobio (lactato y pH), antes, durante y después de la PCR, permiten observar que el Glu es un buen predictor, y se eleva con el grado lesional81. Los valores de Glu reflejan 3 condiciones diferentes del tejido cerebral: a) los valores basales en zonas libres de infarto cerebral disminuyen significativamente con la hipotermia, b) los valores en zonas periinfarto, de penumbra, están elevados de 3 a 4 veces en relación con su situación basal, y disminuyen hasta valores basales durante la hipotermia, y c) los valores en zonas de infarto irreversible están muy elevados y no se ven alterados por la hipotermia. Por lo tanto, en la práctica clínica la microdiálisis puede ser una técnica valiosa para detectar la lesión isquémica cerebral secundaria y las áreas potencialmente reversibles, es más sensible que la monitorización del electroencefalograma y de los potenciales evocados somatosensoriales82.