España se ha convertido en uno de los países más activos en donación en asistolia controlada incorporando la perfusión abdominal normotérmica con ECMO en más del 50% de los donantes, a lo que ha contribuido la creación de equipos móviles para apoyo a hospitales carentes de esta tecnología. El proceso de donación debe ser respetuoso con los deseos y valores del paciente y sus familiares, especialmente si hay manipulación pre mortem, y debe asimismo garantizar la ausencia de flujo cerebral. El hígado es el órgano más beneficiado al reducirse las complicaciones biliares, así como la pérdida de injertos. En el trasplante renal podría contribuir a reducir la incidencia de retraso en la función inicial del injerto; además, el procedimiento es compatible con la cirugía súper rápida en hipotermia cuando también hay donación pulmonar. El futuro pasa por la consolidación de la donación cardíaca al extender la perfusión normotérmica a la cavidad torácica.
Spain has become one of the most active countries in donation after controlled cardiac death, using normothermic abdominal perfusion with ECMO in more than 50% of all donors - a situation contributed to by the creation of mobile teams to support hospitals lacking this technology. The donation process must be respectful of the wishes and values of the patients and their relatives, especially if there is pre mortem manipulation, and the absence of cerebral perfusion should be guaranteed. The liver is the most benefited organ by reducing biliary complications as well as the loss of grafts. In renal transplantation, the technique could contribute to reduce the incidence of delayed graft function. In addition, the procedure is compatible with surgical rapid recovery in hypothermia when there is also lung donation. The future lies in the consolidation of cardiac donation by extending normothermic perfusion to the thoracic cavity.
La donación en asistolia controlada (DAC) inició su camino en España hace aproximadamente 10 años1. A la necesidad creciente de órganos para trasplante se sumaba un descenso progresivo del potencial de donación en muerte encefálica (ME). Asistíamos también a cambios en el cuidado del paciente al final de la vida, patentes en las recomendaciones de la Sociedad Española de Medicina Intensiva Crítica y Unidades Coronarias, que abordaban la adecuación del tratamiento de soporte vital (ATSV) y reconocían lo inapropiado de prolongar el tratamiento más allá de una situación de futilidad2,3. En este contexto se puso en marcha un programa nacional para el desarrollo de la donación de órganos tras la decisión, previa e independiente, de ATSV. Tras un proyecto piloto de DAC, el desarrollo de un nuevo marco regulatorio en 20124 y la publicación del Documento de Consenso Nacional sobre Donación en Asistolia5, se sentaron las bases de su práctica.
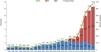
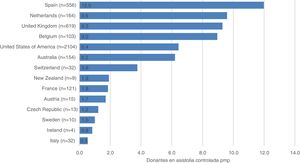
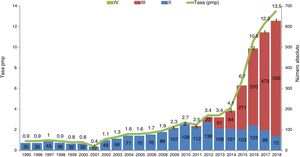
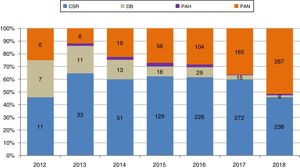
La protocolización de esta actividad, la formación de los profesionales implicados y el apoyo institucional al programa han posicionado a España como uno de los países más activos en DAC (fig. 1)6. En el año 2018 más de 100 hospitales de nuestro país habían desarrollado al menos un proceso de DAC, y el 28% de los donantes registrados lo fueron en asistolia (fig. 2)7.
Donantes en asistolia controlada por millón de población a nivel internacional en 2018.
Donantes en asistolia controlada por millón de población (pmp) reportados al Observatorio Global de Donación y Trasplante. Entre paréntesis el número absoluto de donantes en asistolia controlada.
Fuente: Observatorio Global de Donación y Trasplante (http://www.transplant-observatory.org/).
Evolución de la donación en asistolia en España.
Evolución de la donación en asistolia en España en número absoluto y tasa por millón de población (pmp).
Maastricht tipo ii: fallecimiento tras parada cardiorrespiratoria reanimada sin éxito; Maastricht tipo iii: fallecimiento tras adecuación del tratamiento de soporte vital; Maastricht tipo iv: parada cardiorrespiratoria tras fallecimiento en muerte encefálica.
Fuente: Organización Nacional de Trasplantes.
Al aumento de la actividad de DAC se ha incorporado progresivamente la perfusión abdominal normotérmica con oxigenación de membrana extracorpórea (PAN-ECMO) como técnica de preservación de órganos in situ. Sus beneficios teóricos deberían reflejarse en un mayor número de órganos disponibles y unos mejores resultados postrasplante. Durante estos años la PAN-ECMO ha coexistido con otros procedimientos de extracción: la perfusión abdominal fría con catéter de doble balón y triple luz, en progresivo desuso después de su empuje inicial, y la cirugía súper-rápida (CSR). El uso de la PAN-ECMO ha ido ganando protagonismo, hasta el punto de que se aplica en el momento actual a más del 50% de los procedimientos de DAC (fig. 3). A la explosión de esta técnica en España se ha ido sumando su utilización en otros países de nuestro entorno como Francia, Italia y Reino Unido8.
Evolución de las diferentes técnicas de preservación in situ y extracción en la donación en asistolia controlada en España.
Técnicas de preservación in situ-extracción en donación en asistolia controlada en España, en porcentajes y en números absolutos a lo largo de los años.
CSR: cirugía súper-rápida; DB: doble balón; PAH: perfusión abdominal hipotérmica; PAN: perfusión abdominal normotérmica.
Fuente: Organización Nacional de Trasplantes.
El objetivo de este artículo es describir la técnica de PAN-ECMO en la DAC y las complicaciones asociadas a su utilización, analizar la evidencia disponible sobre su impacto en la efectividad del proceso y los resultados postrasplante, abordar sus retos logísticos y éticos y anticipar su futuro papel en el trasplante cardíaco a partir de estos donantes.
Técnica de perfusión abdominal normotérmica en la donación en asistolia controladaLos potenciales DAC son pacientes con daño cerebral castastrófico o enfermedades neurodegenerativas, cardíacas o respiratorias en fase terminal, en los que se ha tomado la decisión de ATSV por considerarlo fútil y en los que es previsible una muerte precoz. Una vez la familia ha asumido dicha decisión se puede plantear la opción de la donación de órganos y, de ser coherente con los valores y principios de su ser querido, proceder a la preparación del donante.
A diferencia del donante en ME, los órganos de DAC sufren un insulto isquémico derivado de la hipotensión e hipoxia progresivas desde la ATSV hasta la parada cardiorrespiratoria (PCR), más los 5minutos de observación que exige la ley antes de certificar la muerte4.
Con intención de minimizar el insulto isquémico deben iniciarse rápidamente medidas de protección de los órganos. La CSR ha sido durante muchos años el método de elección, y es el estándar habitual en la mayoría de países9. Esta consiste en la laparotomía y/o esternotomía inmediata al exitus, según si hay donación de órganos abdominales, pulmones o ambos, seguida de la canulación de la aorta abdominal y/o arteria pulmonar, la perfusión de líquido frío de preservación y enfriamiento local y la extracción de los órganos correspondientes. Por otro lado, la PAN-ECMO se ha ido posicionando en España como una alternativa cada vez más utilizada. El procedimiento, más complejo que la CSR, incluye varias fases.
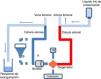
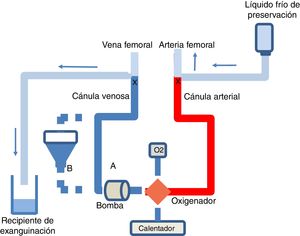
CanulaciónEsta puede hacerse tanto pre mortem como post mortem. La legislación española no prohíbe la realización de intervenciones pre mortem para una mejor preservación de los órganos, siempre que se cuente con autorización específica para ello (habitualmente un consentimiento por representación)5. Es necesario heparinizar y canalizar, en el potencial donante, arteria y vena femorales para su posterior conexión al circuito de ECMO, bajo la correspondiente sedoanalgesia (fig. 4). Habitualmente se utilizan cánulas de menor calibre (cánula venosa 18-21Fr y arterial 15-19Fr) que las usadas en el paciente crítico, ya que se perfundirá solamente la cavidad abdominal.
Esquema del circuito de ECMO y del procedimiento de exanguinación en la donación en asistolia controlada.
Circuito de ECMO sin (A) o con (B) reservorio, bomba de perfusión, oxigenador, fuente de oxígeno y calentador. Al terminar la PAN-ECMO se pinzan las cánulas arterial y venosa y se perfunde líquido frío de preservación por la cánula arterial, y se usa la venosa para la exanguinación.
La canulación es una fase crítica en todo el proceso de PAN-ECMO, ya que puede determinar el éxito o fracaso del mismo. Se han descrito hemorragias, imposibilidad de canulación y migración del balón de oclusión que han condicionado la suspensión de la PAN-ECMO y la realización de una extracción mediante CSR o, en algunos casos, la pérdida del donante10.
Si bien la canulación en la ECMO terapéutica puede ser central o periférica según los casos11, en la preparación pre mortem del DAC el acceso es periférico, bien por cirugía local, percutáneamente o de forma mixta, asumiendo que cualquiera de estas formas puede tener complicaciones12. Aunque no se puede afirmar que una técnica sea mejor que otra, el desarrollo de las técnicas percutáneas mediante Seldinger ha facilitado la participación de los intensivistas en el procedimiento13.
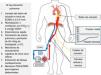
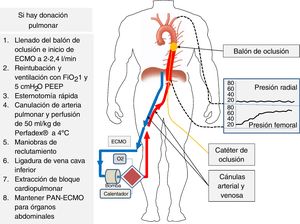
En la arteria femoral contralateral se debe colocar un catéter con balón de oclusión que se avanza vacío hasta la aorta torácica y que, una vez fallecido el paciente y antes de iniciar la ECMO, se llenará de líquido para ocluir la aorta torácica e impedir el flujo ascendente y la reperfusión de corazón y cerebro, que es una de las mayores preocupaciones con el uso de la PAN-ECMO14. Debe controlarse radiológicamente la posición del balón antes de la ATSV y monitorizar la arteria radial izquierda durante el procedimiento para asegurar la ausencia de flujo (fig. 5)15.
Canulación del donante y monitorización para la PAN-ECMO.
Se canaliza la arteria radial izquierda, cánulas arterial y venosa femorales y catéter de oclusión que se coloca al nivel de la aorta torácica. Tras el exitus se llena el balón de oclusión y al iniciar la perfusión con ECMO se observa la subida progresiva de presión no pulsátil al nivel femoral y ausencia de presión al nivel radial, lo que confirma la correcta oclusión de la aorta. Si hay extracción pulmonar se inicia esta siguiendo los pasos que se indican a la izquierda de la figura.
En algunos países como Reino Unido, donde la manipulación pre mortem no está permitida, y en algunos hospitales españoles que han optado por la preparación del donante una vez fallecido, se usa la canulación post mortem y el pinzamiento quirúrgico de la aorta torácica. En estos casos el tiempo de isquemia caliente se prolonga en función de la experiencia del equipo quirúrgico, habiéndose publicado tiempos medios de 7minutos desde la incisión de piel hasta la canulación16, y tiempos de isquemia caliente más prolongados que con la canulación pre mortem17.
Retirada del soporte vitalTerminada la preparación del potencial donante se procede a la ATSV en el propio quirófano o en la unidad de cuidados intensivos (UCI), dependiendo del protocolo de cada hospital, y se inicia el procedimiento.
Perfusión abdominal normotérmicaUna vez certificado el fallecimiento, en los donantes canulados antes de la ATSV, se llena el balón de oclusión de la aorta y se inicia progresivamente la perfusión con la ECMO hasta llegar en unos segundos a flujos entre 2 y 2,4l/min. Cuando la canulación es post mortem la ECMO se inicia después de pinzar la aorta. Se debe mantener una presión arterial media de 60-65mmHg, una temperatura de 36-37°C y un flujo de oxígeno en una relación inicial de 1/1 con el flujo de la ECMO. Se transfundirá y administrará bicarbonato si es necesario para garantizar un hematocrito>25% y un pH de 7,35-7,45, y se modificará el flujo de la fuente de oxígeno para garantizar unos gases arteriales normales. Se debe hacer un control analítico frecuente, al menos cada 30minutos, en el que se incluyen además de los gases arteriales, lactato, hematocrito y hemoglobina, ionograma y perfiles hepático y renal.
En la validación hepática se sugieren valores de AST/ALT iniciales<3 veces el límite superior de la normalidad y valores de AST/ALT finales<4 veces el límite superior de la normalidad para dar por válido el hígado18. Antes de la extracción de los órganos abdominales se detiene la ECMO y se usa la cánula arterial para la perfusión de líquido frío de preservación y la venosa para la exanguinación (fig. 4).
Dentro de los criterios de selección de los órganos se valora el tiempo de isquemia caliente, además del aspecto macroscópico del órgano y los valores analíticos. El tiempo de isquemia caliente total (desde ATSV hasta PAN-ECMO) debe ser inferior a 30-45minutos, y el de isquemia caliente funcional (desde presión arterial sistólica≤60mmHg hasta PAN-ECMO) inferior a 20-30minutos para el hígado. En el pulmón, el páncreas y el riñón se admite un tiempo de isquemia caliente total máximo de 60minutos, aunque este criterio se ha ido modificando últimamente en función de la experiencia5.
No se ha establecido de forma definitiva la duración máxima de la PAN-ECMO, pero la mayoría de las series han utilizado tiempos de entre hora y media y 2horas, a falta de estudios definitivos en este sentido10,19.
Contribución de la perfusión abdominal normotérmica a la donación de órganos abdominalesEl daño de los órganos para trasplante ocurre como consecuencia de la isquemia, desde la interrupción de la circulación del órgano hasta la perfusión de la solución hipotérmica de preservación y la liberación de metabolitos tóxicos como resultado de la reperfusión20. En la DAC se añade el estrés isquémico que sucede durante la fase agónica, por lo que se ha descrito una mayor incidencia de retraso en la función del injerto (RFI) en el caso del trasplante renal, si bien con similar evolución a largo plazo en comparación con el trasplante renal de donante en ME21. En el hígado, especialmente sensible a la isquemia, es mayor el riesgo de disfunción precoz del injerto, lesiones de la vía biliar y retrasplante, y menor la supervivencia del injerto cuando se compara con los trasplantes de órganos procedentes de donantes en ME22. La colangiopatía isquémica, una de las complicaciones más graves del trasplante hepático, es más frecuente en los receptores de injertos de DAC, en los que tiene una incidencia del 16-29% frente al 3-17% de los donantes en ME23. Parece existir una relación directa con el tiempo de isquemia, especialmente con el tiempo desde la asistolia hasta el clampaje previo a la perfusión de líquido frío de preservación24.
Con intención de minimizar estos riesgos se han planteado diversas estrategias encaminadas a reducir el tiempo de isquemia caliente, seleccionar donantes con probable fallecimiento precoz, acortar el tiempo de isquemia fría o mejorar la selección del receptor25. La estrategia que ha ofrecido mejores resultados ha sido el uso de la PAN-ECMO al revertir las desviaciones metabólicas, restablecer la fisiología celular tras la depleción energética y aclarar los metabolitos resultantes de la isquemia. De esta manera se proporciona un preacondicionamiento que soporte primero la preservación estática en frío y posteriormente la isquemia caliente en el receptor, atenuando la lesión de isquemia-reperfusión18,26.
La PAN-ECMO representa una notable mejora de cara a la obtención de órganos abdominales válidos para trasplante cuando se compara con la CSR27,28. Además, a diferencia de esta, transforma la obtención de órganos en un procedimiento «tranquilo», semejante al de una extracción en ME, con tiempo para analizar parámetros bioquímicos, evaluar y monitorizar la recuperación funcional del metabolismo hepático y la atenuación del insulto isquémico previamente a la extracción del hígado19.
La superioridad de la PAN-ECMO en el trasplante hepático de DAC ha sido puesta de manifiesto en 2 recientes estudios retrospectivos multicéntricos. La serie más amplia publicada hasta el momento por Hessheimer et al.17 recoge todos los hígados trasplantados de DAC en España desde junio de 2012 hasta diciembre de 2016. Comparando 95 trasplantes hepáticos de DAC manejados con PAN-ECMO frente a 117 extraídos con CSR encuentra menos complicaciones biliares (8% vs. 31%), una menor incidencia de colangiopatía isquémica (2% vs. 13%) y un riesgo reducido de pérdida del injerto (12% vs. 24%) con la PAN-ECMO. La serie británica de Watson et al.29, en la que se comparan 43 trasplantes hepáticos de DAC con PAN-ECMO, frente a 187 con CSR, encuentra una menor disfunción precoz del injerto (12% vs. 32%), menor pérdida del injerto a los 30 días (2% vs. 12%), menor estenosis de la anastomosis biliar (7% vs. 27%) y ausencia de colangiopatía isquémica (0% vs. 27%). Esta ausencia de colangiopatía isquémica se ha publicado incluso con donantes mayores de 65 años30. A la vista de estos últimos estudios parece justificado considerar que la PAN-ECMO en el trasplante hepático de DAC puede contribuir al éxito del trasplante28.
En cuanto al trasplante renal de DAC se ha publicado una incidencia de no función primaria del injerto del 4%, un RFI del injerto del 58% y una supervivencia al año (censurada para muerte) del 93%1. A pesar de la alta incidencia de RFI, la supervivencia a medio y largo plazo de estos riñones y la función renal es similar a la de aquellos donantes en ME. También son similares los resultados obtenidos con el trasplante de riñones de DAC con criterios expandidos, en comparación con el mismo tipo de injertos de donantes en ME21.
A la vista de esta información ¿existe alguna razón que justifique el uso de la PAN-ECMO en el DAC cuando solo hay extracción renal? Aunque es difícil contestar a esta pregunta, con esta técnica podría reducirse el daño potencial o la pérdida de órganos debido a accidentes quirúrgicos derivados de la CSR31. La PAN-ECMO parece también reducir la incidencia de RFI, y por ende la estancia hospitalaria32. Son necesarios más estudios que confirmen estos hallazgos. De confirmarse una disminución del RFI, debería realizarse una comparación del coste derivado del uso de la ECMO frente al relacionado con una mayor necesidad de diálisis en el postrasplante.
El páncreas es un órgano difícil de conseguir, por lo que la DAC representa una fuente más que añadir a la ME, tanto de forma aislada33 como en el trasplante combinado páncreas-riñón34. Aunque se han publicado resultados favorables en el trasplante de páncreas utilizando PAN-ECMO, la experiencia es todavía limitada16,19.
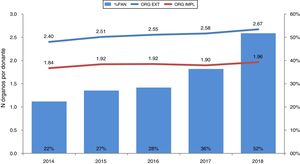
La efectividad en el proceso de donación es un dato más a favor de la PAN-ECMO, ya que la media de órganos extraídos e implantados por donante se incrementa año tras año coincidiendo con su uso creciente (fig. 6). Además, el número de órganos extraídos e implantados cuando se usa la PAN-ECMO es mayor que cuando se usa CSR (3,0 y 2,4 vs. 2,2 y 1,8, respectivamente según datos de la ONT).
Efectividad del uso de la PAN-ECMO en el proceso de donación en asistolia controlada en España.
Efectividad de la donación con el uso de la PAN-ECMO. Esta se ha incrementado año tras año hasta utilizarse en el 52% de todos los donantes en asistolia controlada en 2018. Coincidiendo con ello, el número de órganos extraídos e implantados ha ido aumentando.
ORG EXT: número de órganos extraídos por donante; ORG IMPL: número de órganos implantados por donante; %PAN: porcentaje de utilización de la perfusión abdominal normotérmica sobre el total de donantes en asistolia controlada.
El trasplante pulmonar de DAC ofrece resultados equivalentes e incluso superiores al realizado con donantes en ME35,36. Sin embargo, en nuestro país solo un 10% de los DAC son donantes de pulmón37. En la DAC los pulmones se extraen con CSR, disminuyendo rápidamente la temperatura pulmonar con enfriamiento tópico. Aunque la hipotermia torácica es perjudicial para el hígado y la normotermia abdominal lo es para el pulmón, en caso de usar PAN-ECMO en un donante multiorgánico se ha descrito una técnica combinada de extracción pulmonar con CSR y PAN-ECMO por los grupos británicos, utilizando canulación post mortem y enfriamiento tópico pulmonar con 4l de suero frío (4°C) en cada hemotórax38.
El Hospital Marqués de Valdecilla publicó una variante de esta técnica, añadiendo intervenciones pre mortem para minimizar la isquemia caliente funcional y las complicaciones durante la recuperación; de esta forma no era preciso utilizar 4l de suero salino frío minimizando el riesgo de enfriamiento transdiafragmático del hígado19. Recientemente se ha publicado una experiencia de 19 casos de DAC con este tipo de extracción combinada (la mayor serie publicada en la literatura), con unos resultados excelentes en cuanto a efectividad (se trasplantaron 16 de los 19 hígados extraídos y 37 de los 38 injertos pulmonares), y con supervivencias idénticas al grupo control de órganos procedentes de ME39.
A diferencia de los pulmones de donantes en asistolia no controlada, donde se recomienda el uso de dispositivos ex situ para validar y reacondicionar los pulmones40,41, en las experiencias con pulmones de DAC el uso de estos dispositivos ex situ no es habitual, siendo solo utilizados en casos con tiempos de isquemia funcional caliente muy elevados o pulmones edematosos36.
Dados los excelentes resultados del trasplante pulmonar en la DAC, se debe fomentar la utilización de esta técnica combinada en el donante multiorgánico. La descripción de este procedimiento combinado se resume en la figura 5. Una vez declarada la muerte del paciente e iniciada la PAN-ECMO el cirujano torácico debe realizar una esternotomía rápida. Al mismo tiempo, el donante es reintubado y ventilado con 100% de oxígeno y PEEP de 5cmH2O. La arteria pulmonar se canula y se perfunde a través de ella la solución de preservación (Perfadex®, 50ml/kg). Solo se enfrían los pulmones tópicamente con 1l de suero salino a 4°C. Una vez preservados los pulmones se realizan maniobras de reclutamiento alveolar si fuesen precisas en caso de atelectasias, y se puede proceder a la extracción en bloque del corazón y los pulmones. Previamente a la extracción del bloque cardiopulmonar se debe ligar la vena cava inferior inmediatamente por debajo de la aurícula derecha para separar los compartimentos torácico y abdominal, extrayéndose conjuntamente el bloque cardiopulmonar y dejando la PAN-ECMO funcionando el tiempo preciso, como en cualquier extracción únicamente abdominal.
La complicación más importante del procedimiento es la pérdida de flujo en la bomba del circuito ECMO por el sangrado en la cavidad torácica tras la extracción del bloque cardiopulmonar, o por la pérdida de retorno venoso al ligar la vena cava y aislar ambos compartimentos (tórax y abdomen). Para evitarlo se debe ligar la vena ácigos y realizar una hemostasia cuidadosa de la cavidad torácica. Asimismo, se debe administrar 1-1,5l de solución salina al donante antes de la ligadura de vena cava para compensar la pérdida de retorno venoso. Se ha descrito una variación del procedimiento, con resultados satisfactorios, que consiste en no ligar la vena cava inicialmente, mejorando el volumen de retorno venoso y evitando con ello la complicación descrita anteriormente42.
Se debe destacar que, tras el pinzamiento de la vena cava, se pierden todos los accesos vasculares yugulares, subclavios y de extremidades superiores, por lo que la administración de fluidos y/o hemoderivados solo se puede realizar por un catéter femoral o por el reservorio de la ECMO (fig. 4).
Papel de los equipos móviles de oxigenación por membrana extracorpórea en la promoción y manejo del donante en asistolia controladaSegún recomendaciones de la Extracorporeal Life Support Organization43, la ECMO es una técnica compleja que se debe concentrar en centros con suficiente experiencia en cirugía cardiaca, trasplante cardiaco y/o pulmonar y UCI cardiotorácica. Por otra parte, actualmente son más de 100 los hospitales del territorio nacional que cuentan con programas de DAC, muchos de los cuales carecen de los medios necesarios para poner en práctica procesos con PAN-ECMO. La experiencia publicada sobre los beneficios de este procedimiento, especialmente en la donación hepática, pone de manifiesto la importancia de buscar los medios necesarios para que esta técnica de preservación llegue a todos los centros con programas de DAC. En el apartado sobre recomendaciones del uso de ECMO en donación de órganos del documento de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias se recomienda que «si no se dispone de esa tecnología deben establecerse acuerdos de colaboración con hospitales que cuenten con ella y que puedan desplazarse»44.
En nuestro país se han puesto en marcha en varias comunidades equipos móviles de ECMO que se desplazan a hospitales con DAC para apoyar la preservación y extracción de órganos abdominales45–47. Actualmente son 13 los centros que disponen de estos equipos y, según datos de la ONT, en los últimos 2 años han participado en el 26% de los DAC manejados con PAN-ECMO.
La composición de estos equipos es variable, pero básicamente deben contar con un cirujano, un enfermero/a o perfusionista y un intensivista, que colaborarán estrechamente con la coordinación de trasplantes del hospital donante y con los cirujanos extractores.
Aspectos éticos de la perfusión abdominal normotérmicaEl uso de la PAN-ECMO ha dado lugar a discusiones de tipo ético en relación con la manipulación del paciente antes de su fallecimiento, la información sobre el procedimiento en el consentimiento informado o el restablecimiento de la circulación tras el diagnóstico de fallecimiento14. Se ha considerado la canulación pre mortem o la administración de heparina una agresión a la integridad del paciente para el beneficio de un tercero. Pero en la donación de órganos de donante vivo, por ejemplo, un ciudadano acepta actuaciones sanitarias sobre su propio cuerpo que no están orientadas a mejorar su salud, sino la de otros ciudadanos. Este derecho a ayudar a otros seres humanos no debe vulnerarse desde un enfoque paternalista. Las discusiones sobre la canulación pre mortem deben tener en cuenta el principio de autonomía del paciente, es decir, permitirle elegir la posibilidad de donar sus órganos y de lograr el mejor resultado posible de la donación, como respeto a la libertad de cada cual para gestionar su propia biografía.
El principio de no maleficencia no se vulnera con la canulación pre mortem. No hay intención de dañar y se garantiza el bienestar del paciente mediante una sedoanalgesia adecuada. A lo que sí nos obliga el principio de no maleficencia es a no obstaculizar el derecho a decidir libremente, el derecho al principio de representación del paciente, de la donación como parte integral de los cuidados al final de la vida o el principio de respeto a su proyecto de vida, sus valores y sus ideales.
Cuando el paciente no puede tomar sus propias decisiones se debe recurrir a la toma de estas por representación, utilizando tanto el criterio subjetivo (poniendo en práctica las instrucciones del paciente sobre los cuidados que prefiere cuando sea incapaz) como el criterio del juicio sustitutivo (el representante toma la decisión que adoptaría el mismo paciente si fuera capaz)48.
Para la toma de decisiones en los cuidados al final de la vida es fundamental que la decisión libre se produzca después de recibir la información adecuada. En el caso de la canulación pre mortem o la administración de heparina, es obligatorio que se disponga de un documento de consentimiento informado que registre ese proceso de información a la familia, su comprensión y su acuerdo5.
Se ha sugerido que el restablecimiento de la circulación con el uso de la ECMO invalidaría la declaración de muerte si la perfusión cerebral no está adecuadamente excluida, pues el fallecimiento está determinado por el cese permanente del flujo cerebral14. Sin embargo, este riesgo de la PAN-ECMO es un problema técnico más que ético. El uso de un protocolo de bloqueo aórtico, con comprobación del volumen de oclusión intraaórtico y monitorización invasiva de la presión en arteria radial izquierda durante todo el procedimiento de preservación y extracción garantiza la ausencia de reperfusión cerebral15,18.
El futuro de la perfusión normotérmica: la donación cardiacaEl corazón no ha sido considerado un órgano trasplantable en este tipo de donantes hasta los primeros años del siglo xxi, al considerar que el insulto isquémico tras la PCR ocasionaba un daño miocárdico irreversible. Sin embargo, en 2008 el equipo de Denver (Colorado, Estados Unidos) publicó los 3 primeros casos de trasplante cardiaco pediátrico de DAC49. El protocolo incluía heparinización y canulación pre mortem. La media de edad de los donantes fue de 3,7 días, el tiempo medio desde la ATSV hasta el fallecimiento de 18,3minutos y el tiempo desde la PCR hasta la confirmación de fallecimiento osciló entre 75segundos y 3minutos, lo que no estuvo exento de controversia. Para minimizar el tiempo de isquemia donantes y receptores se colocaron en quirófanos contiguos. La supervivencia de los receptores a los 6 meses fue del 100%.
Un año después el grupo del Hospital Papworth (Cambridge, Reino Unido) recuperó el corazón de una DAC de 57 años en la que, tras el fallecimiento y el pinzamiento de los troncos supraaórticos para evitar la reperfusión cerebral, instauraron un sistema de perfusión toracoabdominal normotérmico con ECMO (PTAN-ECMO). El corazón se recuperó a pesar de 23minutos de isquemia caliente, y los autores plantearon la posibilidad de que estos corazones pudieran ser utilizados para trasplante50.
En 2015 el Hospital St. Vincet (Sidney, Australia) publicó los 3 primeros pacientes adultos trasplantados con corazones de DAC. Los donantes tenían menos de 40 años y un tiempo máximo de isquemia caliente de 30minutos. Los corazones eran extraídos mediante CSR, protegidos con cardioplegía y transferidos a un sistema portátil ex situ (Organ Care System® Transmedics) cebado con la sangre del propio donante para preservación, resucitación y traslado en caso necesario51. Este mismo grupo publicó recientemente su experiencia con 23 trasplantes cardiacos de DAC con una supervivencia al año del 96%, comentando que sus resultados eran equiparables a los obtenidos con donantes en ME52.
El mismo protocolo australiano fue casi simultáneamente utilizado en Reino Unido en los hospitales de Papworth53 y Harefield54, y más recientemente en Manchester55, con extracción mediante CSR de los corazones y transferencia al OCS para su recuperación y evaluación antes del trasplante. Por su parte, el grupo de Papworth utilizó un protocolo diferente (basado en su experiencia previa50) consistente en la recuperación cardíaca in situ mediante PTAN-ECMO, seguida de la preservación ex situ en OCS. En este caso, tras la declaración de muerte, el donante era sometido a esternotomía media y pinzamiento de los troncos supraaórticos pare excluir la circulación cerebral. Tras la canulación de la aorta ascendente y la aurícula derecha se iniciaba la PTAN-ECMO de los órganos potencialmente trasplantables (corazón, pulmón, hígado, páncreas y riñones). La ausencia de flujo cerebral era confirmada mediante Doppler carotídeo, y la función miocárdica evaluada mediante catéter de Swan-Ganz, ecografía transesofágica y curvas presión-volumen. Con este procedimiento Messer et al. publicaron en 2016 los casos de 9 pacientes trasplantados con 100% de supervivencia y sin episodios de rechazo56. Los corazones fueron colocados para su preservación y transporte en OCS excepto en un caso en el que el injerto fue directamente trasplantado previa preservación en frío en un receptor situado en el quirófano contiguo57.
Hasta el año 2019 el número total de corazones trasplantados de DAC entre Australia y Reino Unido es de 105. El grupo de Papworth ha realizado 40 trasplantes mediante extracción directa y recuperación ex situ y 20 con PTAN-ECMO y recuperación ex situ, con unos resultados comparables a los de receptores de donantes en ME58.
En 2019 Tchana-Soto et al. publican los 2 primeros casos europeos, no británicos, con un protocolo modificado59. Estos autores llevan a cabo una canulación periférica pre mortem con pinzamiento de troncos supraaórticos tras el fallecimiento antes de iniciar la PTAN-ECMO. Posteriormente, el corazón es destetado de la ECMO y evaluado in situ antes de ser trasplantado a un receptor del mismo hospital. Los autores comentan que, además de la buena evolución de ambos receptores, con este procedimiento se reducen los importantes gastos que suponen la evaluación y preservación cardíaca ex situ.
La menor disponibilidad de corazones para trasplante, derivada de un cambio en el perfil del donante, ha obligado al uso de criterios expandidos en la aceptación de estos órganos. La consideración del trasplante cardiaco de DAC, como se ha hecho en otros países, podría aumentar el número de corazones disponibles cuando este procedimiento se ponga en marcha en nuestro país.
ConclusionesLa DAC se inició en España hace aproximadamente 10 años, favorecida por la progresiva concienciación de los intensivistas de la importancia de los cuidados al final de la vida del paciente crítico y la ATSV. Su progresivo aumento ha posicionado a España como uno de los países más activos en esta forma de donación en el momento actual. A ello se ha unido el uso cada vez más frecuente de la PAN-ECMO, ganando protagonismo hasta utilizarse en más del 50% de los donantes.
La técnica requiere una cuidadosa canulación del donante, antes o después de su fallecimiento, dependiendo de los diferentes protocolos utilizados, y un conocimiento profundo de las técnicas de perfusión con ECMO.
Asegurar la correcta oclusión de la aorta torácica para evitar la reperfusión cerebral ha sido motivo de preocupación y una exigencia tanto de tipo técnico como ético.
Con la PAN-ECMO se revierte parcialmente el daño ocasionado por el insulto isquémico desde la fase agónica hasta la declaración de exitus, representando una importante mejora de cara a la obtención de órganos abdominales, muy especialmente del hígado, en el que se ha reducido la incidencia de colangiopatía isquémica. Esta técnica no es incompatible con la extracción simultánea de pulmones, a pesar de que para estos se emplea la CSR con hipotermia.
Aunque no está disponible en muchos hospitales, la puesta en marcha de equipos móviles de ECMO ha favorecido la extensión de su uso a hospitales carentes de esta tecnología.
Por último, aunque el corazón no se consideró inicialmente un órgano trasplantable debido al insulto isquémico sufrido tras la PCR, las recientes experiencias australianas y británicas han puesto de manifiesto que el trasplante de corazón de DAC es posible, abriendo un importante campo de mejora a la hora de incrementar el número de corazones para trasplante.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
A la Dra. Elisabeth Coll, Jefe de Servicio de la Organización Nacional de Trasplantes, por la revisión crítica del manuscrito y los datos aportados para su realización.
A la Organización Nacional de Trasplantes tanto por la información aportada en esta ocasión como por la inestimable labor realizada a lo largo de tantos años.