INTRODUCCIÓN
La pericarditis purulenta es una entidad de escasa incidencia en la actualidad, representando sólo un pequeño porcentaje de las causas de pericarditis aguda o subaguda. Descrita clásicamente como complicación de infecciones primarias causadas por gérmenes grampositivos, su espectro microbiológico y sus formas de presentación clínica se han ampliado en las últimas décadas, con la extensión de las terapias inmunosupresoras y de la cirugía cardiotorácica. Su reconocimiento clínico precoz no es sencillo en ausencia de infección primaria evidente. Su curso natural es frecuentemente fatal y la evolución a complicaciones graves en pacientes tratados sigue siendo considerable, especialmente en forma de cuadro séptico, taponamiento recidivante o, con menor frecuencia, constricción pericárdica. No existe un claro consenso sobre cuál es el manejo óptimo de esta entidad, debido en parte a la menor experiencia existente en las últimas décadas. La pericarditis purulenta de etiología neumocócica es una complicación bien reconocida de la infección pleuropulmonar por este germen, aunque excepcional en la actualidad. Presentamos un caso de pericarditis neumocócica de foco primario desconocido y, a propósito de él, revisamos la epidemiología, etiología, presentación clínica y opciones de manejo médico y quirúrgico de las pericarditis purulentas en general, a la luz de una revisión de la literatura médica fundamental publicada al respecto.
CASO CLINICO
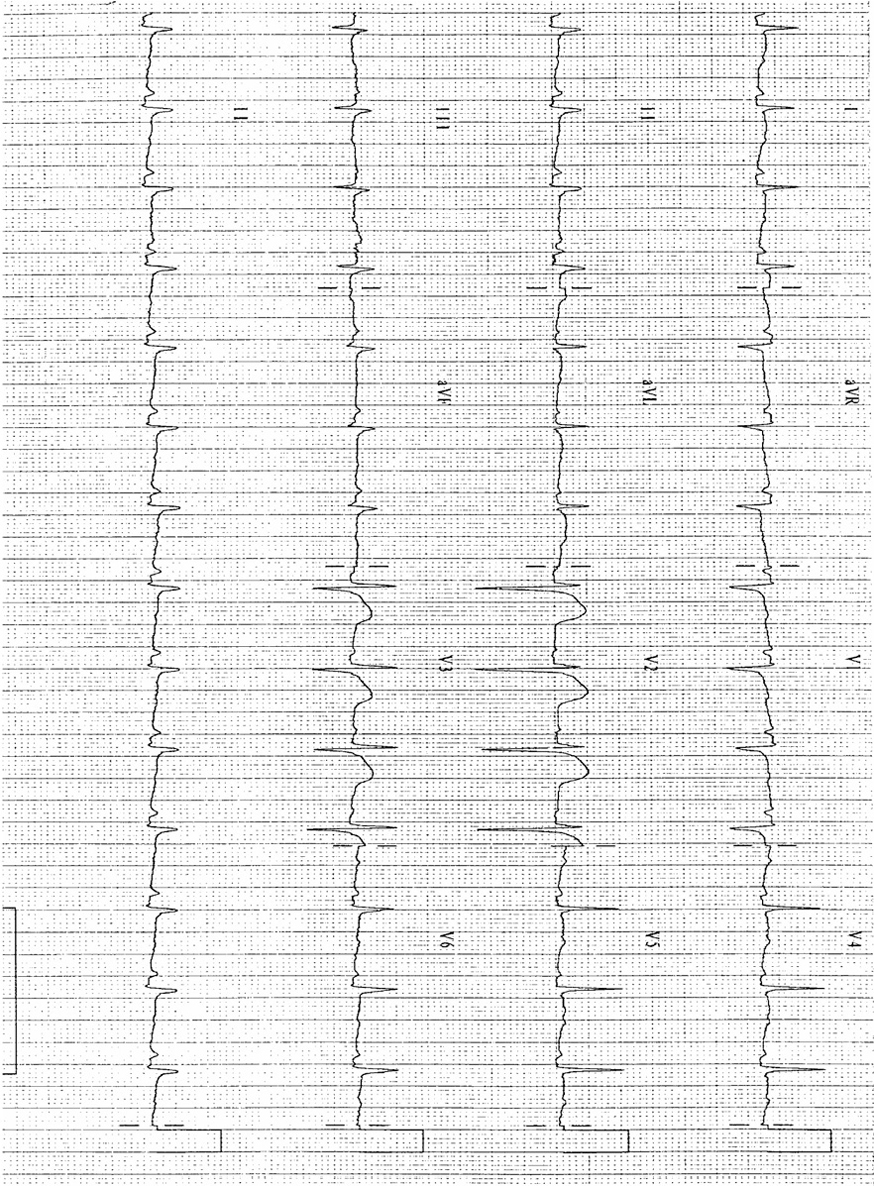
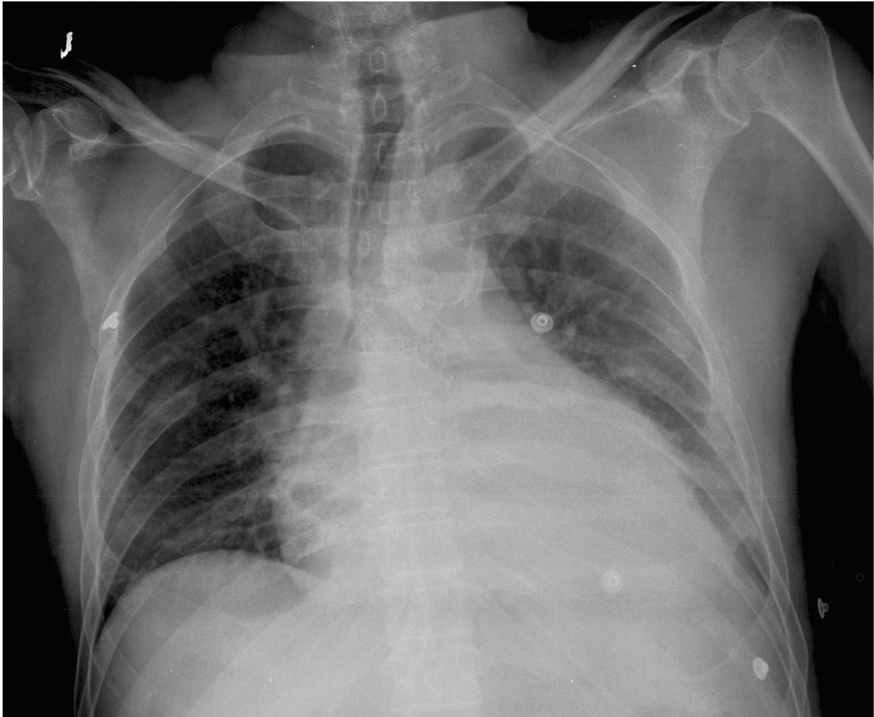
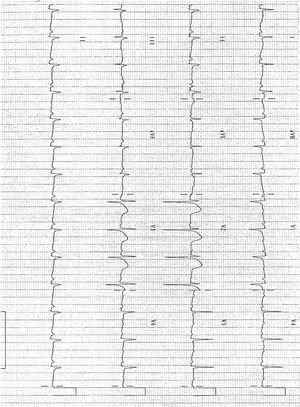
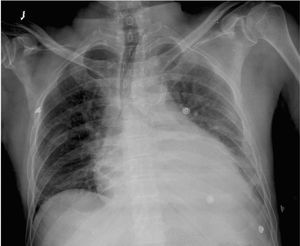
Varón de 56 años de edad, con antecedentes de enfermedad coronaria (infarto agudo de miocardio inferior en 1985, enfermedad de coronaria derecha con tratamiento médico), diabetes mellitus tipo 2 insulinodependiente, hipertensión arterial, ulcus gástrico y bulbar secundario a antiinflamatorios y bursitis séptica estafilocócica cuatro meses antes. Dos semanas antes del ingreso comienza con dolor epigástrico irradiado a región precordial, que aumenta con la inspiración, disnea de moderados esfuerzos y sensación distérmica. A su ingreso presenta tensión arterial sistólica 80 mmHg, frecuencia cardíaca 100 lpm, saturación de O2 con oxigenoterapia 90%, temperatura de 39 ºC e ingurgitación yugular; siendo el resto de la exploración física anodino. En la analítica destaca leucocitosis de 22.640 con 85,5% de polimorfonucleares, troponina 2,43 ng/ml. Electrocardiograma en ritmo sinusal a 95 lpm, elevación segmento ST de 2 mm en V2, mínima elevación en resto de precordiales, descenso PR en V5 V6 y II (fig. 1). Radiografía de tórax con cardiomegalia y discreto pinzamiento del seno costofrénico izquierdo (fig. 2). Se practica ecocardiograma transtorácico y transesofágico que muestran ventrículo izquierdo normal con acinesia inferoposterobasal e hipoquinesia leve lateral, derrame pericárdico severo (20 mm posterior, 7 mm anterior), colapso diastólico de aurícula derecha, leve dilatación de ventrículo derecho, vena cava inferior dilatada (25 mm) con colapso inspiratorio disminuido.
Figura 1. Electrocardiograma: supradesnivelación del segmento ST en V2 e infradesnivelación del segmento PR en I, II, V4 y V5.
Figura 2. Radiografía posteroanterior de tórax; cardiomegalia y borramiento costofrénico izquierdo.
Ingresa en la Unidad de Cuidados Intensivos (UCI), precisando expansión de volumen, soporte inotrópico y oxigenoterapia. Presenta rachas de fibrilación auricular paroxística. Se realiza pericardiocentesis, obteniéndose líquido turbio con pH de 7,03. Ante la sospecha de pericarditis piógena, se inicia cobertura antibiótica empírica con cefepime. En líquido pericárdico se aísla Streptococcus pneumoniae, resistente a penicilina, eritromicina y clindamicina, sensible a cefotaxima. Se realiza toracocentesis de derrame pleural izquierdo obteniéndose exudado sin datos de infección y con cultivo negativo. Se practican hemocultivos seriados siendo el resultado negativo y serología para virus de la inmunodeficiencia humana (VIH), Citomegalovirus, Chlamydia (trachomatis, pneumoniae, psitacci), Legionella, Adenovirus, Virus influenzae, Mycoplasma y hepatitis, con el único resultado positivo para virus de la hepatitis C.
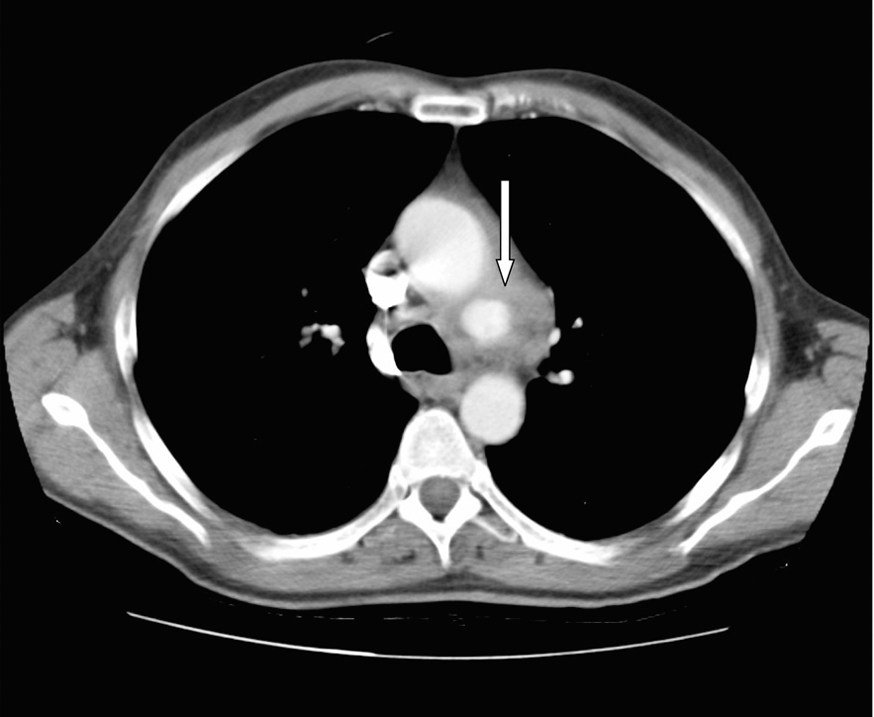
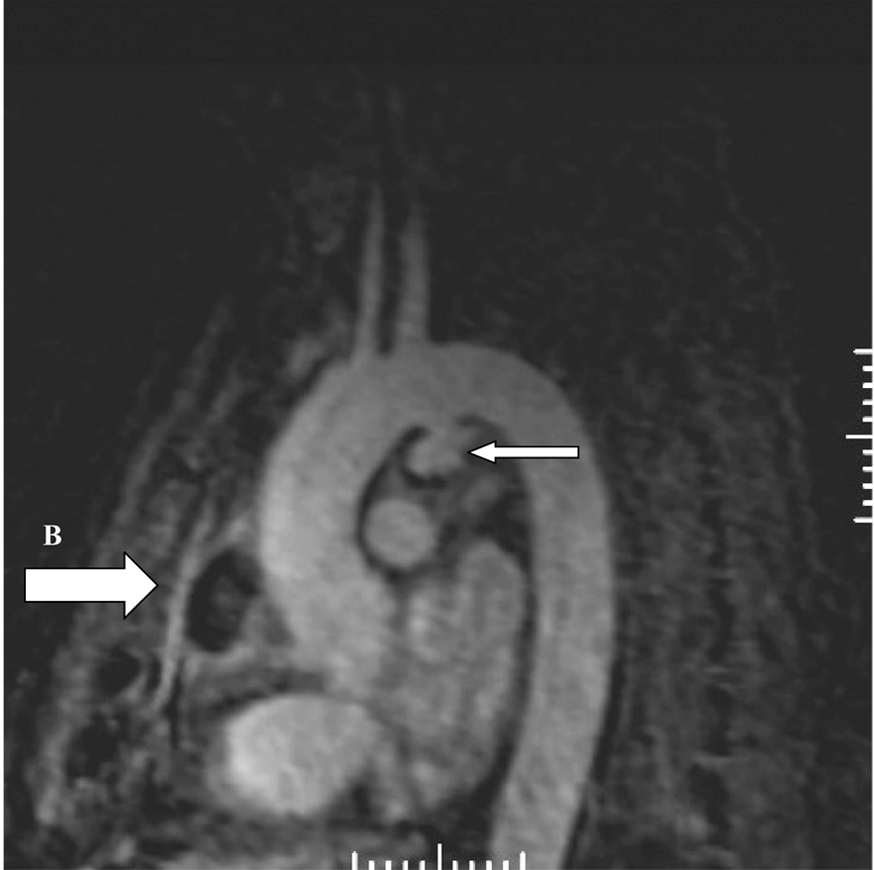
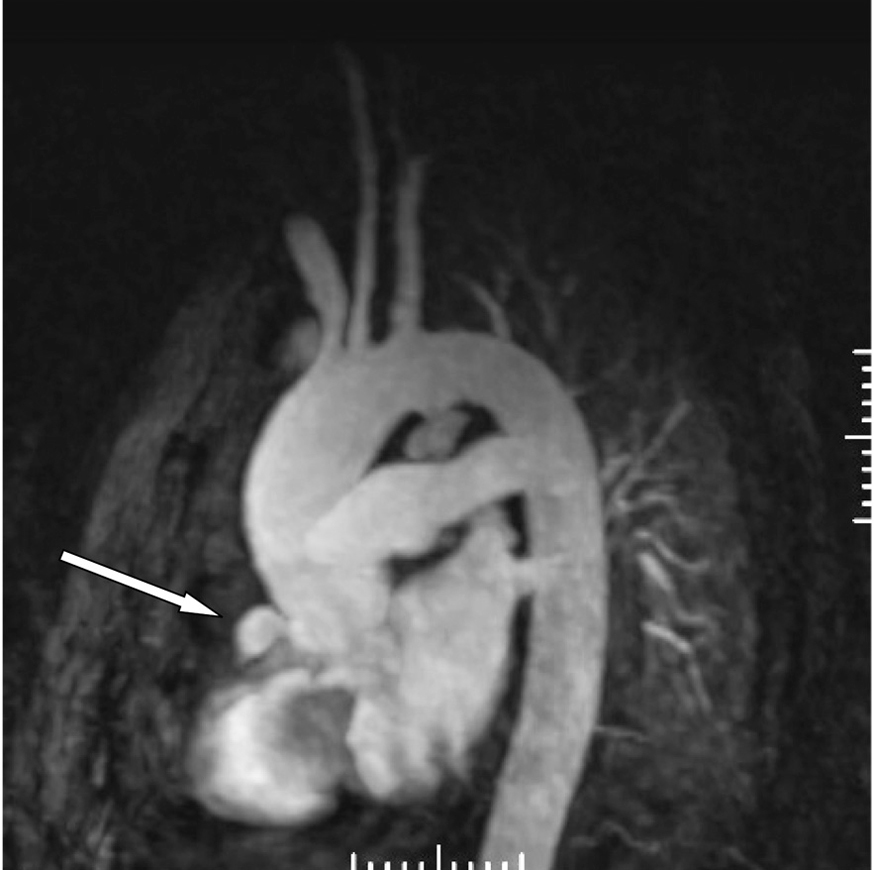
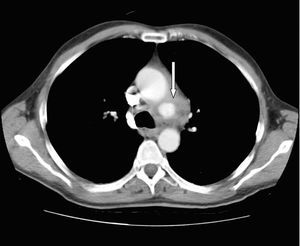
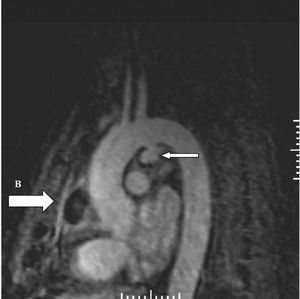
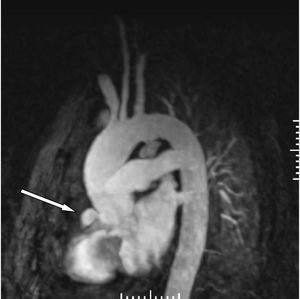
Consultado el caso con el Servicio de Cirugía Cardíaca se decide mantener tratamiento médico y actitud expectante. En ecocardiogramas posteriores mantiene mínimo derrame pericárdico, sin signos de taponamiento y con imágenes de organización en su interior. Presenta buena evolución hemodinámica, respiratoria y general, siendo dado de alta de la UCI a los 5 días de su ingreso. En ecocardiograma transtorácico realizado 10 días después, con el enfermo asintomático, se detecta imagen de probable seudoaneurisma en cayado aórtico, y persistencia de derrame pericárdico. Se practica resonancia magnética nuclear torácica que documenta la presencia de un aneurisma en cayado aórtico, distal a la salida de troncos supraaórticos, probable aneurisma de arteria coronaria derecha y colección intrapericárdica (figs. 3, 4 y 5).
Figura 3. Tomografía computarizada de tórax: imagen de aneurisma en cayado aórtico (flecha).
Figura 4. Angiorresonancia magnética nuclear torácica: aneurisma en cayado aórtico (A) y colección intrapericárdica (B).
Figura 5. Angiorresonancia magnética nuclear torácica: dilatación aneurismática de arteria coronaria derecha.
DISCUSIÓN
Desde la introducción de la antibioterapia en la práctica clínica, la pericarditis purulenta se ha convertido en una enfermedad inusual.
En un estudio de 231 pacientes con derrame pericárdico agudo1, en el que la etiología fue confirmada en un 14% de los casos, en sólo 2 era bacteriana (0,86%). En otra serie de 204 pacientes, 107 casos (52,4%) tuvieron un diagnóstico etiológico, con sólo 19 casos atribuibles a infección microbiana no tuberculosa2.
La pericarditis purulenta (PP) ocurre más frecuentemente como resultado de la extensión directa de una infección pleuro-pulmonar (neumonía o empiema). Ocasionalmente resulta de una siembra hematógena, siendo la infección primaria muy rara. Los organismos más comúnmente implicados son Staphylococcus aureus, Haemophilus influenzae, Neisseria meningitidis y Streptococcus pneumoniae; menos frecuentemente se aíslan bacilos gramnegativos entéricos, Pseudomonas aeruginosa, Salmonella, anaerobios y hongos.
En la era preantibiótica, la etiología neumocócica era la más prevalente. En una revisión de 26 pacientes, entre los años 1960 y 1974, la etiología más frecuente era la estafilocócica, describiéndose sólo dos casos de etiología neumocócica, ambos en el seno de neumonía y empiema. En esta serie, los pacientes con infección postoperatoria o con infección secundaria a afectación intracardíaca tenían un pronóstico infausto, siendo mejor en aquellos casos secundarios a infección pleuro-pulmonar o diseminación hematógena3. En otra experiencia de 12 años (1975-1987) que incluía 15 casos, se describió una elevada tasa de infección por anaerobios o polimicrobiana (superior al 50%), describiéndose sólo un caso de etiología neumocócica4, atribuyeron los autores este cambio de espectro microbiológico respecto de las series clásicas a diversos avances médicos (cirugía cardíaca, quimioterapia, trasplante de órganos) y resaltando la importancia de obtener cultivos específicamente dirigidos a flora anaerobia. Una serie posterior de Sagrista-Sauleda et al5, que recoge 33 casos entre 1972 y 1991, la etiología más frecuente fue la estafilocócica, la estreptocócica (Streptococcus pyogenes) y la neumocócica; resaltando los autores la permanencia de este patrón microbiológico pese al paso del tiempo. En esta serie, 6 pacientes requirieron pericardiectomía; la coinfección predominante fue el empiema y el pronóstico a largo plazo excelente entre los supervivientes.
La PP neumocócica, al igual que las PP en general, habitualmente viene precedida de una infección primaria a otro nivel. En la mayor serie existente, de Kauffman6, de 113 casos, todos menos uno tenían foco primario reconocible, neumónico en un 93% de las ocasiones. Existen escasas comunicaciones de PP neumocócica primaria, en las que se llega incluso a dudar de infección primitiva en sentido estricto7.
La PP produce derrame pericárdico que, si no es tratado, evoluciona a colapso hemodinámico, taponamiento cardíaco y muerte, generalmente de forma rápida. Los síntomas suelen ser de aparición aguda y no específicos, predominando la fiebre, taquicardia, taquipnea y deterioro del estado general sobre los síntomas típicos de pericarditis. El dolor torácico no es frecuente. En una revisión de los aspectos del diagnóstico clínico de esta entidad8, los autores enfatizan su dificultad.
La mayoría de los pacientes presentan o han presentado una infección a otro nivel: neumonía, meningitis, osteomielitis aguda, artritis, otitis media o infección de parte blandas. Los pacientes sometidos a cirugía torácica, cardíaca o esofágica o los que han sufrido traumatismo torácico, son otro grupo de riesgo. La inmunosupresión de cualquier etiología predispone a la infección.
La ecocardiografía es la técnica de elección para el diagnóstico del derrame y, en conjunción con los hallazgos clínicos, para el diagnóstico de taponamiento, además de ayudar a la práctica de la pericardiocentesis que permite la confirmación definitiva del diagnóstico. La técnica se considera segura cuando se practica en el escenario apropiado y por personal entrenado. Aproximadamente el 50%-60% de los cultivos del líquido pericárdico son positivos en los pacientes con PP. El líquido usualmente presenta elevado recuento de leucocitos, a expensas de polimorfonucleares.
El tratamiento apropiado requiere antibioterapia intravenosa, drenaje pericárdico y medidas de soporte intensivo. El tratamiento antibiótico inicial debe cubrir Staphylococcus aureus y bacilos gramnegativos, recomendándose una combinación de un betalactámico resistente a penicilasa con una cefalosporina de 3.ª generación, considerando el uso de vancomicina en áreas de elevada tasa de resistencia estafilocócica. Se recomienda la asociación de un aminoglucósido en caso de inmunosupresión, en el postoperatorio de cirugía cardíaca o cuando el foco primario es genitourinario. La antibioterapia intrapericárdica no parece tener especial indicación dada la excelente penetración de los antimicrobianos convencionales en la cavidad pericárdica. La duración del tratamiento es empírica, pero habitualmente se prolonga al menos por 3-4 semanas.
Aunque la pericardiocentesis evacuadora es imperativa en el paciente inestable y confirma el diagnóstico, a menudo no proporciona una completa y sostenida resolución del derrame. Obviamente, si la pericardiocentesis con aguja no resuelve el taponamiento, el drenaje quirúrgico debe efectuarse de manera urgente. En la serie de Boyle9, de 93 pacientes que recibieron tratamiento antibiótico, 30 requirieron drenaje quirúrgico. Determinar qué pacientes van a requerir cirugía o los que se beneficiarían de pericardiectomía precoz es algo desconocido. El drenaje quirúrgico abierto se ha empleado en un porcentaje importante de los casos de PP descritos en la literatura. Se han descrito diversas técnicas, entre las que las habituales son la implantación de un tubo de drenaje subxifoideo, la práctica de una ventana pericárdica (a pleura o peritoneo) y la pericardiectomía (parcial, interfrénica o completa). La idónea es tema de controversia y las series centradas en los aspectos quirúrgicos del tratamiento son cortas y discrepantes10. Parece claro, no obstante, que la pericardiectomía es necesaria en el grupo de pacientes que desarrollan constricción pericárdica sostenida o taponamiento recurrente pese al empleo de técnicas menos agresivas11. Algunos autores abogan por la práctica de un drenaje quirúrgico agresivo si dos pericardiocentesis evacuadoras son fallidas. La fibrinólisis intrapericárdica precoz es defendida por algunos autores como tratamiento coadyuvante eficaz y seguro destinado a minimizar el riesgo de constricción y la eventual práctica de pericardiectomía. Se trata, igualmente, de comunicaciones sobre series muy cortas de pacientes12-14.
En cuanto al pronóstico, la mortalidad bajo tratamiento adecuado oscila entre el 2% y el 20%. La ausencia de drenaje precoz y adecuado aumenta la tasa de mortalidad. Otros factores de mal pronóstico son la presencia de taponamiento en el momento del diagnóstico, la infección por Staphylococcus aureus o bacilos gramnegativos y la malnutrición. La mayoría de los pacientes sobrevive sin secuelas. La pericarditis constrictiva es la secuela más frecuente, aunque inusual, y ocurre generalmente en las semanas siguientes al diagnóstico. Otras complicaciones aún más raras son la formación de aneurismas micóticos aórticos, la infección miocárdica y la bacteriemia sistémica15.
El caso que presentamos ejemplifica el reto diagnóstico y terapéutico de una entidad infrecuente, sobre la que no existe consenso. Nuestra experiencia apoya la impresión de otros autores, partidarios de un manejo agresivo de esta infección.