INTRODUCCION
En 1892, William Osler afirmó que si no fuera por la gran variabilidad entre los individuos, la medicina podía ser considerada una ciencia y no un arte. En el siglo xxi la medicina intensiva no ha podido erradicar el componente de arte en su labor asistencial.
Indudablemente, factores como la intensidad de la noxa y el estado previo de salud determinan la evolución de la enfermedad. No obstante, existe cada vez mayor evidencia que indica la importancia del componente genético en la presentación clínica y el pronóstico del paciente ingresado en las UCI1.
Los rápidos avances de la biología molecular durante los últimos 10 años han permitido que se conozcan con mayor detalle los mecanismos moleculares de la enfermedad y la respuesta celular al estrés. La base sobre la que descansa esta respuesta son los genes.
El primer genoma secuenciado completamente de un ser vivo corresponde al de la bacteria Haemophilus influenzae. Desde entonces se han secuenciado más de 100 genomas bacterianos y de algunos organismos multicelulares2.
El conocimiento de aspectos genéticos del paciente crítico es de interés por las siguientes razones: a) la variabilidad genética puede ser un factor de riesgo y un indicador pronóstico de enfermedades poligénicas (p. ej., sepsis, fracaso multiorgánico); b) la identificación de características genéticas permitirá una mejor selección de pacientes para ensayos clínicos; c) el estudio de los genes ayudará a descubrir las bases moleculares de la respuesta a los fármacos (farmacogenética)3, y d) los genes pueden resultar en un futuro próximo una diana en el tratamiento: terapia génica del paciente crítico4.
El objetivo de este trabajo es revisar los aspectos elementales del polimorfismo genético (PG) que tienen interés para el enfermo crítico desde el punto de vista de la susceptibilidad y el pronóstico en la infección y la sepsis. Además, pretende resaltar la importancia de un nuevo campo de conocimiento que comienza a aplicarse en medicina intensiva y sobre el que el clínico tendrá que adquirir habilidades para la toma de decisiones en un futuro no muy lejano.
POLIMORFISMO GENÉTICO: CONCEPTO
El PG es una variación en la secuencia del ADN que ocurre en al menos un 1% de la población5; los PG pueden ocurrir en los intrones (secuencias de ADN que no codifican información), los exones (secuencias que codifican información) y las regiones promotoras (regulan el proceso de transcripción). Las variaciones genéticas individuales más frecuentes son las que afectan al cambio de una base por otra de ADN: son los llamados polimorfismos genéticos de un solo nucleótido (SNP, del inglés single nucleotide polymorphisms).
En general, el significado funcional del PG tiene mayor relevancia cuando se traduce en un cambio de un aminoácido en el producto del gen o cuando directamente afecta a la transcripción, la estabilidad o la traslación de ARNm. Además, comienza a existir evidencia de que los PG localizados en los intrones pueden tener también significado funcional6.
MÉTODOS BASICOS DE ESTUDIO DEL POLIMORFISMO GENÉTICO
Polimorfismo del tamaño de los fragmentos de restricción
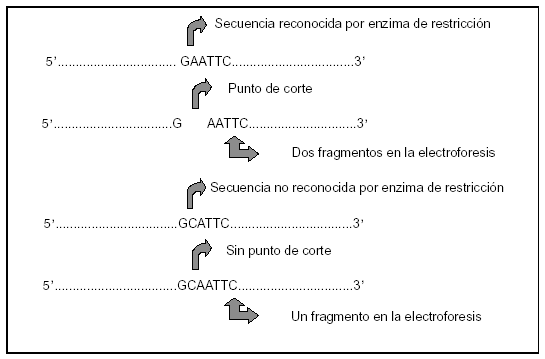
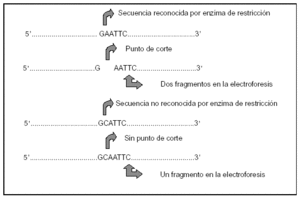
Se utilizan enzimas de restricción (ER), endonucleasas bacterianas que limitan la entrada de ADN extraño al interior de la bacteria, que reconocen las llamadas secuencias de restricción, que son aquellas bases a las que se unen para escindir el ADN. Cuando la existencia de un PG determina que se altere la secuencia de bases que reconoce una ER (GAGTTC) se puede detectar la presencia del polimorfismo al variar la longitud de los fragmentos de ADN que la bacteria escinde (fig. 1).
Figura 1. Polimorfismo del tamaño de los fragmentos de restricción. Mecanismo de acción de las enzimas de restricción (ER: AATTC, GATTC, GCATTC, GCATTC).
Número variable de polimorfismos por repetición en tándem
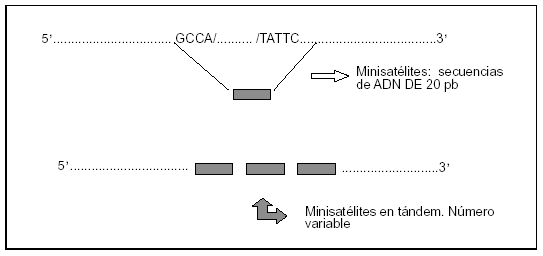
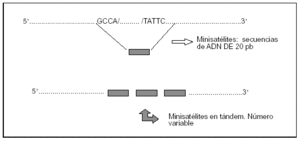
Se analizan los loci que corresponden a secuencias de ADN de 20-70 pares de bases (pb) repetidas en tándem (minisatélites). La singularidad de este tipo de PG reside en que cada locus puede presentar numerosos alelos diferentes (tantos como número de repeticiones). Una forma particular de PG son los microsatélites. Corresponden a la repetición en tándem de secuencias de 2-5 pb (fig. 2).
Figura 2. Polimorfismos por repetición en tándem.
En la actualidad existen técnicas automatizadas capaces de detectar miles de SNP y repeticiones en tándem en pocas horas. Estos nuevos métodos requieren menor manipulación de las muestras y aumentan la sensibilidad de los resultados7.
INTERPRETACION DE LOS ESTUDIOS GENÉTICOS
Existen dos tipos de estudios que interpretan el componente genético de la enfermedad: estudios familiares y estudios de asociación.
1. Estudios familiares. Se realizan a través de árboles genealógicos. Se usan fundamentalmente para el estudio de enfermedades monogénicas.
2. Estudios de asociación. En las enfermedades poligénicas existe más de un gen que contribuye a la susceptibilidad y al pronóstico. En estos casos se analiza un gen que pueda participar en la patogénesis de la enfermedad (gen candidato), cuya principal característica es que tenga importancia funcional. Posteriormente, se compara la frecuencia de aparición del genotipo polimórfico en una población de pacientes (casos) y de controles. La asociación entre el genotipo y el fenotipo se realiza a través de asociaciones estadísticas.
En la selección de casos y controles se deben considerar aspectos fundamentales, como los criterios diagnósticos adecuados y estrictos de la enfermedad que se está investigando y la selección de casos y controles dentro del mismo grupo étnico8. Recientemente, Hirschhorn et al9, en un análisis sistemático de la bibliografía en relación con los estudios de asociación refieren que uno de los errores más frecuentes que determina la aparición de falsos positivos son las diferencias étnicas entre los casos y los controles.
SUSCEPTIBILIDAD GENÉTICA EN LA INFECCION Y LA SEPSIS
El papel determinante de la herencia en el pronóstico de la infección fue demostrado por Sorensen et al10. En este estudio se investigaron las causas de muerte prematura (neoplasias, enfermedad vascular e infección) en una larga serie de sujetos adoptados por otras familias y se compararon con las causas de muerte de los padres adoptivos y naturales. Si los padres adoptivos fallecieron prematuramente a causa de una infección el riesgo relativo (RR) de los sujetos adoptados de fallecer por esta misma causa fue de 0,73 (intervalo de confianza [IC] del 95%, 0,1-5,36). En cambio, si los padres biológicos fallecieron prematuramente por infección el RR de fallecer por esta causa en los hijos naturales es de 5,81 (IC del 95%, 2,47-13,7). Desde la publicación de este trabajo se ha determinado la influencia de la herencia en el pronóstico de otros procesos infecciosos: sida11, hepatitis12 y leishmaniasis13.
GENES CANDIDATOS
Inmunidad natural
La respuesta contra los agentes infecciosos es un proceso que requiere la intervención del sistema inmunitario innato y adquirido. El primero representa la primera línea de defensa mientras se desencadenan los procesos pro y antiinflamatorios14. Cada uno de los pasos que componen la reacción inmunitaria pueden estar afectados por PG, los cuales otorgarán al individuo una mayor o menor susceptibilidad y determinarán finalmente el pronóstico.
Polimorfismo genético de los genes que determinan el reconocimiento de patógenos
Son de tres tipos: a) proteínas solubles (como la mannose binding lectin [MBL]); b) receptores que provocan endocitosis (receptores para FcR-γ), y c) receptores que provocan señales intracelulares (toll-like receptors [TLR] 4 y 2).
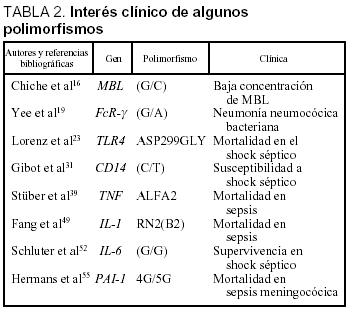
MBL. Es una proteína que se une a las superficies de los microorganismos y endotoxina y provocan la activación del complemento y opsonización15. Para su máxima eficacia esta proteína debe estar presente con unos valores plasmáticos adecuados, que pueden verse influidos por un PG situado en la región promotora del gen consistente en un cambio de G por C en la posición 550 o 22116. Además, existen variaciones en el exón 1 (codones 52, 54 y 57) que determinan alteraciones estructurales de las proteínas, las cuales condicionan una peor activación del complemento independientemente de los valores plasmáticos17.
Receptores para FcR-γ. Se unen a la región Fc de las IgG. Dentro de este grupo existe un tipo FcγRIIa que es el único capaz de unirse a la IgG218. Estos anticuerpos son esenciales contra la defensa de los microorganismos encapsulados. Existe una variación de G a A en el gen de FcγRIIa que condiciona el cambio de una histidina por arginina disminuyendo la afinidad de la inmunoglobulina por estos microorganismos. Se conoce que aproximadamente el 40% de la población de raza blanca es homocigota para este genotipo. En pacientes adultos con neumonía neumocócica bacteriémica se ha visto que la presencia de homocigotos para esta mutación fue más frecuente, determinando una mayor susceptibilidad a las formas graves de esta entidad19. Además, los pacientes sin este genotipo son menos susceptibles a la enfermedad meningocócica grave20.
TLR. Las bacterias gramnegativas son uno de los patógenos más frecuentes implicados en la sepsis. El lipopolisacárido (LPS), el principal componente de su pared, activa los macrófagos y monocitos por lo que se produce una liberación de citocinas proinflamatorias (factor de necrosis tumoral alfa [TNF-α], interleucina [IL] 1, IL-6, IL-8)21. Recientemente se han aclarado los mecanismos moleculares que determinan el reconocimiento del LPS a través de la identificación de una familia de receptores transmembrana denominados toll-like receptor (TLR).
El principal receptor lo constituye el TLR4, y se ha observado en animales con mutaciones en el gen del TLR4 que determinan el cambio de prolina por histidina en posición 712 del receptor cómo la respuesta ante el LPS es de menor intensidad22. En humanos, Lorenz et al23 analizaron las mutaciones Asp299Gly y Thr399Ile del TLR4 en 91 pacientes con shock séptico. La mutación doble Asp299Gly/ Thr399Ile no evidenció diferencias significativas entre el grupo de shock séptico y el grupo control. Sin embargo, la mutación Asp299Gly se asoció a una mayor frecuencia de infección por gramnegativos, shock séptico y mayor mortalidad en pacientes homocigotos.
Recientemente, se ha identificado un PG en el gen del TLR2 (Arg753Gln) que condiciona una mayor susceptibilidad a la infección estafilocócica24.
Por otro lado, también se ha identificado un receptor capaz de unirse a lipopolisacáridos, peptidoglicanos y ácidos lipoteicoicos bacterianos: el CD 1425,26. Este receptor se expresa fundamentalmente en la superficie de los macrófagos, monocitos y neutrófilos polimorfonucleares. Existe una forma soluble (sCD14) cuyos valores se correlacionan con una mayor mortalidad en el shock séptico por bacterias grampositivas y gramnegativas27,28. Se ha identificado un PG en la región promotora del gen del CD14, consistente en un cambio de C por T29. Los sujetos portadores del alelo T poseen valores más elevados de sCD14 que los portadores del alelo C30. Gibot et al31, en un estudio prospectivo, multicéntrico, en pacientes con shock séptico, han observado que el alelo T es más frecuente en pacientes con shock séptico que en el grupo control (el 55 frente al 43%; p = 0,01). Además, la mortalidad observada en el grupo de shock séptico fue del 26,3% (genotipo C/C), el 58,1% (genotipo C/T) y el 71,4% (genotipo T/T), todas ellas estadísticamente significativas (p < 0,01). Según estos autores, el genotipo TT incrementa el RR de mortalidad (odds ratio [OR] 5,3; IC del 95%, 1,2-22,5). En este mismo trabajo los autores relacionan la presencia del genotipo TT del gen CD14 y el genotipo TNF-α2 con el pronóstico. La combinación de estos dos genotipos se asoció con un incremento de riesgo de muerte de 5,36 (IC del 95%, 1,1-25,8).
Otros autores como Hubacek et al32 describieron la ausencia de asociación entre el polimorfismo del CD14 (C-159T) y el pronóstico en la sepsis. Esta aparente contradicción podría explicarse por factores étnicos en los casos y controles y por la gran variabilidad fenotípica de la sepsis. Por este motivo, se recomienda aumentar el tamaño de las muestras y considerar criterios diagnósticos lo más estrictos posible33.
Citocinas proinflamatorias
Factor de necrosis tumoral (TNF)
Toda infección desencadena un proceso inflamatorio y el TNF es uno de los mediadores más importantes ante el estímulo infeccioso34. Las variaciones genéticas individuales que influyen en la expresión o la actividad del TNF pueden influir en las manifestaciones clínicas y el pronóstico de la infección y la sepsis. Los genes responsables de la síntesis del TNF-α y βse sitúan adyacentes a los del sistema HLA III en el cromosoma 635. Además, existen PG en estos genes asociados con valores plasmáticos más elevados de TNF. En el caso del TNF-α, el PG más ampliamente estudiado es el cambio en la posición 308 de guanina (TNF-α1) por adenina en (TNF-α2). También se ha identificado el mismo cambio de bases en la posición 238. En el TNF-β puede existir un cambio de guanina (TNF-β1) por una adenina (TNF-β2) en el primer intrón (posición 1069)36.
McGuire et al37 demostraron que el genotipo homocigoto α2 se asoció con un riesgo cuatro veces superior de desarrollar malaria cerebral y desarrollar secuelas neurológicas comparado con los pacientes heterocigotos o no portadores de ese alelo. Nadel et al38 analizaron el genotipo de 98 pacientes ingresados de forma consecutiva con el diagnóstico de meningococemia en una UCI pediátrica. El alelo α2 se asoció a una forma más grave de meningococemia y a una mayor mortalidad. Stüber et al39 demostraron también que en los pacientes homocigotos para el alelo α2 que desarrollaron sepsis se observaron valores más elevados de TNF y a su vez mayor mortalidad. Estos datos fueron posteriormente corroborados por Mira et al40 que analizaron el genotipo de 89 pacientes con el diagnóstico de shock séptico. Las frecuencias de TNF-α2 fueron significativamente superiores en los pacientes sépticos respecto al grupo control. Además, la mortalidad también fue significativamente mayor en los pacientes portadores del alelo α2.
Más recientemente, O'Keefe et al41, en un estudio prospectivo, analizaron la presencia de adenina en las posiciones 238, 308 o 376 de la región promotora del gen del TNF-α como factor de riesgo para el desarrollo de sepsis. Sólo los pacientes con adenina en posición 308 tuvieron un riesgo 4,6 veces superior de desarrollar sepsis (IC del 95%, 1,9-10,9) y también un riesgo 2,1 veces superior de mortalidad (IC del 95%, 0,6-7,3).
Majetschak et al42 analizaron la relación entre el genotipo del TNF-β y el desarrollo de sepsis en pacientes politraumatizados, y llegaron a la conclusión de que los pacientes homocigotos para el alelo β2 tuvieron más riesgo de desarrollar sepsis grave respecto a los sujetos que eran portadores o no tenían el alelo. Asimismo, los pacientes homocigotos también tuvieron valores de TNF significativamente mayores que los heterocigotos o no portadores.
Waterer et al43 analizaron los genotipos del TNF-α y β de 280 pacientes con neumonía adquirida en la comunidad (NAC) y su relación con el desarrollo de shock séptico e insuficiencia respiratoria y concluyeron que los pacientes homocigotos β2 tuvieron más riesgo de desarrollar shock séptico. Sin embargo, no encontraron asociación entre el genotipo del TNF-α y el riesgo de desarrollar shock séptico. Uno de los hallazgos más significativos de este estudio es la falta de correlación entre los genotipos hipersecretores de TNF (α2 y β2) y el desarrollo de insuficiencia respiratoria; en general, se asume que la hipoxemia y otros signos del síndrome de la respuesta inflamatoria sistémica pueden explicarse por un ambiente proinflamatorio. En cambio, en este estudio se encontró una asociación de la hipoxemia con un genotipo hiposecretor (TNF-β1). La hipoxemia en estos pacientes fue explicada en términos de respuesta inmunitaria atenuada que permite una mayor progresión de la infección más que como una afectación inflamatoria sistémica que puede lesionar la unión alveolocapilar e impedir el intercambio gaseoso. De forma reciente, se ha estudiado la influencia del PG en el pronóstico (mortalidad) de la NAC. Wunderink et al44, en un estudio prospectivo, analizaron los genotipos (TNF-α 238, TNF-α 308 y TNF-β) de 272 pacientes que desarrollaron NAC, y describieron que la presencia de adenina en la posición 238 del gen del TNF se asoció con un mayor riesgo de mortalidad en pacientes con NAC. Además, corroborando los hallazgos previos, los pacientes homocigotos β2 tuvieron un riesgo aumentado de desarrollar shock séptico.
Aunque los estudios en fase II diseñados con tratamientos anti-TNF (anticuerpos o receptores solubles) fueron esperanzadores, los estudios en fase III no han demostrado beneficio en términos de reducción de la mortalidad45, y algunas de estas estrategias terapéuticas han sido probadas con éxito en otros procesos inflamatorios46. Una de las causas del fracaso terapéutico puede ser la mala selección de los casos (pacientes). Según estos datos y conociendo que las estrategias anti-TNF-α reducen la mortalidad en aquellos pacientes con valores más elevados de TNF47 es probable que analizando los genotipos de los pacientes se pueda incluir en los ensayos a los pacientes cuya respuesta sea más previsible y constituyan un grupo más homogéneo que permitirá realizar una mejor interpretación de los resultados.
Interleucina-1
La familia de la IL-1, formada por la IL-1α, la IL-1β y el antagonista del receptor de la IL-1 (IL-1ra), desempeña también un papel importante en la patogenia de la sepsis. La IL-1ra regula la actividad de la IL-1α y β a través de una acción competitiva, y su función es puramente antagonista48. Además, la IL-1α posee 7 alelos según el número de repeticiones en tándem de 46 pares de bases en el intrón 6: A1, A2, A3, A4, A5, A6 y A7. La IL-1β posee dos alelos que se identifican con la enzima de restricción avaI: B1 y B2. Por último, el gen de la IL-1ra posee un número variable de 86 pb repetidas en tándem en el intrón 2 con cinco alelos: RN1, RN2, RN3, RN4 y RN5.
Fang et al49 estudiaron la relación entre los polimorfismos de IL-1ra e IL-1β en el pronóstico de la sepsis. Analizaron de forma prospectiva el genotipo de 93 pacientes sépticos utilizando donantes de sangre como grupo control. No observaron diferencias significativas en las frecuencias de los polimorfismos de la IL-1β y el grupo control. En cambio, los pacientes con sepsis tuvieron una frecuencia significativamente superior del alelo RN2 respecto al grupo control. No encontraron una mayor mortalidad para este alelo en el grupo de pacientes sépticos. Sin embargo, 8 pacientes homocigotos para los alelos RN2 y B2 no sobrevivieron; la sepsis fue la causa atribuible de mortalidad.
Arnalich et al50 realizaron un estudio prospectivo en el que se determinó la influencia del PG en el intrón 2 del gen IL-1ra en el pronóstico sepsis. Para ello compararon los genotipos de 78 pacientes con sepsis grave, 56 pacientes con neumonía no complicada y 130 controles (donantes de sangre). Los pacientes con sepsis grave tuvieron una distribución de frecuencias de los genotipos que no evidenció diferencias significativas con otros grupos. Mediante un análisis de regresión múltiple se evidenció un riesgo 6,47 superior de fallecer en los pacientes homocigotos para el alelo RN2. Además, estos pacientes produjeron valores significativamente más bajos de IL-1ra. La falta de concordancia con estudios previos respecto a una mayor predisposición para desarrollar sepsis y tener peor pronóstico es atribuida a factores étnicos de las muestras de ambos estudios.
Ma et al51 han estudiado la familia de la IL-1 y su relación con la susceptibilidad y el pronóstico de las sepsis. Sólo el alelo RN2 se asoció con mayor susceptibilidad a la sepsis en sujetos homo y heterocigotos. Los pacientes homocigotos para los genotipos A2, B2 y RN2 se asociaron a una mayor mortalidad (70-80%), los pacientes homocigotos para dos de los 3 alelos mencionados tuvieron porcentajes de mortalidad discretamente menores (55-65%). Por el contrario, en los pacientes homocigotos A1, B1 o RN1 se evidenciaron porcentajes de mortalidad aún menores (0-13%) (tabla 2).
Interleucina-6
La IL-6 se encuentra elevada durante la sepsis y se correlaciona con el pronóstico. Existe un PG en la región promotora de este gen (174 G/C) que se ha relacionado con el pronóstico de esta entidad. Se ha visto que este PG no afecta a la incidencia. Sin embargo, los pacientes homocigotos G/G que desarrollaron sepsis tuvieron porcentajes de supervivencia superiores que el resto de los genotipos. En cualquier caso, no se ha logrado correlacionar los niveles plasmáticos con ningún genotipo52.
Citocinas antiinflamatorias
La sepsis induce de manera inicial una liberación de citocinas proinflamatorias que se siguen de otras antiinflamatorias (IL-4, IL-10, IL-13) responsables del síndrome de respuesta compensatoria antiinflamatoria. PG responsables de una compensación antiinflamatoria excesiva pueden tener consecuencias deletéreas.
Interleucina-10. Esta citocina disminuye la función de los macrófagos e indirectamente inhibe la actividad de las células B. Una producción excesiva inhibe la expresión del interferón-γ y retrasa el aclaramiento de los patógenos intracelulares.
Dentro de la región promotora de este gen existen microsatélites con repeticiones CA y SNPs: 1082 (G/A), 819 (C/T) y 562 (C/A). In vitro, el PG 1082G se asoció con valores más elevados de esta citocina53.
Coagulación
Durante la sepsis se activan la coagulación y los sistemas antifibrinolíticos. Se han encontrado concentraciones elevadas del inhibidor del activador de plasminógeno 1 (PAI-1) durante la sepsis54. En la región promotora de este gen existe un PG consistente en la inserción/deleción 4G/5G en la posición 675. Los pacientes 4G presentan valores plasmáticos superiores de PAI-1. Recientemente, se ha demostrado que en pacientes con sepsis meningocócica los portadores del genotipo 4G/4G tuvieron significativamente peor pronóstico respecto a los otros genotipos55.
CONCLUSIONES
En la actualidad existe la tecnología suficiente para diferenciar las características genéticas individuales. Existen ciertos polimorfismos que tienen importancia en cuanto a la susceptibilidad y el pronóstico de enfermedades infecciosas graves. La combinación de algunos de ellos puede resultar fatal. En este sentido, el conocimiento de las variaciones genéticas en la inmunidad innata y las citocinas inflamatorias puede ayudar a distinguir pacientes de alto riesgo. Es necesaria la creación de bases de datos de PG en el paciente crítico en diferentes grupos raciales.