INTRODUCCIÓN
Una parte importante de las infecciones adquiridas en el hospital se diagnostica en los servicios de medicina intensiva (UCI), en especial aquellas que tienen mayor impacto en la evolución de los pacientes como son las neumonías y las bacteriemias1-3. La mayoría de las infecciones detectadas en las UCI se relaciona con la utilización de dispositivos (tubos traqueales, catéteres, sondas uretrales) que alteran las barreras defensivas naturales y facilitan la transmisión cruzada de los agentes patógenos4-6. Ocasionalmente las infecciones se presentan en forma de brotes epidémicos, cuyo origen se ha identificado en reservorios inanimados (ventiladores mecánicos, nebulizadores, sistemas de monitorización) o en portadores crónicos (trabajadores sanitarios o enfermos colonizados) y/o son facilitadas mediante la transmisión cruzada por mala praxis en las técnicas básicas de higiene y/o manipulación de pacientes1,7,8. Paralelamente, en las UCI se observa la aparición de microorganismos patógenos multirresistentes (MPR), debido a la presencia simultánea de los factores de riesgo que facilitan la multirresistencia9,10.
La vigilancia de las infecciones nosocomiales constituye en estos servicios un objetivo esencial. La información obtenida con los sistemas de vigilancia de infección, sea cual sea el método empleado, facilita al personal del hospital, médicos, enfermeras y administradores, el conocimiento de la evolución de las tasas de estas infecciones, así como los cambios en los patrones de sensibilidad-resistencia de los agentes patógenos endémicos de cada UCI. La comparación secuencial de las tasas de infección nosocomial en cada UCI permite identificar problemas asistenciales, introducir medidas para su corrección y evaluar la eficacia de las mismas.
El Grupo de Trabajo de Enfermedades Infecciosas de la Sociedad Española de Medicina Intensiva y Unidades Coronarias (GTEI-SEMIUC) elaboró en 1994 un programa informatizado de vigilancia de infección nosocomial, para ser aplicado en las UCI españolas, con el objetivo de conocer las tasas de las infecciones nosocomiales más graves y frecuentes relacionadas con instrumentalización, así como sus etiologías y la evolución de las resistencias de aquellos microorganismos más prevalentes. Los resultados correspondientes al año 2001 se presentan en este estudio.
PACIENTES Y MÉTODOS
Pacientes de estudio
Se ha incluido de forma prospectiva a todos los pacientes ingresados durante más de 24 h en las UCI participantes, desde el 1 de mayo al 30 de junio del año 2001.
Metodología de la vigilancia
Los pacientes ingresados antes del primer día del período de control y que permanecieron ingresados durante la fase de estudio no han sido objeto de seguimiento. La vigilancia de los pacientes incluidos ha sido continua y fueron seguidos hasta su alta de UCI o hasta un máximo de 60 días.
De todos los pacientes evaluados se han recogido variables demográficas, enfermedad de base, instrumentaciones realizadas (intubación y ventilación mecánica, sondaje uretral, catéteres venosos centrales y catéteres arteriales), estancia hospitalaria previa al ingreso en UCI, estancia en esta unidad y situación clínica en el momento del alta.
Los enfermos fueron clasificados de acuerdo con la enfermedad de base en coronarios, quirúrgicos, traumáticos y médicos. Los pacientes coronarios fueron aquellos cuyo motivo de ingreso fue un síndrome isquémico agudo como angina o infarto de miocardio. Entre los pacientes traumáticos se incluía a los pacientes cuyo motivo de ingreso eran lesiones agudas producidas por un traumatismo. Se incluyó como pacientes quirúrgicos a aquellos cuyo motivo de ingreso fue el control postoperatorio de una intervención programada. Los pacientes médicos eran aquellos cuyo motivo de ingreso no era ninguno de los anteriores, incluyendo a los pacientes que ingresaron después de una intervención quirúrgica no programada.
La gravedad de los pacientes fue valorada mediante la combinación de la puntuación del sistema APACHE II11, y opcionalmente con el sistema SAPS II12, la clasificación clínica de gravedad en el ingreso, utilizada en el National Nosocomial Infection Surveillance System (NNIS), propugnada por los Centers for Disease Control (CDC)13, y la necesidad de cirugía urgente, definida como la necesidad de intervención quirúrgica no programada o electiva, antes o durante la estancia en UCI. La mortalidad cruda se definió como aquella que se produjo durante la estancia en UCI por cualquier motivo.
Infecciones estudiadas
Se han identificado aquellas infecciones relacionadas de forma directa con dispositivos y que se asocian con mayor morbilidad y mortalidad entre los pacientes críticos: neumonías relacionadas con ventilación mecánica (N-VM), infecciones urinarias relacionadas con sonda uretral (IU-SU), bacteriemias primarias (BP) y relacionadas con catéteres vasculares (B-CV) y bacteriemias secundarias (BS). Los criterios utilizados para definir estas infecciones se han publicado por los CDC14. Se ha definido la bacteriemia primaria como la presencia de cultivos positivos en sangre sin foco conocido de infección y, en este estudio, se han incluido en esta definición, para el cálculo de tasas, las bacteriemias relacionadas con catéteres vasculares (BP/B-CV). Asimismo, se han registrado las bacteriemias secundarias.
Las infecciones nosocomiales fueron diagnosticadas por médicos intensivistas, y documentadas como tal en la historia clínica de los pacientes. Los médicos encargados de la vigilancia de infección nosocomial fueron médicos especialistas en medicina intensiva, con especial interés y formación en las enfermedades infecciosas. Estos médicos registraron de forma prospectiva las infecciones, pero no intervinieron, en la mayoría de los casos, de forma directa en su diagnóstico.
Para el diagnóstico etiológico se aceptaron los criterios utilizados por cada UCI participante, siguiendo la normativa propuesta por el CDC14. En el caso de las N-VM se han clasificado las técnicas empleadas en el diagnóstico etiológico en invasoras y no invasoras, dependiendo de la utilización de fibrobroncoscopia (FBS) y/o de biopsias pulmonares. La susceptibilidad a los distintos antibióticos, de los patógenos identificados como responsables de las infecciones, se realizó siguiendo las especificaciones (método y valores) del National Committee for Clinical Laboratory Standards (NCCLS, 1995) que se especifican en las respectivas fichas técnicas15.
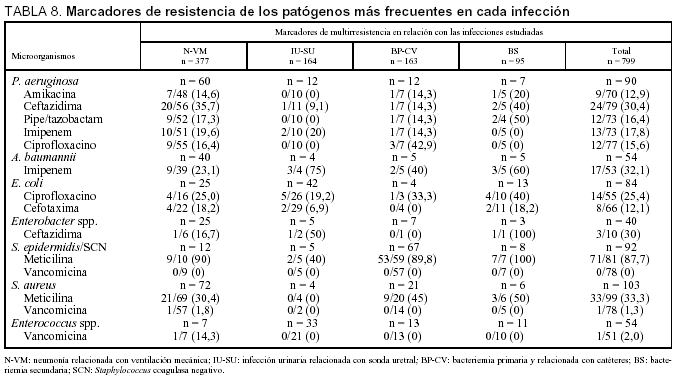
Para el seguimiento de la multirresistencia se han definido marcadores de resistencia para cada microorganismo: para Pseudomonas aeruginosa: amiKacina, ceftazidima, ciprofloxacino, piperacilina-tazobactam e imipenem-cilastatina; para Acinetobacter baumanni: imipenem-cilastatina; para Staphylococcus aureus, Staphylococcus coagulasa negativo (SCN) y Staphylococcus epidermidis: meticilina u oxacilina y vancomicina; para Escherichia coli: ciprofloxacino y cefotaxima; para Enterobacter spp.: ceftazidima, y para Enterococcus spp.: vancomicina.
Factores de riesgo
Los factores de riesgo de cada infección se han calculado de forma global para todos los enfermos ingresados durante el período de vigilancia, según los criterios utilizados en el NNIS16. Para ello se han contabilizado diariamente los pacientes con ventilación mecánica, sonda uretral y catéter venoso central así como el número de catéteres vasculares centrales, incluidos los catéteres de arteria pulmonar, nutrición parenteral, hemodiálisis, y los que incorporan reservorios. Se ha calculado para cada uno de ellos, la razón de utilización, definido como el cociente entre el número de días de utilización de cada instrumentalización y los días de riesgo (días de estancia).
Medidas de incidencia
Para cada una de las infecciones estudiadas (neumonías o infecciones urinarias o bacteriemias) se han estimado la incidencia acumulada (IA) y la densidad de incidencia (DI). La incidencia acumulada se calcula dividiendo el número de infecciones por el total de pacientes de riesgo y se expresa en porcentajes. La densidad de incidencia se calcula dividiendo el número de infecciones por el total de estancias o por el total de días de exposición al dispositivo de riesgo. Se expresa como el número de infecciones por 1.000 días de exposición.
Análisis estadístico
La recogida de datos se ha realizado utilizando la aplicación informática ENVIN-UCI desarrollada en la base de datos Access 97. Las variables cualitativas se describen con el porcentaje de distribución de cada una de las categorías. Las variables cuantitativas se describen con la media y la desviación estándar (DE) cuando siguen una distribución normal; con la mediana, valor mínimo y máximo en caso contrario.
RESULTADOS
Características de la población
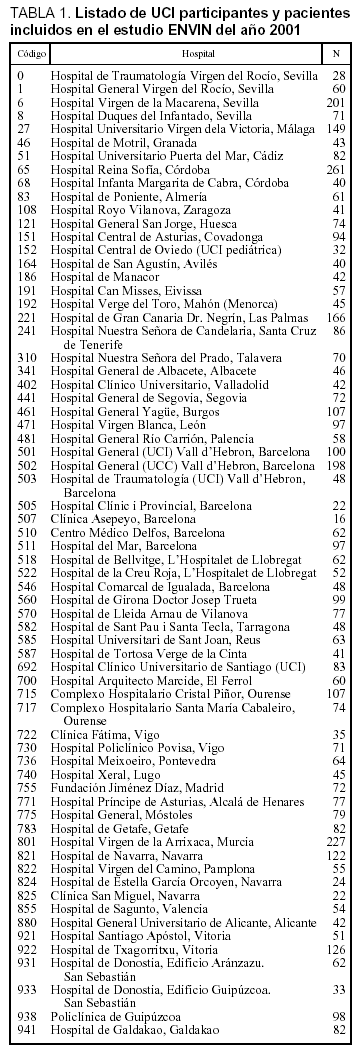
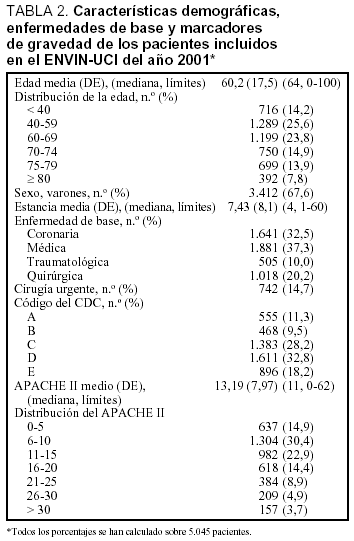
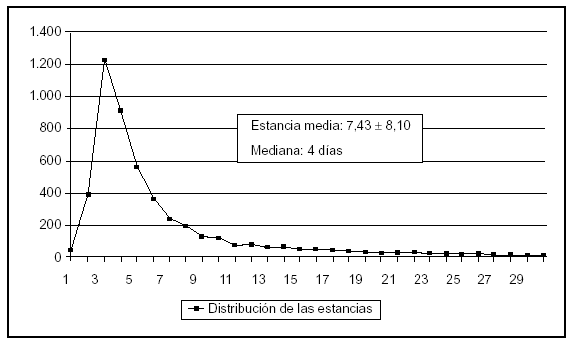
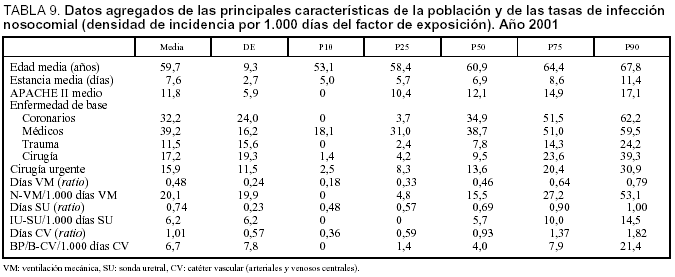
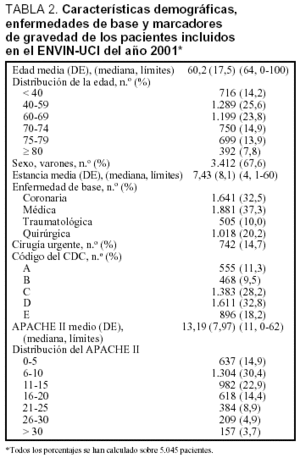
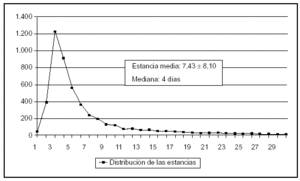
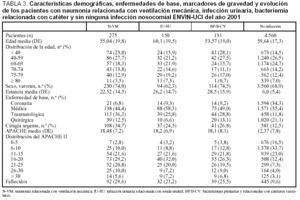
Se ha incluido a 5.045 pacientes ingresados en 67 UCI pertenecientes a 63 hospitales distintos cuya distribución se incluye en la tabla 1. Las características demográficas, la enfermedad de base, los marcadores de gravedad y la estancia media se exponen en la tabla 2. La media (DE) de edades fue de 60,2 (17,5), y predominaron los varones (67,6%), con enfermedad de base médica (37,3%) y coronaria (32,5%). El grado medio de gravedad (DE), expresado mediante el APACHE II, fue de 13,2 (7,9) y una mediana de 11 y la estancia media (DE) fue 7,4 (8,1) días con una mediana de 4 días. En la figura 1 se incluye la distribución de los enfermos según la estancia.
Figura 1. Distribución de los pacientes según los días de estancia.
En 485 pacientes (9,6%) se han detectado 694 infecciones adquiridas en la UCI que se distribuyen en 311 neumonías (44,8%), 155 infecciones urinarias (22,3%), 82 bacteriemias primarias (11,8%), 68 bacteriemias relacionadas con catéter (9,8%) y 78 bacteriemias secundarias (11,2%).
Neumonías relacionadas con ventilación mecánica
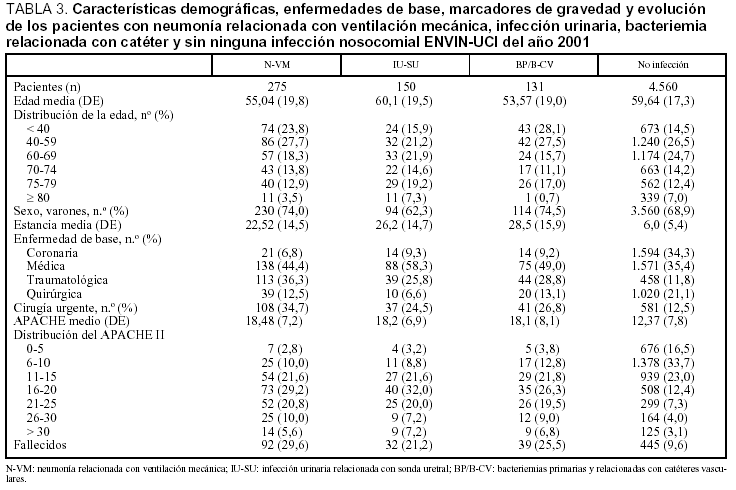
En 248 casos (79,7%) el diagnóstico de N-VM se ha basado en la presencia de signos y síntomas clínicos compatibles con neumonía, asociados con un nuevo y persistente infiltrado radiológico, mientras que en 49 episodios (15,8%) se basó en la extensión de un infiltrado previo y empeoramiento clínico (segunda neumonía). Sólo en 2 casos se diagnosticó por cavitación de un infiltrado pulmonar. La tasas de N-VM fueron de 6,2 casos por cada 100 pacientes ingresados más de 24 h, 15 casos por cada 100 pacientes ventilados, 8,3 casos por cada 1.000 días de estancia y 16,1 casos por cada 1.000 días de ventilación mecánica. En el período analizado se utilizó VM durante 19.295 días (ratio de utilización de VM: 0,51). Las principales características de los 275 pacientes en los que se han diagnosticado las 311 N-VM se incluyen en la tabla 3.
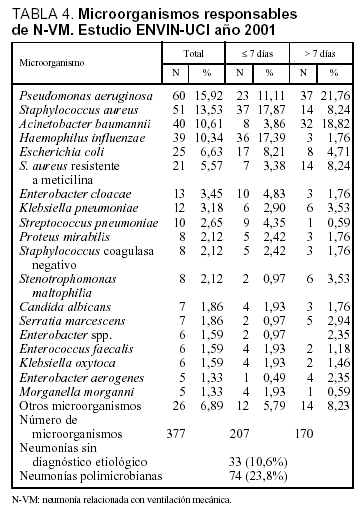
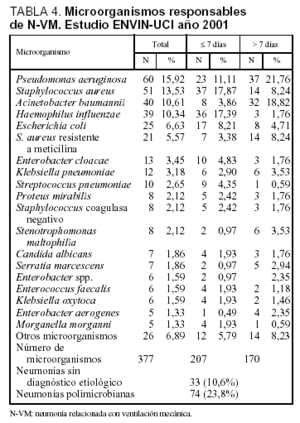
Se ha logrado un diagnóstico etiológico en 278 casos (89,4%), siendo polimicrobianas 74 neumonías (23,8%). Las técnicas empleadas en el diagnóstico etiológico fueron no invasivas en 235 casos (75,6%) e invasivas en 41 casos (16,4%), 18 casos por cepillo bronquial a través de catéter telecopado y 23 casos por lavado broncoalveolar. En dos ocasiones se llegó al diagnóstico etiológico por coincidencia del mismo patógeno en el hemocultivo y en muestras bronquiales no invasoras. Los microorganismos responsables de las neumonías se incluyen en la tabla 4, diferenciándose en ella los responsables de las N-VM tempranas (¾ 7 días de ingreso en UCI) de las tardías (> 7 días). Mientras que en las neumonías tardías han predominado P. aeruginosa (21,8%) y A. baumannii (18,8%), en las neumonías tempranas se han identificado S. aureus sensible a meticilina (17,9%) y Haemophilus influenzae (17,4%).
Infección urinaria relacionada con sonda uretral
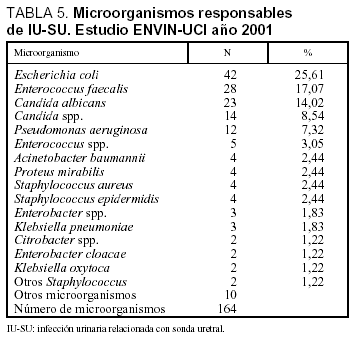
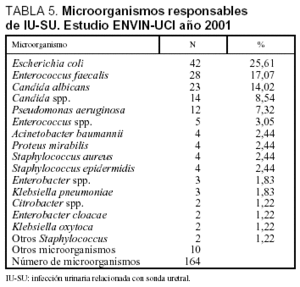
Las tasas de infección urinaria relacionada con sonda uretral (IU-SU) fueron de 3,1 infecciones por cada 100 pacientes ingresados durante más de 24 h en UCI, 4,57 infecciones por cada 100 pacientes con sonda uretral, 4,1 infecciones por cada 1.000 días de estancia y 5,5 infecciones por cada 1.000 días de sonda uretral. En el período analizado se utilizó SU durante 28.256 días (ratio de utilización de SU: 0,75). Las características de los 150 pacientes en los que se diagnosticaron las 155 infecciones urinarias se incluyen en la tabla 3. Los microorganismos responsables de esta infección se exponen en la tabla 5, donde se aprecia el predominio de E. coli (25,6%) seguido por E. faecalis (17,1%), Candida albicans (14,0%) y Candida spp. (8,5%).
Bacteriemia primaria y relacionada con catéter
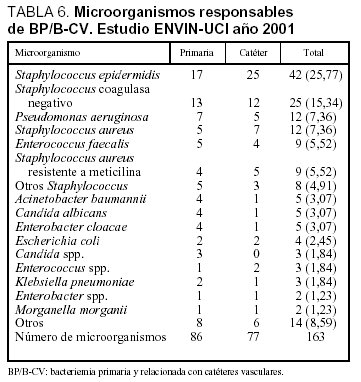
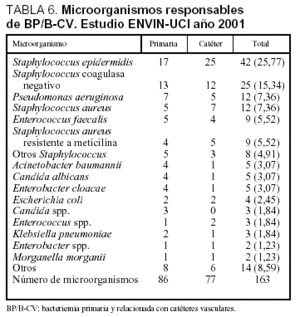
Las tasas de bacteriemia primaria (incluidas las relacionadas con catéteres) fueron 3 bacteriemias por cada 100 pacientes ingresados más de 24 h en UCI, 5,1 bacteriemias por cada 100 pacientes con catéter vascular, 4 bacteriemias por cada 1.000 días de estancia y 3,7 bacteriemias por cada 1.000 días de catéter vascular. En el período analizado se utilizó un catéter venoso central durante 24.127 días y uno arterial durante 16.773 días (ratio de utilización de catéter vascular: 1,09). Las características de los 131 pacientes con bacteriemia primaria y bacteriemia relacionada con catéter vascular se incluyen en la tabla 3 y los microorganismos responsables de estas infecciones se incluyen en la tabla 6, diferenciándose las asociadas con catéter venoso de las bacteriemias primarias.
Bacteriemias secundarias
Las tasas de bacteriemias secundarias han sido de 1,6 bacteriemias por cada 100 pacientes ingresados más de 24 h en UCI y 2,1 bacteriemias por 1.000 días de estancia. El foco origen de las mismas ha sido abdominal en 33 ocasiones (42,3%), seguido del respiratorio, 30 casos (38,5%), y del foco urinario, 8 casos (10,3%).
Densidad de incidencia estratificada por factores de riesgo
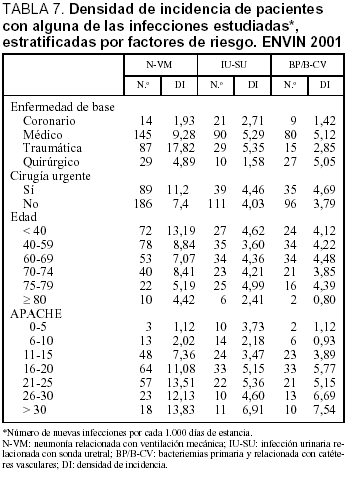
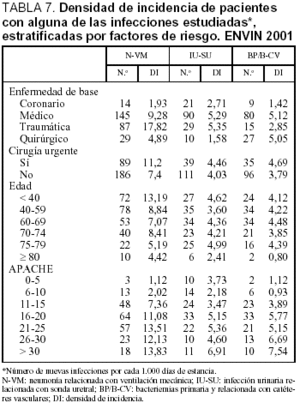
La densidad de incidencia (expresada por 1.000 días de estancia) de todas las infecciones estudiadas y estratificada por enfermedad de base, cirugía urgente, edad y gravedad se incluyen en la tabla 7. En general existe un mayor número de todas las infecciones controladas en los pacientes traumáticos y médicos, en especial en el caso de N-VM y BP/B-CV. El aumento de estas infecciones es mayor en los pacientes de mayor gravedad, en los que precisan cirugía de urgencia, en los más jovenes y en los que fallecen.
Evolución de los marcadores de resistencia
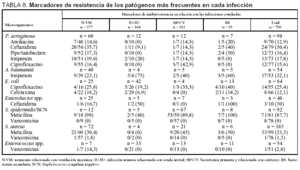
En la tabla 8 se incluyen los marcadores de resistencia de los principales patógenos identificados, y se diferencian para cada una de las infecciones controladas. Destaca la existencia de diferentes tasas de resistencia según el tipo de infección. En conjunto se ha identificado un 30,4% de aislamientos de P. aeruginosa resistente a ceftazidima, un 33,3% de S. aureus resistente a meticilina, un 32,1% de A. baumannii resistente a imipenem y un 25,4% de cepas de E. coli resistentes frente ciprofloxacino. Se han identificado un caso (2%) de cepas de Enterococcus spp. y otro (1,3%) de cepas de Staphylococcus aureus resistentes a glucopéptidos.
Mortalidad
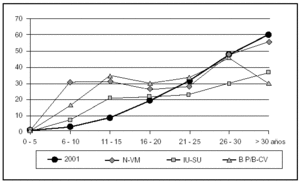
Han fallecido durante el período de vigilancia en la UCI 670 pacientes (13,3%). La mortalidad se ha modificado en función de enfermedad de base (el 5,4% en pacientes coronarios, el 14,2% en pacientes médicos, el 22,0% en pacientes traumatológicos y el 6,5% en pacientes con cirugía programada) y el nivel de gravedad de los pacientes estudiados (fig. 2). La mortalidad global de los pacientes con N-VM fue 90/275 (32,7%), con IU-SU 33/150 (22%) y con BP/B-CV 43/131 (32,8%).
Figura 2. Relación entre el nivel de gravedad y la mortalidad por cada una de las infecciones ENVIN 2001. N-VM: neumonía relacionada con ventilación mecánica; IU-SU: infección urinaria relacionada con catéteres urinarios; BP/B-CV: bacteriemias primarias y relacionadas con catéteres vasculares.
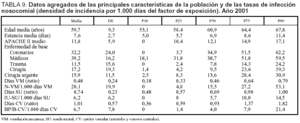
Datos agregados
Con intención de establecer comparaciones entre diferentes UCI se incluyen en la tabla 9 los datos agregados (expresados en percentiles) de las principales variables que definen las características de la población incluida y los factores de riesgo de infección así como de las tasas de las tres infecciones controladas expresadas en densidad de incidencia por 1.000 días del factor de exposición.
DISCUSIÓN
En este estudio de vigilancia epidemiológica se han identificado las tasas nacionales, correspondientes al año 2001, de las principales infecciones hospitalarias diagnosticadas en UCI españolas, relacionadas con dispositivos. Asimismo, se incluyen las etiologías de cada una de ellas y el estado de los marcadores de multirresistencias de los principales microorganismos identificados.
En la última década, en varios países europeos (Bélgica, Francia, Alemania, Portugal y Países Bajos) se han desarrollado programas de ámbito nacional para la vigilancia de infección nosocomial en UCI17. Aunque el objetivo común de todos ellos es la vigilancia de las infecciones nosocomiales en UCI, presentan importantes diferencias en el método de selección de los pacientes de riesgo, en las definiciones de las infecciones controladas y en las tasas que utilizan para expresar las frecuencias, que imposibilita la comparación entre ellos. Existe, sin embargo, un proyecto de vigilancia de infección nosocomial en UCI (HELICS Project) que pretende diseñar un protocolo común para los países de la Comunidad Europea utilizando las mismas definiciones y tasas de las infecciones de riesgo17.
En España, a principios de los años noventa, el GTEI-SEMICYUC inició el diseño del programa de vigilancia ENVIN-UCI, como un sistema de incidencia, de seguimiento continuo de las infecciones de mayor gravedad relacionadas con dispositivos y desde 1994 se han realizado ocho períodos de vigilancia. El grado de participación ha ido en aumento y se dispone en estos momentos de información acumulada de más de 32.000 pacientes
Las tasas de cada una de las infecciones controladas se expresan, en nuestro estudio, como incidencia acumulada (utilizando como denominador todos los enfermos incluidos en el estudio o los que han utilizado un determinado dispositivo) y como densidad de incidencia (utilizando como denominador los días de estancia global o los días de ventilación mecánica, sonda uretral o catéter venoso central). Aunque la forma múltiple de expresar nuestras tasas puede incrementar la confusión, permite su comparación con indicadores de otros estudios.
La tasa utilizada en el estudio NNIS18 es la densidad de incidencia en relación con el número de días de exposición a cada factor de riesgo; sin embargo, en este estudio las frecuencias han sido calculadas para UCI de especialidades, mientras que en nuestro caso las UCI han sido mayoritariamente polivalentes, con predominio de los pacientes médicos y coronarios. Por este motivo, no existen valores de referencia con los que comparar nuestras tasas, excepto los obtenidos por nosotros en los registros de años anteriores19-21. El análisis de la evolución de nuestros datos demuestran que mientras se mantienen, e incluso descienden ligeramente, las tasas de N-VM y IU-SU existe un aumento de las tasas de bacteriemias primarias y relacionadas con CV20. Utilizando la misma metodología (del NNIS) se han publicado tasas en algunos países, con resultados muy dispares, debido a las diferencias de las poblaciones asistidas22-24.
En nuestro estudio, el análisis de la etiología de la N-VM confirma, como ocurre en otros países23-25, el protagonismo de S. aureus como el primer agente patógeno responsable de esta infección, seguido de P. aeruginosa, aunque existen importantes variaciones dependiendo de la clasificación de las N-VM en tempranas o tardías. Mientras que en las tempranas predomina S. aureus sensible a meticilina y H. influenzae, en las tardías son más frecuentes P. aeruginosa, A. baumannii y S. aureus resistente a meticilina26. En infecciones urinarias el principal responsable es E. coli, seguido por Candida spp.. y Enterococcus spp. Mientras que en bacteriemias primarias (incluidas las relacionadas con catéteres) los microorganismos más frecuentes son S. epidermidis y Staphylococcus coagulasa negativo. Esta distribución de etiologías por infecciones se ha mantenido constante a lo largo de los últimos años, observándose una tendencia decreciente de A. baumannii, en especial en infecciones respiratorias y urinarias27.
Los marcadores de multirresistencia que se han controlado en nuestro estudio presentan una diferente distribución, dependiendo del tipo de infección en que se evalúen, aunque en algunos casos el número de cepas aisladas es pequeño. Destaca en el conjunto la presencia de P. aeruginosa resistente a ceftazidima (30,4%), mientras que el resto de marcadores de este agente patógeno se mantiene en una proporción muy aceptable (inferior al 20%), incluido ciprofloxacino que el pasado año alcanzó la mayor tasa de resistencia21. La proporción de cepas de S. aureus resistente a meticilina ha sido del 33,3%, similar al pasado año21. Por contra, se ha observado una estabilización de cepas de E. coli resistentes a ciprofloxacino (25,4%) y un incremento considerable de las resistentes a cefotaxima (12,1%). Se confirma la tendencia a disminuir los aislados de A. baumannii resistente a imipenem (32,1%). Se ha incluido, por primera vez, como marcador Enterobacter spp. resistente a ceftazidima con una frecuencia del 30%, aunque el número de aislados total es escaso en España. A diferencia de otros años, se han detectado una cepa de Enterococcus spp. y otra de Staphylococcus aureus ambas resistentes a vancomicina, aunque su presencia en pacientes críticos continúa siendo mucho menor que la de otros países28,29.
La principal limitación de nuestro estudio es la temporalidad de la vigilancia (limitada en este caso a un período de dos meses), por lo que no se puederesponder, con seguridad, a las tres preguntas fundamentales: ¿son mis tasas similares a lo largo del tiempo o existen cambios de tendencia, estacionales o en un determinado período? ¿Son mis tasas similares o diferentes, mayores o menores, a las de las UCI con una población y un uso de dispositivos, ventilación mecánica y catéteres intravasculares similares? ¿Se han producido cambios en la flora infectante: tipo de patógenos, patrón de sensibilidad antimicrobiana?30. Para responder a estas tres preguntas es necesario disponer de un sistema de vigilancia continua que permita conocer mensualmente tasas, etiologías y marcadores de resistencia. Esto es posible en nuestro país utilizando el programa ENVIN simplificado, que permite obtener la información necesaria para responder a las tres preguntas anteriores con el mínimo esfuerzo posible.
La aplicación de un sistema de vigilancia de infección nosocomial incorpora un valor añadido a la calidad asistencial de una UCI, al margen de las tasas obtenidas. Sin embargo, no hay que olvidar que el objetivo principal de la vigilancia es disminuir las tasas de infección nosocomial, mediante la introducción de medidas de intervención destinadas a prevenir su aparición, así como optimizar los tratamientos empíricos adaptándolos a la sensibilidad de los principales microorganismos responsables de las infecciones controladas. En última instancia, los cambios introducidos deben tener impacto en la disminución de la mortalidad, de las estancias hospitalarias o de los costes del proceso, o bien en un incremento de la calidad de vida30.
En resumen, en nuestro estudio se han identificado en una muestra de pacientes críticos de nuestro país, las tasas nacionales de las infecciones nosocomiales para el año 2001, relacionadas con ventilación mecánica, sonda uretral y catéter venoso central, así como los agentes patógenos que predominan en cada uno de ellos y el estado de los marcadores de multirresistencia. Estas tasas son una referencia para cada UCI teniendo en cuenta que es necesario ajustar los valores esperados al riesgo de cada una de ellas.
AGRADECIMIENTOS
Queremos expresar nuetro agradecimiento a la Dra. Marta Pulido por su ayuda editorial y a Aventis Farma por su colaboración en la realización del proyecto.
*Participantes en el Grupo de Estudio de Vigilancia de la Infección Nosocomial en el paciente crítico. Año 2001:
F. Hernández, J.M. Flores, Hospital Virgen del Rocío (Traumáticos), Sevilla; P. Camacho, S.R. Leal, A. Herruzo, R. Amaya, Hospital Virgen del Rocío (Polivalente) N. Sevilla; A. Arenzana, A.M. Cossio, L. Cantón, S. Ibáñez, C. Calvo, Hospital Virgen de la Macarena, Sevilla; F. Castillo, R. Marco, L. Presa, Y. Galaforte, J.A. González, Hospital Duques del Infantado, Sevilla; M.V. de la Torre, Hospital Universitario Virgen de la Victoria, Málaga; A. Sanz, Hospital de Motril, Motril (Granada); R. Sierra, A. Guerrero, A. Gordillo, O. Lozano, Hospital Universitario Puerta de Mar, Cádiz; H. Sancho, R. Vegas, G. Alonso, M.A. Chirosa, N. Izquierdo, Hospital Reina Sofia, Córdoba; P. Lara, Hospital Infanta Margarita, Córdoba; J. Fierro, J.A. Ramos, A. Cárdenas, M. Ruiz, Hospital de Poniente, El Ejido (Almería); A. Ezpelete, G. Olivar, E. Campos, J. Muñoz, P. Dorado, Hospital Royo Vilanova, Zaragoza; C.A. Homs, Hospital General San Jorge, Huesca; A. Blanco, V. Español, J.A. Gonzalo, G. Muñoz, C. Calleja, Hospital Central de Asturias, Oviedo; C. Rey, A. Concha, Hospital Central (Pediatría), Oviedo; M, Valledor, M.T. Antuña, Hospi tal San Agustin, Avilés (Asturias); C. Santarrufina, J. López, R. Gastaldo, F. Vara, C. Vaquerizo, R. Pitarch, Hospital de Manacor, Mallorca; E. Molina, P. Merino, E. Escudero, E. Bartual, Hospital Can Misses, Ibiza; R. Fernández-Cid, M.A. González, M.A. Arribas, J. Llorca, Hospital Verge del Toro, Mahón (Menorca); J.L. Romero, C. Sánchez, E. Cabrera, Hospital Dr. Negrín, Las Palmas de Gran Canaria; J. Sánchez Godoy, M.C. Ruiz, C. Colmenero, Hospital Nuestra Señora de la Candelaria, Santa Cruz de Tenerife; P. López, F. Árbol, Hospital Nuestra Señora del Prado, Talavera (Toledo); F. García, V. Córcoles, Hospital General de Albacete; P. Ucio, F. Bobillo, Hospital Universitario de Valladolid; M.J. López Cambra, T.L. Álvarez, Hospital General de Segovia; M.J. López Pueyo, A. Zabalegui, R. Giral, Hospital General Yagüe, Burgos; C. Fernández, D. Fontaneda, M.E. Sevillano, S. Gutiérrez, Y. Domínguez, Hospital de León; L. Tamayo, R. Pascual, Hospital Río Carrión, Palencia; M. Palomar, E. Arnau, J. Serra, X. Nuvials, J. Caballero, Hospital de la Vall d'Hebrón, Barcelona; B. Almirante, C. Ferrer, M. Méndez-Aguirre, Hospital de la Vall d'Hebrón (Coronaria), Barcelona; M. Baguena, A. Garnacho, Hospital de la Vall d'Hebrón (Traumatología), Barcelona; E. Zabala, N. Fábregas, A. Alcón, J. Balust, Hospital Clínic (UCI quirúrgica), Barcelona; M. Misis, P. Ortells, Clínica Asepeyo, Barcelona; F. Fernández, Centro Médico Delfos, Barcelona; F. Álvarez-Lerma, Hospital del Mar, Barcelona; M. Pujol, J.M. Galván, L.L. Corral, T. Farré, Hospital de Bellvitge, Hospitalet de Llobregat (Barcelona); A. Rovira, A López, J. Berrade, L. Oussedik, N. Rico, Hospital de la Cruz Roja, Hospitalet de Llobregat (Barcelona); M. Casanovas, Hospital de Igualada (Barcelona); J.M. Sirvent, S. González, Hospital Universitari Dr. Josep Trueta, Girona; F. Barcenilla, S. Rodríguez, D. Campi, Hospital Arnau de Vilanova, Lleida; F. Bodi, P. Jupert, D. Castander, C. Rabassó P. Espinosa, Hospital San Pau i Santa Tecla, Tarragona; F. Esteban, J.M. Galván, Hospital Universitari de San Joan de Reus (Tarragona); J. Luna, Hospital Verge de la Cinta, Tortosa (Tarragona); E. Ferrer, E. Betancort, Hospital Clínico Universitario, Santiago de Compostela (A Coruña); C.J. Fernández, J. González, A. García, Hospital Arquitecto Marcide, El Ferrol (A Coruña); A. Díaz, Compleixo Hospitalario Cristal-Piñol, Ourense; V. López, Hospital Santa María Madre, Ourense; A. Varela, R. Gonzalez, Clínica Fátima, Vigo; M.C. Touza, Hospital Policlínico Povisa, Vigo (Pontevedra); M.J. Guillén, Hospital Meixoeiro, Pontevedra; J. Blanco, M.A. Fernández, Hospital Xeral de Lugo; M.A. Alcalá, A. Gamo, Fundación Jiménez Díaz, Madrid; M. Daguerre, E. Nevado, Hospital Príncipe de Asturias, Alcalá de Henares (Madrid); M. Mas, Hospital General de Móstoles, Madrid; E. Cerdá, M.A. de la Cal, Hospital de Getafe, Getafe (Madrid); A. Martínez Pellús, Hospital de la Arrixaca, El Palmar (Murcia); J. Insausti, M. Loinaz, N. Villanueva, A. Ansotegui, A. Díaz, Hospital de Navarra, Pamplona; E. Maraví, J.M. Martínez, A. Lander, I. Susperregui, J. Eschurri, Hospital Virgen del Camino, Pamplona; J. Lobo, J.A. Tihisa, O. Agudo, P. Anguiano, Hospital García Orcoyen, Estella (Navarra); J. Urtasun, C. Martínez, F. Rodríguez, Clínica San Miguel, Pamplona; V. López, M.J. Broch, Hospital de Sagunto (Valencia); B. Álvarez Sánchez, J. Acosta, J.M. Caturla, Hospital General de Alicante (Alicante); F. Labayen, M. Ulibarrena, A. Manzano, Hospital Santiago Apóstol, Vitoria; C. Castillo, S. Iribarren, T. Muñoz, Y. Poveda, J.L. Dudagoitia, Hospital de Txagorritxu, Vitoria; A. Mendia, I. Azcarate, B. Azcarate, M. Zabarte, F. Alberdi, Hospital Nuestra Señora de Aránzazu, San Sebastián; V. Urbistondo, V. Reina, F. Lavado, Hospital de Donostia (Edificio Guipuzcoa), San Sebastián; E. Laviñeta, K. Reviejo, E. Romo, Policlínica de Guipuzcoa; P. Olaechea, T. Ortega, A. de la Serna, R. de Celis, Hospital de Galdakao, Galdakao (Vizcaya).
Los nombres en cursiva corresponden a los responsables del programa ENVIN-UCI en cada unidad o servicio de pacientes críticos.