Identificar predictores pretrasplante de mortalidad precoz (90 días postrasplante) y evaluar su capacidad discriminante en receptores adultos de trasplante hepático (RTH).
DiseñoEstudio observacional, retrospectivo, de casos y controles anidados sobre una cohorte consecutiva de RTH.
ÁmbitoHospital Universitario.
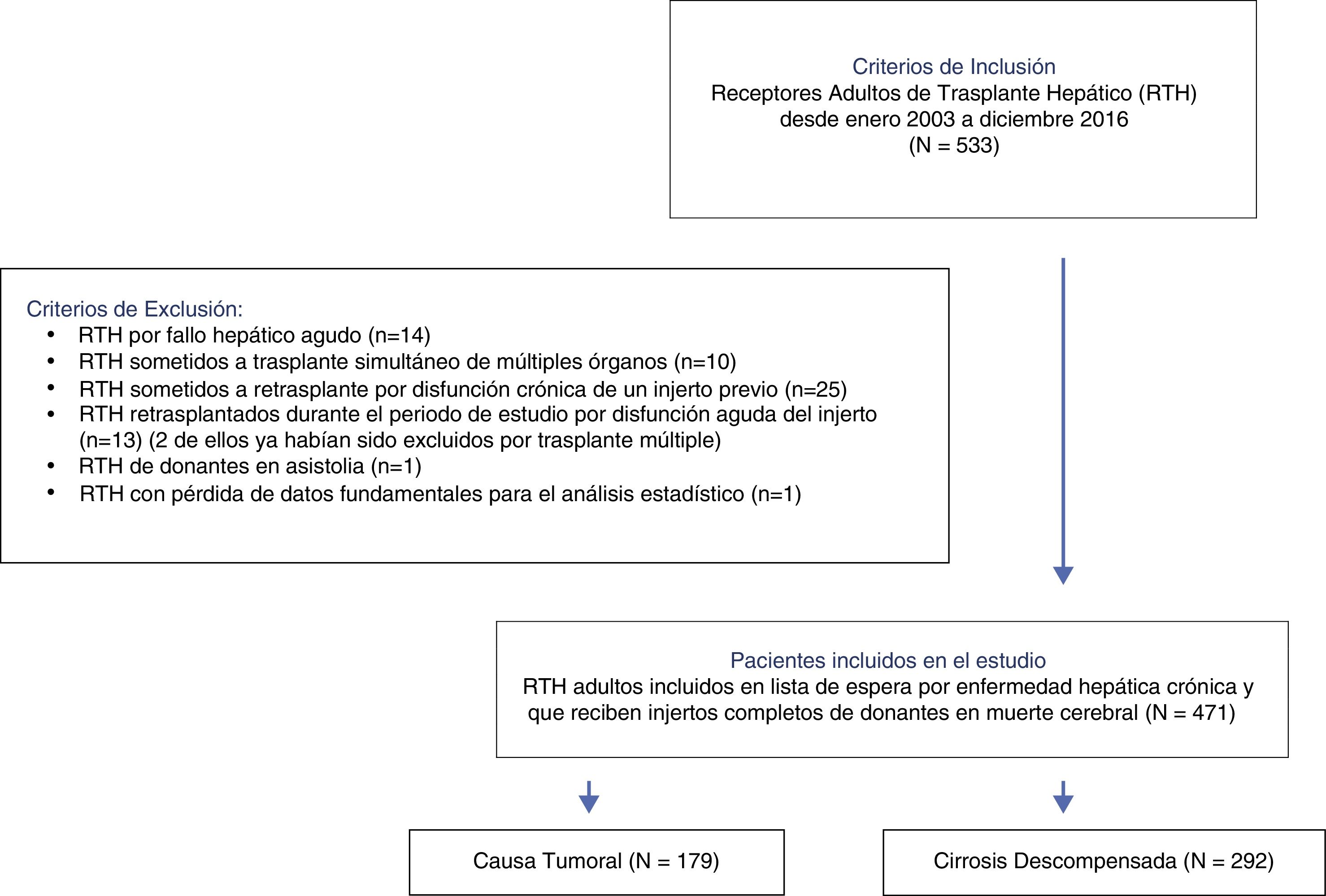
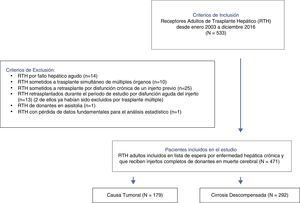
PacientesDesde enero de 2003 a diciembre de 2016, todos los receptores adultos de trasplante hepático fueron elegibles para inclusión. Fueron excluidos los RTH por fallo hepático agudo, disfunción de un injerto previo, trasplante simultáneo de órganos, de donantes en asistolia, y aquellos que precisaron retrasplante durante el periodo de estudio. Para el análisis se incluyeron 471 pacientes.
Principales variables de interésLas características pretrasplante fueron las variables de interés. Los RTH fueron agrupados de acuerdo con la variable dependiente (mortalidad precoz). Los predictores se obtuvieron mediante análisis multivariante de regresión logística. La capacidad discriminante de los modelos obtenidos se evaluó mediante comparación de curvas ROC.
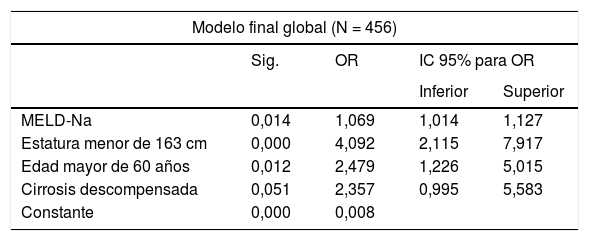
ResultadosSe identificaron como predictores independientes de mortalidad precoz: la puntuación MELD-Na (OR=1,069; IC95%=1,014-1,127), la edad mayor de 60 años (OR=2,479; IC95%= 1,226-5,015), y la estatura del RTH inferior a 163cm (OR=4,092; IC95%=2,115-7,917), considerándose el motivo del trasplante (carcinoma hepatocelular o cirrosis descompensada) como variable de confusión.
ConclusionesEn los RTH por cirrosis descompensada, la puntuación MELD-Na, la edad mayor de 60 años y la estatura del receptor inferior a 163cm son predictores independientes de mortalidad precoz. Esos predictores producen un modelo que clasifica a los pacientes significativamente mejor que el MELD-Na en relación con la mortalidad precoz.
To identify pretransplant predictors of early mortality (90 days after transplantation) and evaluate their discriminating capacity in adult liver transplant recipients (LTR).
DesignAn observational, retrospective, nested cases-controls study from a consecutive cohort of LTRs was carried out.
SettingUniversity hospital.
PatientsAll consecutive LTR between January 2003 and December 2016 were eligible for inclusion. Patients with acute liver failure, previous graft dysfunction, simultaneous multiple organ transplantation, non-heart beating donors, and those needing urgent retransplantation during the study period were excluded. The analysis comprised 471 patients.
Main variables of interestPretransplant characteristics were the main variables of interest. The LTR were grouped according to the dependent variable (early mortality). Multivariate logistic regression analysis was conducted to identify predictors of early mortality. The discriminating capacity of the models obtained was evaluated by comparing ROC curves (models versus MELD-Na).
ResultsThe MELD-Na score (OR = 1.069, 95% CI = 1.014-1.127), age > 60 years (OR = 2.479, 95% CI = 1.226-5.015), and LTR height < 163cm (OR = 4.092, 95% CI = 2.115-7.917) were identified as independent predictors of early mortality. The cause of transplantation (hepatocellular carcinoma or decompensated cirrhosis) was identified as a confounding factor.
ConclusionsIn LTR due to decompensated cirrhosis, the MELD-Na score, age > 60 years, and height < 163cm are independent predictors of early mortality. These factors provide a better classification model than the MELD-Na score for early post-transplant mortality.
El trasplante hepático es la única terapia curativa para los pacientes con enfermedad hepática terminal, pero el riesgo inherente al procedimiento del trasplante es significativo y los receptores de trasplante hepático (RTH) han de poder superarlo. Aunque no existe consenso establecido, se podría considerar la mortalidad durante los primeros 90 días después del trasplante (mortalidad precoz) inferior al 10% como criterio estándar de buena practica clínica en pacientes sometidos a trasplantes electivos1,2.
La desproporción entre donantes y potenciales candidatos al trasplante hizo obligada la priorización de los candidatos en lista de espera. En el pasado, las escalas de Child-Turcotte-Pugh o de la United Network for Organ Sharing (UNOS score) fueron el estándar3, pero los sistemas de distribución de órganos han evolucionado intentando aplicar los principios de justicia individual y máximo rendimiento de la donación4.
La introducción del Model for End-stage Liver Disease (MELD)5 score aportó objetividad y transparencia a la priorización6, y es actualmente utilizado en todo el mundo para la distribución de órganos por su balance entre utilidad y justicia distributiva7, excepto en las situaciones donde el pronóstico no está directamente relacionado con la función hepática, excepciones al MELD, siendo el carcinoma hepatocelular (CHC) el paradigma8.
Aunque la puntuación MELD está bien establecida como predictor de mortalidad antes del trasplante y es utilizada como criterio de distribución de órganos, ha sido ampliamente estudiada y debatida para su mejora9–11, y recientemente ha sido revisada12. Así pues desde enero de 2016 la UNOS incluye la tasa de sodio sérico para el cálculo del MELD.
También se ha estudiado el papel del MELD como predictor de la mortalidad postrasplante, aunque sigue siendo motivo de debate13,14. Por ello, se han estudiado otros factores de riesgo, como la hospitalización previa en UCI15, necesidad de tratamiento de depuración extrarrenal16, antecedentes de cirugía abdominal17, u otras comorbilidades que añadidas al MELD pudieran construir modelos específicos que mejoren la capacidad predictiva de mortalidad postoperatoria precoz18.
Los especialistas en Medicina Intensiva deben participar en los comités de selección de los candidatos para trasplante hepático y deben conocer los factores de riesgo que pueden incrementar la mortalidad postoperatoria.
El objetivo principal del estudio fue identificar otras características clínicas de los candidatos en lista de espera, y por tanto previas al trasplante, que junto al MELD-Na se comporten como predictores independientes de mortalidad precoz (primeros 90 días) tras el trasplante hepático en los receptores adultos electivos. Y como objetivo secundario, valorar la capacidad de predicción o discriminación de las variables incluidas en el modelo obtenido.
Pacientes y métodosSe diseñó un estudio retrospectivo, observacional, de casos y controles anidados sobre una cohorte consecutiva de RTH adultos, en una única institución de ámbito universitario.
Fueron elegibles para su inclusión todos los receptores adultos de trasplante hepático desde enero de 2003 hasta diciembre de 2016. Se consideraron criterios de exclusión: pacientes con fallo hepático agudo, los pacientes sometidos a trasplante simultáneo de múltiples órganos, los receptores de trasplante hepático de donantes vivos o de donantes en asistolia, los receptores electivos de segundos trasplantes por disfunción crónica de un injerto previo y aquellos receptores con necesidad de retrasplante urgente durante el periodo de estudio.
Se consideraron casos a los pacientes que cumplieron el criterio de mortalidad dentro de los 90 días después del trasplante, el resto de los receptores de trasplante fueron considerados controles.
Se registraron variables antropométricas de los receptores (edad, género, peso, talla e índice de masa corporal), la etiología de la enfermedad hepática y puntuaciones pretrasplante relacionadas con el pronóstico de la enfermedad hepática (Child-Pugh, MELD). La puntuación MELD-Na fue calculada (http://www.rccc.eu/calculadoras/MELD.html) con los datos de laboratorio obtenidos en el momento del ingreso hospitalario para realizar el trasplante, momento en que también se registraron urea y creatinina en sangre. Y de la historia clínica se obtuvieron los antecedentes de otras comorbilidades pretrasplante que pudieran incidir sobre la mortalidad postoperatoria, como diabetes mellitus, implantación de transjugular portosystemic shunt (TIPS) o cirugía supramesocólica, y también los antecedentes durante el mes previo al trasplante de criterios de síndrome hepatorrenal, tratamiento con terlipresina, necesidad de soporte renal (diálisis en cualquiera de sus modalidades) e ingresos hospitalarios (tanto en planta como en UCI).
El estudio cumple todos los requerimientos contenidos en el código ético de la OMS (Declaración de Helsinki), fue aprobado por el Comité de Investigación Clínica del hospital, y el Comité de Ética eximió a los investigadores de la necesidad de solicitar el consentimiento informado.
Estudio estadísticoLos pacientes fueron agrupados de acuerdo a la variable dependiente (mortalidad a los 90 días del trasplante). Las variables de estudio cuantitativas de la cohorte fueron analizadas para contrastar su ajuste a la distribución normal (test de Kolmogorov-Smirnov) y se describen como mediana y percentiles 25-75 cuando es apropiado. Para el estudio de casos y controles, todos los factores excepto la puntuación MELD-Na se categorizaron para una mejor comprensión de los resultados desde el punto de vista clínico, y se individualizaron en variables dummy cuando estaba indicado. El punto de corte para la categorización de los factores cuantitativos fue elegido de forma arbitraria según un criterio clínico basado en el valor del cuartil de mayor riesgo. En la variable descompensación de la cirrosis se agruparon las etiologías hepatocelular, biliar y miscelánea.
El análisis bivariante se realizó mediante regresión logística binaria simple. Se obtuvo la tasa de riesgo como odds ratio (OR) y su intervalo de confianza al 95% (IC95%) como medida de asociación. Se consideró significativa la probabilidad p-valor < 0,05.
Se realizó análisis multivariante mediante regresión logística binaria incluyendo en el modelo inicial todos los factores con p-valor ≤ 0,10. Los posibles factores de confusión e interacciones (estatura y género) fueron controlados mediante análisis estratificado y regresión logística. Se obtuvo un modelo intermedio considerando significativos los factores con p-valor ≤ 0,15 y que se ajustó mediante regresión logística binaria atrás por pasos con salida manual de predictores (razón de verosimilitud) y máxima parsimonia considerando significativos los predictores con p-valor ≤ 0,05 para obtener el modelo final. Se construyeron las curvas Receiver Operating Characteristic (ROC) de los modelos y se comparó la probabilidad discriminante de estos según los motivos de trasplante mediante el test de DeLong. El análisis estadístico fue realizado utilizando los paquetes informáticos PASW versión 18 (SPSS Inc. Chicago, IL), y MedCalc statistical software versión 18 (Ostend, Belgium).
ResultadosUn total de 533 trasplantes hepáticos fueron realizados en RTH durante el periodo de estudio. Todos ellos fueron elegibles. Se excluyeron 62 RTH que cumplían alguno o varios de los criterios de exclusión. En total fueron incluidos 471 pacientes para el análisis (fig. 1).
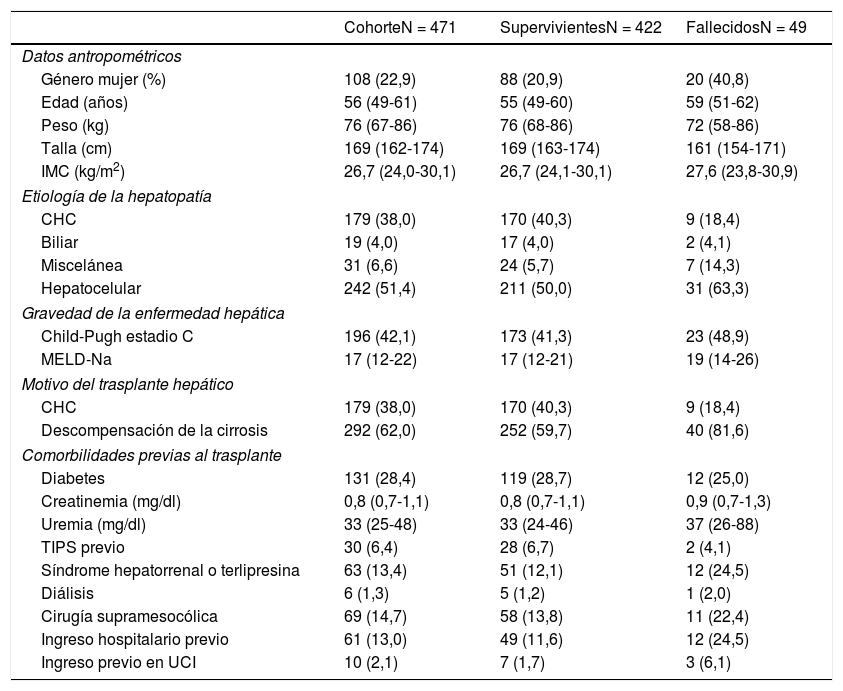
Las características pretrasplante de los grupos de estudio se describen en la tabla 1. La mediana de edad de los RTH fue de 55 años (P25-P75 = 49-60 años), existió predominio de varones (77,1%), y la mediana del IMC fue de 26,7kg/m2 (P25-P75 = 24,0-30,1). Las indicaciones para el trasplante fueron las descompensaciones de la cirrosis (62%) y los tumores hepáticos (38%).
Descripción de las características pretrasplante de la cohorte de receptores de trasplante hepático y casos-controles (N = 471)
| CohorteN = 471 | SupervivientesN = 422 | FallecidosN = 49 | |
|---|---|---|---|
| Datos antropométricos | |||
| Género mujer (%) | 108 (22,9) | 88 (20,9) | 20 (40,8) |
| Edad (años) | 56 (49-61) | 55 (49-60) | 59 (51-62) |
| Peso (kg) | 76 (67-86) | 76 (68-86) | 72 (58-86) |
| Talla (cm) | 169 (162-174) | 169 (163-174) | 161 (154-171) |
| IMC (kg/m2) | 26,7 (24,0-30,1) | 26,7 (24,1-30,1) | 27,6 (23,8-30,9) |
| Etiología de la hepatopatía | |||
| CHC | 179 (38,0) | 170 (40,3) | 9 (18,4) |
| Biliar | 19 (4,0) | 17 (4,0) | 2 (4,1) |
| Miscelánea | 31 (6,6) | 24 (5,7) | 7 (14,3) |
| Hepatocelular | 242 (51,4) | 211 (50,0) | 31 (63,3) |
| Gravedad de la enfermedad hepática | |||
| Child-Pugh estadio C | 196 (42,1) | 173 (41,3) | 23 (48,9) |
| MELD-Na | 17 (12-22) | 17 (12-21) | 19 (14-26) |
| Motivo del trasplante hepático | |||
| CHC | 179 (38,0) | 170 (40,3) | 9 (18,4) |
| Descompensación de la cirrosis | 292 (62,0) | 252 (59,7) | 40 (81,6) |
| Comorbilidades previas al trasplante | |||
| Diabetes | 131 (28,4) | 119 (28,7) | 12 (25,0) |
| Creatinemia (mg/dl) | 0,8 (0,7-1,1) | 0,8 (0,7-1,1) | 0,9 (0,7-1,3) |
| Uremia (mg/dl) | 33 (25-48) | 33 (24-46) | 37 (26-88) |
| TIPS previo | 30 (6,4) | 28 (6,7) | 2 (4,1) |
| Síndrome hepatorrenal o terlipresina | 63 (13,4) | 51 (12,1) | 12 (24,5) |
| Diálisis | 6 (1,3) | 5 (1,2) | 1 (2,0) |
| Cirugía supramesocólica | 69 (14,7) | 58 (13,8) | 11 (22,4) |
| Ingreso hospitalario previo | 61 (13,0) | 49 (11,6) | 12 (24,5) |
| Ingreso previo en UCI | 10 (2,1) | 7 (1,7) | 3 (6,1) |
Las variables cuantitativas se describen como mediana y percentiles 25-75 (P25-P75). Las variables cualitativas se describen como frecuencia y porcentaje de columna. Síndrome hepatorrenal o terlipresina, ingreso hospitalario o en UCI previos, se refieren a comorbilidades durante el mes previo al trasplante.
CHC: carcinoma hepatocelular; IMC: índice de masa corporal; TIPS acrónimo inglés de shunt portosistémico transyugular.
Una proporción elevada de los RTH tenían otras comorbilidades; diabetes mellitus (28,4%), criterios de síndrome hepatorrenal o necesidad de tratamiento con terlipresina en el último mes (13,4%) o habían sido sometidos a terapia de soporte renal en cualquiera de sus modalidades al menos una vez (1,3%), habían sufrido cirugía supramesocólica previa (14,7%), o habían sido ingresados en el hospital en el último mes o estaban ingresados cuando se aceptó la donación del órgano para el trasplante (n=61, 13,0%), y 10 de ellos estaban ingresados en UCI en el momento del trasplante (2,1% del total).
Un total de 49 pacientes (10,4%) cumplían el criterio de la variable principal del estudio (mortalidad antes de 90 días después del trasplante).
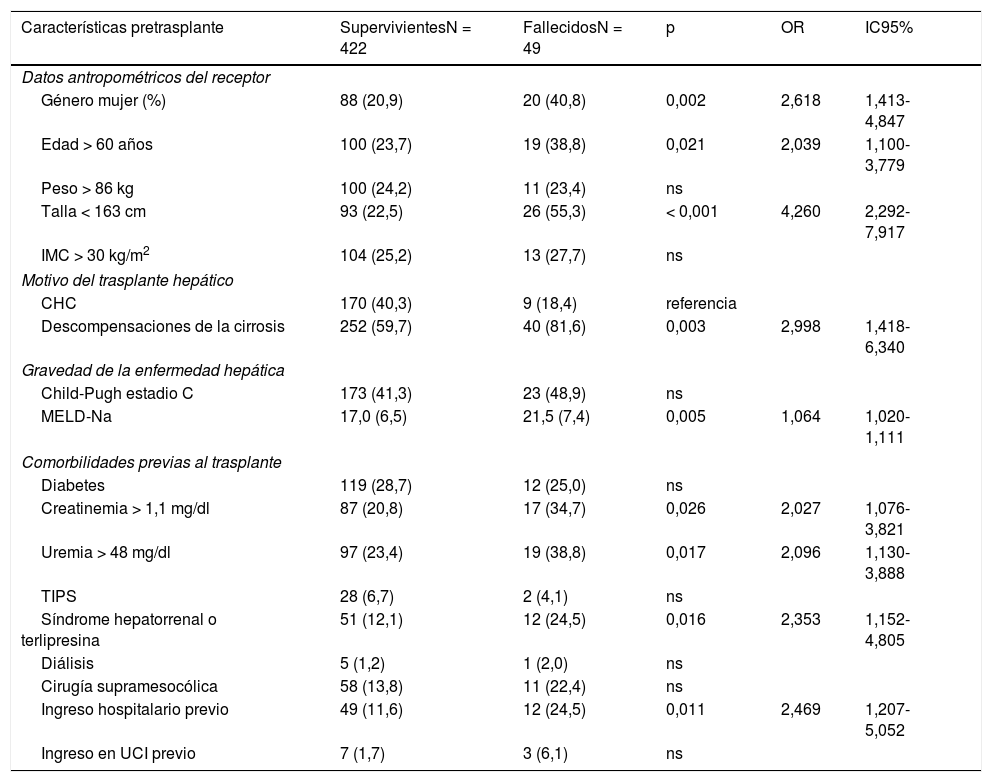
El análisis de los factores de riesgo potencial de mortalidad considerados se muestra en la tabla 2. La mortalidad fue mayor en las mujeres (OR=2,618, IC95%=1,413-4,847), en los RTH mayores de 60 años de edad (OR=2,039, IC95%=1,100-3,779) y en los receptores de estatura menor de 163cm (OR=4,260, IC95%=2,292-7,917). La interacción de la estatura con el género no fue significativa, OR = 0,908 (IC95%=0,820-1,005). En RTH por causa de descompensación de la cirrosis la mortalidad precoz postrasplante es mayor que en los trasplantados por causa tumoral (CHC) (OR=2,998, IC95%=1,418-6,340). La mortalidad también se relaciona con la gravedad de la enfermedad (MELD-Na, OR=1,064 por cada punto de incremento con IC95%=1,020-1,111), pero no solamente por afectación de la función hepática (grado C de Child-Pugh, p-valor = ns). Los RTH que fallecieron presentaban cifras más elevadas de creatinemia (OR=2,027, IC95%=1,076-3,821) y uremia (OR=2,096, IC95%=1,130-3,888)], mayor frecuencia de síndrome hepatorrenal previo (OR=2,353, IC95%=1,152-4,805) y de diálisis pretrasplante (p-valor = 0,615). También habían precisado ingreso hospitalario en el mes previo al trasplante en mayor proporción (OR=2,469, IC95%=1,207-5,052) o estaban ingresados en UCI en el momento del trasplante (OR=3,866, IC95%=0,0967-15,467). La diabetes no se comportó como factor de riesgo de mortalidad precoz (p-valor = ns).
Evaluación de los predictores pretrasplante de mortalidad precoz postrasplante hepático. Análisis bivariante (N=471)
| Características pretrasplante | SupervivientesN = 422 | FallecidosN = 49 | p | OR | IC95% |
|---|---|---|---|---|---|
| Datos antropométricos del receptor | |||||
| Género mujer (%) | 88 (20,9) | 20 (40,8) | 0,002 | 2,618 | 1,413-4,847 |
| Edad > 60 años | 100 (23,7) | 19 (38,8) | 0,021 | 2,039 | 1,100-3,779 |
| Peso > 86 kg | 100 (24,2) | 11 (23,4) | ns | ||
| Talla < 163 cm | 93 (22,5) | 26 (55,3) | < 0,001 | 4,260 | 2,292-7,917 |
| IMC > 30 kg/m2 | 104 (25,2) | 13 (27,7) | ns | ||
| Motivo del trasplante hepático | |||||
| CHC | 170 (40,3) | 9 (18,4) | referencia | ||
| Descompensaciones de la cirrosis | 252 (59,7) | 40 (81,6) | 0,003 | 2,998 | 1,418-6,340 |
| Gravedad de la enfermedad hepática | |||||
| Child-Pugh estadio C | 173 (41,3) | 23 (48,9) | ns | ||
| MELD-Na | 17,0 (6,5) | 21,5 (7,4) | 0,005 | 1,064 | 1,020-1,111 |
| Comorbilidades previas al trasplante | |||||
| Diabetes | 119 (28,7) | 12 (25,0) | ns | ||
| Creatinemia > 1,1 mg/dl | 87 (20,8) | 17 (34,7) | 0,026 | 2,027 | 1,076-3,821 |
| Uremia > 48 mg/dl | 97 (23,4) | 19 (38,8) | 0,017 | 2,096 | 1,130-3,888 |
| TIPS | 28 (6,7) | 2 (4,1) | ns | ||
| Síndrome hepatorrenal o terlipresina | 51 (12,1) | 12 (24,5) | 0,016 | 2,353 | 1,152-4,805 |
| Diálisis | 5 (1,2) | 1 (2,0) | ns | ||
| Cirugía supramesocólica | 58 (13,8) | 11 (22,4) | ns | ||
| Ingreso hospitalario previo | 49 (11,6) | 12 (24,5) | 0,011 | 2,469 | 1,207-5,052 |
| Ingreso en UCI previo | 7 (1,7) | 3 (6,1) | ns | ||
Síndrome hepatorrenal o terlipresina, ingreso hospitalario o en UCI previos, se refieren al mes previo al trasplante.
Excepto la puntuación MELD-Na, variable cuantitativa que se expresa como media (desviación estándar), todas las variables fueron categorizadas de acuerdo al punto de corte del cuartil de mayor riesgo, y se describen como frecuencia y porcentajes, y el contraste de hipótesis se realizó mediante regresión logística binaria simple, expresándose la significación de probabilidad p, tasa de riesgo OR odds ratio e IC95% intervalos de confianza al 95%.
CHC carcinoma hepatocelular; IMC: índice de masa corporal; ns: no signficativo.TIPS: acrónimo inglés de shunt portosistémico transyugular.
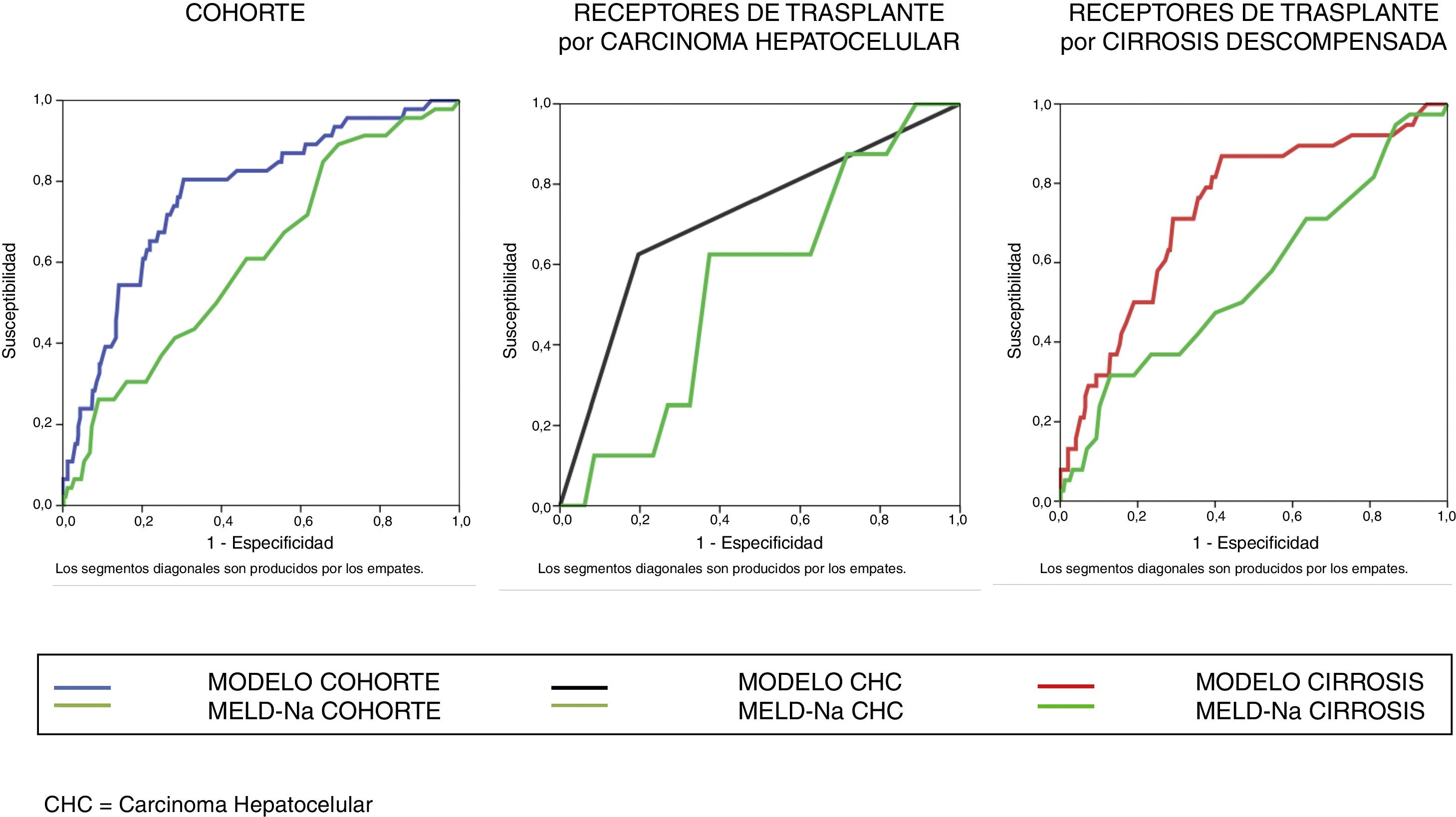
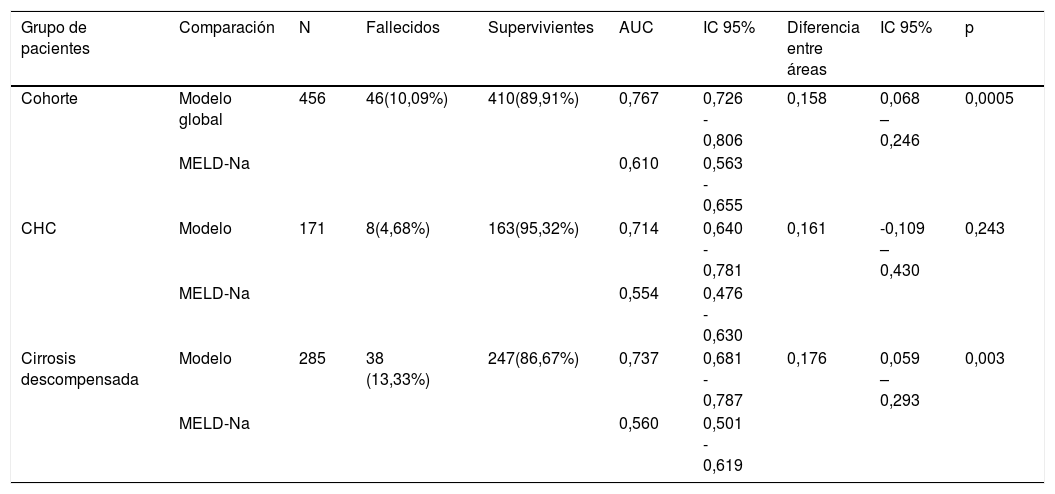
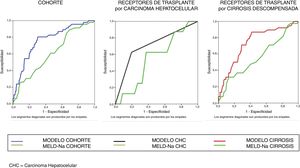
El análisis bivariante identificó 10 variables explicativas predictoras de mortalidad precoz (p-valor ≤ 0,10) que fueron incluidas en el análisis multivariante. Se excluyó la creatinina por colinealidad y se incluyó la cirugía previa por criterio clínico. Este modelo inicial explica entre el 10,0-20,7% de la varianza total, con un porcentaje global de acierto del 90,3%. Tiene muy elevada especificidad (99,7%) aunque muy baja sensibilidad (6,5%). Mediante un proceso de regresión logística atrás por pasos se obtuvo el modelo final que identificó 3 predictores independientes de mortalidad precoz y un factor de confusión (motivo del trasplante) que incrementa en un 27% el coeficiente de regresión ß de la puntuación MELD-Na, por lo que queda en la ecuación final (tabla 3). En esta tabla se muestran los predictores independientes tanto globales como para ambos motivos de trasplante, por causa tumoral y por descompensación de la cirrosis. Se obtuvieron las curvas ROC de ambos en comparación con la curva ROC del MELD-Na (fig. 2) y la capacidad predictiva de los modelos finales fue comparada con respecto al MELD-Na mediante el test de DeLong (tabla 4) confirmándose que el modelo obtenido en los RTH por motivo de descompensación de la cirrosis predice mejor la supervivencia que el MELD-Na de forma significativa (p-valor = 0,003), mientras que el modelo en RTH trasplantados por CHC no mejora la predicción del MELD-Na.
Predictores pretrasplante independientes de mortalidad precoz postrasplante hepático. Análisis de regresión logística multivariante: Modelos finales
| Modelo final global (N = 456) | ||||
|---|---|---|---|---|
| Sig. | OR | IC 95% para OR | ||
| Inferior | Superior | |||
| MELD-Na | 0,014 | 1,069 | 1,014 | 1,127 |
| Estatura menor de 163 cm | 0,000 | 4,092 | 2,115 | 7,917 |
| Edad mayor de 60 años | 0,012 | 2,479 | 1,226 | 5,015 |
| Cirrosis descompensada | 0,051 | 2,357 | 0,995 | 5,583 |
| Constante | 0,000 | 0,008 | ||
| Modelo final para pacientes RTH por causa de CHC (N = 171) | ||||
|---|---|---|---|---|
| Sig. | OR | IC 95% para OR | ||
| Inferior | Superior | |||
| Estatura menor de 163 cm | 0,005 | 7,765 | 1,847 | 32,650 |
| Constante | 0,000 | 0,023 | ||
| Modelo final para pacientes RTH por causa de cirrosis descompensada (N = 285) | ||||
|---|---|---|---|---|
| Sig. | OR | IC 95% para OR | ||
| Inferior | Superior | |||
| MELD-Na | 0,012 | 1,082 | 1,018 | 1,150 |
| Estatura menor de 163 cm | 0,001 | 3,581 | 1,711 | 7,497 |
| Edad mayor de 60 años | 0,011 | 2,845 | 1,269 | 6,376 |
| Constante | 0,000 | 0,015 | ||
CHC: carcinoma hepatocelular; IC95%: intervalo de confianza al 95%; MELD-Na: Mayo End-Liver Disease score; OR: odds ratio; RTH: receptores de trasplante hepático.
Comparación de las curvas ROC mediante el test de DeLong
| Grupo de pacientes | Comparación | N | Fallecidos | Supervivientes | AUC | IC 95% | Diferencia entre áreas | IC 95% | p |
|---|---|---|---|---|---|---|---|---|---|
| Cohorte | Modelo global | 456 | 46(10,09%) | 410(89,91%) | 0,767 | 0,726 - 0,806 | 0,158 | 0,068 – 0,246 | 0,0005 |
| MELD-Na | 0,610 | 0,563 - 0,655 | |||||||
| CHC | Modelo | 171 | 8(4,68%) | 163(95,32%) | 0,714 | 0,640 - 0,781 | 0,161 | -0,109 – 0,430 | 0,243 |
| MELD-Na | 0,554 | 0,476 - 0,630 | |||||||
| Cirrosis descompensada | Modelo | 285 | 38 (13,33%) | 247(86,67%) | 0,737 | 0,681 - 0,787 | 0,176 | 0,059 – 0,293 | 0,003 |
| MELD-Na | 0,560 | 0,501 - 0,619 |
AUC área bajo la curva; CHC: carcinoma hepatocelular; IC95% intervalo de confianza al 95%; N: tamaño de la muestra; P: probabilidad; % porcentaje.
Es conocido que las complicaciones del acto quirúrgico son las que tienen mayor impacto sobre la mortalidad precoz de los RTH17,19,20, pero generalmente no pueden ser previstas ni controladas antes del trasplante. Por ello, precisamos encontrar predictores pretrasplante que puedan ayudarnos a valorar el riesgo de los candidatos en lista de espera y predecir la mortalidad tras el trasplante. Aunque se han realizado múltiples estudios al respecto, los resultados no han sido concluyentes21–25.
Los resultados de nuestro estudio demuestran la diferente asociación de factores de riesgo de mortalidad y motivo del trasplante (CHC vs. descompensación de la cirrosis) e incluyen a la puntuación MELD-Na como predictor independiente de mortalidad precoz en los RTH por cirrosis descompensada.
También confirman los resultados de otros estudios26–28 que incluyen la edad mayor de 60 años como un factor de riesgo independiente de mortalidad, pero este predictor no tiene valor en los RTH por causa tumoral y solo debiera ser tenido en cuenta en los RTH por descompensación de la cirrosis, lo cual podría estar en relación con una mayor comorbilidad en estos pacientes.
Hasta donde nuestro conocimiento alcanza, el presente trabajo es pionero en relacionar la estatura del receptor como factor de riesgo independiente de mortalidad. La causa no puede ser conocida por los datos del estudio, pero sería razonable asociarlo con una mayor tasa de complicaciones quirúrgicas en relación tanto al menor tamaño del campo quirúrgico como a la mayor probabilidad de disparidad de tamaños donante/receptor del hígado29. En nuestro estudio también se aprecia esa asociación, mayor proporción de donantes varones (60,5%) y mayor mortalidad en mujeres (OR=2,618 con IC95%= 1,413-4,847), por lo que el género puede comportarse como factor de confusión. Sin embargo, en nuestros resultados la estatura sigue siendo significativa cuando fue controlada por el género. Estos resultados no coinciden con los de otros autores30 y deberá ser validado.
Y finalmente, nuestro estudio demuestra que incluso considerando una importante cantidad de factores pretrasplante (18 variables) no somos capaces de diferenciar de forma significativa a los pacientes que fallecerán tras el trasplante hepático, dado que nuestros modelos muestran escasa sensibilidad. Esto tiene una muy importante implicación en las evaluaciones pretrasplante de los posibles candidatos.
Desde el punto de vista clínico, es lógico pensar que aquellos pacientes con mayor disfunción hepática, mayor grado de hipertensión portal y mayor disfunción renal (mayor puntuación MELD-Na) tendrán mayor riesgo perioperatorio. En nuestros pacientes cada incremento de 10 puntos en el MELD-Na incrementó la mortalidad un 10% aproximadamente. Pero aunque la puntuación MELD-Na pretrasplante sea un predictor independiente de mortalidad postrasplante precoz, su capacidad predictiva es pobre20,30,31. Esto coincide con nuestros resultados, ya que el MELD-Na explica solo entre el 1,7-3,5% de la varianza de la mortalidad precoz (R2 de Cox-Snell y Nagelkerke). Y por ello, los estudios realizados en pacientes con MELD mayores de 40 puntos no pueden demostrar la futilidad del trasplante en estos pacientes en base solamente a este predictor24,32. Por tanto, no podríamos rechazar la opción del trasplante a pacientes con elevada puntuación MELD-Na en base a este parámetro solamente.
Hay que considerar que en nuestro caso la puntuación MELD-Na es obtenida de los datos de laboratorio en el momento del ingreso para el trasplante del paciente y, más importante, que se refiere a la capacidad predictiva de mortalidad postrasplante y no de pacientes en lista de espera sin trasplante, por ello la capacidad predictiva del MELD-Na es menor que las cifras publicadas por estos autores33,34. Además la capacidad predictiva de la mortalidad postrasplante también disminuye al disgregar el modelo global (tabla 4).
Nuestros datos tienen una debilidad, de la cual somos conscientes tras los resultados del estudio, y es que un predictor tan significativo desde el punto de vista estadístico (la estatura del receptor) no suele ser medido de forma directa sino que es referido por los pacientes y podría tener un sesgo35, aunque este sesgo disminuye al categorizar la variable estatura del receptor en una variable dicotómica. De todas formas, la pregunta clínica es si una diferencia de medianas de 8cm en la estatura de ambos grupos es clínicamente relevante o solo estadísticamente significativa. Para resolverlo precisaríamos corroborar nuestros resultados en otras poblaciones diferentes o haber estudiado a una cohorte de validación. Esta última opción no pudo ser realizada dada la baja frecuencia de mortalidad y el consiguiente tamaño muestral, por lo que debe considerarse una limitación de nuestro estudio.
Nuestros modelos son simples, homogéneos en sus criterios y están centrados en los receptores en lista de espera sin contraindicaciones evidentes (cardiopatía grave, sepsis activa) para el trasplante. Presentan muy elevada especificidad y valores predictivos negativos, pero tienen muy escasa sensibilidad para diferenciar a los pacientes que no sobreviven al trasplante. Otros estudios que incluyen datos del donante y del proceso quirúrgico tampoco demuestran una mejor predicción de mortalidad36,37. Por todo ello, pensamos que podrían ser considerados por los Comités de Evaluación de Candidatos como herramientas de valoración del riesgo en pacientes individualizados, aunque teniendo siempre en cuenta que la predicción de la mortalidad basada en factores pretrasplante es muy pobre en los casos individuales.
En conclusión, los modelos obtenidos con los factores pretrasplante estudiados tienen muy bajo valor predictivo positivo y baja capacidad discriminante (AUROC inferior a 0,8), y por tanto no pueden excluir la posibilidad del trasplante a ninguno de los candidatos, dado que no son capaces de clasificar con seguridad a los pacientes que fallecerán en el periodo postrasplante precoz. Pero estos predictores pueden ayudar a los Comités de Evaluación de Candidatos a valorar el riesgo de mortalidad de los candidatos en base al motivo del trasplante (CHC o no-CHC) y en consecuencia intentar minimizar otros factores de riesgo. Los RTH por causa tumoral (CHC) tienen mayor riesgo de mortalidad precoz si su estatura es inferior a 163cm. Los RTH por causa de cirrosis descompensada tienen mayor riesgo de mortalidad precoz cuanto más elevada sea su puntuación MELD-Na, si su edad es mayor de 60 años y si su estatura es inferior a 163cm, y este modelo predice la supervivencia significativamente mejor que el MELD-Na de forma aislada.
Autoría/colaboradoresJCPL y MRP han contribuido al diseño del estudio y la selección de los criterios de inclusión y exclusión.
MCMV, JCPL y MRP han contribuido a la realización del estudio estadístico.
JCPL, FRE, JMT e IDG han contribuido en el registro de datos.
JCPL es responsable del manuscrito.
Todos los autores son responsables de la revisión final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.