Describir las variables relacionadas con la capacidad tusígena efectiva y el estado de la conciencia medidas previo a la decanulación y comparar sus valores medidos entre los diferentes ámbitos de atención como la Unidad de Cuidados Intensivos (UCI), sala general y centros de desvinculación de la ventilación mecánica y rehabilitación (CDVMR). Secundariamente analizar la evolución de los pacientes una vez decanulados.
DiseñoSerie de casos, longitudinal y prospectiva.
ÁmbitoMulticéntrico 31 UCI (polivalentes) y en 5 CDVMR.
PacientesAdultos traqueostomizados previos a la decanulación.
MedicionesPresión espiratoria máxima, pico flujo espiratorio tosido (PFET), Glasgow Coma Scale (GCS).
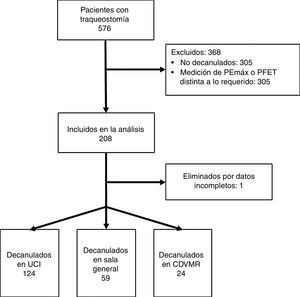
ResultadosDoscientos siete pacientes decanulados, 124 (60%) en UCI, 59 (28%) en sala general y 24 (12%) en CDVMR. El PFET presentó diferencias entre los pacientes (UCI 110 - 190 l/min versus CDVMR 167,5 - 232,5 l/min; p<0,01). El GCS fue diferente entre la sala general (9 -15) versus UCI (10- 15) y CDVMR (12 - 15); p<0,01 y p<0,01, respectivamente. Hubo diferencias en los días de internación (p<0,01), los días con traqueostomía (<0,01) y la cantidad de pacientes derivados a domicilio (p=0,02) entre los distintos escenarios.
ConclusiónExisten diferencias en los valores medidos de PFET y GCS entre los diferentes ámbitos. Una considerable cantidad de pacientes son decanulados con valores de PFET y presión espiratoria máxima por debajo de los puntos de corte sugeridos como predictores de falla en la literatura. Ningún paciente de nuestra serie fue decanulado con un SCG <8 puntos, esto refleja la importancia que le otorga el equipo tratante al estado de conciencia al momento de la decanulación.
To describe the variables related to effective cough capacity and the state of consciousness measured prior to decannulation and compare their measured values between the different areas of care such as the Intensive Care Unit (ICU), General ward and Mechanical Ventilation Weaning and Rehabilitation Centers (MVWRC). Secondarily analyze the evolution of patients once decannulated.
DesignCase series, longitudinal and prospective.
ScopeMulticentric 31 ICUs (polyvalent) and 5 MVWRC.
PatientsTracheostomized adults prior to decannulation.
MeasurementsMaximum expiratory pressure, peak expiratory flow coughed (PEFC), Glasgow Coma Scale (GCS).
ResultsTwo hundred and seven decannulated patients, 124 (60%) in ICU, 59 (28%) General ward and 24 (12%) in MVWRC. The PEFC presented differences between the patients (ICU 110 - 190 l/min versus MVWRC 167.5 - 232.5 l/min, p <.01). The GCS was different between General ward (9 -15) versus ICU (10-15) and MVWRC (12-15); p <.01 and p <.01, respectively. There were differences in the days of hospitalization (p <.01), days with tracheostomy (<0.01) and the number of patients referred at home (p =.02) between the different scenarios.
ConclusionThere are differences in the values of PEFC and GCS observed when decannulating between different areas. A considerable number of patients are decannulated with values of PEFC and maximum expiratory pressure below the suggested cut-off points as predictors of failure in the literature. No patient in our series was decanulated with an GCS <8, this reflects the importance that the treating team gives to the state of consciousness prior to decannulation.
La decisión de retirar la cánula de traqueostomía o decanulación está influenciada por múltiples factores. Al ser un proceso complejo, suele guiarse por algoritmos o protocolos, que pueden variar de acuerdo con cada institución y que establecen criterios a alcanzar o superar para poder avanzar hacia la decanulación1–7. Si bien es cierto que no todos los centros se adhieren o desarrollan protocolos de decanulación, la falla decanulación es un evento poco frecuente y según los valores publicados oscila entre el 0 y el 6%8–12.
Los criterios que suelen estar presentes en la gran mayoría de los protocolos se resumen en la capacidad de proteger la vía aérea a través de una tos eficaz, el buen pasaje de flujo de aire por la vía aérea y una función deglutoria adecuada13–15.
La protección de la vía aérea se evalúa mediante el estado de conciencia y la capacidad tusigena1,4.
El nivel o estado de la conciencia suele recomendarse como una variable a tener en cuenta antes de decidir decanular a un paciente. Sin embargo, no existe un consenso común en cuanto a la forma de evaluarlo y al nivel mínimo a considerar para predecir el éxito de la decanulación8,13,14.
Con respecto a la capacidad de generar tos, los principales indicadores que suelen evaluarse en el proceso de decanulación son el pico flujo espiratorio tosido (PFET) y la presión espiratoria máxima (PEmáx). Los valores clínicos relevantes para estos predictores suelen ser motivo de controversia ya que, diferentes autores postulan valores disímiles13,14.
Otro factor relevante es la heterogeneidad de los ámbitos en donde pueden internarse pacientes con traqueostomía, a saber; unidad de cuidados intensivos (UCI), guardia o la sala general (SG) y los centros de desvinculación de la ventilación mecánica y rehabilitación (CDVMR). En estos ámbitos, generalmente se inicia el proceso de decanulación y en ciertas ocasiones se finaliza16. Si bien entre los ámbitos propuestos existen diferencias en las poblaciones y en la complejidad de atención, los criterios de decanulación suelen ser idénticos o similares16–18.
Hasta el momento no existen estudios que describan las variables clínicas relevantes según el ámbito de internación en donde se encuentre el paciente con traqueostomía. A raíz de esto, nos proponemos describir las variables relacionadas con la capacidad de producir tos efectiva y el estado de la conciencia comúnmente utilizadas en el proceso de decanulación y comparar sus valores medidos entre los diferentes ámbitos de atención como la UCI, la SG y los CDVMR. Además de manera secundaria planeamos analizar la evolución de los pacientes una vez decanulados.
Materiales y métodosSe realizó un estudio de tipo multicéntrico con un diseño de serie de casos longitudinal y prospectivo, que incluyó 31 UCI (polivalentes) y en 5 CDVMR de Argentina en el período comprendido entre 1 de junio de 2014 al 31 de enero de 2015.
Previo al inicio del reclutamiento cada centro incluido obtuvo la aprobación del comité de docencia e investigación y del comité de ética correspondiente a la institución.
La muestra quedó definida por los siguientes criterios de elegibilidad:
Criterios de inclusión: pacientes mayores de 18 años, con traqueostomía realizada durante la internación para el caso de la UCI y la SG y que hayan ingresado ya traqueostomizados en los CDVMR, además debían encontrarse desvinculados de la ventilación mecánica y aptos para ser decanulados (pacientes con decisión de decanular por el equipo tratante).
Criterios de exclusión: pacientes que nunca hayan sido decanulados. Pacientes decanulados cuyos datos provengan de centros que no realicen las mediciones de PEmáx y PFET mediante la técnica deseada por este estudio.
Criterios de eliminación: datos faltantes en las tres variables de resultado principal. En caso de datos faltantes de una o dos variables de resultado principales (GCS, PFET o PEmáx) el paciente solo se excluyó para el análisis de la variable con el dato faltante.
Variables de estudioPredictivas: edad, sexo, Score de Charlson al ingreso, antecedentes relacionados, motivo de ingreso a la UCI, tipo de procedimiento para realizar la traqueostomía (percutáneo o quirúrgico).
Todos los pacientes fueron seguidos como máximo 30 días después de la decanulación y se registraron las variables de evolución, a saber; falla de decanulación (recanulación dentro de los 7 días de decanulado por cualquier motivo), días con traqueostomía (desde que se realiza la traqueostomía hasta que se decanula al paciente), días totales de internación (desde el ingreso a la UCI y/o CDVMR hasta alcanzar un criterio de finalización del estudio, a saber; óbito, alta domicilio, derivación a otro centro o fin de seguimiento 30 días desde la decanulación) y mortalidad a los 30 días.
Variables independientes: ámbito de decanulación (UCI, SG o CDVMR).
Variables de resultado: estado de conciencia medido por el score de coma de Glasgow (GCS), capacidad tusígena valorada mediante PFET y PEmáx.
ProcedimientosLos pacientes fueron clasificados en los diferentes niveles de atención según el lugar donde se realizó la decanulación, resultando tres niveles diferentes de atención a saber; pacientes decanulados en UCI, SG y CDVMR.
Al ser un estudio observacional y pragmático no se solicitó la modificación de los protocolos habituales de medición que utilizaban los centros intervinientes. De todas formas, se solicitó a los centros que describieran el método de medición utilizado para el PFET, la PEmáx y el GCS.
Con el objetivo de homogenizar las mediciones y que estas sean comparables, solo se consideró para el análisis los pacientes provenientes de los centros que hayan medido las variables de resultado siguiendo los procedimientos descriptos en el Anexo 1 (ver material adicional en su versión electrónica).
Análisis estadísticoLas variables categóricas se expresan como recuento absoluto y porcentaje. Las variables medidas en escala numérica discreta o continua se presentan con medidas de tendencia central y dispersión según la distribución encontrada.
Se realizaron pruebas de bondad de ajuste mediante test de Kolmogorov-Smirnov. La igualdad de varianzas se estableció mediante el estadístico de Levenne.
Para las comparaciones entre los diferentes niveles de atención se utilizó el test de X2 para la comparación de variables nominales y el test de Kruskal-Wallis para las comparaciones de variables continuas entre los diferentes niveles de atención. Para identificar los pares con diferencias significativas se realizó un análisis post hoc mediante la prueba de Dunn's - Bonferroni de comparación por pares para las variables continuas y el test de diferencia de proporciones para las variables categóricas.
Por último, se categorizó a los pacientes según hayan o no alcanzado el criterio de corte propuesto (GCS 8 puntos, PFET 160l/m y PEmáx 40cmH2O) y se comparó la distribución de las variables de evolución mediante la prueba U de Mann-Whitney para las variables continuas y el test exacto de Fisher para las variables nominales.
Todos los análisis estadísticos se realizaron utilizando el programa estadístico, IBM SPSS Statistics for Windows Versión 22.0 (Armonk, NY: IBM Corp). Se consideró significativo un p-valor < 0,05.
ResultadosSe estudiaron 207 pacientes provenientes de 36 centros de investigación. De estos, 31 correspondían a UCI o SG y 5 a CDVMR (Anexo 1). La figura 1 describe el flujo de pacientes durante el estudio.
Las características de la muestra y de cada grupo por separado se observa en la tabla 1.
Características basales de serie
| TodosN=207 | UCIN=124 (60%) | Sala generalN= 59 (28%) | CDVMRN=24 (12%) | |
|---|---|---|---|---|
| Edad, X (±SD), años | 53 (17,9) | 54,3 (17,9) | 49,4 (17,85) | 59,5 (17,0) |
| Sexo femenino, n (%) | 77 (37) | 40 (32,0) | 30 (50,8) | 7 (29,2) |
| Score de Charlson, Mn (Q25-Q75) | 1 (0-3) | 1 (0-3) | 1,7 (1-4) | 2 (0,12-3) |
| Ant. respiratorios, n (%) | 42 (20,2) | 26 (21,0) | 7 (11,9) | 9 (37,5) |
| Ant. cardiovasculares, n (%) | 99 (47,6) | 62 (50,0) | 27 (45,8) | 10 (41,7) |
| Ant. neurológicos, n (%) | 34 (16,3) | 20 (16,1) | 9 (15,3) | 5 (20,8) |
| Ant. metabólicos, n (%) | 65 (31,3) | 42 (33,9) | 17 (28,8) | 6 (25,0) |
| Ant. psiquiátricos, n (%) | 12 (5,8) | 8 (6,6) | 4 (6,8) | 0 (0) |
| Ant. oncológicos, n (%) | 18 (8,7) | 11 (8,9) | 3 (5,1) | 4 (16,7) |
| Ant. tabaquista, n (%) | 67 (32,2) | 43 (34,7) | 17 (28,8) | 7 (29,2) |
| ODC, n (%) | 2 (1%) | 1 (0,8) | 0 (0,0) | 1 (4,2) |
| Motivo de ingreso en UCI | ||||
| Médico, n (%) | 87 (41,8) | 60 (48) | 16 (27,1) | 11 (45,8) |
| Quirúrgico de urgencia, n (%) | 46 (22,1) | 27 (21,6) | 17 (28,8) | 2 (8,3) |
| Quirúrgico programado, n (%) | 30 (14,4) | 20 (16) | 8 (13,6) | 2 (8,3) |
| Trauma, n (%) | 5 (2,4) | 4 (3,2) | 0 (0) | 1 (4,2) |
| Trauma con TEC, n (%) | 40 (19,2) | 14 (11,2) | 18 (30,5) | 8 (33,3) |
| TQT percutánea, n (%) | 91 (43,8) | 70 (56,4) | 12 (20,3) | 9 (15,0) |
| Motivo realización de TQT | ||||
| TQT precoz, n (%)a | 79 (38,7) | 47(37,6) | 21(35,6) | 11(55,0) |
| Destete prolongado, n (%) | 54 (26,5) | 30(24,0) | 20(33,9) | 4 (20,0) |
| VMP, n (%)b | 39 (19,1) | 30 (24,0) | 8 (13,6) | 1 (5,0) |
| Extubaciones fallidas, n (%) | 23 (11,3) | 12(9,6) | 7(11,9) | 4(20,0) |
| OVA, n (%) | 9 (4,4) | 6 (4,8) | 3 (5,1) | 0 (0) |
Ant.: antecedentes; CDVMR: centro de desvinculación ventilación mecánica y rehabilitación; ODC: oxígeno domiciliario crónico; OVA: obstrucción de vía aérea; TEC: traumatismo encéfalo craneano; TQT: traqueostomía; UCI: unidad de cuidados intensivos; VMP: ventilación mecánica prolongada.
Se encontraron diferencias estadísticamente significativas en el PFET y en el puntaje GCS entre los diferentes ámbitos de atención (p=0,028 y p<0,01, respectivamente) (tabla 2).
Variables de resultado
| Variable | Estadístico | UCI | SG | CDVMR | P |
|---|---|---|---|---|---|
| PFET (l/min) | Md(Q25-75) | 152,5 (110-190) | 177 (117-214,5) | 200 (167,5-232,5) | 0,02 |
| PEmáx (cmH2O) | Md(Q25-75) | 60 (40-80) | 56 (40-62,5) | 62,5 (43,7 – 75,5) | 0,36 |
| GCS | Md(Máx-Min) | 15 (10-15) | 10 (9-15) | 15 (12-15) | <0,01 |
| Días a la decanulación | Md(Q25-75) | 26 (14 - 41) | 30 (20 - 47) | 56 (32 - 91) | <0,01 |
| Días de internación | Md(Q25-75) | 38 (38 - 83) | 53 (39 - 86) | 83 (76 - 130,7) | <0,01 |
| Falla de decanulación | n (%) | 2 (1) | 1 (0,5) | 0 (0) | 0,81 |
| Alta domiciliaria | n (%) | 81 (38,9) | 24 (11,5) | 10 (4,8) | 0,02 |
| Mortalidad a los 30 días | n (%) | 7 (3,4) | 2 (1) | 0 (0) | 0,42 |
GCS: score de coma de Glasgow; PEmáx: presión espiratoria máxima; PFET: pico flujo espiratorio tosido.
En las variables de evolución se observó diferencias significativas en los días con traqueostomía (UCI, Mn 26 días; SG Mn de 30 días; CDVMR Mn de 56 días, p<0,01), los días de internación (UCI, Mn 53 días; SG Mn de 57 días; CDVMR Mn de 129,5 días, p<0,01) y el número de pacientes que se externaron a domicilio (UCI 81 pacientes [38,9%]; SG 24 pacientes [11,5%]; CDVMR 104,8; p=0,02). No se observaron diferencias en la cantidad de pacientes que presentaron falla de decanulación al igual que en la mortalidad a los 30 días.
En la tabla 3 se presenta las comparaciones post hoc entre los diferentes ámbitos de internación.
Análisis post hoc
| Lugar de decanulación | p | ||
|---|---|---|---|
| PFETMd (Q25-75) | UCI 152,5 (110-190) | SG177 (117-214,5) | 0,198 |
| UCI 152,5 (110-190) | CDVMR200 (167,5-232,5) | 0,01 | |
| SG 177 (117-214,5) | CDVMR200 (167,5-232,5) | 0,159 | |
| GCSMd (Máx - Min) | UCI 15 (10-15) | SG10 (9-15) | <0,01 |
| UCI 15 (10-15) | CDVMR15 (12-15) | 0,211 | |
| SG 10 (9-15) | CDVMR15 (12-15) | <0,01 | |
| Días a decanulaciónMd (Q25-75) | UCI26 (14-41) | SG30 (20-47) | 0,17 |
| UCI26 (14-41) | CDVMR56 (32-91) | <0,01 | |
| SG30 (20-47) | CDVMR56 (32-91) | <0,01 | |
| Días a la internación(Q25-75) | UCI38 (38-83) | SG53 (39-86) | 0,89 |
| UCI38 (38-83) | CDVMR83 (76-130,7) | <0,01 | |
| SG53 (39-86) | CDVMR83 (76-130,7) | <0,01 | |
| Alta domiciliaria a los 30 días, n(%)a | UCI81 (38,9) | SG24 (11,5) | <0,01 |
| UCI81 (38,9) | CDVMR10 (4,8) | 0,03 | |
| SG24 (11,5) | CDVMR10 (4,8) | 0,93 | |
Todos los pares se compararron con la prueba de Dunn's-Bonferroni p<0,05 excepto en las que se indica.
CDVMR: centro de desvinculación ventilación mecánica y rehabilitación; GCS: Escala de Coma de Glasgow; PFET: pico flujo espiratorio tosido; UCI: unidad de cuidados intensivos; SG: sala general.
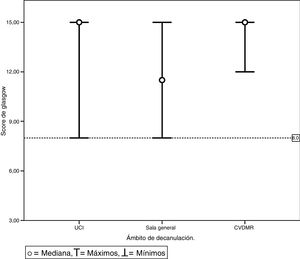
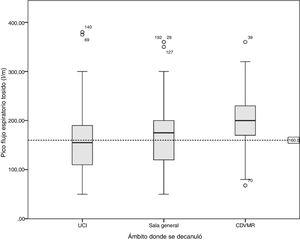
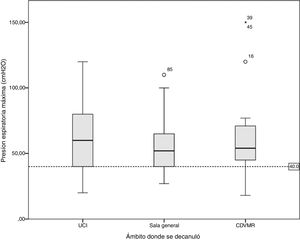
La tabla 4 presenta la comparación de las variables de evolución categorizando a los pacientes en grupos según hayan o no alcanzado los criterios de corte para el PFET y la PEmáx. No se analizó la variable GCS ya que ningún paciente se decanuló por debajo del punto de corte definido. Además, se representan gráficamente en la figura 2 la mediana del GCS con sus respectivos máximos y mínimos según el ámbito de internación. La figura 3 y la figura 4 muestran los diagramas de caja del PFET y la PEmáx según el ámbito de internación.
Evolución de los pacientes decanulados
| N.o. (%) o mediana [Q25-Q75] | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| UCI | SG | CVMR | |||||||
| PFET n= 81 | PFET n= 37 | PFET n=20 | |||||||
| ≥ 160 l/m | < 160 l/m | p | ≥ 160 l/m | < 160 l/m | p | ≥ 160 l/m | < 160 l/m | p | |
| Días a la decanulación | 20,5 [13 - 36] | 33 [19 - 46] | 0,04 | 36,5 [20 - 47] | 24 [19 - 38] | 0,77 | 56 [31 - 77] | 51 [51,2 - 71] | 0,45 |
| Días de internación | 49 [31 - 66] | 77,5 [53 - 98] | <0,01 | 57 [30 - 77] | 54 [43 - 76] | 0,32 | 97 [73 - 150] | 135 [119 - 163] | 0,79 |
| Falla de decanulación | 2 (2,5) | 2 (2,5) | 0,49 | 1 (2,7) | 1 (2,7) | 0,99 | 0 (0) | 0 (0) | NA |
| Alta domiciliaria | 31 (38,3) | 22 (27,2) | 0,06 | 7 (19,8) | 4 (10,8) | 0,99 | 2 (10) | 6 (30) | 0,53 |
| Mortalidad | 2 (2,5) | 5 (6,2) | 0,26 | 2 (5,4) | 0 (0) | 0,51 | 0 (0) | 0 (0) | NA |
| PEmáx n=94 | PEmáx n=48 | PEmáx n=22 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| ≥ 40 cmH2O | < 40 cmH2O | P | ≥ 40 cmH2O | < 40 cmH2O | P | ≥ 40 cmH2O | < 40 cmH2O | P | |
| Días a la decanulación | 25 [13,5 - 44] | 31 [21,5 - 49,5] | 0,17 | 28 [21,2 - 49] | 32 [18,5 - 37] | 0,57 | 51 [31 - 72] | 140 [132 - 197] | <0,01 |
| Días de internación | 52 [36,5 - 90] | 74 [54,5 - 92] | 0,17 | 55,5 [39 - 86,7] | 51 [33 - 59] | 0,33 | 123 [67 - 150] | 221 [200 - 257] | <0,01 |
| Falla de decanulación | 4 (4,3) | 0 (0) | 0,99 | 2 (4,2) | 0 (0) | 0,99 | 0 (0) | 0 (0) | NA |
| Alta domiciliaria | 57 (60) | 4 (4,3) | 0,02 | 18 (37,5) | 2 (4,2) | 0,56 | 10 (45) | 0 (0) | 0,22 |
| Mortalidad | 4 (4,3) | 3 (3,2) | 0,10 | 2 (4,2) | 0 (0) | 0,99 | 0 (0) | 0 (0) | NA |
Comparación por ámbito de internación de la evolución de los pacientes según hayan alcanzado o no el criterio de decanulación.
CDVMR: centro de desvinculación ventilación mecánica y rehabilitación; PFET: pico flujo espiratorio tosido; PEmáx: presión espiratoria maxima; UCI: unidad de cuidados intensivos; SG: sala general.
Gráfico de máximos y mínimos del score de coma Glasgow previo a la decanulación según el ámbito de decanulación. Níngún paciente fue decanulado con un valor del score de coma Glasgow menor a 8 puntos, este valor está representado por la discontinua. Esto fue igual para todos los ámbitos tanto la Unidad de cuidados intensivos, la sala general y los centros de desvinculación de la ventilación mecánica y rehabilitación.
Gráfico de cajas del valor de pico flujo espiratorio tosido según el ámbito de decanulación. La línea representa el valor de corte de 160 l/min. Se observa como este valor no es alcanzado en todos los ámbitos en diferentes proporciones, 46,1% de los pacientes internados en la Unidad de cuidados intensivos, 31,1% en la sala general y el 17,4% en los centros de desvinculación de la ventilación mecánica y rehabilitación (CDVMR).
Gráfico de cajas del valor de presión espiratoria máxima según el ámbito de decanulación. La línea representa el valor de corte de 40 cmH2O. Se observa como este valor no es alcanzado en todos los ámbitos en diferentes proporciones, 9,7% en la Unidad de cuidados intensivos, 5,6% en la sala general y el 13,0% en los centros de desvinculación de la ventilación mecánica y rehabilitación.
Como principal hallazgo hemos observado que los valores de PFET y PEmáx de muchos pacientes no alcanzaron los puntos de corte propuestos por la literatura (160 l/min y 40cmH2O, respectivamente). Por otro lado, el punto de corte para el GCS reportado por la bibliografía sí fue respetado en todas las decanulaciones1,13,19–22. Además, fue notorio encontrar que los valores del GCS y PFET evaluados previamente a la decanulación son significativamente diferentes según el ámbito de internación donde se realice el retiro de la cánula.
Contrariamente a lo observado con el PEFT, la PEmáx presentó diferencias según el ámbito de decanulación, lo cual podría responder al procedimiento utilizado para la obtención de ambas variables. Mientras que la medición del PFT es esfuerzo dependiente, en la medición de la PEmáx, con el uso de una válvula unidireccional, se prescinde en cierta medida del esfuerzo voluntario del paciente19–22.
El ámbito de internación donde se observaron los valores de PFET más bajos fue la UCI. Esto podría ser razonable debido a que los pacientes generalmente se encuentran en recuperación de un período agudo y suelen cursar con una condición altamente prevalente como la debilidad adquirida en la UCI en donde se ha descrito la alteración tanto de la fuerza muscular periférica como respiratoria23–25.
Todos los investigadores del estudio refirieron considerar para la evaluación de la decanulación el punto de corte de PFET de 160 l/min propuesto por Bach y Saporito13. De todas formas pudo observarse que en todos los ámbitos de internación se decanularon pacientes con valores inferiores al punto de corte propuesto. De forma similar, pero en una población de pacientes postoperatorios de neurocirugía Chan et al. definieron un valor de PFET sensiblemente inferior de 29 l/min asociado a la decanulación exitosa14. La diferencia entre ambos estudios creemos radica en la metodología utilizada para la medición. En el estudio de Chan et al. no se controló la posible fuga de aire alrededor de la cánula, lo cual podría subestimar el valor real del PFET en estos pacientes. A raíz de esta debilidad procedimental hemos elegido como valor de referencia el valor de 160 l/m propuesto por Bach que además se encuentra ampliamente aceptado en la práctica diaria8,13. Por lo antes expuesto y considerando que la tasa de falla de decanulación habitual ronda entre el 0% al 6%5,8,9,12,26, nos surge la necesidad de replantear el valor de PFET límite para considerarlo como predictor para una decanulación exitosa.
Otros autores evaluaron la fuerza de la tos, mediante la presión máxima espiratoria generada por la musculatura respiratoria. Ceriana et al. evaluaron de forma prospectiva el punto de corte de PEmáx > a 40cm H2O en un protocolo de decanulación1. Santus et al. proponen un algoritmo cualicuantitativo donde también ponderan el valor de la capacidad tusígena evaluada mediante la PEmáx y adoptan el mismo límite para definir la conducta27. En nuestro estudio no hubo diferencias en el valor de PEmáx con respecto a la tasa de decanulación entre los diferentes ámbitos. Este hallazgo contradictorio podría explicarse a lo expuesto previamente en referencia al uso de válvula unidireccional para la medición de la PEmáx.
Las diferencias observadas en el GCS entre la SG con respecto a UCI y CDVMR sugieren que en la SG se toleran valores del GCS más bajos para la decanulación con respecto a la UCI. Esta observación, creemos, puede reflejar diferentes etapas en el curso de la evolución de un paciente que sobrepasa su etapa crítica. Se podría pensar que los pacientes que son externados de la UCI a una sala de internación generalmente ya tuvieron intentos de decanulación frustra. Este hecho puntual podría condicionar a tolerar un estado de conciencia con menor puntaje al momento de decanular. Esto podría variar en aquellos pacientes que son derivados con traqueostomía a un CDVMR donde los objetivos de tratamiento y los tiempos de internación difieren con respecto a la SG. Además, el paciente es recategorizado en «crónicamente enfermo» lo cual podría resultar en considerar criterios más estrictos para una decanulación. Este tópico no se ha discutido en la bibliografía encontrada.
En nuestro estudio el GCS al momento de la decanulación no estuvo por debajo del punto de corte elegido en ninguno de los ámbitos evaluados. Este hallazgo refuerza lo que postulan diversos autores como Stelfox et al. quienes recolectaron la opinión de expertos en manejo de pacientes con traqueostomía y el estado de conciencia resultó ser uno de los determinantes al momento de una decanulación segura8. Hernandez et al. encontraron mayor tiempo a la decanulación en quienes presentaban un GCS <13 puntos28. En otro estudio con pacientes neuroquirúrgicos Chan et al. valoraron el GCS previo a la decanulación y lo relacionaron con el éxito en la decanulación. Los autores concluyen que si bien el valor del GCS no aumenta el riesgo de fallar la decanulación sí existe una tendencia que sugiere que los pacientes que fallaron tenían un menor valor de GCS (p=0,06)14. Resumiendo, si bien los valores observados o elegidos para definir estado de conciencia varían entre los diversos autores, todos consideran para la decanulación la evaluación del estado de conciencia mediante el GCS a la hora de una decanulación segura.
Las variables de evolución de la serie de pacientes decanulados mostraron los resultados esperados. La mortalidad y la falla de decanulación no fueron significativas entre los diferentes ámbitos. Esto concuerda con otros autores que postulan que una vez que el paciente se encuentra desvinculado y apto para la decanulación el lugar donde se haga la decanulación no influiría en el resultado de la misma27. Contrario a esto existen estudios que atribuyen una mayor mortalidad a las decanulaciones realizadas en la sala general28,29.
Tanto los días de internación como los días a la decanulación resultaron significativamente mayores en la sala general y en los CDVMR. Esto puede explicarse en que suelen ser ámbitos de derivación que le suceden a la estancia en la UCI.
Para finalizar, al comparar la evolución de los pacientes según hayan sido decanulados cumpliendo o no los criterios propuestos por la bibliografía1,8,13,27, observamos que los sujetos que no cumplían con estos parámetros poseían más días de internación, más días a la decanulación y una cantidad mayor de ellos lograba el alta a domicilio. Sin embargo, esta diferencia no resultó estadísticamente significativa entre todos los escenarios.
El estudio presenta limitaciones que deben ser tenidas en cuenta. En primer lugar, cabe destacar la falta de un grupo control (pacientes no decanulados) que nos permitiera realizar una comparación en las variables utilizadas comúnmente para guiar la decanulación y poder así, definir los criterios diagnósticos de las variables estudiadas. Otra limitación radica en la variabilidad de los dispositivos utilizados para la medición del pico flujo espiratorio tosido ya que varios centros no contaron con neumotacógrafos para la medición del pico flujo y utilizaron sensores de pico flujo mecánicos. Por otro lado, los valores de PFET pudieron ser subestimados debido a que no se controló la fuga periostoma al momento de la medición, a diferencia de la PEmáx donde se sobreinfló el balón para las mediciones.
A pesar de las limitaciones expuestas creemos que la fortaleza del estudio radica en la presentación de datos que son utilizados en la práctica cotidiana por centros referentes en manejo de pacientes con traqueostomía. Si bien la decanulación puede ser guiada por una mayor cantidad de variables, varios autores coinciden en que la fuerza de la tos y el estado de conciencia suelen ser las variables con mayor peso para decidir la decanulación1,8,27.
Es necesario que estos resultados sean evaluados de manera prospectiva mediante estudios controlados a fin de establecer criterios de eficacia para las variables propuestas. Sugerimos que es importante evaluar la seguridad de la decanulación pero considerando que la permanencia innecesaria de la cánula de traqueostomía puede producir complicaciones.
ConclusiónEn este estudio se observaron diferencias en los valores de PFET y GCS entre los diferentes ámbitos en los que se realiza el retiro de la cánula de traqueostomía. Una considerable cantidad de pacientes fueron decanulados con valores de PFET y PEmáx por debajo de los puntos de corte sugeridos por la literatura como predictores de falla. Ningún paciente de nuestra serie fue decanulado con un score de coma de Glasgow menor a 8 puntos, lo que refleja la importancia del estado de conciencia al momento de decidir la decanulación. El seguimiento de esta serie refleja el prolongado tiempo de presencia de cánula de traqueostomía y que la decanulación está asociada a una mayor chance de ser externado a domicilio.
Autoría/colaboradoresLadislao Díaz Ballve: participó en la concepción, el diseño del estudio, adquisición de datos, el análisis y la interpretación de los datos. Además del borrador del artículo o la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta.
Darío Villalba: participó en la concepción, el diseño del estudio, adquisición de datos, el análisis y la interpretación de los datos. Además del borrador del artículo o la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta.
Mauro Andreu: participó en la concepción, el diseño del estudio, adquisición de datos, el análisis y la interpretación de los datos. Además del borrador del artículo o la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta.
Miguel Escobar: participó en la concepción, el diseño del estudio y la interpretación de los datos. Además de la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta.
Gastón Morel Vulliez: participó en la concepción, el diseño del estudio y la interpretación de los datos. Además de la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta.
Janina Lebus: participó en la concepción, el diseño del estudio, la adquisición de datos y la interpretación de los datos. Además, de la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta.
Emilio Rositi: participó en la concepción, el diseño del estudio, adquisición de datos y la interpretación de los datos. Además de la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Investigadores por centro
Díaz-Ballve Ladislao y Turón Gonzalo (Hospital Nacional Alejandro Posadas, El Palomar, Buenos Aires); Villalba Darío (Clínica Basilea, CABA); Escobar Miguel, Morel-Vulliez Gastón, Rositi Emilio y Gussoni Mariana (Centro Parque, CABA); Lebus Janina (Clínica La Sagrada Familia, CABA); Falduti Alejandra (Hospital Juan A. Fernández, CABA); Tenasczuk Karina (Alta Complejidad en Red, Hospital El Cruce, Dr. Néstor C. Kirchner, Lomas de Zamora, Buenos Aires); Reinoso Mayra (Hospital Italiano de Buenos Aires, CABA); Quijano Agustina y Bustamante Paola (Clínica de Internación Aguda en Rehabilitación y Cirugía [CIAREC], CABA); Di Pierro Mercedes (Hospital Regional Dr. Ramón Carrillo, Ciudad de Santiago del Estero, Santiago del Estero); Santini Marcela (Clínica Pasteur, Ciudad de Neuquén, Neuquén); Borello Silvina y Aguirre Mariana (Hospital Donación Francisco Santojanni, CABA), Gracia Guadalupe (Sanatorio Colegiales, CABA); Setten Mariano (Centro de Educación Médica e Investigaciones Clínicas «Norberto Quirno» [CEMIC], CABA); Di-Nardo Soledad (Clínica Santa Isabel, CABA); Navarro Emiliano (Hospital Carlos G. Durand, CABA); Ruggeri Federico (Hospital Escuela José de San Martín, Cdad. de Corrientes Provincia de Corrientes); Camargo Marcel, Franco Leandro, Funes Juan, García Luciano y Sosa Adriana (Hospital San Luis, Ciudad de San Luis, San Luis); Uberti Mariano (Clínica San Agustín, Ciudad de Neuquén, Neuquén); Mogadouro Mariela (Sanatorio de La Trinidad Palermo, CABA); Rapetti Leticia (Hospital Universitario UAI, CABA); Baqueiro Ayelen (Hospital Regional Artémides Zatti, Viedma, Río Negro); Garzón Gustavo (Sanatorio Nuestra Señora del Rosario, San salvador de Jujuy, Jujuy); Cervantes Violeta (Hospital María Ferrer, CABA); Revelli Rosana (Hospital Privado Universitario, Cdad. de Córdoba, Córdoba); Moreno Martín (Hospital Regional, Comodoro Rivadavia, Chubut); Hassan Ana Paula (Hospital Zonal, Esquel, Chubut); Busico Marina (Clínica Olivos - SMG, Olivos, Provincia de Buenos Aires); Luponio Marcelo (Hospital Julio C. Perrando, Resistencia, Chaco); Gelabert Deborah (Hospital Óscar Alende, Mar del Plata, Buenos Aires); González Luis (Clínica ALCLA, CABA); Rojas Vanesa (HIGA Petrona Villegas de Cordero, San Fernando, Buenos Aires); Kaspar Guillermina (Instituto de Investigaciones Médicas Alfredo A. Lanari, CABA); Veronesi Magdalena (Clínica Altergarten, CABA); Verduguez Marta (Hospital Simplemente Evita, González Catán, Buenos Aires); Seguil Yanina (Hospital Municipal de Trauma y Emergencias Dr. Federico Abete. Malvinas Argentinas, Buenos Aires); Terán Eduardo (Hospital Central, Ciudad de Mendoza, Mendoza).