Editado por: Alberto García-Salido - Cuidados Intensivos Pediátricos, Hospital Infantil Universitario Niño Jesús, Madrid
Última actualización: Mayo 2024
Más datosEn adultos el fracaso de la ventilación no invasiva (VNI) se ha asociado a peores resultados clínicos debido al retraso en la intubación y en el inicio de la ventilación invasiva (VMI). Existe falta de evidencia de esta asociación en pediatría. Nuestro objetivo fue determinar la asociación entre la duración de la VMI y la estancia, con la duración de la VNI previo a la intubación/VMI en pacientes pediátricos.
DiseñoEstudio de cohorte prospectivo desde enero de 2015 a octubre de 2019.
ÁmbitoUnidad de cuidados intensivos pediátricos (UCIP).
PacientesNiños/as menores de 15años con insuficiencia respiratoria aguda (IRA) que fracasaron a la VNI.
IntervencionesNinguna.
Variables de interés principalesSe registraron variables demográficas y clínicas, índice de mortalidad pediátrica (PIM2), diagnóstico de síndrome de distrés respiratorio agudo pediátrico (SDRAP), duración de la VMI y la VNI, estancia en UCIP y mortalidad intrahospitalaria.
ResultadosSe incluyeron un total de 109 pacientes con una mediana de edad de 7 (3-14) meses. El diagnóstico principal fue neumonía (89,9%). El 37,6% de la muestra presentó SDRAP. No se encontró asociación entre duración de la VNI y duración de la VMI mediante el análisis de Kaplan-Meier (logrank test p=0,479). No se encontraron diferencias significativas entre la estancia en UCIP (p=0,253) y hospitalaria (p=0,669) al categorizar por duración de la VNI. El SDRAP se asoció a mayor duración de la VMI (HR: 0,64 [IC95%: 0,42-0,99]).
ConclusiónNo se encontró asociación entre la duración de la VNI previo a la intubación y la duración de la VMI, ni en la estancia en pacientes pediátricos con IRA.
Noninvasive ventilation (NIV) failure it has been associated to worst clinical outcomes due to a delay in intubation and initiation of invasive mechanical ventilation (IMV). There is a lack of evidence in pediatric patients regarding this topic. The objective was to determine the association between duration of IMV and length of stay, with duration of NIV prior to intubation/IMV in pediatric patients.
DesignA prospective cohort study since January 2015 to October 2019.
SettingA pediatric intensive care unit.
PatientsChildren under 15years with acute respiratory failure who failed to noninvasive ventilation.
InterventionsNone.
Main variables of interestDemographic variables, pediatric index of mortality (PIM2), pediatric acute respiratory distress syndrome (PARDS) diagnosis, IMV and NIV duration, PICU LOS were registered and intrahospital mortality.
ResultsA total of 109 patients with a median (IQR) age of 7 (3-14) months were included. The main diagnosis was pneumonia (89.9%). PARDS was diagnosed in 37.6% of the sample. No association was found between NIV duration and duration of IMV after Kaplan-Meier analysis (Log rank P=.479). There was no significant difference between PICU LOS (P=.253) or hospital LOS (P=0.669), when categorized by NIV duration before intubation. PARDS diagnosis was associated to an increased length of invasive ventilation (HR: 0.64 [95%IC: 0.42-0.99]).
ConclusionsNo association was found between NIV duration prior to intubation and duration of invasive ventilation in critical pediatric patients with acute respiratory failure.
La ventilación mecánica no invasiva (VNI) es usada ampliamente como soporte respiratorio en la insuficiencia respiratoria aguda (IRA) en todas las edades1. Sin embargo, el fracaso de la VNI se ha identificado como factor independiente de mayor mortalidad en adultos con IRA de novo (excluye exacerbación de patología crónica respiratoria o cardiaca), aunque si esta asociación es de causalidad o es un marcador de mayor severidad es un aspecto que aún no está claro2.
En el contexto de la neumonía adquirida en la comunidad se ha descrito que un mayor tiempo de VNI previo a la intubación se asocia con menor sobrevida intrahospitalaria3, relacionando estos resultados con un retraso en la intubación y el inicio de la ventilación mecánica invasiva (VMI). La mortalidad reportada asociada al fracaso de la VNI varía entre el 9%4 y el 12%5. En relación con la duración de la VMI, si bien los estudios no son concluyentes, se ha identificado el fracaso de la VNI como factor de riesgo para una duración de la VMI ≥96h6,7.
El fracaso de la VNI en pacientes con síndrome de distrés respiratorio agudo pediátrico (SDRAP) se ha asociado con una mortalidad significativamente mayor, lo que se exacerba a mayor severidad de la hipoxemia8. Por esta razón, existe gran interés en identificar factores que puedan predecir tempranamente el fracaso de la VNI en pediatría para evitar sus consecuencias clínicas5,9,10.
Un consenso de expertos sugiere que la evaluación de la respuesta a la VNI debe realizarse durante las primeras horas, a fin de evitar el riesgo de retraso de la intubación, aunque no se determina un tiempo específico11. Por otro lado, la duración de la VNI en pacientes que posteriormente se intuban se ha reportado con una mediana de 13h (rango entre 0,5 a 77h)5,10. Así, según lo expuesto, aún no es posible determinar un rango o umbral de tiempo que, de ser superado, suponga un efecto deletéreo en los resultados clínicos del sujeto.
El objetivo principal del presente estudio es determinar la asociación entre la duración de la VNI previo a la intubación y la duración de la VMI, así como en la estancia en la unidad de cuidados intensivos pediátricos (UCIP) y hospitalaria en pacientes pediátricos con IRA en los que fracasó la VNI. De manera secundaria, identificar factores de riesgo de mayor duración de la VMI.
MétodoDiseño de investigaciónSe realizó un estudio de cohorte prospectivo, entre enero del 2015 hasta agosto del 2019, en la UCIP del Hospital Víctor Ríos Ruiz (Los Ángeles, Chile). El estudio contó con la aprobación del Comité de Ético-Científico del Servicio de Salud Biobío y se solicitó consentimiento informado a los tutores.
Población de estudioEl estudio fue realizado en pacientes críticos pediátricos de 0 a 15años que cursaron con una infección respiratoria aguda baja y que requirieron intubación a consecuencia del fracaso de la VNI. Se incluyeron pacientes que tuvieran los siguientes diagnósticos: bronquiolitis aguda definida como infección respiratoria aguda en niños menores de 2años, con rinitis, taquipnea, sibilancias, tos crepitaciones, uso de musculatura accesoria y/o aleteo nasal12; crisis asmática definida en niños con deterioro respiratorio progresivo debido a asma, que puede presentarse con tos, sibilancias, disnea, aumento del trabajo respiratorio y ansiedad13; y neumonía definida en presencia de fiebre, taquipnea, aumento del trabajo respiratorio, roncus, crepitaciones y sibilancias14. Se excluyó a los pacientes con cardiopatía congénita cianótica, usuarios de VNI nocturna, pacientes con daño neurológico y portadores de traqueostomía. La selección de la muestra se realizó mediante una técnica de muestreo no probabilístico de casos consecutivos.
Técnica de aplicación de la VNILa unidad cuenta con un protocolo que fue utilizado durante todo el periodo de estudio (figura 1 del material electrónico suplementario). La decisión de iniciar la VNI se basó en la presencia de aumento del trabajo respiratorio (frecuencia respiratoria aumentada >2 desviaciones estándar del rango normal para la edad y signos de disnea moderada a severa según escala clínica de Woods modificada mayor a 4puntos15) y/o una FiO2>50% para mantener una SatO2>94%16, pese al manejo médico estándar.
Se utilizaron ventiladores BiPAP Synchrony (Respironics®, Pittsburg, PA, EE.UU.) y Trilogy 202 (Respironics®, Pittsburg, PA, EE.UU.) con sistema de humidificación activa (MR 850 Fisher Paykel Healthcare, Auckland, Nueva Zelanda). Se usaron mascaras faciales Performax y oronasales Comfort Full (Respironics®, Pittsburg, PA, EE.UU.). En el material suplementario se muestran los parámetros iniciales sugeridos de acuerdo al protocolo de la unidad. Se usó hidrato de cloral y/o midazolam como sedantes para lograr una buena adaptación. Se realizaron desconexiones breves (<20min) cada 4 a 6h para realizar atenciones kinesiológicas, de enfermería, así como para descomprimir puntos de presión de la interfaz. No se utilizó punción arterial de rutina para valorar la oxigenación, y en su lugar utilizamos el índice índice SpO2/FiO2 (SF) (utilizando valores de SpO2 entre el 88 y el 97%)17, reservando la gasometría arterial o venosa para pacientes con respuesta parcial (reducción no satisfactoria del trabajo respiratorio).
Fracaso de la VNISe definió como la necesidad de intubación, la que es considerada si el trabajo respiratorio o la disnea han empeorado (objetivado por la escala clínica de Woods Modificada) o se presenta una SpO2<85% pese a un soporte ventilatorio alto. Se consideró un nivel alto de asistencia a una presión positiva de vía aérea inspiratoria (IPAP) ≥20cmH2O, presión positiva de vía aérea continua o espiratoria (CPAP/EPAP) ≥10 cmH2O.
Variables registradasPara cada sujeto incluido se registraron las siguientes variables: edad, peso, género, índice pediátrico de mortalidadII (PIM2) al ingreso18; diagnóstico realizado por el pediatra responsable; uso de terapia antibiótica, indicada por pediatra por sobreinfección bacteriana (por sospecha o documentada)14; índice SF17; diagnóstico de SDRAP, realizado de acuerdo a criterios de la Pediatric Acute Lung Injury Consensus Conference (PALICC) para pacientes en VNI basado en el índice SF19; estrategia ventilatoria (ventilador, interfase, modo, presión inspiratoria y espiratoria máxima); motivo del fracaso de la VNI, definido como complicaciones relacionadas con la VNI (intolerancia, escape aéreo, úlceras por presión, entre otras), trabajo respiratorio persistente (reducción de la frecuencia respiratoria y escala clínica de Woods modificada insuficiente o inexistente) y/o hipoxemia (SF<150).
Para el análisis se separó la cohorte según el tiempo de VNI previo a la intubación, estratificándolos según Mayordomo-Colunga et al.5 en un tiempo ≤6h, entre 7 y 24h o >24h. Respecto al seguimiento una vez intubado, se registró la duración en horas de la VMI, estancia en UCIP y hospitalaria (medida en días) y la mortalidad intrahospitalaria.
La recolección de datos fue realizada por kinesiólogos de la unidad, quienes fueron responsables del reclutamiento y del seguimiento a los participantes que cumplieron con los criterios de selección. El registro se realizó en planilla ad-hoc durante el seguimiento hasta el alta hospitalaria o el fallecimiento.
Análisis estadísticoSe analizó la normalidad de las variables usando el test de Kolmogorov-Smirnov. Las variables fueron expresadas como mediana y rango intercuartílico (IQR). Las variables categóricas fueron expresadas en valor absoluto y porcentaje. Se compararon variables continuas a través de la prueba entre grupos con el test de Kruskal-Wallis con corrección de Bonferroni y variables categóricas con el test de chi-cuadrado (χ2) o la prueba exacta de Fisher (F) en caso de menos de cinco elementos por celda.
Para las horas de VMI se realizó estimación de tiempo al evento mediante método de estimación de Kaplan-Meier, tomando como tiempo las horas de VMI y como evento la extubación. La comparación de curvas de tiempo al evento fue mediante prueba de logrank. Se evaluó la asociación de riesgo de aumento de tiempo en VMI mediante método de riesgos proporcionales de Cox, reportando hazard ratio (HR), valor de p e intervalo de confianza al 95%. La interpretación del valor de HR corresponde al riesgo de aumentar el tiempo en VMI y el análisis fue ajustado por SDRAP. La significación estadística para prueba de logrank y HR fue p<0,05.
Considerando que no existe evidencia respecto a duración de la VMI en pacientes con IRA que fracasan en la VNI, se calculó potencia post hoc con un error alfa del 5% para el tiempo de VMI comparado con los tiempos de VMI del estudio de Payen et al.7 y el de Morris et al.20.
ResultadosDescriptivoSe incluyó un total de 109 pacientes en los que fracasó la VNI, de un total de 470 sujetos (23,2%) que usaron la terapia durante el periodo de reclutamiento. La principal causa de IRA fue neumonía (90%), siendo el virus respiratorio sincitial (70,6%) el agente etiológico más frecuente. En el 89% de los casos se usaron antibióticos en el contexto de sobreinfección bacteriana (por sospecha o documentada). El 25,8% de los casos presentaron una patología crónica, siendo la más frecuente el asma (66,6%). El principal motivo de conexión a VNI fue el aumento del trabajo respiratorio en el 84,4% de los casos. La mediana de PIM2 fue del 3,4% (2,8-3,8%). El diagnóstico de SDRAP se realizó en el 37,6% de los casos. El ventilador Trilogy 202 con máscara facial total y modo binivelado se usó en el 90,5% de los casos. Las presiones inspiratorias (IPAP) y espiratorias (EPAP) máximas mostraron una mediana de 14cmH2O (IQR 14-15) y 7cmH2O (IQR 6-7), respectivamente. En 74 casos (67,9%) el fracaso de la VNI se determinó por la persistencia o por el incremento del trabajo respiratorio. Además, en 32 sujetos (28,4%) la decisión de intubar fue de causa mixta (hipoxemia y trabajo respiratorio). Respecto al tiempo de VNI previo al fracaso, el 89,9% de los pacientes fracasaron dentro de las primeras 24h de conexión. La tabla 1 muestra las características de la población estudiada.
Características demografías y clínicas de los pacientes intubados tras el fracaso de la ventilación mecánica no invasiva
| Variables | Resultados |
|---|---|
| Edad (meses) | 7 (3; 14) |
| Sexo masculino | 60 (55,1) |
| Peso (kg) | 8,7 (6,4; 10,5) |
| Sin enfermedad crónicaDiagnóstico | 82 (75,2) |
| Neumonía | 98 (89,9) |
| Bronquiolitis aguda | 9 (8,3) |
| Asma | 2 (1,8) |
| Etiología, VRSUso de antibióticos | 77 (70,6)97 (89,0) |
| Puntuación del índice pediátrico de mortalidad (PIM2) | 3,4 (2,8-3,8) |
| Índice SatO2/FiO2 | 235,7 (70,1) |
| SDRAP | 41 (37.6) |
| Severidad del SDRAPLeveModeradoSevero | 18 (43,9)16 (39,0)7 (17,1) |
| Motivo de fracaso de VNIComplicaciones VNITrabajo respiratorio aumentadoTrabajo respiratorio aumentado e hipoxemia | 3 (2,8)74 (67,9)32 (29,3) |
| Horas de VNI previo a la intubación | 9 (6;15) |
| Tiempo de VNI hasta la intubación≤6 h> 6 y≤24 h> 24 h | 41 (37,6)57 (52,3)11 (10,1) |
| Horas de VMI | 105 (84; 142) |
| Días de hospitalización | 13 (11; 16) |
| Días en UCIP | 6 (5; 8) |
| Mortalidad en UCIP | 1 (0,9) |
SDRAP: síndrome de distrés respiratorio agudo pediátrico; UCIP: unidad de cuidados intensivos pediátricos; VMI: ventilación mecánica invasiva; VNI: ventilación no invasiva; VRS: virus respiratorio sincitial.
Los datos se presentan en n (%) y P50 (P25-P75), cuando corresponda.
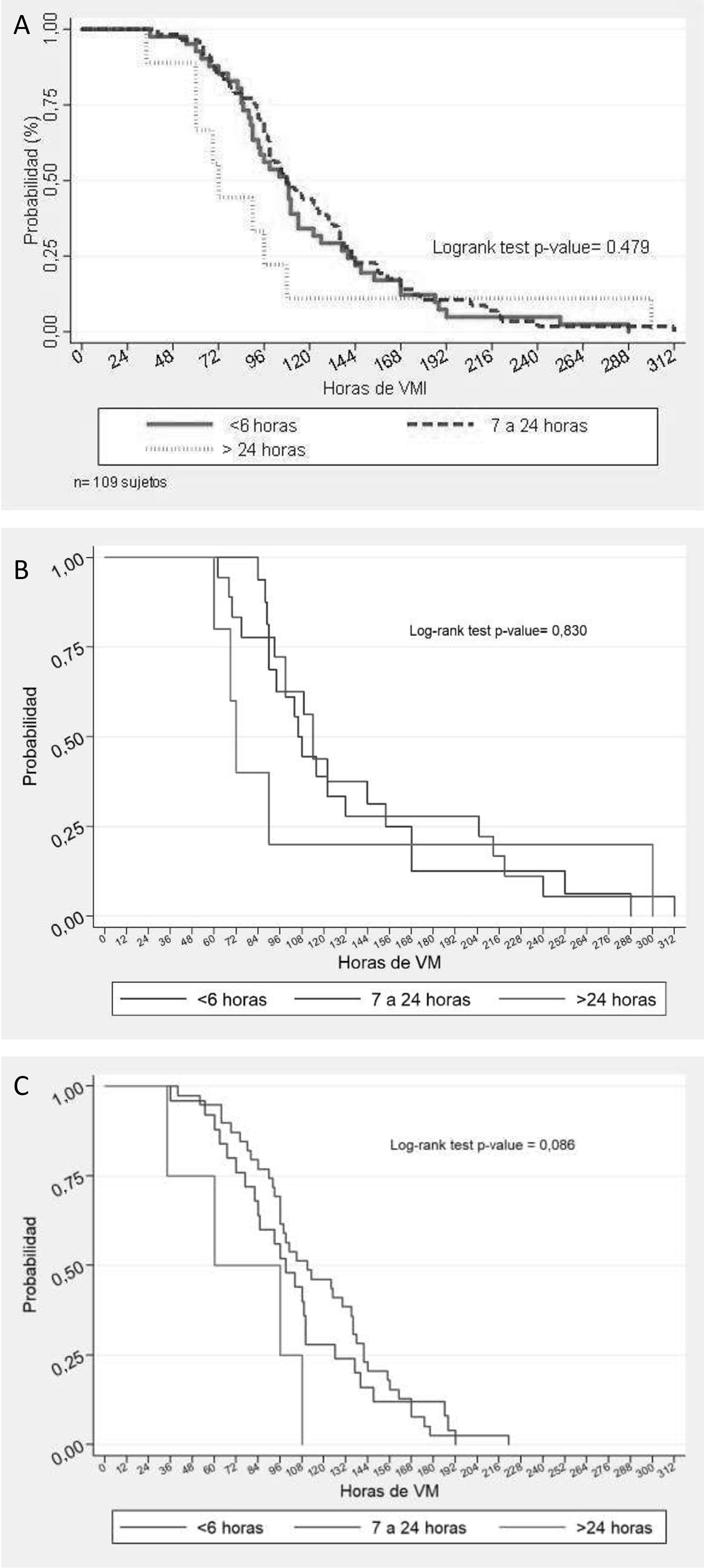
La mediana de duración de la VMI de la muestra total fue de 105 (84-142) horas. No se encontró asociación entre la duración de la VMI y la duración de VNI previo a la intubación (logrank test p=0,479). La figura 1A muestra la curva de tiempo al evento de suspensión de la VMI que compara las curvas de los 3 tiempos de fracaso de VNI. Sin embargo, la presencia de SDRAP sí se identificó como factor de riesgo de una mayor duración de la VMI (tabla 2). Para evitar la posible confusión en la evaluación de la principal relación causal analizada, se ajustó un modelo multivariable de riesgos proporcionales de Cox en la que el efecto del tiempo en VNI sobre la duración de la VMI posterior se controló por la presencia de SDRAP. En este modelo, la duración de la VNI previa no presentó significación estadística (tabla 3).
Estimación de Kaplan-Meier sobre los tiempos de ventilación mecánica invasiva (VMI) tras fallo de ventilación mecánica no invasiva (VNI). A)Se comparan las curvas según el tiempo de conexión a VNI (≤6h, 7 a 24h y >24h) previo al uso de VMI, mostrando un valor p de Logrank de 0,479. B)En el subgrupo con síndrome de distrés respiratorio agudo pediátrico se muestra un valor p de Logrank de 0,830. C)En el subgrupo sin síndrome de distrés respiratorio agudo pediátrico se muestra un valor p de Logrank de 0,086.
Análisis univariado de riesgo de mayor duración de ventilación mecánica invasiva posterior al fracaso de ventilación mecánica no invasiva
| Variable | Hazard ratio | p | IC 95% |
|---|---|---|---|
| Sexo masculino | 0,768 | 0,179 | [0,522-1,129] |
| Peso, kg | 0,978 | 0,159 | [0,949-1,009] |
| Edad, meses | 0,993 | 0,191 | [0,983-1,003] |
| Uso de antibióticos | 0,748 | 0,348 | [0,408-1,372] |
| Puntuación de PIM2 | 0,006 | 0,931 | [0,881-1,148] |
| Bronquiolitis | 0,873 | 0,079 | [0,930-3,774] |
| Neumonía | 0,706 | 0,284 | [0,374-1,333] |
| Asma | 0,663 | 0,566 | [0,163-2,703] |
| Presencia de SDRAP | 0,643 | 0,042 | [0,420-0,985] |
| SDRAP leve | 0,831 | 0,478 | [0,498-1,386] |
| SDRAP moderado | 0,838 | 0,557 | [0,465-1,510] |
| SDRAP severo | 0,536 | 0,120 | [0,244-1,176] |
| Horas de VNI previo a la intubación | 0,995 | 0,335 | [0,984-1,006] |
| Tiempo de VNI hasta la intubación | |||
| ≤6 h | Referencia | ||
| > 6 y ≤24 h | 0,896 | 0,593 | [0,598-1,342] |
| > 24 h | 1,382 | 0,396 | [0,655-2,919] |
PIM2: índice pediátrico de mortalidad; SDRAP: síndrome de distrés respiratorio agudo pediátrico; UCIP: unidad de cuidados intensivos pediátricos; VNI: ventilación no invasiva.
Análisis multivariado de riesgo de mayor duración de ventilación mecánica invasiva posterior al fracaso de ventilación mecánica no invasiva ajustado por SDRAP
| Variable | Hazard ratio | p | IC 95% |
|---|---|---|---|
| SDRAP | 0,605 | 0,024 | [0,392-0,935] |
| ≤6 h | Referencia | ||
| > 6 y≤24 h | 0,841 | 0,407 | [0,560-1,265] |
| > 24 h | 1,510 | 0,285 | [0,709-3,214] |
SDRAP: síndrome de distrés respiratorio agudo pediátrico.
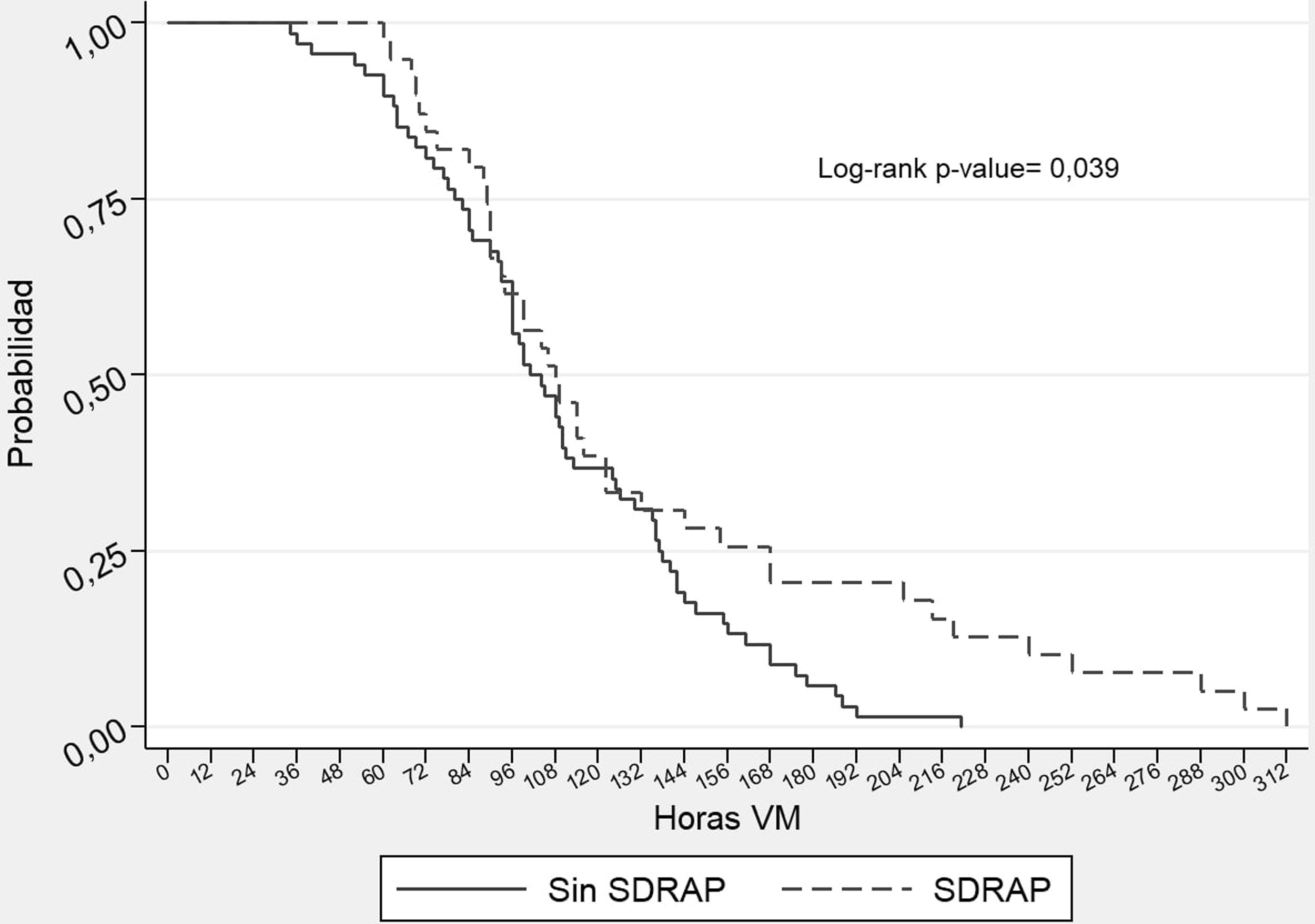
Para complementar el análisis se utilizó la presencia de SDRAP como variable de control, considerando que tiene asociación fuerte con el fracaso de VNI8 y que en nuestra muestra se identificó una asociación con una mayor duración de la VMI (tabla 2), por lo que se realizó el análisis en los subgrupos SDRAP (fig. 1B) y No SDRAP (fig. 1C). Sin embargo, los resultados no muestran asociación entre la duración de la VMI y la duración de la VNI previo a la intubación para el grupo de SDRAP (logrank test p=0,830) ni para el grupo No SDRAP (logrank test p=0,086). No obstante, como se muestra en la figura 2, la duración de la VMI fue mayor en el grupo de SDRAP comparado con el grupo No SDRAP (logrank test p=0,0386).
Estancia en UCI y hospitalariaLa mediana de estancia en la UCI fue de 6 (5-8) días, y la de hospitalización, de 13 (11-16) días. La estancia tanto en la UCI (p=0,25) como hospitalaria (p=0,67) no se asoció con los tiempos de conexión a VMI.
Estimación de potencia post hocPara la estimación de la potencia post hoc se incluyeron los tiempos de VMI reportados en este trabajo de 118,3±53,97h de VMI y los reportados en la literatura (en 2 estudios similares): 182,3±556,7h7 y 4 (2-7) días20, para un error alfa del 5%, nos brindó una potencia de la estimación del 100% y 99,1%, respectivamente.
DiscusiónDe acuerdo a nuestra búsqueda, este estudio prospectivo es el primero en pediatría que indaga las posibles implicaciones clínicas de la duración de la VNI previo a la intubación. En esta cohorte de pacientes que fracasaron en la VNI no se encontró asociación entre los diferentes tiempos (≤6h, 7-24h y >24h) de duración de la VNI previo a la intubación y la duración de la VMI, así como tampoco con la estancia en UCIP y hospitalaria. Los resultados en relación a la duración de la VMI (mediana de 105h, equivalente a 4,3días) y la estancia en UCIP (mediana de 6días) son comparables con lo publicado por Morris et al.20, quienes reportaron una mediana de 4días de duración de la VMI y 5días de estancia en la UCIP.
Morris et al.20 realizaron un estudio destacable por su extensa muestra prospectiva y el análisis desarrollado, que demostró que el uso de «VNI inicial» (primera línea de manejo de la IRA) se asoció de forma significativa a una disminución en la duración de la VMI (1,6días), un aumento de los días libres de ventilación mecánica en 28días (3,7días) y una reducción de la estancia en UCIP de 2,1días. Sin embargo, se debe considerar que el grupo de VNI incluye tanto el éxito como el fracaso de la VNI, lo que limita el análisis del grupo de fracaso y sus resultados posteriores. Por otro lado, Payen et al.7, en un estudio retrospectivo, reportaron que el fracaso de la VNI se asoció a una duración de la VMI ≥96h; no obstante, las características de la población estudiada difieren de la analizada en nuestro grupo. Por su parte, Ganu et al.6, en un estudio retrospectivo de 10años de seguimiento, reportaron diferencias significativas en la mediana de duración de la VMI entre pacientes con bronquiolitis aguda severa que se conectaron a VMI inicial (4,41±5,57) versus VNI inicial (5,55±3,63). Sin embargo, no se reportó la duración de la VNI previo a intubación, y la muestra corresponde a una entidad específica. Dada la naturaleza de los últimos dos estudios descritos no es posible determinar si la relación entre la VNI y la mayor duración de la VMI es de causalidad. Una explicación para la falta de asociación entre la duración de la VNI y los resultados clínicos analizados podría ser la detección oportuna del fracaso de la VNI. Lo anterior, dado por el seguimiento estrecho y permanente por parte del equipo clínico, sumado a los criterios de fracaso adecuados, que permite reducir el riesgo de retrasar la intubación21.
En nuestro estudio, la presencia de SDRAP se identificó como factor asociado a mayor duración de la VMI. Un resultado similar al publicado por Monteverde et al.22, quien reportó una significativa mayor tasa de SDRAP (definición de Berlín) en el grupo de VMI prolongada versus no prolongada (44 versus 20% respectivamente, p<0,01). Además, se ha identificado que el grado de hipoxemia se asocia fuertemente a mayor probabilidad de intubación (logrank p=0,0003)8. En este sentido, la presencia de SDRAP se ha asociado al fracaso de VNI, a la mayor duración de la VMI y a mayor mortalidad. Por tanto, es razonable enfatizar en este grupo que el tiempo de respuesta debe ser limitado, como es recomendado en consensos de expertos11,23. Sin embargo, en nuestro estudio, al usar la variable SDRAP como controladora, las curvas de Kaplan Meier (fig. 1 B y C) no muestran asociación entre la duración de la VNI y la duración de la VMI, y tampoco el análisis multivariable de Cox ajustado por SDRAP detectó asociación estadísticamente significativa entre ambas variables (tabla 3). Al analizar esta falta de asociación se debe considerar que solo el 17,1% de los casos de SDRAP serían severos; no obstante, el consenso define que no es posible clasificar por severidad los casos de SDRAP en la VNI19.
Otro aspecto destacable es la duración de la VNI, que en nuestro estudio mostró una mediana de 9h (rango: 6 a 15h), un tiempo menor que la mediana (13h; rango 0,5 a 77h) reportada por Mayordomo-Colunga et al.5 y a las 22h (rango: 1-312h) obtenidas por Bernet et al.24. La variabilidad de los rangos sugiere que el fracaso de la VNI como evento no es exclusivo de las primeras horas y, por tanto, la valoración de la respuesta debe ser constante y prolongada.
LimitacionesPrimero, los resultados provienen de un único centro, aunque se incluyó una muestra compuesta principalmente por niños previamente sanos con neumonía y bronquiolitis (98,2%) causada por virus respiratorio sincitial, que corresponden a características extrapolables a una UCIP indiferenciada. Por otra parte, en la metodología se describe el equipamiento utilizado y el material suplementario resume las sugerencias de manejo de nuestra unidad. Segundo, al momento de interpretar los resultados se debe considerar que la muestra tiene alta tasa de neumonía asociada a uso de antibióticos, que podría indicar que hay una fuerte presencia de IRA hipoxémica, condición que se ha asociado de manera independiente a fracaso de la VNI10. Tercero, para estratificar la muestra se utilizaron los rangos de duración de VNI propuestos por Mayordomo-Colunga et al.5 junto al tiempo como variable continua (sin estratificar), y aunque otra estratificación de la duración de la VNI podría mostrar un resultado diferente, no existe un estándar para estratificar la duración de la VNI.
ConclusiónEn este estudio, el tiempo de VNI previo a la intubación, clasificada en tres categorías (<6h, 7-24h y >24h), no se asoció a un incremento en la duración de la VMI, así como tampoco a un aumento de la estancia en UCIP ni hospitalaria. Aunque se identificó la presencia de SDRAP como factor de riesgo de mayor tiempo en VMI al utilizarla como variable de control, tampoco se determinó asociación con los resultados clínicos analizados.
FinanciaciónEste estudio no contó con ningún tipo de financiamiento.
Contribución de los autoresFernando Bustos-Gajardo ha desarrollado la idea de estudio, además de la contribución sustancial de la concepción y el diseño de este, reunión de datos recolectados en conjunto al análisis e interpretación de estos, conjuntamente en la redacción del artículo.
Soledad Luarte-Martínez ha desarrollado el diseño del estudio, el análisis e interpretación de este, conjuntamente en la redacción del artículo y la revisión crítica del contenido.
Sebastián Dubo ha desarrollado el diseño del estudio, el análisis e interpretación de los datos, conjuntamente con la redacción del artículo y la revisión crítica del contenido.
Rodrigo Adasme ha desarrollado el diseño del estudio, el análisis e interpretación de los datos, conjuntamente con la redacción del artículo y revisión crítica del contenido.
Todos los autores aprobaron la versión final del manuscrito, siendo responsables de todos los aspectos que lo componen, asegurando que los relacionados con la veracidad o integridad de todas las partes del manuscrito fueron adecuadamente investigados y resueltos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relacionado directa o indirectamente con los contenidos del manuscrito.