INTRODUCCION
Son conocidas las profundas interrelaciones que se establecen, en el marco de la sepsis, entre la activación del sistema inmune y el sistema de la coagulación1. Por lo común, el resultado de dicha interacción consiste en la aparición de un estado procoagulante, proinflamatorio y vasoconstrictor que tiende a reparar el daño y erradicar los microorganismos invasores2. En otras ocasiones dicha relación da lugar a episodios de sangrado de origen multifactorial, siendo los principales las alteraciones plaquetarias, el déficit de factores vitamina K-dependientes y la insuficiencia hepática.
Presentamos el caso de un paciente con diagnóstico de abdomen agudo apendicular, que evolucionó hacia un estado séptico que requirió varias reintervenciones y se complicó con la aparición de un sangrado peritoneal a causa de un cuadro de hemofilia adquirida por la aparición de autoanticuerpos contra el FVIII.
CASO CLINICO
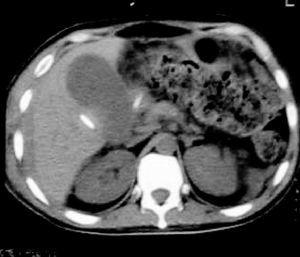
Paciente de 34 años de edad, sin antecedentes médicos de interés, que acude al hospital por un cuadro de abdomen agudo como consecuencia de una apendicitis flegmonosa retrocecal ascendente, que fue intervenida quirúrgicamente en las siguientes 12 horas tras el ingreso hospitalario. Tres días más tarde, el paciente presenta dolor de tipo cólico en hemiabdomen inferior y diarrea. Al examinarlo el abdomen está tenso, distendido, y con aumento de los ruidos hidroaéreos. Fue diagnosticado de evisceración encubierta y se realizó una enterolisis por bridas y plástica de pared abdominal. Diez días después de esta intervención, se observó un débito purulento por la herida quirúrgica, fiebre, aumento del dolor abdominal y nueva evisceración. En el quirófano se encontró una peritonitis purulenta por perforación del íleon a 50 cm de la válvula ileocecal, y una fístula enterocutánea. Se realizó resección intestinal, anastomosis entérica término-terminal y se dejó un drenaje frente a la anastomosis. El paciente ingresó en la Unidad de Cuidados Intensivos en el postoperatorio inmediato, presentando los siguientes signos vitales: presión arterial 110/70 mmHg, frecuencia cardíaca de 138 latidos por minuto (lpm), frecuencia respiratoria de 26 respiraciones por minuto (rpm), temperatura axilar 35,2 ºC, Glasgow coma score 15. La analítica mostraba los siguientes resultados: hematocrito 32,3%, hemoglobina 9,7 g/dl, leucocitos 13.800/mm3, plaquetas: 378.000/mm3, tiempo de protrombina 73%, tiempo de cefalina 62 segundos, glucosa 1,22 g/l, urea 0,45 g/l, creatinina 0,71 g/l, sodio 134 mEq/l, potasio 4,4 mEq/l, calcio total 8,51 mg/dl, bilirrubina total 2,8 mg/dl, bilirrubina directa 2,1 mg/dl, proteínas totales: 5,46 g/dl, albúmina 3,01 g/dl. Se inició tratamiento antibiótico con metronidazol, ampicilina y gentamicina, soporte inotrópico con noradrenalina y oxigenoterapia. A las 72 horas de evolución el enfermo persistía séptico, sin aislamiento de microorganismos en los cultivos y con distensión y dolor abdominal e intolerancia digestiva. Una ecografía abdominal mostró una colección subhepática residual y se decidió realizar el drenaje de la misma por vía percutánea. Tras el drenaje el paciente evolucionó con agravamiento del estado general, hipotensión arterial, taquicardia, taquipnea, signos de mala perfusión periférica, oliguria, sangrado pericatéter y un gran hematoma (15 x 15 cm) en hipocondrio y flanco derecho. Una nueva analítica mostró un tiempo de protrombina del 90% y de cefalina de 107 segundos y un recuento plaquetario de 286.000/mm3. Tras la transfusión de 4 unidades de glóbulos rojos desplasmatizados y de plasma fresco congelado, el tiempo de protrombina era del 85%, el tiempo de cefalina de 76 segundos, el tiempo de Ivy 5 minutos, y el recuento de plaquetas 300.000/mm3. Se realizó una determinación de factor VIII con un resultado del 5% (valores normales: 50-150%) y que no se corrigió con plasma, diagnosticándose la presencia de factor inhibidor circulante. No se pudo determinar la concentración del mismo. La presencia de una alteración del tiempo de cefalina que no se corrige con el agregado de plasma normal y la presencia de bajos niveles de factor VIII circulante se consideraron diagnósticos de hemofilia adquirida, por lo que se inició un tratamiento inmunosupresor con metilprednisolona 60 mg/día, transfusión de plasma fresco congelado y varias unidades de glóbulos rojos, pero ante el fracaso de la terapéutica se agregó ciclofosfamida en dosis de 100 mg/día y terapia sustitutiva con 3.600 U de factor VIII cada 8 horas. A las 48 horas de tratamiento el paciente no presentaba signos de sangrado, pero continuaba con un tiempo de cefalina de 86 segundos y un tiempo de protrombina del 80%. Se inició tratamiento con gammaglobulina 1,5 g/kg en infusión durante 48 horas y rFVIIa 90 µg/kg cada 2 horas. A las 12 horas de este tratamiento el paciente sufrió un episodio de hipotensión arterial y descenso de la hemoglobina hasta 5,1 g/l, con persistencia de la coagulopatía (tiempo de protrombina 56% y tiempo de cefalina 54 segundos), por lo que se inició tratamiento con vitamina K parenteral, se cambió el tratamiento antibiótico a imipenem y vancomicina y se realizó una nueva tomografía axial computarizada (TAC) de abdomen (fig. 1), donde se observó un importante hematoma organizado en la zona peritoneal. El paciente fue llevado de nuevo al quirófano, donde se realizó un drenaje del hematoma. Pasadas 72 horas el paciente se encontraba afebril, hemodinámicamente normal, con un abdomen menos distendido, blando y depresible y tolerando nutrición enteral. En la analítica presentaba un recuento plaquetario de 240.000/mm3, tiempo de protrombina del 92% y tiempo de cefalina de 46 segundos, por lo que fue dado de alta de la UCI, permaneciendo en el hospital por espacio de dos meses sin recidivas hasta el alta hospitalaria.
Figura 1. Se observa en el flanco derecho una lesión heterogénea con zonas hipodensas en su interior que corresponde a restos hemáticos. La lesión se encuentra limitada por una pared que podría corresponder al epiplón y/o mesenterio.
DISCUSION
La hemofilia adquirida es una diátesis hemorrágica causada por la depleción inmune de factor VIII. La aparición de estos autoanticuerpos con actividad proteolítica contra la porción procoagulante del factor VIII suele darse en la evolución de la hemofilia A y, en menor medida, en la B3,4. Asimismo, se ha descrito en pacientes con enfermedades autoinmunes como la artritis reumatoidea y, en los últimos años, en el marco de infecciones graves, asociado al uso de diversos fármacos, al período puerperal, hemodiálisis, y exploraciones quirúrgicas4-6. Habitualmente el diagnóstico de sospecha, con o sin la presencia de sangrado, se realiza ante la aparición de un tiempo de cefalina prolongado con tiempo de sangría normal (lo que descarta enfermedad de Willebrand) que no se corrige con la mezcla con plasma normal (lo que implica la presencia de inhibidores). La confirmación requiere la cuantificación del factor VIII y del título sérico de los inhibidores, que se miden por unidades Bethesda (BU/ml).
El enfoque terapéutico del trastorno consiste en erradicar a los inhibidores y alcanzar la hemostasia4-7. Para lograr el primer objetivo se han planteado distintas estrategias. Se ha intentado la plasmaféresis con administración concomitante de factor VIII y/o plasma fresco congelado, así como la absorción extracorpórea de anticuerpos por inmunoglobulinas adsorbidas sobre proteína A8,9. Sin embargo, la inducción de tolerancia inmunológica por medio del ya clásico esquema de Green10 es la estrategia que mejores resultados ofrece. La misma consiste en la administración de altas dosis de factor VIII junto a un inmunosupresor como la ciclofosfamida, en dosis de 100 mg/día, con o sin corticoides. Con este esquema se minimiza el efecto antigénico del factor VIII y se induce tolerancia. Lamentablemente esta estrategia podría ser muy peligrosa en el curso del estado séptico, por lo cual se ha decidido combinarla con el uso de inmunoglobulina polivalente en dosis de 1,5 ug/kg en infusión continua como una mejor opción terapéutica11. Ello es discutible, ya que la eficacia observada con el uso de inmunoglobulina llega al 12%, muy por debajo del 30% conocido para los corticoides12. En cuanto al segundo objetivo, también se han ensayado diferentes variantes como son las siguientes: el uso de factor VIII de origen porcino, concentrado plasmático de factores de la coagulación, concentrado de complejo protrombínico, etc. Todos ellos con una efectividad menor del 50%13. El uso de factor VII recombinante activado (rFVIIa) ha resultado de gran utilidad para alcanzar la hemostasia en este tipo de pacientes. La base fisiológica sobre la que se sustenta el uso de rFVIIa es que el mismo permite la generación de trombina sobre la superficie celular gracias a la activación del factor X. La formación del coágulo en estas condiciones no difiere del que se produce cuando todas las proteínas de la cascada de la coagulación están presentes. A su vez, dado que el factor VII no es por sí mismo enzimáticamente activo, el riesgo de desarrollar coagulación intravascular diseminada, así como de efectos tromboembólicos, es menor, aunque no desaparece. Los mejores resultados se alcanzan con concentraciones de 10 ug/ml. La administración endovenosa puede hacerse como infusión continua o en bolos de dosis altas (90-100 µg/kg), siendo esta última la estrategia más eficiente y con mayor perfil de seguridad14. Aunque se ha considerado la posibilidad de que alguno de los fármacos utilizados haya desencadenado el trastorno, ninguno se ha podido discontinuar, ya que resultaban imprescindibles para el tratamiento y a su vez no se encontraban expresamente mencionados como desencadenantes en la bibliografía4,11,15.
Persiste aún la incógnita acerca de la etiología del proceso. Una excelente revisión de Delgado15 acerca de este tema nos informa que la etiología se conoce sólo entre el 40-50% de los casos. Nuestro paciente no tiene historia de sangrado ni antecedentes personales o familiares que lo vinculen a enfermedades crónicas de tipo autoinmune, así como tampoco a enfermedades malignas. La serología viral fue negativa y los episodios desencadenantes son la agresión séptica y la injuria quirúrgico-anestésica. Si bien ambos procesos no se excluyen entre sí, tampoco se complementan necesariamente para la generación de autoanticuerpos, por lo que cabe la posibilidad de que cualquiera o ambos procesos hayan sido los desencadenantes.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún
conflicto de intereses.