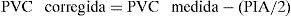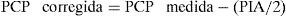La Hipertensión Intraabdominal (HIA) y el Síndrome Compartimental Abdominal (SCA) son entidades frecuentes en los pacientes graves y cursan con una alta mortalidad. En esta revisión se actualizan los aspectos más debatidos sobre la HIA y el SCA: factores desencadenantes, epidemiología, pronóstico, métodos de medición de la presión intraabdominal (PIA), consecuencias fisiopatológicas y medidas terapéuticas, tanto médicas como quirúrgicas. Se plantea que, simultáneamente a los mecanismos de lesión estrictamente físicos, como la compresión directa de vasos y órganos intraabdominales, la transmisión de la PIA a otros compartimentos y el descenso del gasto cardíaco, pueden intervenir también una serie de mediadores inmunoinflamatorios generados en el propio intestino. La hipoperfusión, la isquemia mantenida y el fenómeno isquemia-reperfusión actuarían sobre la microbiota, el epitelio y sistema inmune intestinal desencadenando el Síndrome de Distrés Intestinal Agudo, una respuesta inflamatoria sistémica y una eventual disfunción multiorgánica que pueden aparecer en fases tardías del SCA.
Seriously ill patients frequently present intra-abdominal hypertension (IAH) and abdominal compartment syndrome (ACS) as complications, and the associated mortality is very high. This review offers an update on the most controversial aspects of these entities: factors favoring their appearance, the most common causes, prognosis, and methods of measuring intra-abdominal pressure (IAP), physiopathological consequences in relation to the different organs and systems, and the currently accepted treatment measures (medical and/or surgical). Simultaneously to the strictly physical mechanisms of injury, such as direct compression of intra-abdominal organs and vessels, the transmission of IAP to other compartments, and the drop in cardiac output, a series of immune-inflammatory mediators generated in the intestine itself may also intervene. Hypoperfusion, sustained ischemia and the ischemia-reperfusion phenomenon, would act upon the microbiota, intestinal epithelium and intestinal immune system, triggering a systemic inflammatory response and multiorgan dysfunction that appears in the final stages of ACS.
La hipertensión intraabdominal (HIA), con su eventual progresión al Síndrome Compartimental Abdominal (SCA), es una complicación frecuente que aparece en pacientes graves ingresados en los servicios de cirugía, reanimación posquirúrgica y en unidades de cuidados intensivos (UCI). Ambas entidades son fácilmente identificables, prevenibles, potencialmente tratables y, en ocasiones, infradiagnosticadas, al confundirse con otros procesos patológicos con los que comparten manifestaciones clínicas similares.
Aunque conocidas desde hace más de siglo y medio, no ha sido hasta hace poco más de dos décadas que se ha producido una verdadera explosión de publicaciones e investigación sobre las consecuencias clínicas del aumento de la presión intraabdominal (PIA) y el papel del SCA en el desarrollo del Síndrome de Disfunción Multiorgánica (SDMO). Desde aquella observación inicial, hace más de 150 años, que relacionaba el aumento de la PIA con la elevación de la presión intratorácica1, y la posterior demostración de los efectos deletéreos de la HIA sobre la función renal, pulmonar y el estado hemodinámico, el interés por esta entidad ha ido en aumento2,3.
Las Conferencias de Consenso promovidas por la World Society for Abdominal Compartment Syndrome (WSACS) han estandarizado el método de medición de la PIA y han establecido definiciones y recomendaciones basadas en la evidencia científica que ha permitido emplear un lenguaje común así como elaborar protocolos diagnósticos y terapéuticos que han mejorado la evolución de estos pacientes4,5. Además, la presencia de HIA o SCA combinado con el grado de tolerancia a la nutrición enteral proporciona un score que permite evaluar la función gastrointestinal en pacientes críticos6. Recientemente varios autores han sugerido la necesidad de modificar o al menos reevaluar algunas de las definiciones y recomendaciones referidas7,8.
Esta puesta al día pretende revisar críticamente los aspectos más debatidos de la HIA/SCA, como factores de riesgo y patologías asociadas, fisiopatología, métodos diagnósticos y avances terapéuticos, así como la relación entre HIA/SCA y el Síndrome de Distrés Intestinal Agudo.
DefinicionesEl valor normal de la PIA en pacientes críticos adultos es aproximadamente 5-7mmHg, siendo mayor en pacientes obesos y en embarazadas (9-14mmHg) y menor en la población pediátrica. La presión de perfusión abdominal (PPA), diferencia entre presión arterial media (PAM) y PIA, refleja de forma más fiable el flujo sanguíneo eficaz y, por tanto, la perfusión esplácnica, siendo mejor predictor del fracaso de órganos y mortalidad que la PIA o la PAM de forma aislada9.
Por consenso, la HIA se define como el aumento patológico, persistente o repetido, de la PIA ≥ 12mmHg4. Sin embargo, se desconoce el nivel de PIA que puede generar efectos negativos sobre la microcirculación intestinal, la perfusión renal o el compartimento torácico. Recientemente, algunos autores consideran que el umbral crítico de HIA debería ser una PIA ≥ 20mmHg de forma mantenida7.
El SCA se define como la presencia de una PIA>20mmHg, con o sin PPA<60mmHg, asociada a una nueva disfunción o fracaso de órganos4. Se clasifica en primario, secundario y recurrente, aunque a veces existe una combinación o solapamiento entre un SCA primario y secundario, lo que aumenta las dificultades diagnósticas y terapéuticas (p.ej. pacientes con traumatismo abdominal junto con una resucitación masiva con fluidos o un proceso séptico). El SCA recurrente puede aparecer tras un cierre definitivo de la pared abdominal o en un abdomen abierto.
Las definiciones de consenso de la WSACS en relación a la HIA y el SCA4 se describen en la tabla 1.
Definiciones de consenso en relación a la HIA y el SCA
| Definición 1: | La PIA es la presión estable que existe dentro de la cavidad abdominal |
| Definición 2: | PPA=PAM–PIA |
| Definición 3: | GF=PFG–PTP=PAM–(2 x PIA) |
| Definición 4: | La PIA debe expresarse en mmHg, medirse al final de la espiración, en posición supina completa, sin contracciones musculares abdominales y calibrar el «cero» a nivel de la línea axilar media en la cresta ilíaca |
| Definición 5: | El método de referencia estándar para la medición intermitente de la PIA es intravesical, con un volumen máximo instilado de 25mL de suero salino estéril |
| Definición 6: | La PIA normal en pacientes críticos adultos es aproximadamente 5-7mmHg |
| Definición 7: | La HIA se define como el aumento patológico mantenido o repetido de la PIA≥12mmHg |
| Definición 8: | La HIA se clasifica en:- Grado I (PIA 12-15mmHg)- Grado II (PIA 16-20mmHg)- Grado III (PIA 21-25mmHg)- Grado IV (PIA>25mmHg) |
| Definición 9: | El SCA se define como el aumento mantenido de la PIA>20mmHg (con o sin PPA<60mmHg) asociado con nuevo fracaso/disfunción de órgano |
| Definición 10: | El SCA primario es una situación asociada con lesión o enfermedad en la región abdominopélvica, que frecuentemente requiere intervención quirúrgica o radiológica intervencionista precoz |
| Definición 11: | El SCA secundario hace referencia a causas no originadas en la región abdominopélvica |
| Definición 12: | El SCA recurrente es una situación en la que el SCA reaparece tras un tratamiento médico o quirúrgico previo de un SCA primario o secundario |
HIA: hipertensión intra-abdominal; GF: gradiente de filtración; PAM: presión arterial media; PFG: presión de filtración glomerular; PIA: presión intra-abdominal; PPA: presión de perfusión abdominal; PTP: presión tubular proximal; SCA: síndrome compartimental abdominal Adaptado de Malbrain et al4.
Las tasas de incidencia publicadas de HIA y SCA en pacientes críticos son muy variables, dependiendo de los criterios diagnósticos utilizados10. Estudios más recientes, aplicando las definiciones de consenso, muestran una alta prevalencia en pacientes médico-quirúrgicos ingresados en UCI (entre 37-64% de HIA y 4-12% de SCA)11,12. Además, la presencia de HIA, especialmente si se asocia una PPA disminuida o existe un SCA, se relaciona con un peor pronóstico, con mayor riesgo de SDMO y mortalidad11,12.
Etiología y factores de riesgoLa HIA y el SCA aparecen en situaciones clínicas que reducen la distensibilidad (compliance) de la pared abdominal, aumentan el volumen intraabdominal o una combinación de ambos. Los factores de riesgo para el desarrollo de HIA y SCA4,5 se muestran en la tabla 2.
Factores de riesgo para el desarrollo de la HIA y el SCA
| 1. Disminución de la compliance de la pared abdominal: |
| - Insuficiencia respiratoria aguda, especialmente con presión intratorácica elevada (ventilación mecánica, uso de PEEP, presencia de auto-PEEP, etc) |
| - Cirugía abdominal con cierre primario o a tensión |
| - Hematoma en la pared abdominal o en vaina de los rectos |
| - Traumatismo abdominal grave |
| - Quemaduras graves, con escara abdominales |
| - Obesidad (índice de masa corporal>30) |
| - Posición en prono y posición semi-incorporada (cabecera elevada>30°) |
| 2. Aumento del volumen intra-abdominal: |
| - Dilatación del tracto gastrointestinal: gastroparesia, distensión gástrica, ileo, vólvulo, pseudo-obstrucción colónica, etc |
| - Masa intraabdominal o retroperitoneal (como abscesos o tumores) |
| - Hemoperitoneo o hematoma retroperitoneal |
| - Neumoperitoneo (incluyendo laparoscopia con elevada presión de insuflación) |
| - Ascitis (disfunción hepática) |
| 3. Combinación de ambos factores (fuga capilar/resucitación con fluidos): |
| - Sepsis grave y shock séptico |
| - Pancreatitis aguda grave |
| - Infección intraabdominal complicada |
| - Resucitación masiva con fluidos (> 5 litros/24 horas) |
| - Politransfusión (> 10 unidades de concentrados de hematíes/24 horas) |
| - Quemaduras extensas |
| - Politraumatismo grave |
| - Cirugía de control de daños |
| - Acidosis (pH<7,2) |
| - Hipotermia (temperatura corporal<33°C) |
| - Coagulopatía (recuento plaquetario<55.000/mm3, TP>15 segundos o<50%, APTT>2 veces por encima de valores normales ó INR>1.5) |
Aunque tradicionalmente se ha considerado que los grupos de pacientes con mayor riesgo eran los posquirúrgicos, politraumatizados y grandes quemados, en los últimos años también se ha descrito en otras patologías:
- 1.
Sepsis grave y shock séptico: en estudios recientes se ha publicado una alta incidencia de HIA en estos pacientes, oscilando entre un 40-50% o incluso tasas superiores (82% de HIA; 38% de SCA)13. La relación entre sepsis grave y HIA/SCA se circunscribe a varios aspectos: a) la HIA aparece frecuentemente en pacientes que reciben una resucitación masiva con fluidos y presentan un aumento de la permeabilidad capilar, factores ambos presentes en la sepsis; b) la HIA/SCA comparte con la sepsis grave varios mecanismos fisiopatológicos y ambos pueden evolucionar a un SDMO14, y c) la HIA tiene un impacto directo sobre los valores de presión venosa central (PVC) y presión capilar pulmonar (PCP), lo que obliga a una estrecha monitorización de la PIA durante la resucitación, especialmente cuando se requiere un aporte alto de fluidos. Existen estudios en pacientes politraumatizados, posquirúrgicos, sépticos y quemados graves que relacionan la administración masiva de fluidos con una mayor incidencia de HIA/SCA y un aumento de mortalidad15.
- 2.
Pancreatitis aguda grave (PAG): la incidencia de HIA y SCA en estos pacientes es muy alta (60-80% y 25-56%, respectivamente) y su presencia se asocia con una mayor morbimortalidad16. Por ello, sería recomendable la monitorización sistemática de la PIA en todos los pacientes con PAG para poder identificar y tratar precozmente la HIA.
- 3.
Síndrome Cardiorrenal: la elevación de la PIA es un factor que se ha implicado en el desarrollo de este síndrome17. En pacientes con insuficiencia cardiaca descompensada aguda, aumentos leves de la PIA producen deterioro de la función renal, que se corrige con el control de la HIA18.
La cavidad abdominal y el retroperitoneo se comportan como compartimentos estancos y cualquier cambio en el volumen de su contenido puede modificar la PIA. La pared abdominal tiene una compliance limitada y la relación presión-volumen abdominal es curvilínea, de forma que a niveles bajos de volumen la relación es lineal, pero cuando se alcanza un volumen crítico existe un incremento exponencial de la presión3,19.
En la cavidad abdominal existen estructuras anatómicas sujetas a cambios de volumen y de forma. Así, en algunos órganos sólidos (hígado o bazo) las modificaciones suelen ser lentas, mientras que las vísceras huecas (tracto gastrointestinal) pueden aumentar significativamente su tamaño de forma aguda (por traumatismo, inflamación o infección). Los vasos sanguíneos y linfáticos pueden también influir, especialmente si existe aumento de la permeabilidad capilar (fuga capilar) o ante administración masiva de fluidos.
La pared abdominal, con su amplia área peritoneal, puede absorber grandes cantidades de líquido, pero si existe inflamación o un exceso de aporte va a responder generando un exudado o trasudado, con aumento del volumen y la PIA. El edema de la pared abdominal puede contribuir también a disminuir su compliance19.
Los mecanismos fisiopatológicos implicados en la afectación de diversos órganos y sistemas por la HIA son: a) un efecto mecánico directo sobre el retorno venoso de órganos intraabdominales; la alteración inicial se produce a nivel capilar, seguido del aumento de las resistencias venosas y congestión venosa, dando lugar al aumento de la permeabilidad capilar, con fuga capilar y, por tanto, generando un círculo vicioso con incremento progresivo de la PIA; b) una reducción del flujo sanguíneo arterial y de la perfusión de los órganos intraabdominales; c) una dificultad al drenaje linfático abdominal, y d) por último, una compresión directa de órganos tanto por la HIA como por el aumento del edema3.
Recientemente, se ha sugerido que, además de estos mecanismos físicos, la isquemia intestinal secundaria a la HIA y el aumento de la permeabilidad de la barrera intestinal, favorecerían la translocación bacteriana y la liberación de mediadores inmunoinflamatorios a partir del tracto gastrointestinal (TGI) contribuyendo al desarrollo de un SDMO14,20–23.
Las consecuencias fisiopatológicas descritas por el aumento de la PIA son:
- a)
A nivel cardiovascular: la HIA produce un aumento de la PVC y la PCP, disminución del retorno venoso, aumento de resistencias vasculares y reducción del gasto cardíaco. Ello se debe a la compresión vascular intraabdominal con descenso del flujo en vena cava inferior y activación del sistema renina-angiotensina-aldosterona (SRAA), el desplazamiento caudocefálico del diafragma y la transmisión abdomino-torácica de la PIA, con un aumento de las presiones intratorácicas y compresión cardiaca3.
En pacientes con HIA, el aumento de la PVC y la PCP puede no reflejar el estado de la volemia, por lo que se recomienda su corrección con el valor de PIA existente3:
La monitorización hemodinámica con parámetros volumétricos, como el volumen telediastólico global (GEDV) o el volumen sanguíneo intratorácico (ITBV), permite estimar la precarga con mayor fiabilidad, ya que prácticamente no se afectan por el nivel de HIA24.
- b)
A nivel respiratorio: el incremento de la PIA provoca un aumento de las presiones de la vía aérea y la presión pleural, junto con disminución de la capacidad residual funcional, reducción de la compliance total del sistema respiratorio (sobre todo, de la compliance de la pared torácica), aumento del espacio muerto y del shunt intrapulmonar y desarrollo de atelectasias, hipercapnia e hipoxemia3,7.
En pacientes en ventilación mecánica con HIA se recomienda corregir la presión meseta o plateau (Pplat) según la PIA existente [Pplat corregida=Pplat medida–(PIA/2)]. Además, la presión positiva al final de la espiración (PEEP) se debería ajustar para contrarrestar la PIA, por lo que se ha sugerido que la PEEP óptima sería igual al valor de PIA3. Sin embargo, la transmisión de presiones a través del diafragma es muy variable y bidireccional, de forma que un aumento significativo del nivel de PEEP podría elevar la PIA, especialmente en pacientes con HIA previa. Varios estudios han intentado evaluar la relación existente entre PEEP y PIA, con resultados contradictorios8,25.
- c)
A nivel renal: el riñón es uno de los órganos más vulnerables a la HIA y la oliguria, uno de los signos más precoces17,26. Los mecanismos implicados en la disfunción renal incluyen: disminución del filtrado glomerular, congestión venosa renal, reducción del flujo arterial por descenso del gasto cardíaco, compresión directa de la corteza renal, activación del SRAA y liberación de mediadores proinflamatorios3,17,26.
- d)
A nivel del sistema nervioso central (SNC): el aumento de la PIA puede provocar un incremento de la presión intracraneal (PIC), con reducción de la presión de perfusión cerebral (PPC). El aumento de la presión intratorácica produce un descenso del retorno venoso intracerebral, con congestión venosa y edema. Sin embargo, recientemente se ha descrito una posible relación entre los cambios en la PIC y la PPC asociados a la HIA y la presencia de isquemia del SNC mediada por citoquinas, con aumento de niveles de interleuquina-6 (IL-6) y factor de necrosis tisular-α (TNF-α)27. Se ha observado que el tratamiento y control de la HIA puede ser eficaz para reducir una hipertensión intracraneal refractaria28.
- e)
A nivel hepático y gastrointestinal: la HIA reduce el flujo portal y de arteria hepática, tronco celíaco y arteria mesentérica superior, altera la función mitocondrial y reduce el aclaramiento de lactato a nivel hepático. La alteración de la compliance de la pared abdominal, junto con la hipoperfusión de músculos y tejidos blandos, aumentan el riesgo de infección de la herida quirúrgica, favoreciendo las dehiscencias y evisceraciones. El principal efecto negativo de la HIA es, sin embargo, la reducción del flujo sanguíneo en la mucosa intestinal, con isquemia y descenso del pH intramucoso gástrico (pHi)3,21,22. Recientemente, la HIA se ha relacionado con el grado de tolerancia a la nutrición enteral para establecer un score de fracaso gastrointestinal6 (tabla 3).
Tabla 3.Gastrointestinal Failure (GIF) score
Puntuación Sintomatología clínica 0 Función gastrointestinal normal 1 NE<50% de las necesidades calculadas o ausencia de NE tres días después de una cirugía abdominal 2 Intolerancia a NE (alto volumen de residuo gástrico, vómitos, distensión abdominal o diarreas severas) o HIA 3 Intolerancia a NE más HIA 4 Síndrome compartimental abdominal HIA: hipertensión intraabdominal; NE: nutrición enteral
Adaptado de Reintam et al6
Para establecer el diagnóstico de HIA y SCA es fundamental realizar una medición fiable de la PIA. La exploración física, al igual que los estudios radiológicos y ecográficos, tiene una baja sensibilidad para detectar HIA. La medición del perímetro abdominal o la palpación abdominal no reflejan de un modo preciso el nivel de PIA29,30.
En los compartimentos que contienen predominantemente fluidos, como la cavidad abdominal, la presión aplicada a la superficie de un fluido no compresible se transmite con el mismo valor en cada una de las partes. Por ello, la PIA medida en un punto de la cavidad abdominal puede asumirse que representa la PIA existente en el interior de todo el abdomen. Las técnicas de medición de la PIA son variadas, con métodos directos e indirectos y, a su vez, intermitentes o continuos. Entre ellos están: medición intraperitoneal directa o de la presión en vena cava inferior, medición de la presión a nivel intragástrico, rectal, uterino o la presión intravesical29.
En el momento actual, se acepta que el método más sencillo y fiable para medir la PIA es la medición de la presión intravesical4,5. Es una técnica sencilla, reproducible, poco invasiva y barata, existiendo dispositivos que permiten la medición intermitente o continua. Para que la medición sea precisa y adecuada debe ser obtenida al final de la espiración, con el paciente en decúbito supino, calibrado el «cero» a nivel de la línea axilar media en la cresta iliaca, en ausencia de contracciones musculares abdominales voluntarias y, si es necesario, instilando suero salino (25mL) y medir tras 30-60 segundos.
Recientemente se han propuesto nuevas técnicas para valorar la presencia de HIA o SCA, como la Eco-Doppler renal con medición del índice de resistencia de la arteria renal, que se correlaciona con el grado de HIA31.
Medidas terapéuticas en la HIA/SCALas recomendaciones de consenso de la WSACS en relación a la HIA y el SCA5 se muestran en la tabla 4.
- 1.
Medidas no quirúrgicas en la HIA/SCA. La descompresión quirúrgica se consideraba hasta hace poco la única opción terapéutica en pacientes que desarrollaban una HIA o SCA. Sin embargo, existen actualmente una serie de medidas no quirúrgicas para la prevención y tratamiento de estas entidades. Únicamente aquellos pacientes que no respondan a estas medidas tienen indicación de una descompresión quirúrgica urgente32.
Las medidas terapéuticas no quirúrgicas se aplican a cinco niveles3,5,32:
- 1.1.
Disminuir el contenido intraluminal: el íleo paralítico es muy frecuente en pacientes sometidos a cirugía abdominal, traumatismos abdominales graves, peritonitis, resucitación masiva con fluidos, alteraciones electrolíticas o administración excesiva de opiáceos o sedantes. Todos ellos son factores de riesgo para el desarrollo de HIA y SCA4,5.
El aumento del contenido gastrointestinal intraluminal (líquido o gaseoso) puede producir una elevación de la PIA. En estos casos diversas medidas terapéuticas pueden reducir la PIA: a) corregir las alteraciones electrolíticas que favorecen el íleo paralítico (hipopotasemia, hipomagnesemia o hipofosfatemia); b) colocación de sondas nasogástricas o rectales; c) administración de enemas; d) uso de fármacos gastroprocinéticos o coloprocinéticos (eritromicina, metoclopramida o neostigmina); e) reducción del aporte o suspensión de la nutrición enteral, y f) si estas medidas no son efectivas, se debe considerar la colonoscopia descompresiva.
- 1.2.
Evacuar lesiones ocupantes de espacio intraabdominales: como hemoperitoneo, hematoma retroperitoneal, ascitis, abscesos o, incluso, aire libre. Inicialmente se debe intentar el drenaje con técnicas percutáneas, como paracentesis evacuadora, aspiración por punción o colocación de drenajes guiado por ecografía-TAC. La extracción de pequeñas cantidades de líquido intraabdominal puede reducir de forma significativa la PIA en pacientes con HIA y baja compliance de la pared abdominal. El uso de estas técnicas percutáneas ha reducido de forma significativa la necesidad de descompresión quirúrgica y con ello la morbi-mortalidad asociada33.
- 1.3.
Mejorar la compliance de la pared abdominal: a) mantener una adecuada sedoanalgesia, ya que el dolor y la agitación aumentan el tono muscular de la pared abdominal y elevan la PIA. Se recomienda ajustar bien la dosis de los fármacos sedantes y opiáceos, y la sedación inhalatoria en pacientes críticos puede considerarse una alternativa34; b) retirar vendajes compresivos y escaras abdominales; c) la posición corporal puede modificar la PIA y se recomienda el decúbito supino con la cabecera a menos de 20°, evitando el decúbito prono. La posición en Trendelemburg invertido puede ser útil en pacientes con HIA, ya que mantiene la cabecera elevada y evita la compresión abdominal, y d) administración de relajantes musculares35.
- 1.4.
Optimizar la administración de fluidos: es un punto clave en el manejo de la HIA y uno de los factores de riesgo que se asocia a su aparición y empeoramiento. El tratamiento debe dirigirse a: a) evitar una resucitación excesiva con fluidos; b) intentar un balance hídrico negativo o equilibrado al tercer día de evolución; c) considerar la administración de coloides o sueros salinos hipertónicos, para reducir el volumen total administrado36, y d) si el paciente está hemodinámicamente estable, valorar el uso de diuréticos y las terapias de reemplazo renal intermitentes o continuas3,18.
- 1.5.
Optimizar la perfusión tisular regional y sistémica: a) la resucitación con fluidos debe estar dirigida por objetivos; b) mantener una PPA ≥ 60mmHg; c) empleo de una monitorización hemodinámica como guía de la resucitación, y d) ante la imposibilidad de mantener la PPA ≥ 60mmHg con las anteriores medidas, administrar fármacos vasoactivos (como noradrenalina).
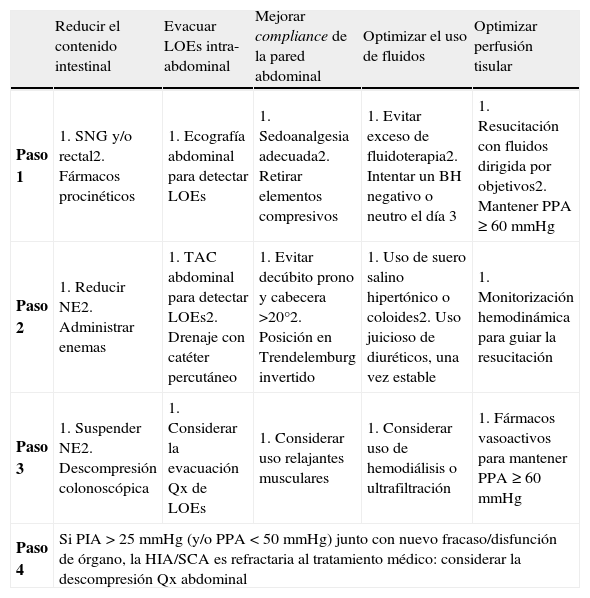
Las medidas terapéuticas no quirúrgicas descritas deben aplicarse de un modo escalonado (tabla 5). La respuesta positiva se refleja al conseguir mantener una PIA<15mmHg, con una PPA ≥ 60mmHg. El fracaso de estas medidas, con una PIA>25mmHg persistente (con o sin PPA<50mmHg) y una nueva disfunción/fracaso de órganos, obliga a considerar la descompresión quirúrgica abdominal inmediata.
Tabla 5.Medidas terapéuticas no quirúrgicas en HIA y SCA
Reducir el contenido intestinal Evacuar LOEs intra-abdominal Mejorar compliance de la pared abdominal Optimizar el uso de fluidos Optimizar perfusión tisular Paso 1 1. SNG y/o rectal2. Fármacos procinéticos 1. Ecografía abdominal para detectar LOEs 1. Sedoanalgesia adecuada2. Retirar elementos compresivos 1. Evitar exceso de fluidoterapia2. Intentar un BH negativo o neutro el día 3 1. Resucitación con fluidos dirigida por objetivos2. Mantener PPA ≥ 60mmHg Paso 2 1. Reducir NE2. Administrar enemas 1. TAC abdominal para detectar LOEs2. Drenaje con catéter percutáneo 1. Evitar decúbito prono y cabecera >20°2. Posición en Trendelemburg invertido 1. Uso de suero salino hipertónico o coloides2. Uso juicioso de diuréticos, una vez estable 1. Monitorización hemodinámica para guiar la resucitación Paso 3 1. Suspender NE2. Descompresión colonoscópica 1. Considerar la evacuación Qx de LOEs 1. Considerar uso relajantes musculares 1. Considerar uso de hemodiálisis o ultrafiltración 1. Fármacos vasoactivos para mantener PPA ≥ 60mmHg Paso 4 Si PIA>25mmHg (y/o PPA<50mmHg) junto con nuevo fracaso/disfunción de órgano, la HIA/SCA es refractaria al tratamiento médico: considerar la descompresión Qx abdominal HIA: hipertensión intraabdominal; LOEs: lesiones ocupantes de espacio; NE: nutrición enteral; PIA: presión intraabdominal; PPA: presión de perfusión abdominal; Qx: quirúrgica; SCA: síndrome compartimental abdominal; SNG: sonda nasogástrica; TAC: tomografía axial computarizada
Adaptado de Cheatham et al32.
- 1.1.
- 2.
Tratamiento quirúrgico en la HIA/SCA. La prevención y la identificación precoz es la mejor forma de actuar ante un SCA19. Si el SCA está establecido, la descompresión quirúrgica conservadora es el tratamiento aceptado, bien con abordaje anterior para resolver la patología intraabdominal primaria y proceder al cierre primario sin tensión o descompresión dejando un abdomen abierto (AA), o bien mediante acceso retroperitoneal translumbar para drenaje y descompresión de la celda pancreática ante una PAG que condiciona HIA37.
Recomendaciones de consenso en relación a la HIA y SCA
| Factores de riesgo: | Al ingreso en UCI y ante la presencia de un fracaso de órgano nuevo o progresivo se debe revisar la presencia de factores de riesgo para HIA/SCA (GRADO 1B) |
| Indicación monitorización: | Si existen dos o más factores de riesgo para HIA/SCA se debe medir una PIA basal (GRADO 1B) y si existe una HIA debe medirse de forma seriada la PIA durante todo el proceso del paciente crítico (GRADO 1C) |
| Medición de PIA: | Los estudios deberían adoptar el método de medición estandarizado de la PIA recomendado por las definiciones de consenso o proporcionar suficientes detalles de la técnica utilizada que permita una interpretación fiable de los datos de PIA presentados (GRADO 2C) |
| Epidemiología: | La incidencia y prevalencia estimadas de HIA/SCA deberían basarse en las definiciones de consenso (GRADO 1C) |
| Epidemiología: | La media, mediana y valor máximo de la PIA deberían proporcionarse tanto al ingreso como durante el período de estudio (GRADO 2C) |
| Tratamiento: | El tratamiento adecuado y manejo de la HIA y/o SCA se basa en cuatro principios generales:- Monitorización seriada de la PIA- Optimización de la perfusión sistémica y de la función de órganos en pacientes con PIA elevada- Instaurar procedimientos médicos específicos para reducir la PIA y las consecuencias sobre los órganos de la HIA/SCA- Descompresión quirúrgica rápida en la HIA refractaria |
| Tratamiento médico: | a) Ante los beneficios significativos y los riesgos limitados, se recomienda que la PPA debe mantenerse por encima de 50-60mmHg en pacientes con HIA/SCA (GRADO 1C)b) No se pueden realizar actualmente recomendaciones en relación a la sedación y analgesia en la HIA/SCA ya que no existen estudios prospectivos que hayan evaluado sus riesgos y beneficiosc) Una prueba corta con relajantes musculares puede considerarse en pacientes seleccionados con HIA moderada a severa, mientras actúan otras intervenciones para reducir la PIA (GRADO 2C)d) La contribución potencial de la posición corporal en el aumento de la PIA debe tenerse en cuenta en pacientes con HIA moderada a severa o SCA (GRADO 2C)e) No se pueden realizar recomendaciones en relación a la descompresión nasogástrica/colónica y agentes procinéticos, ya que hasta el momento no existen estudios prospectivosf) El volumen de resucitación debe ser estrechamente monitorizado para evitar la sobre-resucitación en pacientes en riesgo de HIA/SCA (GRADO 1B) y debería considerarse la resucitación con coloides o salino hipertónico en pacientes con HIA para reducir la progresión a SCA secundario (GRADO 1C)g) No se pueden realizar recomendaciones sobre el uso de diuréticos y la hemofiltración/ultrafiltración venovenosa continua ya que no existen estudios clínicos en pacientes con HIA/SCAh) La descompresión percutánea con catéter debe considerarse en pacientes con líquido intraperitoneal, absceso o sangre que presentan HIA sintomática o SCA (GRADO 2C) |
| Cierre abdominal temporal: | 1. La descompresión quirúrgica debería realizarse en pacientes con SCA que son refractarios a otras opciones terapéuticas (GRADO 1B) y una posible descompresión debería considerarse en el momento de la laparotomía en pacientes que muestran múltiples factores de riesgo para HIA/SCA (GRADO 1C)2. No se pueden realizar recomendaciones sobre el cierre abdominal definitivo en este momento |
HIA: hipertensión intra-abdominal; PIA: presión intra-abdominal; PPA: presión de perfusión abdominal; SCA: síndrome compartimental abdominal; UCI: Unidad de Cuidados Intensivos.
Adaptado de Cheatham et al5.
Según el estado de la cavidad abdominal, el AA se clasifica en diversos grados38: a) grado 1-A: AA limpio sin adherencias y/o fijación; b) grado 1-B: AA contaminado sin adherencias y/o fijación; c) grado 2-A: AA limpio con adherencias y/o fijación; d) grado 2-B: AA contaminado con adherencias y/o fijación; e) grado 3: AA complicado con fístula, y f) grado 4: AA bloqueado, con adherencias-fijación intestinal, imposible de cerrar, con o sin fístula.
El manejo del abdomen abierto contenido (AAC) incluye, por un lado, la descompresión y/o drenaje y, por otro, el manejo de la pared abdominal, evitando la tensión, retracción y daño de la piel, músculo y aponeurosis, protegiendo la piel, impidiendo o tratando la infección y el edema, preservando una buena vascularización y estimulando la granulación. Para alcanzar este objetivo, se debe seleccionar un apósito temporal que permita la contención de las vísceras intraabdominales que no forme adherencias, no reactivo, que evite la contaminación de la cavidad peritoneal e impida la evisceración y ello sin causar una tensión excesiva en la pared abdominal que aumente la PIA.
Entre los métodos de contención temporal para el manejo del AAC están, entre otros: a) cierre exclusivo de la piel: método rápido para pacientes inestables que precisan re-exploraciones en las siguientes 24 horas; b) cobertura plástica tipo bolsa de Bogotá: útil como tratamiento inicial temporal hasta la aplicación de otras opciones de contención39; c) cierre abdominal temporal tipo Wittmann patch®19; d) cierre dinámico tipo Abra®40; e) técnica «en sándwich»41; f) cierre con materiales protésicos o coberturas bicapa siliconadas: el material de interposición entre los bordes separados de la aponeurosis evita la evisceración y el SCA, y solo deben emplearse cuando no es posible el cierre precoz de la aponeurosis42. El uso de un material protésico sobre un gran defecto produce una hernia ventral y si se coloca tensionado puede favorecer o empeorar un SCA43. Una vez retirada la prótesis de contención, las asas intestinales se cubren por tejido de granulación y cuando no exista signos de infección puede realizarse la reconstrucción plástica; g) técnica de cierre con «vacuum pack»: cierre rápido de la pared abdominal aplicando una aspiración continua y drenajes44, y h) técnicas de cierre con terapia de presión negativa (TPN): es uno de los métodos de elección para el manejo óptimo del AAC43. El cierre asistido con aspiración o terapia VAC® (Vacuum Assisted Clousure) genera una presión subatmosférica a través de un apósito reticulado de poliuretano, permitiendo la expansión del contenido abdominal, sin aumentar la PIA, y aspirando el exudado intraabdominal.
La reconstrucción de un AAC debe realizarse lo antes posible buscando la funcionalidad de la pared. Las reconstrucciones plásticas se pueden realizar con: a) colgajos libres microvasculares; b) colgajos de vecindad pediculados; c) colgajos musculares, musculocutáneos o mioaponeuróticos; d) injertos dermoepidérmicos, o incluso e) uso de células madre adultas procesadas, obtenidas de membrana amniótica humana, que facilitan la epitelización45.
El manejo del AAC se puede dividir en varias fases que se resumen en la tabla 6.
Manejo del Abdomen abierto contenido (AAC)
| 1. Fase aguda- Descompresión en 24-48 horas, inicialmente a veces con bolsa de Bogotá, cambiando luego a TPN- Valorar el cierre de la pared: si es posible, cierre por planos sin tensión, y si no es posible seguir con TPN y cambios cada 48 horas |
| 2. Fase intermedia- Desde las primeras 48 horas hasta los 10 días- Valorar otra vez el cierre de la pared por planos y sin tensión; si no es posible, seguir con la TPN y cambios cada 48 horas- Se debe intentar aproximar la pared aprovechando la expansión de los tejidos |
| 3. Fase tardía reconstructiva- A partir de los 10 días hasta el cierre final- Valorar de nuevo el cierre de la pared por planos y sin tensión; si no es posible, seguir con la TPN y la estimulación del tejido de granulación, cubriendo con piel, colgajo dérmico o implantes de membrana amniótica- El final será un gran defecto ventral complejo (eventración gigante) que debe solucionarse a largo plazo |
TPN: terapia de presión negativa.
Hasta ahora, las manifestaciones locales y los efectos clínicos adversos a distancia que aparecen en la HIA y el SCA se han relacionado con mecanismos estrictamente físicos: compresión de vísceras intraabdominales, transmisión de la HIA a estructuras venosas contenidas en los espacios peritoneal y retroperitoneal e incluso a otros compartimentos como el torácico y disminución del gasto cardiaco con reducción del flujo sanguíneo sistémico, con isquemia y disfunción de órganos3. Sin embargo, recientemente se ha sugerido que, simultáneamente, se ponen en marcha una serie de agentes endógenos inmunoinflamatorios que, originados en el TGI, participarían en la lesión tisular tanto a nivel local como a distancia. Es decir, que independientemente de la isquemia secundaria al descenso del flujo sanguíneo o al efecto directo de la HIA sobre los distintos órganos, se generarían a partir del propio intestino una serie de mediadores inflamatorios que serían, al menos en parte, los causantes del SDMO que se presenta en las fases más tardías del SCA14,22,23.
Este proceso se inscribiría dentro de lo que conocemos como el «two hits model»46: un primer hit (golpe), en forma de traumatismo grave, sepsis o shock, prepara al TGI para que un segundo hit, representado por el desarrollo del propio SCA, el mantenimiento o empeoramiento de la isquemia, o la aparición de la lesión isquemia-reperfusión, desencadene la inflamación del endotelio y del epitelio intestinal con aumento de la permeabilidad y el edema de la pared. El edema, a su vez, incrementa el grado de hipoperfusión conduciendo a un círculo vicioso en el que la HIA se perpetúa y da lugar a una hiperrespuesta inflamatoria que, si es suficientemente severa y mantenida, produce un aumento generalizado de la permeabilidad capilar. En el pulmón origina una lesión pulmonar aguda o un Síndrome de Distrés Respiratorio agudo (SDRA), en el riñón produce una necrosis tubular aguda y en el intestino el SDIA22,23, como elementos del SDMO de la fase tardía del SCA no tratado.
El SDIA es una forma de disfunción del TGI donde el tubo digestivo responde de una forma inespecífica frente a agresiones de diferente naturaleza, como es el caso del SCA. Se produce una pérdida de la función de barrera del intestino, con translocación de bacterias, de endotoxina y antígenos bacterianos, al menos hasta la lámina propia y nódulos linfáticos mesentéricos47,48, una alteración de la composición y de las funciones de la microbiota y una hiperrespuesta del sistema inmune intestinal. El intestino se convierte en una fuente de mediadores, que alcanzan el resto del organismo a través del sistema linfático y activan las cascadas inflamatorias responsables del Síndrome de Hiperpermeabilidad Capilar, de la alteración de la función mitocondrial, la apoptosis y la muerte celular48–50.
Existe evidencia clínica y experimental que implica a diversos mediadores en la lesión múltiple de órganos que aparece en el SCA. Así, en grandes quemados con SCA secundario, se produce una elevación precoz de citoquinas proinflamatorias (IFN-γ, IL-6, IL-4 e IL-2) en plasma y, sobre todo, en líquido ascítico, que se correlacionan con el grado de HIA, la severidad del cuadro y la supervivencia. Se sugiere que el tercer espacio peritoneal actuaría como reservorio de citoquinas responsable de las lesiones sistémicas21. En pacientes quirúrgicos, la HIA también se asocia al incremento de los valores séricos de IL-10, de adenosina y lactato, y con la isquemia intestinal estimada por tonometría51. A nivel experimental, la inducción de SCA mediante la inyección de aire en peritoneo se acompaña de un descenso del flujo e isquemia de la pared intestinal, disrupción de la flora y producción de radicales libres de oxígeno, proteasas y citoquinas14,52–54. En estos modelos experimentales, la HIA/SCA actúa como un segundo golpe (hit). La preparación del sistema inmune se produce durante un periodo de 8-16 horas tras el insulto inicial y es, en este periodo especialmente vulnerable, cuando el segundo hit consigue el efecto máximo y la respuesta inflamatoria alcanza su mayor intensidad20.
Hoy se conocen mejor las complejas relaciones entre los diferentes componente del TGI: la flora endógena, el sistema inmune y el epitelio de la mucosa intestinal. Estos tres componentes, en condiciones normales, establecen entre ellos estrechos diálogos con los que regulan la homeostasis del huésped y la reparación del daño tisular tanto local como a distancia; sin embargo, en circunstancias patológicas, especialmente en aquellos procesos que se acompañan de isquemia del TGI como sucede en el SCA, van a ser los responsables del inicio y el mantenimiento de la respuesta inflamatoria y de las lesiones sistémicas50,55,56. Esto se lleva a cabo a través de la liberación de diversos agentes proinflamatorios como IL-1, TNF-α y IFN-γ y, especialmente, del High Mobility Group Box-1 (HMGB-1), un mediador que, si bien no tiene por si mismo una gran actividad inflamatoria, es capaz de potenciar la respuesta del resto56,57.
Existe abundante información sobre la ecología del tracto intestinal en el periodo de salud, pero en las situaciones de estrés (sepsis grave, traumatismo severo, cirugía mayor o quemaduras, entre otras) es mucho más escasa. La hipoperfusión e isquemia del tubo digestivo altera el equilibrio de la flora comensal, favorece el asentamiento de microorganismos invasores y la adquisición de virulencia de la propia flora endógena56. Las bacterias entéricas utilizan unos sofisticados sistemas para comunicarse entre ellas, los Quórum Sensing (QS), que les permite, con el concurso del epitelio y del sistema inmune local, iniciar y regular la respuesta a la agresión58,59. La composición de la microbiota influye decisivamente en la regulación de esta respuesta.
Las bacterias comensales, mediante los QS, son capaces de detectar los cambios del entorno (generalmente químicos, como el pH, estado de oxi-reducción, osmolaridad, tensión de oxígeno del medio, disponibilidad de nutrientes intraluminales e, incluso, niveles de hormonas contrarreguladoras) e identificar la presencia de ciertos compuestos solubles segregados por el epitelio a la luz intestinal en respuesta a la isquemia, hipoxia o a la lesión tisular provocadas por el SCA. Estos cambios intraluminales son potentes estímulos para los QS no solo de la flora comensal sino también de ciertos oportunistas patógenos, que les llevan a activar o desactivar determinados genes de virulencia y cambiar, en un momento dado, de colonizadores a microorganismos altamente virulentos55.
El epitelio intestinal también participa en la respuesta a la agresión. Las células epiteliales monitorizan el microambiente intestinal mediante los denominados receptores de reconocimiento de patrones: los receptores de membrana Toll-like receptors (TLRs), en el medio extracelular, y la familia del nucleotide-binding-oligomerization-domine (NOD), en el espacio intracelular. Ambos reconocen ciertos componentes estructurales de las bacterias que no existen en las células eucariotas, conocidos como MAMP (microbial-associated molecular patterns), y algunas moléculas endógenas, DAMP (danger-associated molecular patterns)59,60, liberadas por los tejidos dañados o isquémicos. Esta información se transmite al sistema inmune intestinal que pone en marcha los mecanismos de defensa del huésped ante la presencia de estructuras moleculares no propias.
La invasión de bacterias o sus componentes y la acumulación de las moléculas producidas en la lesión isquémica intestinal (ácido hialurónico, heparan fosfato, ciertas heat shock proteins, y, sobre todo, el HMGB) activan los receptores de reconocimiento de patrones, TLRs y NOD. El resultado es la migración del factor de transcripción nuclear NF-κB al núcleo de la célula y la expresión de los genes necesarios para la síntesis de los mediadores, básicamente citoquinas y quimoquinas, que aumentan la permeabilidad de la barrera intestinal y estimulan la quimiotaxis y la activación leucocitaria57. En los casos más severos del SCA, o cuando el insulto coincide con el periodo de mayor vulnerabilidad o de máxima reacción del sistema inmune, estos mediadores actúan como segundo hit, iniciando el Síndrome de Respuesta Inflamatoria Sistémica20,59. Entonces, a través de la vía estéril, mediada por DAMPs (daño tisular isquémico, lesión de isquemia/reperfusión, etc.), o a través de los MAMPs de los microorganismos entéricos translocados, el SCA se convierte en el desencadenante de la hiperrespuesta generalizada y del SDMO, en el que intervienen, al menos, tres grupos de agentes inflamatorios: los radicales de oxígeno libres, los derivados del óxido nítrico y varias citoquinas proinflamatorias (TNF-α, IL-1, IL-6…), que amplifican y perpetúan el cuadro.
Todos estos mediadores, junto con algunos componentes de las bacterias fagocitadas (lipopolisacaridos y peptidoglicanos) y leucocitos polimorfonucleares activados, abandonan el intestino a través de la vía linfática48 y son los efectores últimos del aumento de la permeabilidad capilar en órganos ricos en epitelio (como pulmón, riñón o hígado), de la lesión endotelial y del SDMO que aparece en la fase final del SCA y que caracterizan al SDIA22,23.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.