INTRODUCCIÓN
El síndrome de Guillain-Barré (SGB) es una polineuropatía aguda mixta, desmielinizante y axonal, que constituye la causa más frecuente de parálisis fláccida en los países desarrollados. Puede aparecer a cualquier edad, siendo más frecuente en la infancia, entre los 5 y los 10 años. Su etiopatogenia, aún no totalmente aclarada, implica a mecanismos inmunológicos1.
Los desencadenantes de esta reacción inflamatoria anómala son infecciosos, tóxicos, bioquímicos, y algunos autores relacionan hasta un 5-10% de los casos con el antecedente de una intervención quirúrgica o en el contexto de una enfermedad tumoral2.
Se han comunicado también casos de SGB en pacientes receptores de órganos trasplantados (la mayoría, receptores de injertos renales3 y de médula ósea4). También se han comunicado casos en receptores de trasplante cardíaco y hepático5. En casi todos ellos se demostró la infección de novo o la reactivación de la infección por citomegalo-virus (CMV) o la bacteriemia por Campylobacter jejuni.
Presentamos un caso de SGB en el postoperatorio inmediato de un trasplante hepático, en un paciente en el que no se encontró ninguno de los factores de riesgo reconocidos previamente como desencadenantes del síndrome (salvo, quizá, el de la propia intervención quirúrgica).
OBSERVACIÓN CLÍNICA
Se trata de un varón de 13 años, con enfermedad de Alagille, seropositivo (IgG) para citomegalovirus (CMV), que ingresó en la UCI pediátrica (UCIP) tras la realización de trasplante hepático segmentario procedente de cadáver. El postoperatorio inmediato trancurrió sin incidencias, siendo dado de alta al cuarto día con tratamiento inmunosupresor con 6-metilprednisolona y tacrolimus (dosificado según los valores plasmáticos).
Al sexto día se realizó una laparotomía exploratoria ante una anemización brusca y sospecha de sangrado abdominal, encontrándose necrosis isquémica del injerto secundaria a trombosis de la arteria hepática (a pesar de tratamiento profiláctico con heparina). Reingresó en la UCIP en el contexto de un shock hipovolémico-séptico. Precisó tratamiento expansor de volemia e inotrópico, que se retiró gradualmente.
Al décimo día recibió un retrasplante hepático segmentario de cadáver, continuándose con la misma pauta inmunosupresora.
Durante la evolución recibió tratamiento antimicrobiano (aislamiento de Bacteroides fragilis y Staphylococcus coagulasa negativo en el tejido de trasplantectomía). Además, se administró anfotericina B liposomal y, desde el primer trasplante, tratamiento profiláctico de la infección por CMV con ganciclovir.
A los 14 días del primer trasplante el paciente refirió parestesias y dolor en ambos pies, con escasa respuesta a los analgésicos habituales. En los días sucesivos se añadió al cuadro una pérdida de fuerza que impedía la marcha y alteración de la sensibilidad táctil y propioceptiva en pies y piernas, con abolición de los reflejos aquíleo y rotuliano.
Todos los estudios microbiológicos (hemocultivos, cultivos de aspirado bronquial, drenajes quirúrgicos, coprocultivo, LCR, etc.) resultaron negativos (salvo el mencionado de trasplantectomía). También fueron negativos los cultivos y detección mediante PCR (reacción en cadena de la polimerasa) de virus del herpes y enterovirus en LCR, así como los cultivos de CMV en sangre, orina y faringe.
En el estudio citoquímico de LCR se evidenció una glucosa de 113 mg/dl, proteínas de 56 mg/dl (normal, 15-45) y ausencia de células (disociación albúmino-citológica).
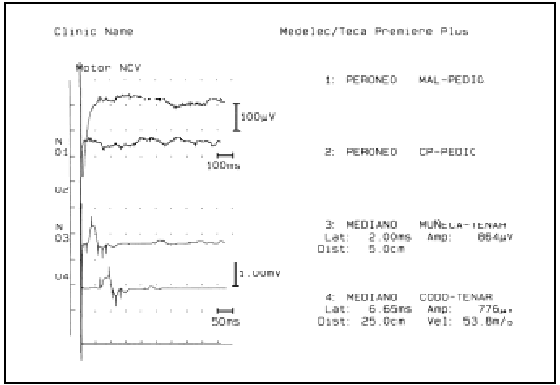
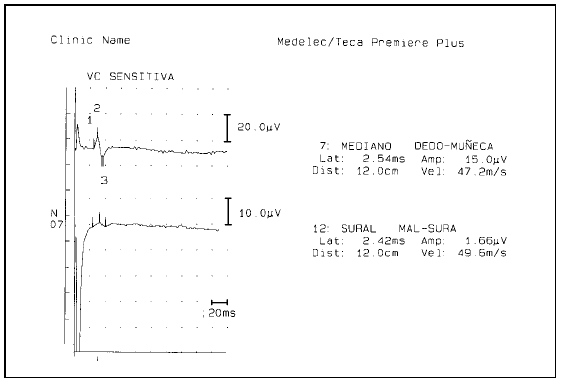
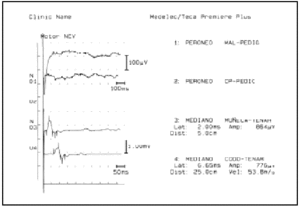
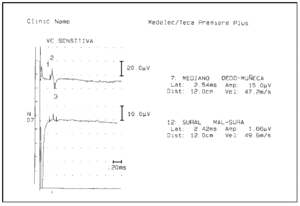
La electroneuromiografía mostraba polineuropatía axonal motora grave en los miembros inferiores, leve en los superiores, con una leve afección sensitiva en miembros inferiores. No había signos de desmielinización (figs. 1 y 2).
Figura 1. Electroneurograma motor. Obsérvese la ausencia de potencial motor al estimular el nervio peroneo. Igualmente, potencial de muy baja amplitud al estimular el nervio mediano (valor normal > 2 μV), con velocidad de conducción normal. En ambos casos, indicativos de lesión axonal motora, sin desmielinización.
Figura 2. Electroneurograma sensitivo. Disminución de la amplitud del potencial sensitivo del nervio sural (valor normal > 4 μV) con velocidad de conducción normal, lo que indica lesión axonal sensitiva de dicho nervio, sin desmielinización. Normalidad de la exploración en el nervio mediano.
El cuadro neurológico se diagnosticó como SGB axonal de predominio motor, y ha seguido un tratamiento fisioterapéutico, observándose a lo largo de 12 meses de evolución una recuperación parcial de la fuerza de ambas piernas (marcha en steppage) y disminución de las parestesias.
DISCUSIÓN
Las manifestaciones motoras y sensitivas del SGB son muy variables. El estudio neurofisiológico también muestra diferencias entre pacientes. El patrón más frecuente es el de desmielinización, con disminución de las velocidades de conducción y un aumento de las latencias.
En el otro extremo existen formas más graves, como la de nuestro paciente, con signos de denervación: son las formas axonales. Han ganado entidad propia los subtipos denominados AMAN (acute motor axonal neuropathy) o forma motora pura con degeneración axonal y AMSAN, que también presenta participación sensitiva. Tienen un peor pronóstico, con una recuperación funcional más lenta y en ocasiones, incompleta.
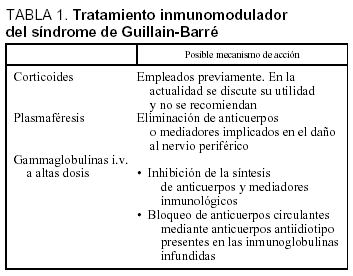
El tratamiento consiste básicamente en el soporte de las funciones vitales, principalmente soporte ventilatorio en las formas graves. Otras medidas incluyen el empleo de fármacos inmunomoduladores, que pueden aminorar los síntomas y acelerar la recuperación (tabla 1)6. Nuestro paciente recibía tratamiento inmunosupresor con corticoides en el momento del inicio del SGB.
El inicio de los síntomas suele estar precedido, de 1 a 6 semanas antes, de un cuadro infeccioso. Se ha implicado a los virus de la familia del herpes (CMV, VEB, varicela-zoster) y a diversas vacunas. En los EE.UU., en la campaña de vacunación de la gripe de 1976-1977 se observó un incremento en la incidencia de SGB entre la población vacunada. Sin embargo, observaciones posteriores sólo han comunicado un mínimo aumento de un caso adicional de SGB por cada millón de personas vacunadas7.
Entre los agentes infecciosos, C. jejuni, con antecedente de gastroenteritis previa, es el más frecuentemente implicado en el SGB, especialmente en las formas axonales.
En la mayoría de los casos de SGB en pacientes trasplantados se ha encontrado un agente infeccioso cuya primoinfección o reactivación ha precedido al inicio de la sintomatología. En una población inmunodeprimida es lógico que el agente más frecuentemente comunicado haya sido del CMV, un patógeno particularmente temido y "perseguido" en las primeras etapas del postrasplante, cuando los valores de inmunosupresión alcanzan su máximo nivel4,6,8,9. C. jejuni es otro de los microorganismos comunicado como causante3.
Ninguno de los microorganismos habitualmente asociados al desarrollo del SGB pudo ser aislado o detectado como agente infeccioso activo en el período inmediatamente anterior al inicio de los síntomas en el caso aquí presentado.
Wilson et al10 presentaron 3 pacientes con trasplante hepático, en tratamiento con tacrolimus, que desarrollaron polirradiculoneuropatía inflamatoria crónica desmielinizante, entidad de base inmunológica de características clínicas similares al SGB.
Es evidente que la propia inmunosupresión, per se, ya constituye una alteración del equilibrio inmunológico. Esta alteración quizá permita que queden libres o prevalezcan clones de linfocitos capaces de generar una respuesta de autoagresión, al quedar inhibidos linfocitos T supresores.
Por otra parte, el órgano trasplantado supone una fuente de estímulos antigénicos que ponen en marcha los mecanismos inmunológicos del huésped, generando una respuesta de defensa que lleva al rechazo del injerto. Esta misma respuesta inmunitaria quizá podría causar también un daño en los propios órganos del huésped, y explicar la agresión desmielinizante en este caso.
Quizá en el caso del trasplante de médula ósea podría especularse con algo parecido a una especie de "enfermedad injerto contra huésped", en la que las células inmunológicas del injerto ataquen directamente a la fibra nerviosa del huésped; pero en el trasplante de órganos sólidos esta posibilidad no parece demasiado probable.
Así pues, en nuestro paciente no se ha encontrado ninguno de los factores de riesgo habitualmente asociados con el desarrollo de dicha entidad. Al igual que ocurre con otras enfermedades de base inmunitaria, todavía faltan por aclarar muchas claves que nos ayuden a entender mejor la etiopatogenia de estos procesos.