El soporte respiratorio no invasivo (SRNI) comprende 2 modalidades de tratamiento, la ventilación mecá-nica no invasiva (VMNI) y la terapia de alto flujo con cánulas nasales (TAFCN) que se aplican en pacientes adultos, pediátricos y neonatales con insuficiencia respiratoria aguda (IRA). Sin embargo, el grado de acuerdo entre las distintas especialidades sobre el beneficio de estas técnicas en diferentes escenarios clínicos es controvertido. El objetivo del presente consenso fue elaborar una serie de recomendaciones de buena práctica clínica para la aplicación de soporte no invasivo en pacientes con IRA, avaladas por todas las sociedades científicas involucradas en el manejo del paciente adulto y pediátrico/neonatal con IRA.
Para ello se contactó con las diferentes sociedades implicadas, quienes designaron a su vez a un grupo de 26 profesionales con suficiente experiencia en su aplicación. Se realizaron 3 reuniones presenciales para consensuar las recomendaciones (hasta un total de 71) fundamentadas en la revisión de la literatura y en la actualización de la evidencia disponible en relación con 3 categorías: indicaciones, monitorización yseguimiento del SRNI. Finalmente, se procedió a votación telemática de cada una de las recomendaciones, por parte de los expertos de cada sociedad científica implicada. Para la clasificación del grado de acuerdo se optó por un sistema analógico de clasificación fácil e intuitivo de usar, y que expresara con claridad si el procedimiento relacionado con el SRNI debía hacerse, podía hacerse o no debía hacerse.
Non-invasive respiratory support (NIRS) in adult, pediatric, and neonatal patients with acute respiratory failure (ARF) comprises two treatment modalities, non-invasive mechanical ventilation (NIMV) and high-flow nasal cannula (HFNC) therapy. However, experts from different specialties disagree on the benefit of these techniques in different clinical settings. The objective of this consensus was to develop a series of good clinical practice recommendations for the application of non-invasive support in patients with ARF, endorsed by all scientific societies involved in the management of adult and pediatric/neonatal patients with ARF.
To this end, the different societies involved were contacted, and they in turn appointed a group of 26 professionals with sufficient experience in the use of these techniques. Three face-to-face meetings were held to agree on recommendations (up to a total of 71) based on a literature review and the latest evidence associated with 3 categories: indications, monitoring and follow-up of NIRS. Finally, the experts from each scientific society involved voted telematically on each of the recommendations. To classify the degree of agreement, an analogue classification system was chosen that was easy and intuitive to use and that clearly stated whether the each NIRS intervention should be applied, could be applied, or should not be applied.
El soporte respiratorio no invasivo (SRNI) comprende dos modalidades de tratamiento, la ventilación no invasiva (VMNI) y la terapia de alto flujo con cánulas nasales (TAFCN) que se aplican en pacientes adultos, pediátricos y neonatales con insuficiencia respiratoria aguda (IRA). El desarrollo del conocimiento científico sobre su aplicación en diferentes patologías graves ha conllevado su uso generalizado. Sin embargo, el grado de acuerdo entre las distintas especialidades sobre el beneficio de estas técnicas en diferentes escenarios clínicos es controvertido, dado que no existe un documento de consenso sobre la aplicación de soporte no invasivo en la IRA y mucho menos que abarque todos los grupos etarios. Este hecho puede llegar a no garantizar la seguridad y las mejores condiciones (calidad) para el paciente durante el proceso de su aplicación.
El objetivo del presente documento de consenso fue elaborar una serie de recomendaciones de buena práctica clínica para la aplicación de soporte no invasivo en pacientes con IRA, avaladas por todas las sociedades científicas involucradas en el manejo del paciente adulto y pediátrico/neonatal. Las respectivas sociedades designaron a los expertos en la materia que consideraron oportunos para la representación en el grupo de trabajo. Para fundamentar el consenso, se empleó una revisión de la literatura (overview) y actualización de la evidencia disponible en relación con tres categorías: indicaciones, monitorización y seguimiento, así como la elaboración de recomendaciones de actuaciones clínica basadas en el consenso de profesionales donde existiera evidencia de suficiente calidad y una concordancia alta.
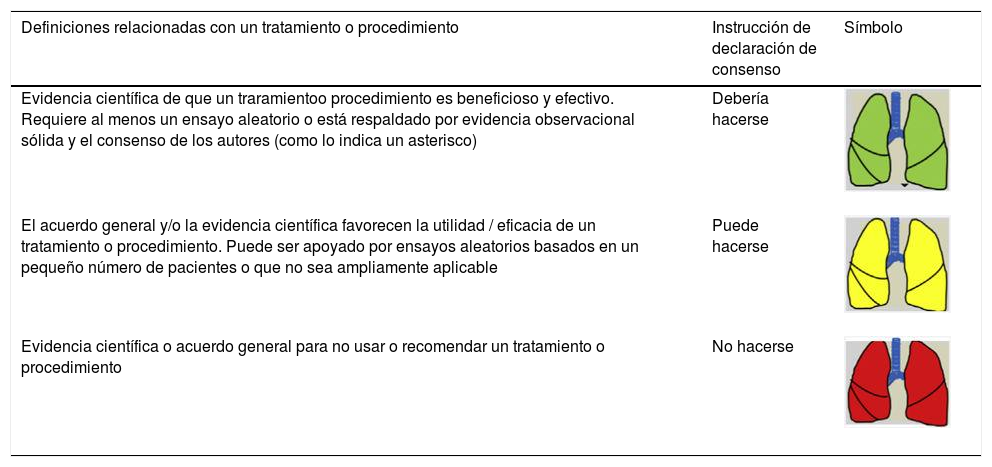
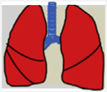
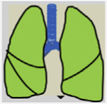
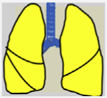
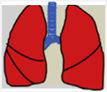
Las recomendaciones de consenso (sugerencias de práctica clínica) se basaron cuando esto era posible en evidencias de calidad, derivadas de los datos publicados disponibles. En caso contrario, se recurrió al consenso tácito de los miembros del grupo de trabajo. Para la clasificación del grado de acuerdo se optó por un sistema analógico de clasificación fácil e intuitivo de usar1. Así, un símbolo (pulmón) verde indica una recomendación de consenso “debería hacerse”: tratamiento o procedimiento indicado que se basa en al menos un ensayo aleatorio, o está respaldado por evidencia observacional sólida de que es beneficioso y efectivo. Un “pulmón amarillo” indica acuerdo general y / o evidencia científica a favor de un “puede hacerse”: esta declaración o la utilidad / eficacia de un tratamiento o procedimiento se basa en ensayos clínicos realizados con un número pequeño de pacientes o resultados que quizás no sean ampliamente aplicables a todos los pacientes con dichas características. Por último, las estrategias de manejo para las cuales existe evidencia científica de daño potencial o mala praxis y que por lo tanto no deben ser promovidas (“no hacer”) están indicadas por un pulmón rojo (tabla 1). Para definir el grado de acuerdo se procedió a votaciones telemáticas una vez definidos los puntos clave. Los grupos de votación se definieron por el perfil etario del paciente (adulto, pediátrico y neonatal), de forma que cada especialista únicamente podía emitir su voto en el grupo previamente asignado conforme a su experiencia.
Razonamiento científico de las definiciones basadas en «Pulmones de colores» para las sugerencias de práctica clínica
| Definiciones relacionadas con un tratamiento o procedimiento | Instrucción de declaración de consenso | Símbolo |
|---|---|---|
| Evidencia científica de que un traramientoo procedimiento es beneficioso y efectivo. Requiere al menos un ensayo aleatorio o está respaldado por evidencia observacional sólida y el consenso de los autores (como lo indica un asterisco) | Debería hacerse | |
| El acuerdo general y/o la evidencia científica favorecen la utilidad / eficacia de un tratamiento o procedimiento. Puede ser apoyado por ensayos aleatorios basados en un pequeño número de pacientes o que no sea ampliamente aplicable | Puede hacerse | |
| Evidencia científica o acuerdo general para no usar o recomendar un tratamiento o procedimiento | No hacerse |
Se incluyen en este resumen las principales recomendaciones y los puntos clave en cada uno de los tres apartados anteriormente mencionados. Asimismo, dichas recomendaciones se plasman en las tablas 2-8, donde se expresa la opinión mayoritaria y el porcentaje de dicha opción, siendo necesario un consenso igual o superior al 50% de miembros para emitir la recomendación o sugerencia correspondiente. En caso de igualdad entre dos de las opciones (puede o debe hacerse) se han reflejado las dos en el documento. Puede asimismo consultarse el documento completo como suplemento on line.
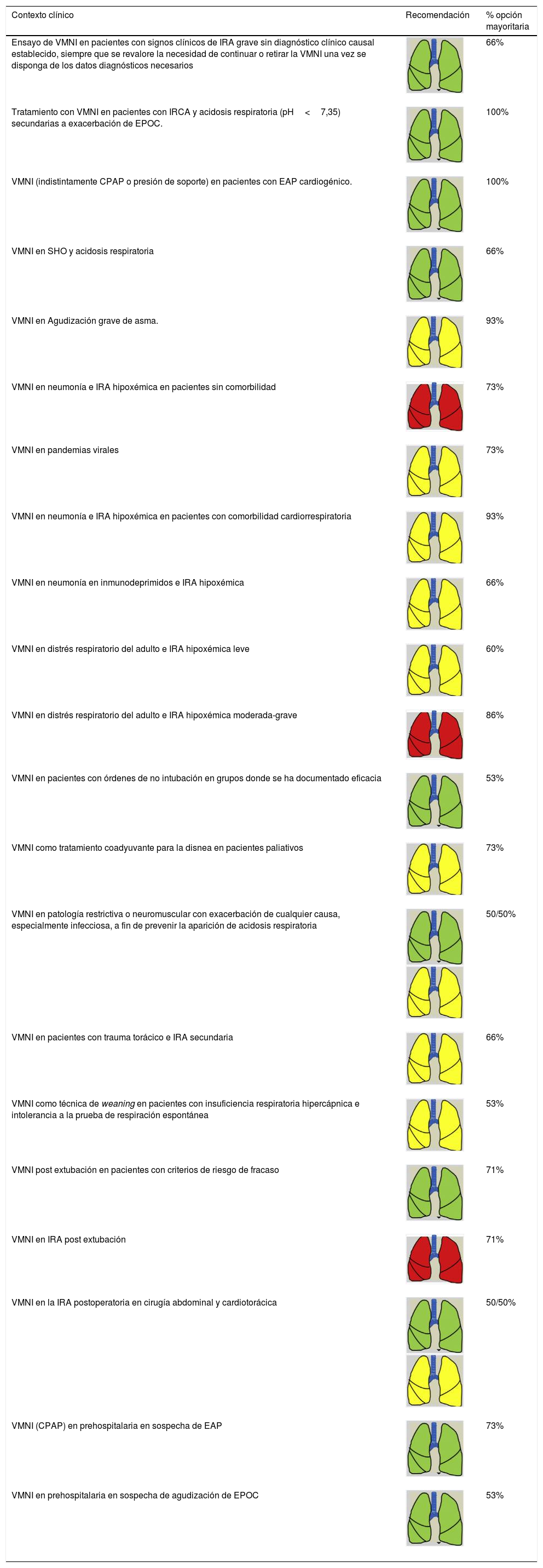
Recomendaciones de consenso para las indicaciones de SRNI (VMNI) en pacientes en edad adulta
| Contexto clínico | Recomendación | % opción mayoritaria |
|---|---|---|
| Ensayo de VMNI en pacientes con signos clínicos de IRA grave sin diagnóstico clínico causal establecido, siempre que se revalore la necesidad de continuar o retirar la VMNI una vez se disponga de los datos diagnósticos necesarios | 66% | |
| Tratamiento con VMNI en pacientes con IRCA y acidosis respiratoria (pH<7,35) secundarias a exacerbación de EPOC. | 100% | |
| VMNI (indistintamente CPAP o presión de soporte) en pacientes con EAP cardiogénico. | 100% | |
| VMNI en SHO y acidosis respiratoria | 66% | |
| VMNI en Agudización grave de asma. | 93% | |
| VMNI en neumonía e IRA hipoxémica en pacientes sin comorbilidad | 73% | |
| VMNI en pandemias virales | 73% | |
| VMNI en neumonía e IRA hipoxémica en pacientes con comorbilidad cardiorrespiratoria | 93% | |
| VMNI en neumonía en inmunodeprimidos e IRA hipoxémica | 66% | |
| VMNI en distrés respiratorio del adulto e IRA hipoxémica leve | 60% | |
| VMNI en distrés respiratorio del adulto e IRA hipoxémica moderada-grave | 86% | |
| VMNI en pacientes con órdenes de no intubación en grupos donde se ha documentado eficacia | 53% | |
| VMNI como tratamiento coadyuvante para la disnea en pacientes paliativos | 73% | |
| VMNI en patología restrictiva o neuromuscular con exacerbación de cualquier causa, especialmente infecciosa, a fin de prevenir la aparición de acidosis respiratoria | 50/50% | |
| VMNI en pacientes con trauma torácico e IRA secundaria | 66% | |
| VMNI como técnica de weaning en pacientes con insuficiencia respiratoria hipercápnica e intolerancia a la prueba de respiración espontánea | 53% | |
| VMNI post extubación en pacientes con criterios de riesgo de fracaso | 71% | |
| VMNI en IRA post extubación | 71% | |
| VMNI en la IRA postoperatoria en cirugía abdominal y cardiotorácica | 50/50% | |
| VMNI (CPAP) en prehospitalaria en sospecha de EAP | 73% | |
| VMNI en prehospitalaria en sospecha de agudización de EPOC | 53% |
CPAP: presión positiva continua; EAP: edema agudo de pulmón; EPOC: enfermedad pulmonar obstructiva crónica; IRA: insuficiencia respiratoria aguda; SRNI: soporte respiratorio no invasivo; VMNI: ventilación mecánica no invasiva.
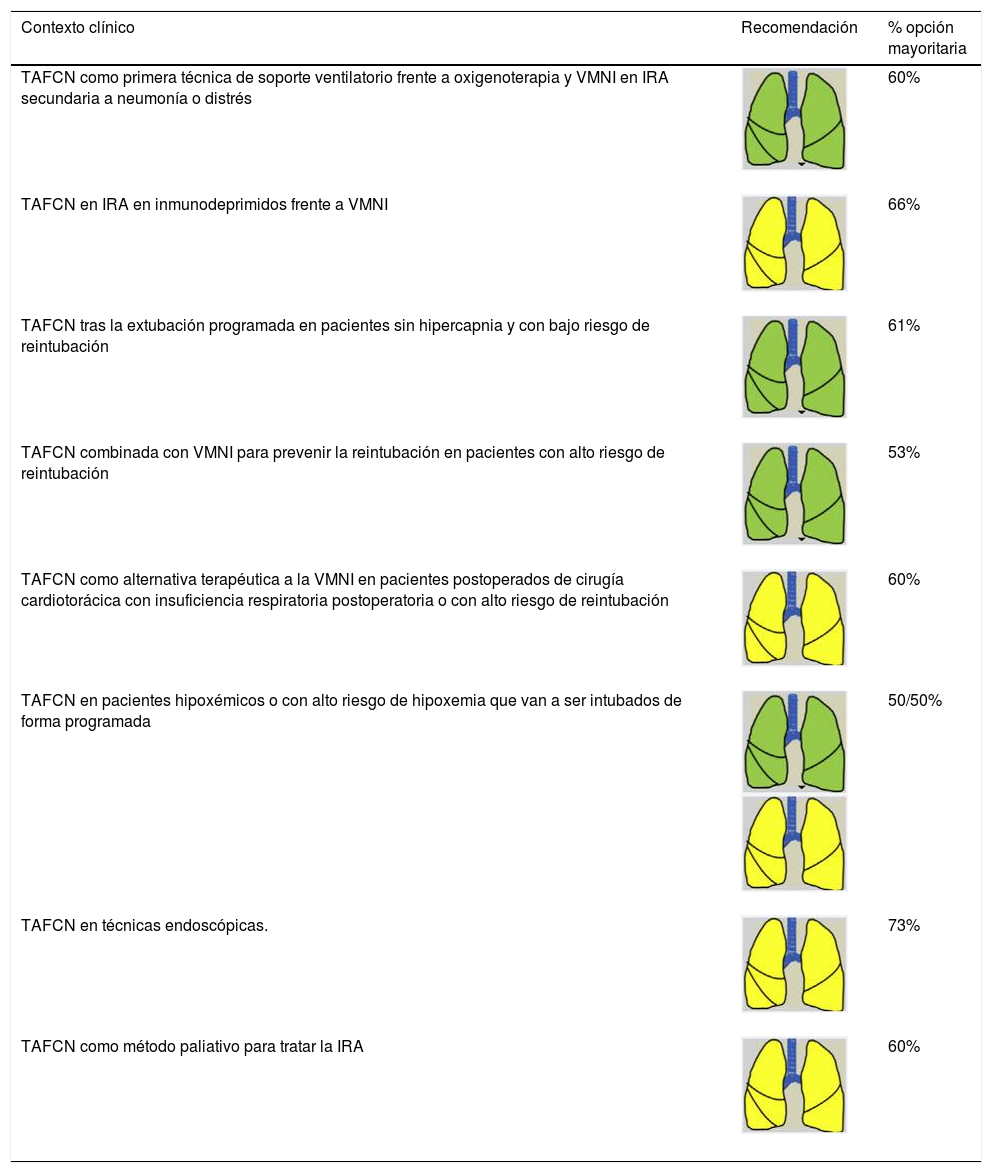
Recomendaciones de consenso para las indicaciones de SRNI (TAFCN) en pacientes en edad adulta
| Contexto clínico | Recomendación | % opción mayoritaria |
|---|---|---|
| TAFCN como primera técnica de soporte ventilatorio frente a oxigenoterapia y VMNI en IRA secundaria a neumonía o distrés | 60% | |
| TAFCN en IRA en inmunodeprimidos frente a VMNI | 66% | |
| TAFCN tras la extubación programada en pacientes sin hipercapnia y con bajo riesgo de reintubación | 61% | |
| TAFCN combinada con VMNI para prevenir la reintubación en pacientes con alto riesgo de reintubación | 53% | |
| TAFCN como alternativa terapéutica a la VMNI en pacientes postoperados de cirugía cardiotorácica con insuficiencia respiratoria postoperatoria o con alto riesgo de reintubación | 60% | |
| TAFCN en pacientes hipoxémicos o con alto riesgo de hipoxemia que van a ser intubados de forma programada | 50/50% | |
| TAFCN en técnicas endoscópicas. | 73% | |
| TAFCN como método paliativo para tratar la IRA | 60% |
IRA: insuficiencia respiratoria aguda; SRNI: soporte respiratorio no invasivo; TAFCN: terapia de alto flujo con cánulas nasales; VMNI: ventilación mecánica no invasiva.
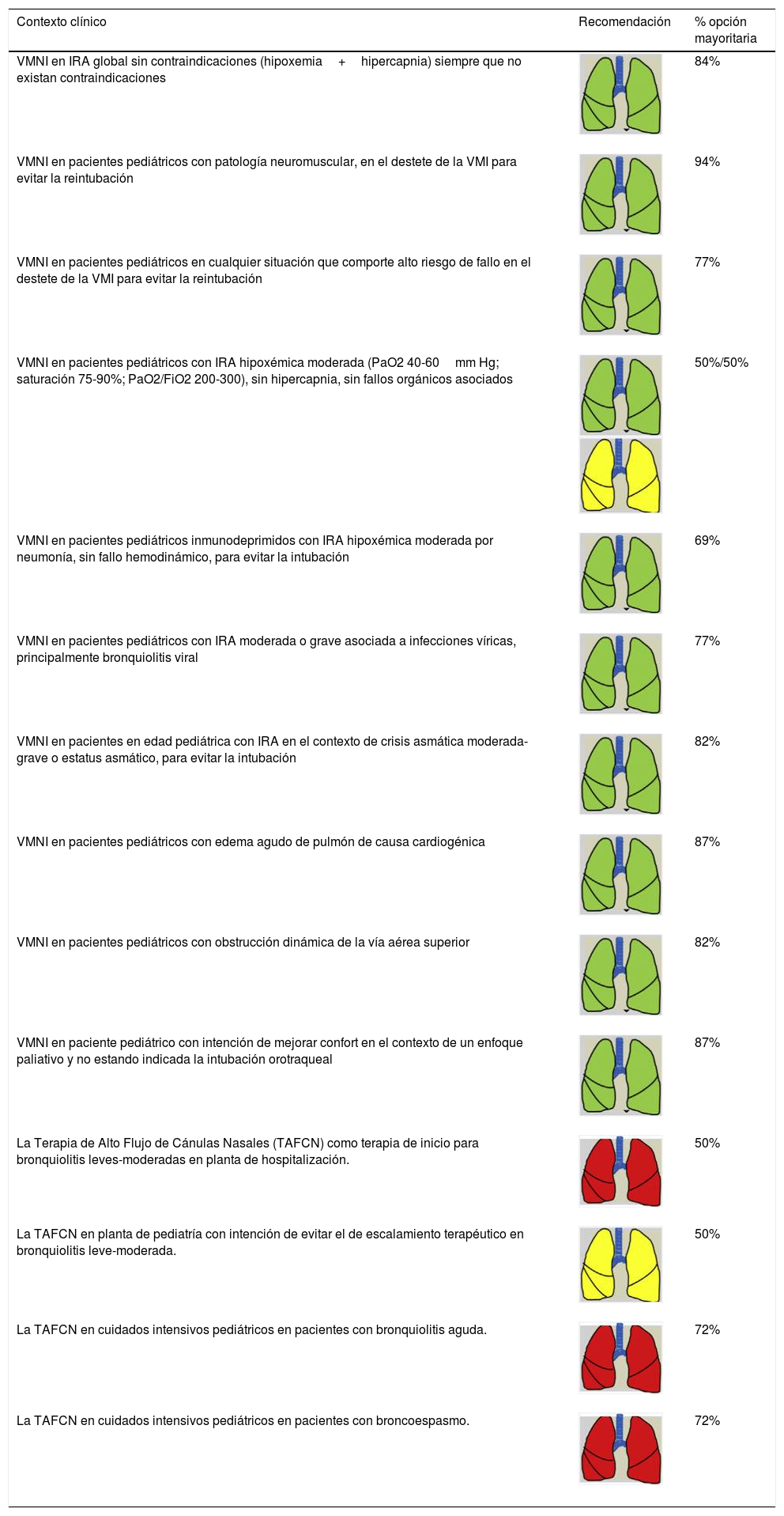
Recomendaciones de consenso para las indicaciones de SRNI en pacientes en edad pediátrica
| Contexto clínico | Recomendación | % opción mayoritaria |
|---|---|---|
| VMNI en IRA global sin contraindicaciones (hipoxemia+hipercapnia) siempre que no existan contraindicaciones | 84% | |
| VMNI en pacientes pediátricos con patología neuromuscular, en el destete de la VMI para evitar la reintubación | 94% | |
| VMNI en pacientes pediátricos en cualquier situación que comporte alto riesgo de fallo en el destete de la VMI para evitar la reintubación | 77% | |
| VMNI en pacientes pediátricos con IRA hipoxémica moderada (PaO2 40-60mm Hg; saturación 75-90%; PaO2/FiO2 200-300), sin hipercapnia, sin fallos orgánicos asociados | 50%/50% | |
| VMNI en pacientes pediátricos inmunodeprimidos con IRA hipoxémica moderada por neumonía, sin fallo hemodinámico, para evitar la intubación | 69% | |
| VMNI en pacientes pediátricos con IRA moderada o grave asociada a infecciones víricas, principalmente bronquiolitis viral | 77% | |
| VMNI en pacientes en edad pediátrica con IRA en el contexto de crisis asmática moderada-grave o estatus asmático, para evitar la intubación | 82% | |
| VMNI en pacientes pediátricos con edema agudo de pulmón de causa cardiogénica | 87% | |
| VMNI en pacientes pediátricos con obstrucción dinámica de la vía aérea superior | 82% | |
| VMNI en paciente pediátrico con intención de mejorar confort en el contexto de un enfoque paliativo y no estando indicada la intubación orotraqueal | 87% | |
| La Terapia de Alto Flujo de Cánulas Nasales (TAFCN) como terapia de inicio para bronquiolitis leves-moderadas en planta de hospitalización. | 50% | |
| La TAFCN en planta de pediatría con intención de evitar el de escalamiento terapéutico en bronquiolitis leve-moderada. | 50% | |
| La TAFCN en cuidados intensivos pediátricos en pacientes con bronquiolitis aguda. | 72% | |
| La TAFCN en cuidados intensivos pediátricos en pacientes con broncoespasmo. | 72% |
FiO2: fracción inspiratoria de oxígeno; IRA: insuficiencia respiratoria aguda; PaO2: presión arterial de oxígeno; SRNI: soporte respiratorio no invasivo; TAFCN: terapia de alto flujo con cánulas nasales; VMI: ventilación mecánica invasiva; VMNI: ventilación mecánica no invasiva.
Recomendaciones de consenso para las indicaciones de SRNI en pacientes en edad neonatal
| Contexto clínico | Recomendación. | % opción mayoritaria |
|---|---|---|
| VMNI preventiva en todos los pacientes prematuros (< 30 semanas de EG) con distrés respiratorio. | 100% | |
| VMNI tras la extubación y para evitar la reintubación en prematuros de <30 semanas de EG | 100% | |
| VMNI en estabilización tras el nacimiento en <32sem de EG y/o <1500 gramos de peso. | 100% | |
| TAFCN en neonatos con insuficiencia respiratoria leve-moderada. | 100% | |
| TAFCN tras la extubación y para evitar la reintubación en el paciente pretérmino> 28 sem de EG | 100% | |
| TAFCN en el destete del CPAPn | 100% |
CPAPn: presión positiva continua nasal; EG: edad gestacional; SRNI: soporte respiratorio no invasivo; TAFCN: terapia de alto flujo con cánulas nasales; VMNI: ventilación mecánica no invasiva.
Recomendaciones de consenso para el procedimiento y seguimiento del SRNI en pacientes en edad adulta
| Procedimiento. | Recomendación | % opción mayoritaria |
|---|---|---|
| Estratificación de pacientes candidatos a SRNI. Priorización de ingreso en áreas de intensivos de los pacientes de alto riesgo. | 93% | |
| Uso de ventiladores específicos para VMNI en agudos o bien ventiladores de pacientes críticos con módulo de VMNI. | 80% | |
| Las interfases de elección en el paciente agudo adulto son las máscaras nasobucales y faciales totales. | 87% | |
| La ventilación por presión en modo espontaneo/asistido es el modo de elección en la insuficiencia respiratoria aguda | 93% | |
| Monitorización continua de parámetros fisiológicos durante el procedimiento (FR, FC, SpO2) | 93% | |
| Seguimiento con ayuda del análisis de las curvas de flujo y presión proporcionadas por el ventilador | 67% | |
| Uso de humidificación activa durante la VMNI | 53% | |
| Valoración de la eficacia de la VMNI al cabo de una hora de su inicio, siendo la valoración a las 4-6 h un buen indicador del éxito/fracaso de la técnica | 93% | |
| Si no se obtiene respuesta a la VMNI, debe plantearse la interrupción de la técnica de forma precoz y valorar la intubación endotraqueal y ventilación invasiva. | 100% | |
| Retirada directa de la VMNI en pacientes con exacerbación de la EPOC tras la normalización del pH y la mejora de la condición clínica general | 53% | |
| Evaluación de la continuidad de la VMNI en el SHO agudizado una vez solventado el episodio agudo, ya que muchos pacientes presentan trastorno del sueño de base | 73% | |
| Valoración de ventilación domiciliaria crónica post agudización que haya requerido VMNI en aquellos pacientes con enfermedad pulmonar restrictiva, neuromusculares y EPOC en los que persiste una PC02> 56mm Hg al alta | 80% | |
| En la aplicación de TAFCN, utilizar flujos entre 40-50 lpm en pacientes con IRA hipoxémica moderada con una FiO2 mínima para mantener una SpO2 alrededor de 93-94% con la humidificación y temperatura ya anotadas previamente. | 100% |
EPOC: enfermedad pulmonar obstructiva crónica; FC: frecuencia cardíaca; FiO2: fracción inspiratoria de oxígeno; FR: frecuencia respiratoria; IRA: insuficiencia respiratoriaaguda; PaCO2: presión parcial de dióxido de carbono; SHO: síndrome de hipoventilación asociado a obesidad; SpO2: saturación de oxígeno; SRNI: soporte respiratorio no invasivo; TAFCN: terapia de alto flujo con cánulas nasales; VMNI: ventilación mecánica no invasiva.
Recomendaciones de consenso para procedimiento y seguimiento del SRNI en pacientes en edad pediátrica
| Procedimiento. | Recomendación | % opción mayoritaria |
|---|---|---|
| En el paciente pediátrico deben valorarse los criterios clínicos de mejora a la 1-2 horas de inicio de la técnica: disminución de FC, FR, que deben ser acorde a la edad del paciente, mejora del trabajo respiratorio (disnea) y disminución de la actividad de los músculos respiratorios accesorios. | 97% | |
| En el paciente pediátrico se debe monitorizar la PaO2 / FiO2 o SaO2 / FiO2 | 97% | |
| La ventilación por presión en modo espontaneo/asistido es el modo de elección inicial en la insuficiencia respiratoria aguda global (hipoxémia+hipercapnia) | 74% | |
| El modo CPAP es el modo de elección inicial en la en la IRA tipo I, hipoxémica sin hipercapnia, con fuerzo respiratorio conservado. | 74% | |
| Uso de humidificación activa en el paciente en edad pediátrica | 94% | |
| Durante el soporte respiratorio no invasivo es necesario mantener un buen posicionamiento del paciente y la colocación de una sonda nasogástrica | 64% | |
| En la VMNI en fase aguda, en paciente en edad pediátrica, el nivel de PS debe ser de alrededor de 4-5 cmH2O sobre el nivel de presión espiratoria (PEEP o EPAP). Una vez conseguida la tolerancia del paciente, el nivel de PS puede incrementarse en intervalos de 2cm H2O hasta lograr disminuir el trabajo respiratorio. | 94% | |
| La retirada de VMNI en el paciente en edad pediátrica depende de la patología motivo de la indicación: más rápido cuanto menos tiempo de evolución. | 69% | |
| En los pacientes neuromusculares pediátricos puede requerirse mantenimiento soporte crónico no invasivo en domicilio. | 97% |
CPAP: presión positiva continua; EPAP: presión espiratoria; FC: frecuencia cardíaca; FiO2: fracción inspiratoria de oxígeno; FR: frecuencia respiratoria; IRA: insuficiencia respiratoria aguda; PaO2: presión arterial de oxígeno; PEEP: presión espiratoria; PS: presión de soporte; SaO2: saturación de oxígeno; SRNI: soporte respiratorio no invasivo; VMNI: ventilación mecánica no invasiva.
Recomendaciones de consenso para procedimiento y seguimiento del SRNI en pacientes en edad neonatal
| Contexto clínico | Recomendación | %opción mayoritaria |
|---|---|---|
| Uso de humidificación activa en el paciente neonatal | 100% | |
| La interfase de elección en neonatología son las cánulas binasales cortas o mascarilla nasal. | 100% | |
| Los ventiladores de elección para VMNI neonatal son los generadores de flujo variable frente a continuo | 100% | |
| FiO2 de acuerdo a SatO2 para EG | 100% | |
| Mantener un buen posicionamiento del paciente y colocación de sonda orogástrica | 100% | |
| Consideración como criterios de fracaso la necesidad de una FiO2 de 0,4-0,5 para alcanzar la saturación diana en función de su edad gestacional, la disnea progresiva y las pausas de apnea, además de la persistencia de acidosis respiratoria. | 100% | |
| Iniciar la retirada de VMNI cuando FiO2<0,4, no apneas y/o bradicardias y, no signos clínicos de dificultad respiratoria | 100% |
EG: edad gestacional; FiO2: fracción inspiratoria de oxígeno; PaO2: presión arterial de oxígeno; SatO2: saturación arterial de oxígeno; VMNI: ventilación mecánica no invasiva.
- •
Ante un paciente con disnea y signos de insuficiencia respiratoria grave de causa desconocida, el uso de VMNI puede permitir ganar el tiempo necesario para recabar información imprescindible acerca del diagnóstico causal, pronóstico, estado basal del paciente o adecuación del esfuerzo terapéutico. Así, en aquellos pacientes con disnea moderada-grave, taquipnea y signos de trabajo respiratorio, se puede iniciar VMNI, siempre y cuando no existan contraindicaciones para ello o indicación de intubación urgente inmediata. Posteriormente y con la mayor celeridad posible debe continuarse con la evaluación diagnóstica que permita identificar el diagnóstico y el pronóstico de la enfermedad causante de la IRA. En cuanto a la valoración gasométrica (en caso de disponer de ella) una necesidad de FiO2 superior a 0,4 para conseguir adecuada oxigenación o la presencia de fallo ventilatorio agudo (pH<7,35 con PaCO2>45mm Hg) son indicativas de que el paciente puede ser tributario de VMNI2,3.
- •
El uso de VMNI con presión de soporte en pacientes EPOC con pH<7,35 y PaCO2> 45mm Hg reduce el riesgo de intubación, la estancia hospitalaria y la mortalidad respecto al tratamiento médico estándar4–7. Por el contrario, el beneficio en las agudizaciones que cursan sin acidosis respiratoria no ha sido establecido8,9. Se sugiere también que puede ser utilizada en el ámbito prehospitalario de forma segura siguiendo las recomendaciones del punto anterior10.
- •
El uso de soporte de presión positiva (CPAP o VMNI con presión de soporte) reduce la tasa de intubaciones en pacientes con edema agudo de pulmón cardiogénico (EAPc) y se acompaña también de una reducción en la mortalidad11. Respecto a la comparación de ambas modalidades, CPAP o VMNI con presión de soporte, no existen datos que avalen la superioridad de una respecto de la otra en cuanto a la evolución, aunque los pacientes tratados con VMNI parecen mejorar algunas variables clínicas de forma más rápida12–14. También es eficaz la utilización de CPAP en el EAPc en el ámbito prehospitalario, demostrándose una reducción de la necesidad de intubación15.
- •
Se recomienda el uso de VMNI en pacientes con descompensación de síndrome de hipoventilación asociado a obesidad (SHO) y presencia de acidosis respiratoria16.
- •
Es posible, individualizando en cada situación, y en condiciones de muy estrecha vigilancia de la respuesta (idealmente en entorno de Unidades de Intensivos) una prueba corta de VMNI en pacientes con agudización grave de asma17.
- •
Es recomendable una prueba de VMNI en pacientes con IRA por neumonía y comorbilidad cardiorespiratoria, mientras que no es aconsejable en pacientes sin dicha comorbilidad18.
- •
La VMNI precoz puede ser una alternativa a considerar en pacientes con inmunosupresión e IRA, si bien faltan estudios comparativos de mejor calidad con TAFCN.
- •
No se puede recomendar el uso de la VMNI en la IRA hipoxémica secundaria a distrés respiratorio (SDRA)19, salvo en casos leves y en entorno de monitorización de Unidades de Cuidados Intensivos20.
- •
Se sugiere el uso de VMNI en pacientes con indicación de limitación terapéutica para intubación y ventilación invasiva, si pertenecen a alguno de los grupos diagnósticos en los que se documenta eficacia de la VMNI, siempre y cuando, además, mejore la sensación de disnea durante el procedimiento21. Existe la posibilidad de administrar VMNI como tratamiento coadyuvante para la disnea en pacientes paliativos22,23.
- •
En pacientes con insuficiencia respiratoria crónica secundaria a patología neuromuscular y de caja torácica, se recomienda en caso de exacerbación de cualquier causa (especialmente infecciones), el soporte con VMNI para prevenir y tratar la acidosis respiratoria24.
- •
Se sugiere el uso de VMNI en pacientes con IRA y traumatismo torácico en ausencia de neumotórax no drenado9.
- •
Se puede plantear la utilización de VMNI en pandemias virales, en pacientes cuidadosamente seleccionados, en centros con experiencia y en un ambiente protegido de habitaciones con presión negativa25,26. Existen asimismo unas sugerencias de indicación y procedimiento específicas para la infección por SARS-Cov227.
- •
En el contexto de weaning de la ventilación mecánica invasiva (VMI), los enfermos que presentan factores de riesgo de fracaso de la extubación (especialmente enfermos con EPOC), una estrategia de aplicación de VMNI postextubación reduce la tasa de reintubaciones, especialmente si se combina con TAFCN. Sin embargo, en poblaciones sin dichos factores de riesgo, la VMNI no puede recomendarse como estrategia genérica de desconexión de la ventilación mecánica. En cuanto a la IRA post extubación, debería tratarse con VMI28.
- •
Se sugiere la utilidad de la VMNI en la IRA postoperatoria abdominal y cardiotorácica, sin que se hayan descrito efectos adversos significativos a nivel de las anastomosis quirúrgicas29,30.
- •
Se recomienda el uso de la VMNI en cualquier paciente en edad pediátrica con IRA global sin contraindicaciones31,32.
- •
Se recomienda el uso de VMNI en pacientes en edad pediátrica en cualquier situación que comporte alto riesgo de fallo en el destete de la VMI (incluyendo pacientes con patología neuromuscular), con la finalidad de evitar la reintubación31,32.
- •
Se recomienda una prueba de uso de VMNI en pacientes con IRA no hipercápnica moderada, sin fallos orgánicos asociados, así como también en pacientes inmunodeprimidos con IRA33–35.
- •
Se recomienda el uso de VMNI en pacientes con IRA moderada o grave asociada a infecciones víricas, principalmente bronquiolitis viral36–38.
- •
Se recomienda el uso de VMNI en pacientes en edad pediátrica con IRA en el contexto de crisis asmática grave39–41.
- •
Se recomienda que aquellos pacientes en edad pediátrica que utilicen VMNI a domicilio y precisen traslado al hospital por IRA se mantenga la VMNI durante dicho proceso de traslado.
- •
De forma genérica, todo neonato, nacido a término o prematuro, con patología respiratoria y aumento del trabajo respiratorio con alteración leve–moderada de la oxigenación y/o ventilación sería potencial candidato al tratamiento con VMNI42.
- •
A destacar su uso en la prematuridad: 1.- Estabilización inicial tras el nacimiento (< 32 semanas de EG y/o <1500 gramos de peso). 2.- Síndrome de distrés Respiratorio (patología propia del prematuro por déficit de surfactante). 3.- Prevención de IRA tras la extubación (< 30 sem de EG)43.
- •
Se recomienda la TAFCN como primera técnica de soporte respiratorio no invasivo en pacientes con neumonía grave y/o SDRA, frente a oxigenoterapia y VMNI en pacientes sin indicación directa de intubación orotraqueal19.
- •
Se sugiere que la TAFCN puede emplearse en pacientes con IRA e inmunosupresión44, aunque faltan estudios comparativos de mejor calidad frente a VMNI.
- •
Puede valorarse el uso de TAFCN tras la extubación programada en pacientes sin hipercapnia y con bajo riesgo de reintubación45.
- •
No puede recomendarse el uso rutinario de TAFCN para prevenir la reintubación en pacientes sin hipercapnia y con alto riesgo de reintubación, salvo si se combina con VMNI45,46.
- •
Puede considerarse el uso de la TAFCN como alternativa terapéutica a la VMNI en pacientes postoperados de cirugía cardiotorácica con insuficiencia respiratoria postoperatoria o con alto riesgo de reintubación47.
- •
Se sugiere el empleo de técnicas de preoxigenación con VMNI y/o TAFCN frente a la oxigenoterapia convencional en pacientes hipoxémicos que van a ser intubados de forma programada, con vistas a reducir el riesgo de hipoxemia peri-intubación. Las técnicas mixtas de VMNI más TAFCN deberían reservarse para pacientes severamente hipoxémicos y alto riesgo de desaturación precoz durante el procedimiento de intubación (paciente obeso mórbido)48,49.
- •
No puede recomendarse el uso de la TAFCN como terapia de inicio ni de rescate, para bronquiolitis leves-moderadas50,51, en planta de hospitalización para evitar ingresos en UCIP.
- •
No se recomienda el uso de la TAFCN en pacientes con broncoespasmo.
- •
En UCIP no se recomienda el uso de la TAFCN en lugar de la CPAP.
- •
La TAFCN se utiliza en aquellas patologías respiratorias con insuficiencia respiratoria leve-moderada. Hay evidencia y consenso en el destete de la CPAPn y el destete ventilatorio para evitar la reintubación en el paciente pretérmino> 28 semanas de EG52.
- •
De forma genérica, los pacientes candidatos a recibir SRNI deben estratificarse en función del riesgo de fracaso, en base a la patología que motivó su indicación y su situación clínica. Aquellos que presenten un alto porcentaje de fracaso y que, por tanto, merecen mayor dedicación y medios, deben ser valorados ya de inicio por un especialista que disponga de un entorno con una adecuada monitorización y disponibilidad inmediata para iniciar medidas de soporte vital avanzado.
- •
La dotación de personal de las unidades que proporcionan SRNI debe ser de una ratio médico-paciente no superior a 1:6 y enfermería-paciente no superior a 1:4. Deben contar además con monitorización continua mínima indispensable (pulsioximetría, ECG) las 24h sea cual sea el lugar donde se realice.
- •
Los ventiladores utilizados deberían ser específicos para VMNI y de fácil manejo, ya que suelen ser utilizados por personal con alto índice de rotación. También pueden emplearse los ventiladores de pacientes críticos siempre y cuando dispongan de algoritmos específicos para VMNI. No se recomienda el uso de ventiladores domiciliarios en paciente agudo, salvo en aquellos casos de pacientes con ventilación domiciliaria y que presenten buena evolución con su ventilador durante la fase aguda. En paciente en edad pediátrica y siempre que sea posible conviene utilizar equipos que estén homologados para adaptarse a pacientes hasta 5kg de peso. En neonatologia se recomiendan los generadores de flujo variable por encima de los de flujo continuo.
- •
La selección de la interfase es fundamental para el correcto desarrollo de la técnica, ya que es el elemento que con mayor frecuencia produce falta de confort y en un porcentaje elevado es causa de rechazo de la VMNI. En adultos y de forma genérica, las interfases de elección son las máscaras oronasales o las faciales totales. Es aconsejable tener preparadas varias alternativas, especialmente para aquellos pacientes que por sus características no se adaptan adecuadamente a la elegida inicialmente como teóricamente idónea. Existen durante la reciente pandemia por SARS-CoV2 experiencias positivas con casco o helmet, incluso con variantes de posición durante el procedimiento, como la combinación de VMNI y TAFCN con decúbito prono53,54. Por su parte, en neonatología, las interfases de elección son las cánulas binasales cortas.
- •
En VMNI se recomienda usar sistemas de humidificación activa, sin añadir resistencia ni espacio muerto al sistema. Esta recomendación es especialmente importante en los pacientes pediátricos en edad más temprana y en el neonato, en los cuales los altos flujos utilizados causan sequedad de la vía aérea y pueden dificultar el control de la temperatura corporal.
- •
En la VMNI en fase aguda se utiliza principalmente la ventilación controlada por presión (presión de soporte –PS-) por su capacidad de compensar fugas y facilidad de sincronización con el paciente55. Los objetivos de la programación del ventilador son proporcionar un volumen corriente superior a 300ml (o 5ml/Kg de peso ideal) y conseguir una frecuencia respiratoria (FR) espontánea menor de 25rpm en el paciente adulto. En paciente en edad pediátrica, el nivel de PS debe ser de alrededor de 4-5 cmH2O sobre el nivel de presión espiratoria (PEEP o EPAP). Una vez conseguida la tolerancia del paciente, el nivel de PS puede incrementarse en intervalos de 2cm H2O hasta lograr disminuir el trabajo respiratorio. En el paciente neonatal, la presión inspiratoria suele ajustarse a valores unos 2-4 puntos por encima del nivel de PEEP, que a su vez suele ser de 5-6 cmH20, pudiendo variar en función del reclutamiento alveolar requerido y la tolerancia hemodinámica.
- •
El objetivo de programación de la TAFCN en el adulto se considera alrededor de los 45-50 l/min de flujo de gas. En cuanto a la oxigenación, debe programarse una FiO2 mínima para mantener la Sp02 alrededor de 93-94% - entre 88-89% en casos de enfermedad pulmonar crónica asociada -, y una temperatura de acondicionamiento alrededor de 37°C Para el seguimiento de su eficacia es útil el uso del índice ROX (SpO2/FiO2:FR). Un valor ≥ 4,88 se asocia a mayor probabilidad de éxito en el tratamiento del paciente56,57.
- •
En pediatría, como regla general en lactantes menores de un año la TAFCN debe programarse a partir de los 2 L/min y deben ajustarse al peso corporal, con la fórmula de 2 L/kg/min hasta los 8-10kg de peso. En los pacientes en edad pediátrica mayores, los flujos deben ser siempre superiores a 6 l/min, pudiéndose utilizar incluso hasta 20 o 30 l/min, cercano a lo que sería 1 l/kg/min58 La FiO2 debe ajustarse para un objetivo de saturación periférica de oxigeno entre 92 y 97%. La temperatura, por defecto, se sitúa alrededor de 37°C para conseguir una humidificación óptima.
- •
En neonatología, la TAFCN se utiliza con un rango inicial de entre 4 a 8 L/min de flujo. Cuando se alcancen los objetivos clínicos y gasométricos puede iniciarse el descenso hasta 2 l/min, cuando ya se pueden retirar.
- •
En el paciente adulto, el control de la eficacia de la VMNI se basa en la monitorización de una serie de parámetros fisiológicos (nivel de conciencia, FR, frecuencia cardíaca -FC-, SaO2) y en la práctica de una gasometría de eficacia al cabo de una hora de la instauración de la terapia para determinar su eficacia. La monitorización del volumen corriente en modalidad de presión es asimismo importante para detectar y tratar tanto la hipoventilación como los volúmenes corrientes elevados, que pueden empeorar la lesión pulmonar inducida por el ventilador59 Puede ser de utilidad también la monitorización avanzada mediante las curvas de flujo y presión tiempo proporcionadas por el ventilador en caso de disponer de ellas.
- •
Se distinguen tres tipos de fracaso de la VMNI, el fracaso inmediato (dentro de la primera hora de la técnica y atribuible a mala tolerancia), el precoz (entre la hora 1 y la 48, siendo el tipo más frecuente de los tres) y el tardío (después de las 48 horas y atribuible mayormente a infección nosocomial).
- •
Además de la práctica de la gasometría a la hora del inicio de la técnica, la valoración de la eficacia a las 4-6h es un buen indicador del éxito/fracaso de la VMNI. Si no se produce mejoría clínica (mejoría de encefalopatía, reducción del trabajo respiratorio, reducción de la frecuencia respiratoria, reducción de la escala de disnea) o gasométrica (persistencia o aumento de la acidosis respiratoria o de la hipoxemia, según el tipo de insuficiencia respiratoria) en este periodo de tiempo, debe considerarse que la técnica ha fracasado.
- •
El fracaso de la VMNI debe implicar un cambio de estrategia, que incluye inmediatamente la consideración de la intubación orotraqueal, especialmente en los pacientes con IRA hipoxémica. En determinadas situaciones y teniendo siempre en cuenta que cualquier maniobra que prolongue de forma innecesaria la duración del fracaso de la VMNI puede conllevar un aumento de la mortalidad, pueden plantearse modificaciones en la programación del ventilador, interfase, tratamiento médico administrado, etc.
- •
En pacientes con EPOC y acidosis respiratoria se puede retirar la VMNI directamente cuando el episodio agudo se haya resuelto, se haya normalizado el pH y exista una mejoría tanto de la PaCO2 como de la condición clínica general, con tolerancia de la respiración espontánea sin soporte ventilatorio60. Si persiste la hipercapnia (> 56mm Hg) tras 2-4 semanas del alta hospitalaria se recomienda valorar instaurar ventilación crónica domiciliaria61.
- •
En pacientes con patología neuromuscular o de caja torácica, la VMNI puede precisar una retirada más progresiva, siendo dificultosa en muchas ocasiones la retirada total y debiéndose transicionar a VMNI crónica domiciliaria.
- •
En pacientes con síndrome de hipoventilación obesidad es recomendable continuar con VMNI nocturna durante algunos días adicionales y evaluar también la posible indicación de CPAP o ventilación nocturna domiciliaria a largo plazo.
- •
En el paciente en edad pediátrica, los objetivos no difieren con respecto al paciente adulto, siendo los criterios clínicos de mejora a la 1-2 horas de inicio de la técnica: disminución de FC, FR, que deben ser, acorde a la edad del paciente, inferiores al momento en el que se inició la técnica, mejora del trabajo respiratorio (disnea) y disminución de la actividad de los músculos respiratorios accesorios. Se usan también una serie de escalas de dificultad respiratoria (Pulmonary Score, Wood-Dowes, Tussing, etc) para valorar la evolución.
- •
La retirada de VMNI en el paciente en edad pediátrica depende de la patología motivo de la indicación. Así, en asma suelen requerir soporte por espacio de 48-72 horas, en las bronquiolitis entre 5 y 7 días y en los pacientes neuromusculares puede requerirse soporte crónico no invasivo posterior en domicilio.
- •
En neonatología es especialmente importante para el éxito de la técnica la colocación del paciente, con una adecuada alineación de la vía aérea. Se consideran indicativos de fracaso la necesidad de una FiO2 de 0,4-0,5 para alcanzar la saturación diana en función de su edad gestacional, la disnea progresiva y las pausas de apnea, además de la persistencia de acidosis respiratoria.
- •
Para la retirada de VMNI en el paciente neonatal, se aconseja que los requerimientos de oxígeno estén por debajo de 0,4 para mantener una adecuada oxigenación, que no presente apneas y/o bradicardias, y ausencia de trabajo respiratorio62.
Se han elaborado unas recomendaciones de práctica clínica con respecto al uso actual de la VMNI /TAFCN para la insuficiencia respiratoria aguda en el paciente adulto y en edad pediátrica/neonatal. El manejo clínico de la insuficiencia respiratoria aguda del enfermo adulto y pediátrico-neonatal debe tener en cuenta la heterogeneidad de los escenarios clínicos con respecto a las indicaciones, estratificación y seguimiento para el empleo de la VMNI y la TAFCN. Las recomendaciones recogidas en este documento reflejan por primera vez el grado de acuerdo entre las principales sociedades científicas y proporciona una herramienta de trabajo actualizada para todos los médicos encargados del manejo de los enfermos adultos y pediátricos-neonatales con insuficiencia respiratoria aguda que permiten disminuir la variabilidad clínica en la asistencia de estos enfermos.
Es altamente probable que algunas de estas recomendaciones se modifiquen a lo largo del tiempo con la generación o consolidación del conocimiento científico en este campo, especialmente en lo que respecta al papel de la VMNI y la TAFCN frente a otras tecnologías emergentes como la oxigenación y extracción extracorpórea de CO2. Es por tanto necesario un enfoque sistemático, dinámico y holístico para mejorar el manejo de este problema tan prevalente y reducir así la importante carga de atención médica en el ámbito hospitalario que permita mejorar los desenlaces clínicos de los enfermos.
De acuerdo con los autores y los editores este artículo se ha publicado en Archivos de Bronconeumología (https://doi.org/10.1016/j.arbres.2020.08.013).