Los nuevos tratamientos frente a diversas neoplasias hematológicas han mejorado el pronóstico de estas enfermedades al ampliar sus opciones terapéuticas. Sin embargo, estos fármacos no están exentos de efectos secundarios y sus complicaciones pueden llegar a poner en riesgo la vida del paciente. Considerando los potenciales peligros que pueden presentar, es necesario plantearse si su uso implica protocolizar el ingreso de los pacientes considerados de riesgo en la Unidad de Cuidados Intensivos (UCI), para garantizar una vigilancia y monitorización estrictas.
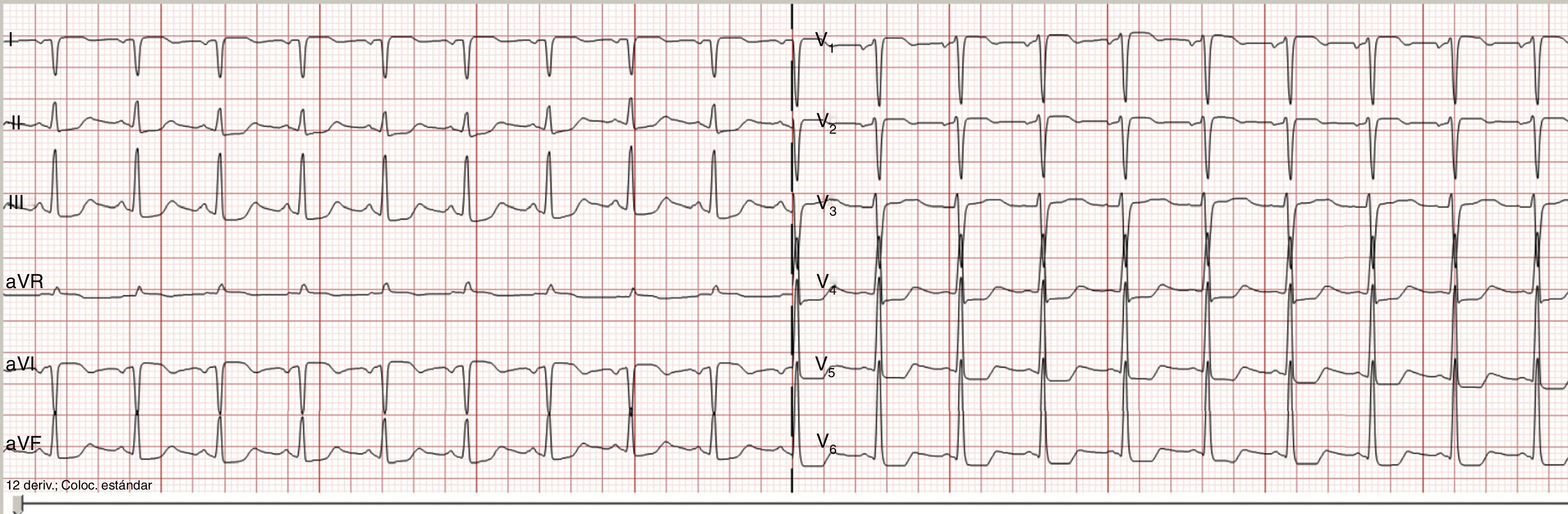
Presentamos el caso de un varón de 56 años con mieloma múltiple, sin otros antecedentes clínicos de interés ni cardiopatía previa asociada que, tras la administración de tratamiento quimioterápico con carfilzomib (Kyprolis®), sufrió una parada cardiorrespiratoria. El paciente fue diagnosticado en el 2003 de mieloma múltiple IgG estadio inicial IIIA, ISSI, y recibió radioterapia, quimioterapia, rescate con células progenitoras hematopoyéticas y posterior consolidación con trasplante autógeno. Se le realizaron 2estudios ecocardiográficos transtorácicos en el 2011 y 2012 que mostraban una insuficiencia mitral y tricúspide leve, sin otras alteraciones relevantes. Tras remisión completa, en el 2012 se observó progresión biológica; se le administró nuevo ciclo de tratamiento quimioterápico, a pesar de lo cual se constató un aumento progresivo del componente monoclonal, con múltiples focos hipermetabólicos correspondientes a infiltración tumoral; se inició tratamiento con pomalidomida, dexametasona y ciclofosfamida. Al no obtenerse respuesta con dicho tratamiento y observar progresión de la enfermedad, se planteó como terapia alternativa la administración de carfilzomib, lenalidomida y dexametasona (KRd). Sin estudio ecocardiográfico previo se inició tratamiento con carfilzomib. El esquema de dosis utilizado fue de 20mg/m2 los días 1 y 2 del ciclo y 27mg/m2 los días 8, 9, 15 y 16. Recibió un primer ciclo sin complicaciones y fue durante la infusión del segundo ciclo, 28 días después, cuando presentó disnea súbita y síndrome febril en la segunda dosis, que precisó ingreso en el Servicio de Hematología. Clínicamente hipotenso, mal perfundido y con insuficiencia respiratoria aguda, se realizó TC craneal y angio-TC torácica que descartaron embolia pulmonar y enfermedad cerebral, y ecocardiografía en la que se observó una insuficiencia mitral leve-moderada y una válvula tricúspide con insuficiencia leve que permitió estimar una presión sistólica de la arteria pulmonar de 37mmHg. Se inició tratamiento antibiótico empírico, sueroterapia y oxigenoterapia con mejoría clínica. Sin embargo, a las 3 h presentó edema agudo de pulmón y posterior parada cardiorrespiratoria. Se realizaron medidas habituales de reanimación cardiopulmonar durante 5 min, con administración de 1mg de adrenalina y posterior recuperación de ritmo propio en fibrilación auricular; se le trasladó a UCI. En la radiografía de tórax se confirmó el diagnóstico de edema agudo de pulmón observando un patrón «en alas de mariposa», redistribución perihiliar y cardiomegalia. En la ECG se constató un descenso del segmento ST en la cara inferolateral (fig. 1), sin movilización enzimática significativa (troponinaT 53ng/l). No se realizó coronariografía, ya que el paciente no refirió en ningún momento dolor torácico sugestivo de cardiopatía isquémica y los cambios electrocardiográficos se pusieron en el contexto de la parada cardiorrespiratoria. El paciente recibió tratamiento con furosemida, corticoides y antibioterapia, con buena recuperación neurológica, hemodinámica y respiratoria, sin observar en la monitorización nuevos cambios electrocardiográficos, por lo que recibió el alta a las 48 h de su ingreso. Se consideró como probable etiología del evento cardiaco la hipótesis de un efecto secundario por carfilzomib. En los días posteriores sufrió nuevo deterioro clínico por progresión de su enfermedad hematológica. El paciente rechazó continuar con el tratamiento médico y falleció en la planta de Hematología 10 días después.
El carfilzomib, aprobado en el 2012, es un potente inhibidor de segunda generación de la actividad tipo de quimiotripsina del proteasoma 20 S de uso en el mieloma múltiple refractario y en otras enfermedades como la macroglobulinemia de Waldenstrom, el linfoma, la amiloidosis y algunas enfermedades autoinmunes1. Su administración se realiza por vía intravenosa en unos 10 min; se recomienda la premedicación con dexametasona para minimizar la intensidad de síntomas frecuentes como fiebre, náuseas, fatiga o cefalea2. Presenta un amplio espectro de efectos adversos, desde reacciones transfusionales hasta complicaciones tanto hematológicas (trombocitopenia y anemia) como no hematológicas3. El estudio PX–171–007 señaló que una alta dosis de carfilzomib da como resultado una mejor eficacia que la dosis aprobada4 de 27mg/m2, sin embargo, dosis más elevadas incrementan la probabilidad de presentar eventos adversos cardiovasculares. El carfilzomib se caracteriza por presentar bajas tasas de neuropatía periférica —complicación frecuente con otros regímenes terapéuticos basados en el bortezomib—, pero estudios y series de casos recientes indican que el tratamiento con inhibidores del proteasoma puede estar asociado con graves eventos cardíacos5. En los ensayos iniciales se registraron episodios de fallo cardíaco con insuficiencia cardíaca congestiva, edema pulmonar y disminución de la función del ventrículo izquierdo en un 7% de los pacientes y los acontecimientos adversos descritos más comunes fueron las arritmias, la mayoría de ellas benignas y de origen supraventricular6. Publicaciones más recientes informan de un alto número de complicaciones cardiacas. Danhof et al.7 refieren efectos adversos graves en el 50% de los pacientes y fallo cardiaco izquierdo en el 23%. El riesgo de eventos cardiacos adversos fue más frecuente en pacientes que habían recibido concomitantemente doxorrubicina o radioterapia torácica, como es el caso aquí presentado, por lo que se recomienda una cuidadosa selección de los pacientes y un estrecho seguimiento de la población considerada de riesgo. En la tabla 1 se muestran los efectos adversos y los factores de riesgo para presentar toxicidad cardiaca.
Efectos adversos cardiovasculares del carfilzomib y factores de riesgo para la presentación de toxicidad cardiaca
| Eventos adversos, en porcentaje | Factores de riesgo para toxicidad cardíaca |
|---|---|
| Cardiovasculares | |
| Arritmia cardiaca (13,3%) | Enfermedad cardiovascular previa |
| Fallo cardíaco (7,2-23%) | Tratamiento combinado con doxorrubicina |
| Enfermedad coronaria (3,4%) | Radioterapia torácica |
| Miocardiopatía (1,7%) | |
| Disnea (42,2%) | |
| Hematológicos | |
| Anemia (46,8%) | |
| Trombocitopenia (36,3%) | |
| Neutropenia (20,7%) | |
| Otros | |
| Neumonía (12,7%) | |
| Aumento de los niveles de creatinina sérica (24,1%) | |
| Insuficiencia renal aguda (5,3%) | |
| Hiperglucemia (12%) | |
| Alteraciones hidroelectrolíticas: hipopotasemia (14%), hipomagnesemia (14%), hipercalcemia (11%) | |
Se ha postulado que los efectos sobre el sistema cardiovascular puedan estar mediados por varios mecanismos derivados de la inhibición del proteasoma. El más importante es la acumulación de proteínas dañadas y no degradadas en el interior de los miocitos, las cuales pueden ser tóxicas para su función8. En modelos animales se ha demostrado que induce disfunción ventricular y, a nivel estructural, se observa agrandamiento y vacuolización de los cardiomiocitos, pleomorfismo mitocondrial, fibrosis intersticial perivascular e inducción de apoptosis9. Además, la inhibición del proteasoma genera cambios en la actividad de la óxido nítrico sintasa endotelial (eNOS) y en los niveles de óxido nítrico, lo que conduce a la vasodilatación y disfunción endotelial asociadas con hipertensión arterial y enfermedad coronaria, entre otros. En estudio se encuentran fármacos como el apremilast que por su efecto protector frente a la cardiotoxicidad inducida por el carfilzomib desempeña un papel clave en la modulación del estrés oxidativo10.
El paciente oncohematológico es un paciente frágil que requiere un manejo muy complejo. Prevenir la aparición de eventos adversos graves en los pacientes considerados de riesgo mediante un ingreso corto para monitorización electrocardiográfica y cardiorrespiratoria podría ser una necesidad y una nueva oferta en la cartera de servicios en la UCI. Esto requerirá la realización de protocolos con participación multidisciplinar (Farmacología Clínica, Hematología y Medicina Intensiva) para seleccionar a aquellos pacientes considerados de alto riesgo y que se pudieran beneficiar de esta monitorización, dado el número limitado de camas de UCI.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.