INTRODUCCIÓN
El bacilo de Calmette-Guérin (BCG) es una cepa viva atenuada de Mycobacterium bovis, una especie del grupo M. tuberculosis complex. El tratamiento con instilaciones de BCG es más efectivo que la mayoría de agentes quimioterápicos intravesicales en la profilaxis y tratamiento del carcinoma superficial de vejiga y el carcinoma in situ. Sin embargo, el tratamiento con BCG provoca más reacciones locales y sistémicas, algunas de gravedad extrema1.
Presentamos un caso de infección diseminada de M. bovis secundario a la instilación intravesical de BCG en el que el ADN de la micobacteria fue identificado por técnica de reacción en cadena de la polimerasa (PCR) en muestras de sangre y broncoaspirado (BAS).
OBSERVACIÓN CLÍNICA
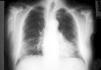
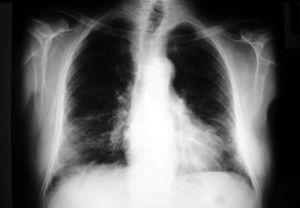
Se trata de un paciente de 75 años que el año anterior fue diagnosticado de carcinoma vesical en estadio I, al que se le practicó resección transuretral y fue tratado con instilaciones intravesicales de BCG. No se realizó profilaxis antituberculosa previa al tratamiento con BCG intravesical. El paciente recibió la última instilación dos semanas antes del ingreso; desde entonces presentó episodios de fiebre y escalofríos, motivo por el que fue tratado en otro hospital empíricamente con ciprofloxacino por sospecha de infección urinaria y con isoniacida debido al antecedente del tratamiento con BCG. A los tres días de ser dado de alta consultó de nuevo por fiebre, escalofríos y disnea progresiva. Ingresó en la Unidad de Cuidados Intensivos (UCI) de nuestro hospital por insuficiencia respiratoria aguda. La temperatura axilar era de 37,5º C, el pulso 65 x´, la presión arterial de 135-55 mmHg y la frecuencia respiratoria de 24 x´. En la exploración física destacaban crepitantes en ambas bases pulmonares y hepatomegalia de dos traveses. El sedimento de orina no fue patológico. La analítica mostraba un hematocrito, leucocitos y plaquetas normales, bilirrubina total normal, GPT 203 U/l, GOT 165 U/l, fosfatasa alcalina 249 U/l, GGT 148 U/l y LDH 1026 U/l, con el resto de parámetros bioquímicos normales. La GSA con FiO2 al 50%: pH 7,48, pO2 63 mmHg, pCO2 27,6 mmHg, HCO3 20,9 mmol/l, exceso de base -0,5 mmol/l, saturación arterial de O2 93,7%. En la radiografía de tórax se apreciaba un patrón miliar intersticial (fig. 1).
Figura 1. Radiografía de tórax donde se observa un patrón miliar.
Se administró tratamiento empírico con antibioticoterapia de amplio espectro. Los antecedentes de la administración de BCG intravesical y la afectación pulmonar y hepática hicieron sospechar de una complicación sistémica por BCG, por lo que se inició tratamiento antituberculoso con isoniazida, rifampicina, etambutol y metilprednisolona al cabo de 48 horas. Se suspendió el resto de antibióticos una vez obtenido el resultado de los cultivos, que fue negativo. La tomografía axial computarizada (TAC) torácica revelaba un patrón en vidrio esmerilado bilateral sin adenopatías hiliares. Se practicó fibrobroncoscopia evidenciando signos inflamatorios difusos en el árbol bronquial. El paciente presentó alucinaciones visuales sin focalidades en la exploración neurológica, por lo que se realizó punción lumbar obteniendo un líquido cefalorraquídeo (LCR) normal. La biopsia de médula ósea mostró una estructura trabecular normal, con una médula ósea normocelular con histiocitos epitelioides agrupados formando microgranulomas. La tinción de Ziehl-Neelsen, el cultivo de Löwenstein-Jensen y cultivos convencionales de sangre, orina, broncoaspirado, cepillado bronquial, LCR y médula ósea fueron negativos.
El laboratorio de nuestro hospital no dispone de medios líquidos para el cultivo de micobacterias, por lo que se envió una muestra de BAS al Hospital de la Santa Creu i Sant Pau de Barcelona, siendo negativo el resultado. Se enviaron muestras de sangre, BAS y LCR al laboratorio del Hospital Joan XXIII para efectuar la técnica de PCR in-house. La sensibilidad de la técnica es aproximadamente de 1 ng/µl de ADN de M. tuberculosis complex.
El ADN de M. tuberculosis complex por PCR fue positivo en sangre y en el BAS, y negativo en el LCR. La función hepática se normalizó; sin embargo hubo un empeoramiento de la insuficiencia respiratoria desarrollando un síndrome de distrés respiratorio agudo (SDRA). En la radiografía de tórax aparecieron infiltrados alveolointersticiales bilaterales. Precisó intubación orotraqueal y ventilación mecánica con FiO2 del 100% y presión positiva al final de la espiración (PEEP) elevada. No presentó deterioro hemodinámico ni hubo alteraciones de la coagulación. A pesar del tratamiento el paciente sufrió exitus por fallo multiorgánico a los 28 días del ingreso.
DISCUSIÓN
En 1976 Morales et al2 demostraron la eficacia de la administración de BCG intravesical en el tratamiento del carcinoma superficial de vejiga. El mecanismo de acción no es del todo conocido, aunque se cree que los efectos antitumorales son debidos a la estimulación de la inmunidad no específica que provoca la destrucción tumoral. Lamm et al3 evaluaron las complicaciones de este tratamiento en 2.602 pacientes. Los efectos secundarios locales más frecuentes fueron: cistitis (91%), hematuria macroscópica (1%), espasmo vesical (0,2%), prostatitis granulomatosa (0,9%), epidídimo-orquitis (0,4%) y obstrucción ureteral (0,3%). Los efectos sistémicos fueron: fiebre alta (mayor de 39º C [2,9%]), rash (0,3%), artralgia y artritis (0,5%), y de mayor gravedad, absceso renal (0,1%), neumonitis granulomatosa y/o hepatitis (0,7%), citopenia (0,1%) y sepsis (0,4%).
La etiopatogenia de la afectación sistémica está en controversia. Unos autores opinan que se trata de una diseminación de BCG, mientras que otros defienden un mecanismo de hipersensibilidad. La mayoría de autores sugiere que la afectación sistémica está causada por una reacción de hipersensibilidad tipo IV a la BCG, basándose en la negatividad de la tinción Ziehl-Neelsen y los cultivos3-5. Otros autores defienden la teoría de la infección sistémica mediante siembra hematógena a partir de la vejiga1,6-8. Los factores que orientan al diagnóstico de diseminación de la infección son la tinción o cultivo de micobacterias positivos y la presencia de granulomas no caseificantes en lugares distantes.
Proctor et al7 publican un caso de hepatitis granulomatosa en que demuestran infección al obtener una tinción de Ziehl-Neelsen positiva en la biopsia hepática. Asimismo, McParland et al1 constatan neumonitis por infección en un paciente al obtener un cultivo de biopsia pulmonar positiva para M. bovis. No obstante, la ausencia de aislamiento del germen no descarta una etiología infecciosa, ya que el resultado está en función de múltiples factores, como el número de microorganismos presente, el método de transporte y técnicas de cultivo de la muestra8. Leebeek et al6 describieron un caso de hepatitis granulomatosa por infección de BCG. El examen histológico de la biopsia hepática mostró granulomas epitelioides no caseificantes. La tinción de Ziehl-Neelsen y los cultivos Löwenstein-Jensen de orina, sangre, médula ósea e hígado fueron negativos. Sin embargo, la técnica de PCR realizada en la muestra hepática fue positiva para ADN micobacteriano.
En el paciente de nuestro caso, aunque la tinción y el cultivo de micobacterias fueron negativos, se hallaron granulomas no caseificantes en la biopsia de médula ósea. Estos resultados hicieron barajar los diagnósticos de siembra hematógena y de reacción de hipersensibilidad al BCG. En muestras de sangre y BAS del paciente se detectó ácido nucleico del grupo de M. tuberculosis complex por la técnica de PCR. En este caso lo más probable es que se trate de una infección diseminada por M. bovis, aunque no se puede afirmar ya que no fue aislado en ninguno de los cultivos. Cabe mencionar que un resultado positivo de esta técnica también podría ser debido a una infección o reactivación por M. tuberculosis u otra especie del grupo de M. tuberculosis complex.
La tinción de Ziehl-Neelsen es el procedimiento más fácil y rápido para evidenciar la presencia de micobacterias, pero con frecuencia el resultado es negativo. El cultivo de micobacterias sigue siendo el gold standard para la confirmación del diagnóstico de tuberculosis. Sin embargo, a pesar de la incorporación de los medios líquidos, es un método lento con un tiempo medio de 14 días para la detección de micobacterias. Asimismo, puede haber falsos negativos en caso de recogida o procesamiento de la muestra inadecuados.
La detección de ADN de la micobacteria por la técnica del PCR es rápida y, junto con la tinción y el cultivo, diferencia infección de hipersensibilidad. Esta técnica consiste en la amplificación de secuencias específicas de ácidos nucleicos que pueden ser detectadas mediante sondas de ácidos nucleicos.
Hay múltiples trabajos publicados que evalúan la sensibilidad de la técnica de la PCR para tuberculosis. Los resultados son muy variables en función del método utilizado, el diseño y el análisis de los estudios. En las muestras no respiratorias la sensibilidad varía, según los estudios, entre 53%-90% en comparación con el cultivo. La sensibilidad de la PCR en las muestras respiratorias, en referencia al cultivo, oscila entre el 75%-100%. Entre el 30%-60% de las muestras negativas al examen microscópico son positivas con la técnica de PCR. La especificidad de la PCR es del 98%-100%9.
Se recomienda suspender el tratamiento con BCG y administrar isoniacida 300 mg/d durante 3 meses en pacientes tratados con instilaciones de BCG intravesical que presenten fiebre superior a 39,5º C sin foco aparente que no cede con antitérmicos al cabo de 12 horas. En el caso de la neumonitis granulomatosa o hepatitis se recomienda la suspensión de las instilaciones de BCG y el tratamiento con isoniacida 300 mg, rifampicina 600 mg y etambutol 1.200 mg diarios durante 6 meses. La sepsis es la complicación más grave y puede asociarse a shock, coagulación intravascular diseminada o fallo multiorgánico. Es obligatoria la suspensión de la administración con BCG, y establecer tratamiento con isoniacida, rifampicina y etambutol, añadiendo 500 mg de cicloserina dos veces al día por vía oral durante 5 días. Se recomienda el uso combinado de corticosteroides (40 mg de prednisolona al día) con tuberculostáticos, por aumentar la ratio de supervivencia1. Las indicaciones de la profilaxis con 300 mg diarios por vía oral durante 3 días de isoniacida se describen en la tabla 1. El tratamiento con BCG está contraindicado en pacientes con tuberculosis activa, inmunodeprimidos y gestantes11.
Este caso es muy instructivo en cuanto al aspecto diagnóstico y la actitud terapéutica. Se demuestra la utilidad de las técnicas de detección de micobacterias por PCR en el diagnóstico de infección. En todo paciente con sepsis tras la instilación intravesical de BCG se debe sospechar infección sistémica por M. bovis. Ante una afectación sistémica tras la instilación de BCG se debe iniciar el tratamiento antituberculoso lo más pronto posible, mientras se espera el resultado de las pruebas de detección de la micobacteria, puesto que un retraso en el inicio podría conducir a la muerte del paciente. Se recomienda la asociación de cicloserina y corticoides en casos graves.
AGRADECIMIENTOS
Queremos expresar nuestro agradecimiento al Dr. Jaume Benages, del Servicio de Urología, y al Dr. Xavier Clivillé, del Servicio de Microbiología.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses
Correspondencia: Dr. Y. del Castillo.
Unidad de Cuidados Intensivos.
Hospital de Sant Pau i Santa Tecla.
Rambla Vella, 14.
43003 Tarragona. España.
Correo electrónico: ucista@sv.ftecla.es
Manuscrito aceptado el 27-I-2005.