La detección y el tratamiento precoces de la isquemia son el objetivo principal de los cuidados intensivos neurológicos. El encéfalo representa sólo el 2% del peso corporal total, pero recibe el 15% del volumen minuto cardíaco, y es responsable del 15%-20% del consumo de oxígeno del organismo1. Esto es debido al desequilibrio entre unos elevados requerimientos de nutrientes (especialmente glucosa y oxígeno) y una incapacidad de almacenamiento, lo que se traduce en una especial sensibilidad a la isquemia.
En el paciente críticamente enfermo la isquemia cerebral está presente en numerosas situaciones que van desde la forma focal incompleta del ictus, de la hemorragia subaracnoidea con vasoespasmo o del traumatismo craneoencefálico, hasta la presentación de la isquemia global completa de la parada circulatoria cerebral, pasando por formas de isquemia global incompleta características de la hipotensión o la hipoxemia intensas, o del escaso flujo sanguíneo cerebral (FSC) obtenido durante las maniobras de resucitación cardiopulmonar1. Estos eventos actúan sobre una circulación cerebral intacta o, más frecuentemente, afectada previamente por los factores de riesgo prevalentes (edad avanzada, tabaquismo, hipertensión arterial, dislipemia, diabetes mellitus o cardiopatía) o emergentes (foramen oval permeable, anticuerpos antifosfolípido, microangiopatía, etc.)2.
El objetivo de cualquier técnica de monitorización cerebral es la detección precoz de la isquemia, antes de que su magnitud y duración lleven al desarrollo de un infarto irreversible. Para ello, se dispone de diversas técnicas de medición que pueden ser agrupadas en tres tipos:
1. De la perfusión cerebral, registrando directamente el flujo sanguíneo cerebral con técnicas de medicina nuclear (tomografía por emisión de positrones [PET] y tomografía por emisión de fotón simple [SPECT]) o de láser-doppler, o infiriéndolo desde el conocimiento de su velocidad (ultrasonidos) o de la presión intracraneal.
2. De la extracción de oxígeno, registrando la saturación yugular venosa o tisular de oxígeno.
3. De la actividad cerebral, registrando la exploración clínica, el electroencefalograma, el índice biespectral o la entropía y los potenciales evocados somatosensoriales o auditivos3.
La «neurosonología» es el empleo de los ultrasonidos en el sistema nervioso central, que son vibraciones, generalmente inaudibles por el ser humano, de frecuencia superior a los 20.000 ciclos por segundo (0,2 MHz). Los ultrasonidos habitualmente utilizados en medicina tienen frecuencias entre 0,5 y 20 MHz (a mayor frecuencia, menor penetración en los tejidos), siendo de 0,5 a 4 MHz los más utilizados en neurosonología. Sus usos incluyen: a) fines diagnósticos, como la ecografía (modos A, M, B, color, power, segundo armónico, tridimesional, etc.), el doppler (continuo o pulsado) o la asociación de ambos («dúplex» o «tríplex»)4; y b) fines terapéuticos, como la «ultrasonolisis» o «ultrasonotricia» sola o combinada con el empleo de medicamentos (por ejemplo, ultrasonotrombolisis)4,5.
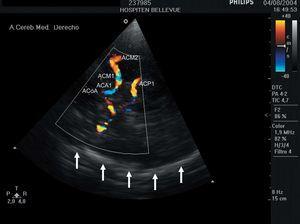
A través de las ventanas acústicas orbitaria, temporal (anterior, media y posterior) y occipital, y otras menos empleadas como la frontal, pueden identificarse la totalidad de los vasos intracraneales de mayor calibre que constituyen el denominado Polígono de Willis, en función de su posición (profundidad y angulación), al signo del espectro (positivo o negativo), a la velocidad de la sangre en su interior y a la realización de maniobras de compresión selectivas (en las técnicas «ciegas» espectrales) o a la visualización directa en la ecografía dúplex (fig. 1). Las técnicas neurosonológicas carecen de falsos positivos (aunque sí errores de interpretación), pero pueden tener falsos negativos al insonar la proximidad de una lesión sin llegar a alcanzarla. Muchas de estas limitaciones se reducen con el empleo de las técnicas de ecografía-doppler («dúplex»), que permiten la elección del punto de medición, o de los denominados «ecopotenciadores», partículas inocuas (habitualmente polisacáridos) que se administran de forma endovenosa y se fragmentan al contacto con los ultrasonidos aumentando la intensidad de la señal acústica4,6.
Figura 1. Imagen transversal del Polígono de Willis registrada con ecografía dúplex transcraneal. Las flechas señalan el cráneo contralateral a la insonación (en este caso izquierdo).
Las limitaciones principales de las técnicas de ultrasonidos son la dependencia del operador y la variabilidad de los registros, si bien ésta puede ser subsanada con la aplicación de procedimientos estrictos y con la calibración periódica de la técnica contrastando su sensibilidad y especificidad en cada centro contra el estándar de oro, en este caso la angiografía digital con contraste7. La meticulosidad en la realización del procedimiento reducirá también el porcentaje de «ausencia de ventana acústica» (habitualmente descrito como 5%-10%), lo que puede conseguirse también con el empleo de los ecopotenciadores4,6,7.
La primera aplicación clínica reconocida de los ultrasonidos en los cuidados intensivos neurológicos es la detección del vasoespasmo en las hemorragias (subaracnoideas, traumáticas, etc.) y de las estenosis intracraneales, mucho antes de que puedan ser detectados por las demás técnicas de medición del flujo sanguíneo cerebral, siendo además útiles para monitorizar la respuesta y registrar la reperfusión o el posible hiperaflujo8.
La observación de espectros con alto índice de pulsatilidad (entendido como la diferencia entre las velocidades sistólica y diastólica, dividida por la velocidad media), permite sospechar la presencia de una presión intracraneal aumentada (siempre y cuando sea superior a 20 mmHg). Esta característica sirve de base para la inclusión de los ultrasonidos entre las técnicas complementarias de la presión intracraneal en la monitorización neurológica del paciente crítico. La reactividad vascular cerebral, y por tanto la capacidad de autorregulación, puede ser también cuantificada de forma fiable mediante insonación unilateral o bilateral (con casco de monitorización) de la arteria cerebral media y registro de los cambios en la velocidad media del flujo sanguíneo ante estímulos tales como la apnea/hiperventilación o la administración de carbógeno 5% (CO2 5% + O2 95%), siendo un indicador muy sensible del estado de la microcirculación4,6-8.
La presencia de microembolismos, bien espontáneos desde focos embolígenos cardíacos, carotídeos o arteriales intracraneales, bien producidos durante la realización de intervenciones para cirugía cardíaca o vascular (invasivas o endovasculares), puede ser también observada en forma de sonidos transitorios de alta intensidad o HITS (high intensity transient signals), cuya velocidad será directamente proporcional a su peso, siendo más rápidos (y por tanto de menor duración en el espectro) los de contenido aterotrombótico, y más lentos (por lo tanto más anchos en el espectro) los correspondientes a microburbujas gaseosas. Esta última característica es empleada también para detectar la presencia de cortocircuito (shunt) de derecha a izquierda mediante el paso de microburbujas (creadas con agitaciones enérgicas y luego inyectadas) a través de un foramen oval permeable o, con menor frecuencia, de una fístula arteriovenosa pulmonar4,6,8,9.
Por último, junto a todo este amplio abanico de posibilidades para la utilización de los ultrasonidos como herramienta para ayudar a conseguir tanta «vida encefálica» como sea posible, el aplanamiento o la inversión diastólica del espectro ultrasónico y la precariedad/ausencia sistólica y diastólica, en presencia de una evidencia clínica concluyente, son criterios actualmente aceptados en el diagnóstico de confirmación de la «muerte encefálica»10.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses
Correspondencia: Dr. J.A. Álvarez Fernández.
Hospital Hospiten Rambla.
Avda. General Franco, 115.
38004 Santa Cruz de Tenerife. España.
Correo electrónico: jalvarez@hospiten.es
Manuscrito aceptado el 9-III-2005.