En la segunda mitad de los años sesenta se publicaron varios estudios que mostraban la relación entre la respiración con fracciones inspiradas de oxígeno elevadas y la destrucción de los neumocitos que tapizan la pared alveolar. Kistler et al1 encontraron en ratas a las que ponían en un atmósfera de O2 al 100% que a los dos días se había producido la lesión de los neumocitos tipo I, y la pared del alveolo se encontraba tapizada por unas membranas con el detritus de los neumocitos. Caldwell et al2, en un grupo de voluntarios que respiraron O2 al 100%, constataron que estos individuos mostraban alteraciones de la función pulmonar a las pocas horas. Un paso más es el que dan Nash et al3 al analizar el efecto combinado de las concentraciones elevadas de O2 y la ventilación mecánica. Las lesiones que se producen son el aumento del intersticio alveolar, la presencia de membranas hialinas, y más tarde la hiperplasia de las células que revisten el alveolo. Probablemente el hecho más notable es el de que estas lesiones fueron más frecuentes en los pacientes con insuficiencia respiratoria postraumática. Toda esta información se encontraba dispersa, y por eso resultó de un gran interés el trabajo que en 1967 publicaron Ashbaugh et al4. Estos autores describieron en 12 pacientes un nuevo síndrome caracterizado por disnea de comienzo súbito, hipoxemia refractaria a la administración de oxígeno y alteraciones de la mecánica respiratoria, que tenían diferentes patologías de base. Durante las siguientes dos décadas el síndrome permanece con la pobre definición que caracterizó su descripción original, manteniendo el nombre de síndrome del distrés respiratorio del adulto (SDRA), por su similitud al descrito en niños recién nacidos, caracterizado por la presencia de membranas hialinas y la reducción o ausencia del surfactante pulmonar. Las posibles etiologías habían incrementado su número, y la falta de criterios diagnósticos bien definidos hacía que resultase realmente difícil comparar los resultados de unos estudios con otros.
El segundo punto de referencia en la evolución del conocimiento del SDRA ha sido el estudio de Murray et al5 en el que hacen una clasificación según la gravedad del síndrome. Esta clasificación, basada en la extensión de la afectación radiológica, la intensidad de la alteración del intercambio gaseoso (desde una relación PaO2/FiO2 > 300 hasta relación PaO2/FiO2 <100), la PEEP necesaria y la distensibilidad pulmonar, representa el primer intento real de establecer diferencias en un síndrome todavía pobremente definido.
En 1994 la Conferencia de Consenso Americana-Europea sobre síndrome de distrés respiratorio agudo (AECC) se constituye con el objetivo de «llevar claridad y uniformidad a la definición de lesión pulmonar aguda y del síndrome de distrés respiratorio agudo». El resultado establecía como criterios diagnósticos la aparición aguda de infiltrados alveolares bilaterales en la radiografía de tórax, hipoxemia caracterizada por una relación PaO2/FiO2 inferior a 200 y la ausencia de hipertensión en la aurícula izquierda6.
Estos criterios, como se revisa en otro capítulo de esta monografía, adolecen de una definición clara sobre las condiciones necesarias para el registro en la clínica, y de hecho, la ausencia de insuficiencia cardíaca puede ser evidenciada mediante un catéter en la arteria pulmonar, o también se acepta la ausencia de criterios clínicos de insuficiencia cardíaca izquierda, que en muchos casos resulta muy difícil de valorar. Algo similar ocurre con el criterio del intercambio gaseoso, para el que no se especifica si ha de medirse con una FiO2 fija, o con un determinado nivel de PEEP.
De cualquier modo, estos criterios han venido siendo utilizados desde entonces, y ello nos ha permitido contar con una razonable uniformidad diagnóstica, que a su vez, permite comparar resultados, clasificar pacientes y diseñar ensayos clínicos7-10.
La parte negativa de esta mejora en el diagnóstico clínico del síndrome del distrés respiratorio agudo, mediante los criterios de la Conferencia de Consenso, está en que sólo recientemente han empezado a ser validados. Se ha desconocido cuál era su sensibilidad y su especificidad, y por tanto, si existe alguna modificación en los propios criterios o en la manera de registrarlos que puede mejorar su capacidad diagnóstica.
BASES HISTOLÓGICAS DE LA LESIÓN PULMONAR AGUDA
La alteración histológica que corresponde a la entidad clínica de lesión pulmonar aguda es el denominado daño alveolar difuso (DAD) que fue descrito por Katzenstein et al en 197611, y cuyos criterios se mantienen en uso.
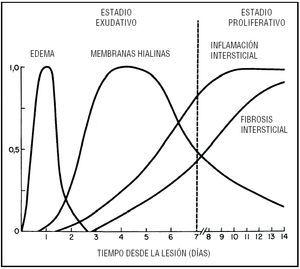
Aunque los fenómenos de destrucción y reparación se pueden solapar en el tiempo y, de hecho, es habitual que puedan verse al mismo tiempo en el pulmón de un paciente que ha sufrido uno de los estímulos nocivos y esté en el proceso de desarrollo de un SDRA, Katzenstein et al12 han descrito un esquema ya clásico que ayuda a entender la secuencia de aparición de las lesiones histológicas que caracterizan el SDRA (fig. 1).
Figura 1. Secuencia de aparición y evolución de las lesiones histológicas en el daño alveolar difuso a lo largo de los días. Las alteraciones que caracterizan al estadio exudativo y al proliferativo se superponen con el tiempo.
La aparición de lesiones pulmonares se ha dividido clásicamente en dos fases:
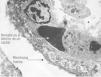
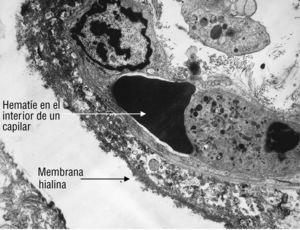
1) Fase exudativa. Presencia inicial de edema en el intersticio alveolo-capilar, seguido de destrucción de los neumocitos tipo I que tapizan los alveolos, sustituidos por la aparición de un material PAS positivo, denominado membranas hialinas. Estas membranas, que son el signo más distintivo del DAD, están constituidas por fibrina y detritus procedentes de la destrucción de los neumocitos tipo I, como se ve con microscopía electrónica (fig. 2).
Figura 2. Imagen de microscopía electrónica correspondiente a un pulmón con síndrome de distrés respiratorio agudo. La membrana basal del alveolo está recubierta por el material resultante de la destrucción de los neumocitos tipo I y que constituyen la membrana hialina.
2) Fase proliferativa. Caracterizada por la proliferación de los neumocitos tipo II que tapizan la superficie alveolar. En la microscopía electrónica se observan unos cuerpos lamelares que dan una imagen de reparación formada por células altas que recubren el interior del alveolo. Si el estímulo nocivo continúa y el proceso pulmonar mantiene su actividad se va a producir un depósito de colágeno en el intersticio, ensanchándolo, al tiempo que disminuye el tamaño de los alveolos y los separa, produciéndose una fibrosis pulmonar que caracteriza las fases avanzadas del DAD (fig. 3)12.
Figura 3. A) Alveolos de apariencia normal, de septos delgados; B) membranas hialinas revistiendo el alveolo; C) neumocitos tipo 2 de estructura cuboidea y prominentes que revisten el alveolo en la fase respiratoria; D) intersticio ensanchado con proliferación de fibroblastos.
Como es obvio, la reconstrucción de la secuencia cronológica de estas lesiones se ha realizado mediante material obtenido de biopsias pulmonares o autopsias de pacientes que sufrieron alguna de las patologías o agresiones que se consideran como factores de riesgo de desarrollar SDRA, aunque la cronología que establece como punto de partida la agresión no siempre puede estar bien definida, e incluso algunas veces no son episodios recortados en el tiempo. Saber cuándo es el momento en el que se ha desencadenado la secuencia de alteraciones que han dado lugar al inicio del SDRA no resulta siempre sencillo. Por tanto, el esquema es de una gran utilidad didáctica, pero no se puede asegurar que la cronología en días sea una evidencia constatada.
Recientemente hemos descrito la evolución cronológica de las lesiones pulmonares en un modelo de rata sometido a ventilación mecánica agresiva (volumen tidal de 35 ml/kg y ZEEP durante 45 minutos)13,14. Tras el estímulo nocivo los animales fueron despertados y extubados, falleciendo el 50% en las 6 horas siguientes. Se hizo un seguimiento de los animales supervivientes y se sacrificaron a las 48 horas, 72 horas y 7 días. El estudio histológico de los pulmones tras su sacrificio muestra una rápida reparación de las lesiones a las 48 horas, que ha finalizado por completo a las 72 horas. El proceso reparativo de proliferación de los neumocitos tipo II, que cubre la superficie alveolar para suplir a los neumocitos I destruidos, resulta rápido y muy eficaz, y el proceso de diferenciación hacia neumocitos tipo I permite recuperar la estructura inicial si el estímulo nocivo desaparece.
Hay que considerar que estos estudios están realizados en ratas y la cronología no puede ser extrapolada a los humanos. Sin embargo, este modelo animal, que no había sido previamente estudiado, nos abre una vía de gran interés para analizar la evolución del SDRA.
ORIGEN PULMONAR Y EXTRAPULMONAR
En el trabajo original de Ausbach et al4 la etiología de los 12 pacientes estudiados no era la misma para todos. En el estudio de Murray et al5, publicado en 1988, las tres partes de la definición de injuria del parénquima pulmonar incluían una que diferenciaba un proceso crónico o agudo, una segunda que incluía la severidad medida por el injury score propuesta por ellos, y una tercera referida a la etiología. Esta última proponía dos grupos, uno constituido por la neumonitis aspirativa, el embolismo graso, la ingestión de fármacos o productos químicos (por ejemplo heroína, paraquat, etc.), inhalación de gases tóxicos (humo, fosgeno, etc.) o los agentes infecciosos (Influenza A, Pneumocystis carinii). El segundo grupo asocia la aparición de SDRA a sepsis, transfusiones sanguíneas múltiples, pancreatitis aguda y coagulación intravascular diseminada.
Si analizamos estos datos con un cierto detenimiento podemos hallar dos aspectos de interés; uno es que los autores del artículo establecen ya una clara distinción entre etiología pulmonar o de lesión directa y etiología extrapulmonar o de lesión indirecta. El segundo aspecto es que no se refiere la neumonía bacteriana como factor etiológico pulmonar, y que tan sólo puede ser considerada como factor etiológico mediante la producción de sepsis, y por tanto como etiología indirecta. Este último punto es de gran importancia dado que el motivo más frecuente de confusión diagnóstica del SDRA va a ser la neumonía bacteriana.
La clasificación propuesta inicialmente por Murray et al5 posteriormente se ha incorporado en las conclusiones de la Conferencia de Consenso publicadas en 19944. La distribución de los factores etiológicos entre pulmonar o directo y extrapulmonar o indirecto se mantiene, y de igual modo la presencia de neumonía bacteriana como etiología indirecta, mediante el estímulo de la sepsis y/o el shock.
La importancia en la diferenciación entre origen pulmonar y extrapulmonar ha aumentado en los últimos años debido a la publicación de varios trabajos que establecen diferencias en el patrón radiológico, en la mecánica pulmonar o en la respuesta al tratamiento cuando el origen de la lesión pulmonar aguda es pulmonar o extrapulmonar.
Goodman et al15 encuentran que el patrón radiológico del SDRA de origen extrapulmonar es en vidrio deslustrado uniforme y simétrico, mientras que en el SDRA de origen pulmonar la imagen en vidrio deslustrado no es prevalente y los infiltrados son claramente asimétricos.
Gattinoni et al16 estudiaron a 12 pacientes con SDRA de origen pulmonar (11 pacientes con neumonía y uno con alveolitis hemorrágica) y a 9 pacientes con SDRA de origen extrapulmonar (3 pacientes politraumatizados, 3 pacientes con peritonitis, 2 pacientes con infarto intestinal y uno con shock hemorrágico). A todos se les aplicaron diferentes niveles de PEEP y se analizaron los cambios en la mecánica respiratoria encontrando que los cambios son consistentes con una prevalencia de consolidación en los casos de SDRA de origen pulmonar y prevalencia de edema y colapso alveolar en el SDRA de origen extrapulmonar.
Lim et al17, al analizar la respuesta al prono de un grupo de 31 pacientes con SDRA, encuentran que en la fase inicial del síndrome los casos de origen pulmonar y los de extrapulmonar responden de un modo diferente a la posición en prono en cuanto al tiempo en el que se producen los cambios en la oxigenación, los cambios en la mecánica respiratoria e incluso en las modificaciones en las imágenes radiológicas. Los autores concluyen ante estos hallazgos que hay dos categorías de SDRA y que, incluso, se trata de dos síndromes distintos que pueden requerir diferentes pautas de tratamiento con ventilación mecánica.
Estos datos parecen proponer de un modo firme las posibles diferencias entre los pacientes que cumplen los criterios diagnósticos de la conferencia de consenso y cuyo origen es pulmonar y aquellos con los mismos criterios pero de origen extrapulmonar. Se podría plantear la hipótesis de que bajo el diagnóstico de SDRA pulmonar se encuentran casos de neumonía bacteriana. Por el contrario, en presencia de los criterios diagnósticos de SDRA, en los pacientes con un factor etiológico extrapulmonar, las lesiones pulmonares corresponden en la gran mayoría de los casos al patrón histológico de DAD.
Estas posibles diferencias en las alteraciones histológicas pulmonares que subyacen bajo los criterios clínicos de SDRA tienen una gran repercusión en el pronóstico de los pacientes. La mortalidad de los enfermos con neumonía sometidos a ventilación mecánica se sitúa entre el 20 y 30%8,18, mientras que la de los que tienen un SDRA alcanza el 50 y 60%7,19. Esto tiene importancia tanto para el posible pronóstico del paciente como en los ensayos clínicos diseñados para probar la eficacia de un tratamiento. Podemos suponer qué sucede si la distribución de los pacientes con criterios clínicos de SDRA en un ensayo clínico se desquilibra incluyendo en uno de los grupos un mayor número de neumonía bacteriana (más pacientes con origen pulmonar que extrapulmonar).
VALIDEZ DE LOS CRITERIOS CLÍNICOS DEL SÍNROME DE DISTRÉS RESPIRATORIO DEL ADULTO
Durante los más de 10 años que han transcurrido desde el establecimiento de los criterios diagnósticos de SDRA en la Conferencia de Consenso, se ha venido utilizando estos criterios en la práctica clínica y en todos los estudios epidemiológicos y ensayos clínicos en los que se ha analizado el efecto de nuevos tratamientos. Sin embargo, hasta recientemente no se conocía la validez de estos criterios para detectar la presencia de daño alveolar difuso.
En 1986 Obnibene et al20 observan en la autopsia de 11 pacientes con neutropenia grave y criterios de SDRA que 5 de ellos tenían cambios histológicos de DAD, mientras que los otros 6 mostraban criterios de neumonía bacteriana.
Recientemente se han publicado dos estudios que han evaluado la correlación de los criterios clínicos de la conferencia de consenso21 y de tres definiciones diferentes de SDRA17 con el hallazgo en el estudio histológico de daño alveolar difuso.
Esteban et al21 analizan, en 382 pacientes fallecidos en la unidad de cuidados intensivos, la correlación existente entre el diagnóstico clínico de SDRA de acuerdo con los criterios de la conferencia de consenso y los hallazgos histológicos en el pulmón en la autopsia clínica. El diagnóstico clínico fue hecho por intensivistas sin conocer los resultados de la autopsia. Los patólogos realizaron los diagnósticos también de un modo independiente de los clínicos. En los 284 pacientes con factores de riesgo para SDRA se observó que existía coincidencia clinicopatológica en 84 pacientes de los 112 que presentaron DAD en la autopsia. Al mismo tiempo 43 pacientes con los criterios clínicos de SDRA no mostraban cambios de DAD y en 27 casos no había criterios clínicos, pero sí histológicos. Con estos datos la sensibilidad de los criterios de la Conferencia de Consenso fueron para la población general analizada del 75% (intervalo de confianza para el 95%: 66 a 82%) y la especifidad del 84% (intervalo de confianza para el 95%: 79 a 88%). Si se considera sólo la población con factores de riesgo para SDRA la sensibilidad permanece constante, pero la especificidad disminuye al 75% (intervalo de confianza para el 95%: 68 a 81%).
Si el análisis se realiza dependiendo de si el factor de riesgo fuese pulmonar (n = 106) o extrapulmonar (n = 178) observamos diferencias en la exactitud diagnóstica de los criterios de la Conferencia de Consenso. En los pacientes con factores de riesgo extrapulmonar la sensibilidad fue significativamente mayor (85% frente a 61%; p = 0,009) mientras que la especificidad fue mayor, pero no estadísticamente diferente (78% frente a 69%; p = 0,2).
En el análisis de los errores observamos que en los 43 pacientes diagnosticados de SDRA sin daño pulmonar agudo en la autopsia (falsos positivos) el diagnóstico patológico fue: neumonía (32 casos), hemorragia pulmonar (4 casos), edema pulmonar hidrostático (3 casos), embolismo pulmonar (3 casos) y fibrosis intersticial (1 caso). En el otro lado, los 27 casos falsos negativos (ausencia de diagnóstico clínico de SDRA, pero presencia de DAD) fueron diagnosticados por los clínicos de edema pulmonar (12 pacientes) y neumonía (12 pacientes). En tres pacientes no se diagnosticó patología pulmonar.
Pese a lo aparentemente satisfactorio que resulta la utilización de los criterios de la conferencia de consenso, debe intentarse lograr algún cambio que mejore la eficacia diagnóstica. Ferguson et al22 compararon los hallazgos de la autopsia con tres definiciones diferentes: criterios de la conferencia de consenso, Lung Injury Score (LIS) y una nueva definición creada por el método Delphi23. De las tres definiciones la conferencia de consenso fue la más sensible, aunque sin alcanzar significación estadística: 83% (intervalo de confianza para el 95%: 72-95%) frente a 74% (intervalo de confianza para el 95%: 61-87%) para un LIS > 2,5 y 69% (intervalo de confianza para el 95%: 55-83%) para la definición Delphi. Sin embargo, la especificidad fue más elevada para la definición Delphi (82%; intervalo de confianza para el 95%: 75-90%) que el LIS > 2,5 (77%; intervalo de confianza para el 95%: 69-85%) y que la definición de la conferencia de consenso (51%; intervalo de confianza para el 95%: 41-61%).
Como conclusión, y con los datos que disponemos actualmente, podemos considerar que los criterios diagnósticos de la Conferencia de Consenso Americana-Europea ofrecen una buena fiabilidad para diagnosticar las alteraciones histológicas pulmonares que caracterizan al SDRA. Este nivel de fiabilidad nos permite su utilización en la práctica clínica diaria, si bien hemos de tener presente que es mucho menor cuando el factor etiológico es de origen pulmonar. Pero si se ha de realizar un ensayo clínico, la distribución aleatoria habrá de hacerse independientemente para los pacientes con etiología pulmonar y para aquellos con etiología extrapulmonar. Con ello evitaremos sesgos que produzcan diferencias en el desenlace no relacionados con el tratamiento analizado.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses
FE DE ERRATAS
En el artículo «Recomendaciones de la 7ª Conferencia de Consenso de la SEMICYUC . Pancreatitis aguda grave en Medicina Intensiva» publicado en el número 5 de Medicina Intensiva [Med Intensiva. 2005;29(5):279-304] en la página 285, en el apartado Proteína C reactiva, donde dice «los valores de corte sugeridos por los autores varían desde 80 mg/dl a 210 mg/dl. Actualmente se acepta un punto de corte de 150 mg/dl» debe decir «los valores de corte sugeridos por los autores varían desde 80 mg/l a 210 mg/l. Actualmente se acepta un punto de corte de 150 mg/l» y donde dice «La PCR sérica fue el primer marcador estudiado como diferenciador entre formas graves y leves de PA con un punto de corte a las 48 h de 150 mg/dl» debe decir «La PCR sérica fue el primer marcador estudiado como diferenciador entre formas graves y leves de PA con un punto de corte a las 48 h de 150 mg/l».
Financiado en parte por Red Gira (G03/063) y Red Respira (C03/11).
*Éste es el segundo de 9 artículos de la Puesta al día en Medicina Intensiva: síndrome de distrés respiratorio agudo.
Correspondencia: Dr. A. Esteban.
Servicio de Cuidados Intensivos.
Hospital Universitario de Getafe.
Ctra. de Toledo, km 12,500.
28905 Getafe, Madrid. España.
Correo electrónico: aesteban@ucigetafe.com