La transfusión de sangre alogénica (TSA) no es inocua, y como consecuencia han surgido múltiples alternativas a la misma (ATSA). Existe variabilidad respecto a las indicaciones y buen uso de las ATSA. Dependiendo de la especialidad de los médicos que tratan a los pacientes, el grado de anemia, la política transfusional, la disponibilidad de las ATSA y el criterio personal, estas se usan de forma variable. Puesto que las ATSA tampoco son inocuas y pueden no cumplir criterios de coste-efectividad, la variabilidad en su uso es inaceptable.
Las sociedades españolas de Anestesiología y Reanimación (SEDAR), Hematología y Hemoterapia (SEHH), Farmacia Hospitalaria (SEFH), Medicina Intensiva y Unidades Coronarias (SEMICYUC), Trombosis y Hemostasia (SETH) y Transfusiones Sanguíneas (SETS) han elaborado un documento de consenso para el buen uso de la ATSA. Un panel de expertos de las 6 sociedades ha llevado a cabo una revisión sistemática de la literatura médica y elaborado el 2013. Documento Sevilla de Consenso sobre Alternativas a la Transfusión de Sangre Alogénica. Solo se contempla las ATSA dirigidas a disminuir la transfusión de concentrado de hematíes.
Se definen las ATSA como toda medida farmacológica y no farmacológica encaminada a disminuir la transfusión de concentrado de hematíes, preservando siempre la seguridad del paciente. La cuestión principal que se plantea en cada ítem se formula, en forma positiva o negativa, como: «La ATSA en cuestión reduce/no reduce la tasa transfusional». Para formular el grado de recomendación se ha usado la metodología Grades of Recommendation Assessment, Development and Evaluation (GRADE).
Since allogeneic blood transfusion (ABT) is not harmless, multiple alternatives to ABT (AABT) have emerged, though there is great variability in their indications and appropriate use. This variability results from the interaction of a number of factors, including the specialty of the physician, knowledge and preferences, the degree of anemia, transfusion policy, and AABT availability. Since AABTs are not harmless and may not meet cost-effectiveness criteria, such variability is unacceptable.
The Spanish Societies of Anesthesiology (SEDAR), Hematology and Hemotherapy (SEHH), Hospital Pharmacy (SEFH), Critical Care Medicine (SEMICYUC), Thrombosis and Hemostasis (SETH) and Blood Transfusion (SETS) have developed a Consensus Document for the proper use of AABTs. A panel of experts convened by these 6 Societies have conducted a systematic review of the medical literature and have developed the 2013 Seville Consensus Document on Alternatives to Allogeneic Blood Transfusion, which only considers those AABT aimed at decreasing the transfusion of packed red cells.
AABTs are defined as any pharmacological or non-pharmacological measure aimed at decreasing the transfusion of red blood cell concentrates, while preserving patient safety. For each AABT, the main question formulated, positively or negatively, is: «Does this particular AABT reduce the transfusion rate or not?» All the recommendations on the use of AABTs were formulated according to the Grades of Recommendation Assessment, Development and Evaluation (GRADE) methodology.
Recomendamos:
- -
Terapia transfusional restrictiva en pacientes anémicos, sin hemorragia activa.
- -
Administración perioperatoria de ácido tranexámico (ATX) en pacientes intervenidos de cirugía cardiaca.
- -
Administración de hierro (Fe) iv en pacientes oncológicos, para prevenir la anemia inducida por la quimioterapia y/o radioterapia, como administración coadyuvante de otros agentes eritropoyéticos.
- -
Administración de eritropoyetina humana recombinante (rHuEPO) en el periodo preoperatorio o perioperatorio, en pacientes sometidos a cirugía ortopédica programada.
No recomendamos:
- -
Administración de desmopresina (DDAVP) en pacientes sometidos a cirugía electiva.
- -
Administración de rHuEPO en pacientes críticos anémicos.
Recomendamos:
- -
Recuperación perioperatoria de sangre autóloga (RSA) en cirugía de artroplastia de rodilla y cadera.
- -
RSA en el periodo perioperatorio de cirugía cardiaca con circulación extracorpórea.
- -
RSA en el periodo intraoperatorio de la cirugía de reparación de rutura de aneurisma de aorta abdominal (AAA).
- -
Administración de ácido épsilon-aminocaproico (¿-ACA) en el periodo perioperatorio de pacientes intervenidos de cirugía cardiaca.
- -
Administración de ATX en el periodo perioperatorio de pacientes intervenidos de cirugía hepática.
- -
Administración de ATX en pacientes sangrantes politraumatizados.
- -
Administración de Fe iv en pacientes con anemia posparto.
- -
Administración de Fe iv en pacientes con enfermedad inflamatoria intestinal.
No recomendamos:
- -
Donación preoperatoria de sangre autóloga (DPSA) en procedimientos quirúrgicos que generalmente requieran la transfusión de 2 o menos unidades de concentrado de hematíes.
- -
Hemodilución aguda normovolémica (HAN) en cirugía mayor.
- -
Administración de ¿-ACA en el periodo perioperatorio de pacientes intervenidos de cirugía ortopédica.
- -
Administración de Fe oral en el periodo postoperatorio de pacientes intervenidos de cirugía de prótesis de rodilla (PTR), prótesis de cadera (PTC), revascularización miocárdica y en pacientes críticos (quirúrgicos o quemados).
Recomendamos:
- -
DPSA en cirugía ortopédica. Solo en pacientes con pérdidas moderadas-severas de sangre (requiriendo 3 o más unidades de concentrado de hematíes).
- -
RSA en el periodo perioperatorio de cirugía de columna, junto con otras técnicas de ahorro de sangre.
- -
Tromboelastografía (TEG) en pacientes quirúrgicos o traumatizados con hemorragia grave.
- -
Administración de concentrados de complejo protrombínico (CCP) en pacientes previamente tratados con antagonistas de la vitamina K (AVK) y que presentan hemorragia intracraneal (HIC).
- -
Administración de fibrinógeno (FBN) en pacientes traumatizados con hemorragia grave. Siempre que la TEG o el estudio de coagulación documenten déficit de FBN.
- -
Administración de fluidos en pacientes con pérdidas leves o moderadas de sangre.
Sugerimos:
- -
La administración de CCP en previamente tratados con AVK, sangrantes o que van a ser sometidos a procedimientos invasivos.
- -
La administración de ATX en el periodo perioperatorio de pacientes sometidos a cirugía de PTC, PTR, columna vertebral, ginecológica y de prostatectomía radical.
- -
La administración de ATX en pacientes con úlcera péptica sangrante.
- -
La administración de rHuEPO en el periodo perioperatorio de pacientes intervenidos de cirugía cardiaca y de cáncer gastrointestinal.
Sugerimos:
- -
DPSA en el periodo periopertorio de pacientes intervenidos de resección de neoplasia colorrectal, próstata o hepática. Se sugiere el uso coadyuvante de rHuEPO.
- -
DPSA en el periodo perioperatorio de pacientes sometidos a cirugía cardiaca electiva con circulación extracorpórea.
- -
La administración de FBN en el periodo perioperatorio de pacientes sometidos a cirugía cardiaca, de reparación de aneurisma abdominal, cistectomía radical o hemorragia obstétrica. Siempre que la TEG o el estudio de coagulación documenten déficit de FBN.
- -
Fe oral en el periodo preoperatorio de la cirugía de cáncer de colon y cirugía ortopédica.
- -
La administración de Fe iv en el periodo preoperatorio de pacientes anémicos que van a ser sometidos a cirugía ortopédica, ginecológica o digestiva.
- -
La administración de Fe iv en el periodo perioperatorio de pacientes sometidos a cirugía ortopédica, con alta probabilidad de desarrollar anemia perioperatoria.
- -
La administración de Fe iv en pacientes oncológicos para prevenir la anemia inducida por la quimioterapia y/o radioterapia, sin la administración coadyuvante de otros agentes eritropoyéticos.
- -
La administración de fluidos en pacientes con sangrado crítico.
Sugerimos:
- -
RSA en pacientes sometidos a cirugía tumoral hepática, cirugía urológica, traumatismos abdominales, cesárea o ruptura de embarazo ectópico.
- -
La administración de CCP en pacientes no tratados previamente con AVK y que presentan traumatismo sangrante, hemorragia periquirúrgica o insuficiencia hepática aguda. Siempre que la TEG o el estudio de coagulación documenten déficit de factores de coagulación.
- -
La administración de CCP, en lugar de plasma fresco congelado (PFC) o factor vii recombinante activado (rFviia) en pacientes previamente tratados con AVK y en quienes se precisa revertir urgentemente la anticoagulación.
- -
La administración de rFviia en pacientes con hemorragia crítica o refractaria, incluyendo HIC, hemorragia posparto y hemorragia en el periodo periquirúrgico de la cirugía cardiaca o hepática.
- -
La administración de Fe iv en el periodo postoperatorio de pacientes intervenidos de cirugía cardiaca, ortopédica, ginecológica tumoral o cesárea.
No hay evidencia para recomendar o sugerir la administración de perfluorocarbonados (PrFC) o hemoglobinas glucosiladas (HBOC).
Justificación y objetivosEl Documento Sevilla (DS) sobre Alternativas a la Transfusión de Sangre Alogénica (ATSA) fue publicado en 2006. El objetivo original del DS fue generar recomendaciones basadas en la mejor evidencia disponible sobre las indicaciones de las ATSA, a fin de asesorar a todos los profesionales involucrados en la administración de las transfusiones sanguíneas y las ATSA. Este mismo objetivo sustenta la presente Actualización del Documento Sevilla (ADS). También, como en el DS original, la ADS define las ATSA como toda medida encaminada a disminuir los requerimientos transfusionales y, por tanto, la transfusión de hematíes, preservando en todo momento la seguridad del paciente. Para su análisis fueron divididas en ATSA farmacológicas y no farmacológicas.
Son varias las razones que justifican esta ADS: 1) La persistente variabilidad en el uso clínico de las ATSA; 2) la desaparición de fármacos que en el DS original tenían un alto grado de evidencia (aprotinina); 3) las nuevas indicaciones para fármacos, no contemplados en el DS original (complejo protrombínico y FBN); 4) las alarmas generadas por las agencias gubernamentales, con respecto a los efectos adversos de algunos fármacos (eritropoyetina recombinante); 5) el cambio a una nueva metodología más actual, útil y eficaz para valorar los grados de evidencia y formular recomendaciones (metodología Grades of Recommendation Assessment, Development and Evaluation [GRADE]); y, por último, 6) la incorporación como miembro de pleno derecho de la Sociedad Española de Farmacia Hospitalaria (SEFH).
Las recomendaciones de la ADS están dirigidas a pacientes quirúrgicos, traumatizados y/o críticos, con pérdidas sanguíneas que pueden requerir el uso de ATSA. Como en el DS original, solo se contemplan las ATSA relativas a la transfusión de concentrado de hematíes (TCH). Para el objetivo de este documento definimos la tasa transfusional como el número de unidades de concentrado de hematíes transfundidas y/o el porcentaje de pacientes transfundidos. La cuestión principal que se plantea en cada ítem se formula, en forma positiva o negativa, como: La ATSA en cuestión reduce/no reduce la tasa transfusional. Para formular el grado de recomendación sobre el uso de una determinada ATSA para reducir la tasa transfusional se ha usado la metodología GRADE.
MetodologíaSociedades científicas. Miembros del panel de expertosHan participado un total de 6 sociedades científicas de ámbito nacional correspondientes a las especialidades de Anestesiología y Reanimación, Hematología y Hemoterapia, Medicina Intensiva y Farmacia Hospitalaria: Sociedad Española de Anestesiología, Reanimación y Terapéutica del Dolor (SEDAR), Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC), Sociedad Española de Hematología y Hemoterapia (SEHH), Sociedad Española de Transfusión Sanguínea (SETS), Sociedad Española de Trombosis y Hemostasia (SETH) y SEFH. Estas sociedades han seleccionado a los miembros del panel encargados de configurar y redactar la presente ADS, actuando sus presidentes como observadores. Cada una de estas sociedades estuvo representada por 6 miembros, excepto las 3 sociedades hematológicas (SEHH, SETS y SETH), que participaron conjuntamente con 6 miembros. Con la salvedad de los aportados por la SEFH, la elección de los miembros del panel y su participación en la configuración de la ADS no difirió sustancialmente de la del DS original1.
Metodología Grades of Recommendation Assessment, Development and EvaluationLa elección de la metodología GRADE se fundamentó en que esta presenta una serie de ventajas sobre la metodología DELPHI usada en el DS original. Estas ventajas incluyen: 1) Separación clara entre la calidad de la evidencia y el grado de recomendación; 2) criterios explícitos y comprensivos para bajar o subir la puntuación de la calidad de la evidencia; 3) proceso transparente de traslado de la evidencia a las recomendaciones; 4) reconocimiento explícito de valores y preferencias; y 5) clasificación clara y pragmática de las recomendaciones en fuertes (Recomendación 1) o débiles (Recomendación 2), soportadas por una evidencia de calidad alta (A), moderada (B) o baja/muy baja (C), que facilita su interpretación por clínicos, pacientes y proveedores de servicios de salud, así como su utilización en el desarrollo de guías de práctica clínica2–4.
De acuerdo con la metodología GRADE, la formulación de una recomendación fuerte implica que los beneficios de la intervención superan claramente a los riesgos y cargas de la misma (recomendación positiva) o viceversa (recomendación negativa), en todos los casos. Sin embargo, las implicaciones pueden ser muy distintas, en función de la calidad de la evidencia. Así, una recomendación 1A o 1B está soportada por evidencia de calidad alta o moderada e indica que dicha intervención puede ser utilizada sin reservas en la mayoría de los pacientes y en casi todas las circunstancias, mientras que una recomendación 1C indica que esta recomendación está soportada por evidencia de calidad baja y que podría cambiar cuando se disponga de evidencia de más alta calidad4.
En lo que respecta a una recomendación débil, una recomendación 2A o 2B indica que está soportada por evidencia de calidad alta o moderada, siendo muy probable que exista un equilibrio entre los beneficios de la intervención propuesta y sus posibles riesgos y cargas, y que la mejor alternativa para ese paciente puede variar en función de sus circunstancias, los valores sociales (por ejemplo, disponibilidad de recursos) o las preferencias del mismo. Por el contrario, una recomendación 2C indica que está soportada por evidencia de calidad baja, habiendo incertidumbre sobre la existencia de dicho equilibrio entre beneficios, posibles riesgos y cargas, y que la utilización de otras alternativas puede ser igualmente razonable4.
Cuando se hizo una recomendación fuerte, el panel utilizó la terminología «recomendamos …» o «no recomendamos…». Alternativamente, también se utilizaron las expresiones «se puede...», «debería…» o «no debería…». Cuando se hizo una recomendación débil, el panel utilizó una terminología menos concluyente, tal como «sugerimos…» o «podría…»4.
Para una mayor claridad, el panel definió la población de pacientes a quienes va dirigida la intervención recomendada, su seguridad y, siempre que fue posible, indicó cómo debía implementarse. Finalmente, ha de tenerse en cuenta que para algunas intervenciones no fue posible establecer una recomendación basada en la evidencia (Recomendación 0).
Alternativas a la transfusión de sangre alogénica no farmacológicasSe clasifican en terapia transfusional restrictiva, DPSA, HAN y RSA.
Terapia transfusional restrictiva en pacientes no sangrantesPacientes críticos, politraumatizados y/o quirúrgicos, sin afectación cardiológica y/o del sistema nervioso centralRecomendamos la TCH para mantener cifras de hemoglobina (Hb) entre 70 y 90g/L, con objeto de disminuir la tasa transfusional. 1A.
Estudios controlados realizados en pacientes críticos euvolémicos adultos5 y niños6, incluyendo pacientes quirúrgicos, han documentado que la mayoría de las personas pueden tolerar cifras de Hb tan bajas como 70-80g/L7,8, y estos niveles de Hb son los recomendados por la Asociación Americana de Bancos de Sangre8. La tolerancia del paciente a la anemia normovolémica está condicionada por la reserva cardiopulmonar, el volumen y velocidad de las pérdidas sanguíneas, y el carácter agudo o crónico de la anemia.
Pacientes críticos, politraumatizados y/o quirúrgicos, con afectación cardiológica y/o del sistema nervioso centralRecomendamos la TCH para mantener cifras de Hb entre 80 y 100g/L, con objeto de disminuir la tasa transfusional. 1A.
Se ha documentado que los pacientes con cardiopatía isquémica y/o intervenidos de cirugía cardiaca tienen una pobre tolerancia a la anemia9. Los pacientes anémicos con cardiopatía isquémica sintomática y/o disfunción cerebral pueden precisar cifras más altas de Hb. Los pacientes anémicos (hematocrito<33%) mayores de 65 años y con infarto agudo de miocardio mejoran su resultado clínico cuando se corrige la anemia con la TCH10. La eficacia de la transfusión está ligada al grado de anemia e isquemia miocárdica. Los pacientes anémicos (<120g/L de Hb) con elevación del ST mejoran su resultado clínico con la TCH11. Por el contrario, los pacientes con anemia ligera y aquellos con isquemia, pero sin elevación del ST, pueden empeorar el resultado clínico con la TCH9. Los pacientes intervenidos de cirugía cardiaca, sin datos de isquemia perioperatoria, toleran cifras de Hb de 80g/L sin incrementar la morbimortalidad9,12,13. Un estudio reciente14 ha documentado que los pacientes cardiópatas, octogenarios, intervenidos de fractura de cadera, no empeoran su resultado clínico cuando se transfunden acorde a la sintomatología clínica o umbral transfusional menor o igual de 80g/L, en comparación con pacientes transfundidos liberalmente, esto es, con umbral de 100g/L.
Debido a su alta tasa metabólica, el cerebro tiene poca tolerancia a la anemia, precisando de una oferta de oxígeno continua y abundante. Como la Hb es el principal componente del transporte de oxígeno, la anemia podría afectar negativamente la función cerebral15, en pacientes con traumatismo craneoencefálico, hemorragia subaracnoidea y/o accidente cerebrovascular isquémico. Es probable, aunque no se ha documentado taxativamente, que los pacientes anémicos con disfunción cerebral grave precisen niveles discretamente más altos de Hb15-17.
SeguridadEn pacientes quirúrgicos euvolémicos, casi todos los estudios aleatorizados realizados hasta la fecha han demostrado que el uso de un umbral de transfusión «restrictivo» no provoca un aumento de la morbimortalidad ni de la duración de la estancia hospitalaria, mientras que reduce tanto el porcentaje de pacientes transfundidos como el volumen de sangre alogénica que se administra. Los pacientes críticos, sobre todos con afetación aguda de la función cerebral y/o cardiológica, pueden presentar peores resultados clínicos si se permiten cifras bajas de Hb. Sin embargo, aunque la anemia puede incrementar la morbimortalidad, la TCH no revierte, necesariamente, sus efectos deletéreos.
ResumenLa mayoría de los pacientes con traumatismo, críticos y/o quirúrgicos pueden tolerar cifras de Hb de 70g/L. Sin embargo, si presentan afectación aguda cardiológica y/o del sistema nervioso central pueden precisar cifras de Hb de al menos 80g/L. En todo caso, la decisión de transfundir debería de individualizarse para cada paciente.
Donación preoperatoria de sangre autólogaLa DPSA es una modalidad de autotransfusión que consiste en la extracción, en los días o semanas previos a la intervención, de una o varias unidades de la propia sangre del paciente. Estas unidades se someten a tamizado serológico y almacenamiento, precedido o no de fraccionamiento, y su reinfusión al paciente se realiza durante la intervención y/o en el postoperatorio inmediato.
Cirugía ortopédica mayorNo recomendamos el uso rutinario de DPSA para reducir la tasa transfusional, en procedimientos que requieran generalmente≤2U/paciente. 1B.
En pacientes adultos sometidos a cirugía ortopédica mayor (rodilla, cadera o columna), los resultados provenientes de estudios aleatorizados controlados (RCT) y observacionales mostraron una reducción del 20% de la tasa transfusional. Sin embargo, en la mayor parte de estos estudios no se establecieron criterios de transfusión (que podrían disminuir el efecto positivo de la DPSA). Además, el 60-70% de los pacientes con DPSA recibió algún tipo de transfusión, autóloga o alogénica, y el 40% de las unidades depositadas no se utilizaron18–22. La administración preoperatoria de rHuEPO23 o la recuperación perioperatoria de sangre24 son al menos tan eficaces como la DPSA en disminuir los requerimientos transfusionales. Recomendamos el uso de DPSA para reducir la tasa transfusional en procedimientos de cirugía ortopédica mayor, que requieran generalmente≥3U/paciente, preferentemente con tratamiento coadyuvante con Fe y/o rHuEPO. 1C.
Estudios observacionales en pacientes sometidos a procedimientos ortopédicos con alto volumen de hemorragia indican que la DPSA reduce significativamente la tasa transfusional en la revisión de PTC y en la corrección de escoliosis, no utilizándose hasta el 30% de las unidades depositadas25,26. Se ha comprobado que en cirugía protésica la utilización de rHuEPO, como coadyuvante del programa de DPSA, disminuye la exposición a TSA en mayor cuantía que la DPSA como única técnica, aunque se incluyeron pocos pacientes y esta alternativa no resultó coste-efectiva1. Además, en cirugía de escoliosis o cirugía vertebral compleja en la población pediátrica, el tratamiento coadyuvante con rHuEPO, con/sin Fe intravenoso, permite un mejor cumplimiento del programa de DPSA, con una significativa reducción de la exposición a TSA cuando se compara con DPSA como única técnica27,28. Finalmente, la administración concomitante con Fe iv puede mejorar la respuesta a la rHuEPO, reduciendo su dosis y mejorando la relación coste-efectividad de esta estrategia29.
Cirugía cardiaca electivaSugerimos el uso de DPSA para reducir la tasa transfusional, en procedimientos electivos de cirugía cardiaca bajo circulación extracorpórea (CEC) en adultos. 2B.
Los resultados de estudios observacionales grandes indican que la donación de 2 unidades era la estrategia más efectiva para evitar la TSA con el menor incremento de costes22,30. En algunos estudios, el tratamiento coadyuvante con rHuEPO ha mejorado los resultados de la DPSA en cirugía cardiaca en adultos y niños1.
Cirugía oncológicaSugerimos el uso de la DPSA para reducir la tasa transfusional en pacientes sometidos a cirugía para la resección de neoplasias sólidas. 2B.
Los resultados de diversos RCT y estudios observacionales sugieren que la DPSA reduce hasta en un 30% los requerimientos transfusionales en cirugía de cáncer colorectal31, prostatectomía32 y resección hepática33, mejorando los resultados con tratamiento coadyuvante con rHuEPO31-33.
SeguridadLa DPSA estaría contraindicada de forma permanente en pacientes con marcadores serológicos víricos positivos, enfermedad cardiovascular grave y, de forma temporal, en infecciones bacterianas activas, Hb menor de 10g/dL o peso menor de 10kg34. Los resultados de un metaanálisis reciente18 indicaron que la DPSA reduce la tasa transfusional sin incrementar la morbimortalidad. No obstante, debe recordarse que la incidencia de efectos adversos durante la DPSA es superior a la de la donación altruista y que la DPSA aumenta el riesgo de recibir cualquier tipo de transfusión. Es obligatorio por ley desechar tanto las unidades no utilizadas, como aquellas con marcadores serológicos positivos, y comunicar los efectos adversos al sistema nacional de hemovigilancia35.
ResumenLa DPSA estaría indicada en pacientes sometidos a procedimientos quirúrgicos electivos en los que el riesgo de transfusión es superior al 30-50% (generalmente con Hb<14,5g/dL) y/o en pacientes con dificultad para encontrar sangre alogénica compatible que se niegan a recibir TSA. El riesgo de recibir TSA se reduce aún más si se asocia a rHuEPO y Fe en cirugías que requieren el predepósito de 3 o más unidades. Finalmente, debemos recordar que la DPSA solo debería implementarse en aquellos pacientes en los que la fecha de la intervención esté garantizada.
Hemodilución aguda normovolémicaLa HAN consiste en la extracción y anticoagulación de un volumen determinado de sangre y su sustitución simultánea por cristaloides y/o coloides para mantener la normovolemia. Aunque se ha utilizado la HAN extrema y otros tipos de hemodilución, la HAN moderada hasta alcanzar generalmente valores de hematocrito del 25-30% es la más empleada. Se utiliza en intervenciones de cirugía mayor con hemorragia moderada-grave y habitualmente se realiza después de la inducción a la anestesia y antes de la fase hemorrágica de la cirugía.
Cirugía mayorNo recomendamos el uso rutinario de la HAN como técnica única de ahorro de sangre, dada su escasa eficacia para disminuir la tasa transfusional. 1B.
Los resultados de 2 metaanálisis de 42 RCT mostraron una pequeña reducción significativa de la tasa transfusional18,36. Sin embargo, la eficacia de la HAN quedó prácticamente eliminada cuando existía un protocolo de transfusión y cuando se asoció o se comparó con otras técnicas de ahorro de TSA (DPSA, ácido tranexámico e hipotensión controlada)18,36,37.
SeguridadLa HAN solo debería utilizarse en aquellas instituciones en las que pueda implementarse la logística para la extracción de sangre, llevar a cabo la reposición de la volemia sin menoscabo de la atención al paciente, y seguir las recomendaciones de la Guía sobre la transfusión de componentes sanguíneos y derivados plasmáticos38. Las bolsas pueden conservarse en quirófano a temperatura ambiente durante un máximo de 6h y administrarse en orden inverso al de su extracción. Aunque en la mayor parte de los estudios analizados no se observó que la HAN se asociara a un aumento del riesgo de morbimortalidad, la calidad de la evidencia a este respecto es moderada-baja36,37. Se ha asociado el uso de HAN con un incremento de las tasas de fracaso renal en adultos39 y de alteraciones del desarrollo psicomotor en los niños40, ambos sometidos a cirugía cardiaca. Por el contrario, el uso de HAN se asoció con disminución del riesgo de infección postoperatoria en cirugía ortopédica41.
ResumenLa mayoría de los estudios no muestran una reducción significativa del riesgo de exposición a TSA, aunque ha aportado a la terapia transfusional el concepto de la tolerancia a niveles bajos de Hb en grupos de pacientes de bajo riesgo. Por tanto, a pesar de su bajo coste, la HAN solo debería utilizarse asociada a otros métodos de ahorro de sangre en pacientes seleccionados, salvo en aquellos centros donde no puedan implementarse otras alternativas a la TSA. La evidencia disponible sobre otras modalidades de hemodilución distintas de la HAN, como la hemodilución hipervolémica moderada o la hemodilución aguda aumentada, no permite realizar ningún tipo de recomendación sobre las mismas1.
Recuperación perioperatoria de sangre autólogaLa RSA puede efectuarse en diversas intervenciones quirúrgicas en las que se produce un sangrado significativo. En el periodo intraoperatorio, la RSA se realiza utilizando dispositivos que aspiran, anticoagulan, lavan y concentran la sangre vertida en el campo quirúrgico, retornándola al paciente en forma de concentrado de hematíes en suero salino. En el periodo postoperatorio, la RSA consiste en la recolección y reinfusión de la sangre procedente de los drenajes postoperatorios. Cuando no se efectúa recuperación intraoperatoría, la postoperatoria se realiza habitualmente con dispositivos que recuperan y reinfunden sangre total filtrada y no lavada.
Cirugía ortopédica- Artroplastia de rodilla y cadera Recomendamos el uso de la RSA, con sangre lavada o filtrada, para disminuir la tasa transfusional. 1B.
En pacientes intervenidos de PTR42,43 o PTC44,45 primarias, la recuperación postoperatoria de sangre lavada y no lavada redujo en un 20% el riesgo absoluto de recibir TSA (11 vs. 30%), pero no el número de unidades de TSA, por paciente transfundido. La RSA perioperatoria con sangre lavada también fue eficaz para reducir la tasa transfusional en PTC de reintervención, especialmente si se asocia a otras técnicas de ahorro de sangre46.
- Cirugía de columna Recomendamos el uso de la RSA, dentro de un programa multimodal, para reducir la tasa transfusional en pacientes de cirugía ortopédica para la corrección de escoliosis o cirugía degenerativa vertebral compleja (>3 niveles). 1C.
En cirugía de columna lumbar o lumbosacra instrumentada, con o sin autoinjerto de cresta ilíaca, la RSA no redujo significativamente el porcentaje de pacientes con TSA, aunque sí el volumen de sangre alogénica transfundida47. En cirugía de corrección de escoliosis, en la que el sangrado puede alcanzar hasta el 90% del volumen sanguíneo estimado del paciente, la RSA sola o asociada a otras medidas de ahorro de sangre reduce significativamente la tasa transfusional48,49.
Cirugía cardiacaRecomendamos el uso de la RSA perioperatoria para reducir la tasa transfusional en procedimientos de cirugía cardiaca con CEC. 1B.
En cirugía cardiaca con CEC, la recuperación y reinfusión de la sangre lavada del campo quirúrgico y del reservorio de cardiotomía reduce el porcentaje de pacientes expuestos a TSA con respecto a los controles, aunque no el número de unidades transfundidas por paciente50. Sin embargo, la RSA no resulta eficaz si se limita al procesamiento de la succión pericárdica51 o cuando se utiliza en cirugía cardiaca sin CEC52.
Cirugía vascular mayorRecomendamos el uso de la RSA intraoperatoria para disminuir la tasa transfusional en cirugía vascular para la reparación de AAA. 1B.
En cirugía electiva de AAA, los resultados de diversos estudios han demostrado que la utilización de la RSA intraoperatoria redujo casi en un 40% el riesgo absoluto de exposición a TSA con respecto al control, y el volumen de sangre transfundida53. Se ha estimado que la técnica es coste-efectiva para sangrados superiores a 800mL. En la reparación de AAA rotos, la RSA reduce la tasa transfusional en 3 unidades por paciente53,54. Finalmente, debe recordarse que la utilización de prótesis endovasculares reduce el sangrado y las necesidades transfusionales en comparación con la cirugía abierta, tanto en AAA electivos como rotos, aunque el papel de la RSA en este tratamiento no ha sido suficientemente estudiado55.
Otras cirugíasSugerimos el uso de la RSA intraoperatoria de sangre lavada, filtrada y/o irradiada para disminuir la tasa transfusional en intervenciones de cirugía tumoral hepática o urológica, traumatismos abdominales, cesárea o ruptura de embarazo ectópico. 2C.
Diversos RCT y estudios observacionales sugieren que la RSA puede reducir la tasa transfusional en pacientes intervenidos de trasplante hepático por hepatocarcinoma o cirrosis46, prostatectomía radical56, cesárea57, ruptura de embarazo ectópico58 y traumatismo abdominal59.
SeguridadDel análisis de los estudios clínicos realizados en distintos tipos de procedimientos quirúrgicos electivos o urgentes se desprende que la RSA intra y/o postoperatoria no aumenta la morbimortalidad ni la duración de la estancia hospitalaria, aunque se han descrito algunos efectos adversos graves, especialmente coagulopatía, cuando se reinfunden grandes volúmenes de sangre recuperada y procesada. En cirugía ortopédica, aunque apenas se han detectado efectos adversos graves, no se aconseja reinfundir un volumen superior a 1.000mL de sangre filtrada y no lavada60. Sin embargo, en cirugía cardiaca los resultados de una revisión sistemática indican que la RSA postoperatoria de sangre filtrada no lavada no es recomendable18. La indicación de la RSA en cirugía tumoral y cesárea es controvertida. En cirugía tumoral, los resultados de un metaanálisis reciente muestran que la RSA no aumenta la incidencia de recidiva o metástasis tumoral61.
ResumenLa RSA intraoperatoria estaría indicada en pacientes sometidos a cirugía electiva en la que se prevé un sangrado mayor de 1.500mL y pueda recuperarse al menos el equivalente a 1,5-2 unidades de concentrado de hematíes. Por su parte, el uso de la recuperación postoperatoria de sangre no lavada estaría restringido a pacientes con Hb<15g/dL intervenidos de cirugía protésica programada en la que se espere un sangrado postoperatorio entre 500 y 1.000mL, y pueda recuperarse al menos el equivalente a una unidad de TSA1. Las recomendaciones realizadas están limitadas por el hecho de que la mayoría de los ensayos aleatorizados examinados fueron pequeños y no fue posible ocultar adecuadamente el tratamiento, lo que pudo influir en la práctica transfusional.
Tromboelastografía. Manejo de la coagulación a la cabecera del pacienteLa TEG es un método que valora las propiedades viscoelásticas de la coagulación de forma global (modelo celular de la coagulación). Presenta los resultados gráficamente, permitiendo valorar la formación y la lisis del coágulo en menos de 10min. Puede ser realizada a la cabecera del paciente (point-of-care) y tiene las siguientes ventajas sobre los tests convencionales de la coagulación: 1) Rapidez en la obtención de resultados, conduciendo a decisiones clínicas precoces, y 2) valoración global de la coagulación en sangre total62,63. Hasta el 35% de los pacientes traumatizados sangrantes presentan alteraciones de los tests de coagulación cuando acuden al hospital. La llamada coagulopatía aguda traumática64 es un factor independiente de mal pronóstico y necesita ser tratada precoz y agresivamente. Por otra parte, los pacientes quirúrgicos manifiestan diferentes alteraciones de la coagulación, que deben tratarse de forma individualizada. La TEG permite la administración individualizada de hemocomponentes (concentrados de plasma y plaquetas) y de concentrados de factores de coagulación (FBN y complejo protrombínico).
Paciente sangrante con traumatismo graveRecomendamos el uso de TEG para guiar la reposición de factores de coagulación y reducir la tasa transfusional. 1C.
Los pacientes con traumatismos sangrantes pueden presentar alteraciones tempranas (en los 30min que siguen al traumatismo) de la coagulación, incluyendo hipocoagulabilidad, hipercoagulabilidad y/o hiperfibrinólisis62,63. Al menos una veintena de estudios han documentado que el uso de TEG permite un más eficiente manejo de la coagulación y puede reducir la tasa transfusional62,64.
Paciente sangrante quirúrgicoRecomendamos el uso de TEG para guiar la reposición de factores de coagulación y reducir la tasa transfusional. 1C.
Un estudio retrospectivo que incluyó más de 3.000 pacientes intervenidos de cirugía cardiaca, documentó que la TEG disminuye significativamente las tasas transfusional y de fenómenos tromboembólicos65. Estudios retrospectivos que incluyeron un bajo número de pacientes intervenidos de cirugía vascular, hepática y obstétrica, concluyeron que la TEG reduce la tasa transfusional y permite el tratamiento precoz de las alteraciones de la coagulación66,67.
SeguridadLa TEG no tiene riesgos para el paciente. No obstante, no valora la función plaquetaria, por lo que los pacientes con disfunción plaquetaria deben de valorarse con otras tecnologías63.
ResumenLa TEG es una técnica útil para la valoración precoz de las alteraciones de la coagulación y permite la administración selectiva de hemocomponentes y factores de la coagulación. Aunque su uso se asocia con una disminución significativa de la transfusión de hemoderivados, no disminuye la alta mortalidad del paciente con sangrado grave67.
Alternativas farmacológicas a la transfusión de sangre alogénicaSe clasifican en ATSA farmacológicas para disminuir el sangrado, incrementar la eritropoyesis y favorecer el transporte de oxígeno.
Alternativas farmacológicas a la transfusión de sangre alogénica para disminuir el sangradoLa reducción de las pérdidas sanguíneas perioperatorias es primordial a la hora de disminuir la exposición del paciente a la TSA. Puede conseguirse con un manejo adecuado de antiagregantes y anticoagulantes, con el mantenimiento de la normotermia, hipotensión controlada, inducida o permisiva, la realización de una hemostasia quirúrgica cuidadosa y, cuando sea posible, de una cirugía mínimamente invasiva, el uso selectivo de drenajes, y en su caso, con la mínima presión de aspiración. Finalmente, debe valorarse la administración de fármacos que, al incrementar los niveles de los factores de coagulación, puedan favorecer la formación del coágulo, aseguren su estabilidad y/o retrasen su lisis.
Concentrado de complejo protrombínicoLos CCP son derivados plasmáticos que contienen cantidades variables de los factores de coagulación ii, ix y x (CCP de «3 factores», comercializados en EE. UU.) o de los factores de coagulación ii, vii, ix y x (CCP de ««4 factores»», comercializados en Europa). Los 3 CCP de «4 factores» que se comercializan en España son de eficacia similar, pero tienen diferencias moderadas en su composición. Para evitar trombogenicidad tras su administración, los CCP contienen proteína C, proteína S, antitrombina iii y/o heparina68.
Pacientes en tratamiento con antagonistas de la vitamina K con hemorragia activa o que precisen de un procedimiento quirúrgico urgente o emergenteSugerimos la administración de CCP para disminuir el sangrado y/o la tasa transfusional. 2A.
La normalización del International Normalized Ratio (INR) se alcanza en virtualmente todos los pacientes, entre 10 y 30min tras la administración de CCP69-71. Cuando el objetivo de administrar CCP es evitar el sangrado en pacientes que van a ser sometidos a cirugía u otros procedimientos invasivos, o disminuir la hemorragia en pacientes con sangrado activo, la mayoría de los estudios documentan disminución o cese del sangrado72. Las guías clínicas sugieren el uso de CCP de «4 factores» en pacientes sangrantes en tratamiento con AVK, independientemente del valor de INR73. En pacientes quirúrgicos, el CCP puede ser preferible al rFVIIa y/o plasma fresco74. Sin embargo, el escaso número de estudios, el carácter retrospectivo de la mayoría de ellos, el bajo número de pacientes incluidos, el tratamiento concomitante con plasma u otros fármacos prohemostáticos, la ausencia de grupo control y las diferencias metodológicas, dificultan la extracción de conclusiones sólidas.
Pacientes en tratamiento con antagonistas de la vitamina K y hemorragia intracranealRecomendamos la administración de CCP para disminuir el sangrado. 1C.
La HIC es el evento más grave asociado con la anticoagulación con AVK. El riesgo de HIC se duplica por cada punto de incremento de INR. La velocidad del crecimiento del hematoma y las secuelas neurológicas y la mortalidad son más elevadas en la HIC asociada a la ingesta de AVK que con otros tipos de HIC75–78. La mortalidad en las primeras 24h puede llegar al 33%79,80. En pacientes tratados con CCP, la corrección del INR y el control del sangrado se alcanzan de forma más eficaz que en aquellos tratados con PFC81,82. Sin embargo, la mortalidad y las secuelas permanecen invariablemente altas independientemente del tratamiento elegido79,80.
Pacientes no tratados con antagonistas de la vitamina K, con coagulopatía en el contexto de traumatismo, hemorragia periquirúrgica o insuficiencia hepática agudaSugerimos la administración de CCP para disminuir el sangrado y/o la tasa transfusional. 2C.
Sangrado en paciente politraumatizado. Generalmente los pacientes con hemorragia masiva son transfundidos con un mayor número de unidades de concentrado de hematíes que de PFC (ratios 3:1 o superior). Datos recientes documentan que la mortalidad mejora si la ratio se eleva a 1:1:1 (cantidades equiparables de hematíes, plasma y plaquetas) en pacientes traumatizados con hemorragia crítica en el contexto militar, sugiriendo la necesidad de aportar grandes cantidades de factores de coagulación, desde el inicio de la hemorragia83, aunque existe controversia al respecto84. El CCP podría aportar grandes cantidades de factores de forma más rápida y precoz, disminuyendo los requerimientos transfusionales85.
Sangrado en paciente quirúrgico. La administración de CCP se asocia a disminución de los requerimientos transfusionales en el periodo perioperatorio86, sobre todo en pacientes sometidos a cirugía cardiaca65.
Insuficiencia hepática aguda. Un solo estudio observacional sugiere que el CCP podría ser útil en el tratamiento del sangrado o en la profilaxis del mismo en pacientes con déficit de factores hepatodependientes secundario a insuficiencia hepática aguda87.
Pacientes en tratamiento con antagonistas de la vitamina K y que precisan revertir de forma inmediata la anticoagulación. Complejo protrombínico frente a plasma fresco congelado y factor vii recombinante activadoSugerimos que el tratamiento con CCP es superior a la administración de PFC y de rFviia para disminuir el sangrado y/o la tasa transfusional. 2C.
El PFC contiene cantidades variables de todos los factores de coagulación. Aunque no se ha establecido la dosis óptima, suelen recomendarse dosis de 15ml/kg, no obstante, podrían ser necesarias dosis tan altas como 30ml/kg para aportar cantidades óptimas de factores de coagulación88,89. Las ventajas del CCP sobre el PFC son: 1) Su mayor contenido en factores de coagulación hepatodependiente, aunque el CCP no tiene FBN ni factor xiii; 2) no necesita compatibilidad de grupo sanguíneo (PFC, sí); 3) mayor rapidez de administración (el PFC necesita descongelación, lo que retrasa su administración); 4) mayor eficacia y rapidez en corregir el INR (menos de 30min con CCP); 5) menor volumen de administración (a la dosis sugerida, se necesitan, al menos, 1.000ml de PFC en un paciente de 70kg, lo que puede provocar sobrecarga circulatoria asociada a transfusión (TACO) y lesión pulmonar aguda producida por transfusión (TRALI) 69–71. La mayoría de las guías73,74 y estudios observacionales81,82 sugieren que el CCP es superior al PFC para controlar la hemorragia inducida por los AVK. En un estudio con modelo animal, la administración de CCP o de PFC fue más eficaz que la de rFviia para detener el crecimiento del hematoma en ratones con HIC inducida con AVK90. Aunque la administración de rFviia puede disminuir el tamaño del hematoma en pacientes con HIC, la mortalidad permanece invariablemente alta y la elevada tasa de efectos tromboembólicos desaconseja el uso sistemático de rFviia en pacientes con hemorragia crítica inducida por AVK91.
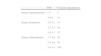
DosisEn la HIC la administración de 25-50U/kg de CCP aminora el crecimiento del hematoma, corrige el INR en menos de 30min y permite el control quirúrgico del hematoma80. En general, puede optarse por dosis fijas o dosis individualizada. Un estudio reciente no ha encontrado ventaja en usar dosis individualizada, recomendando una dosis fija única de 1.000U para todas las situaciones en que se use CCP92. Sin embargo, la mayoría de los autores recomiendan dosis individualizadas, basadas en el peso del paciente, el INR actual y el INR que se pretende conseguir (target), variando entre 15-50U/kg. En todos los casos la administración de CCP debe suplementarse con 5-10mg de vitamina K, iv. Generalmente, la administración de CCP se basa en el porcentaje de factores plasmáticos, por lo que se debe convertir el INR a dicha proporción. El cálculo de la dosis se realiza mediante la expresión: unidades de factores de CCP=(% nivel deseado de factores-% nivel actual de factores)×peso en kg. Ejemplo: varón de 80kg con INR de 7,5 a quien se desea disminuir el INR a 1,5. El cálculo de la dosis sería: (40-5)×80=2.800UI de CCP. El siguiente esquema es útil para el cálculo de la dosis93 (tabla 1).
SeguridadSe han descrito tasas variables, pero bajas, de fenómenos tromboembólicos, sobre todo arteriales (ictus, infarto de miocardio, tromboembolismo pulmonar)65,70,94 en pacientes tratados con CCP. Sin embargo, en la mayoría de los casos no se ha documentado una relación causa-efecto entre la administración de CCP y el incremento de fenómenos tromboembólicos clínicamente relevantes. La mayoría de los autores describen el CCP como un fármaco seguro94.
ResumenAl igual que en otras guías de práctica clínica recientes, sugerimos administrar CCP en pacientes tratados con AVK, sangrantes o sometidos a procedimiento invasivo, aunque esta recomendación está basada en estudios retrospectivos que incluyeron pocos pacientes (2C). Exceptuamos de este bajo grado de recomendación a los pacientes con HIC (1C), en quienes una muestra más amplia de estudios retrospectivos y al menos 2 prospectivos han documentado una disminución del crecimiento del hematoma. El CCP podría ser potencialmente útil (2C) en pacientes sangrantes y no tratados con AVK.
FibrinógenoLa presencia de niveles adecuados de FBN es crítica para lograr una hemostasia eficaz. La concentración plasmática de FBN es de 1,5-4,5g/L. El FBN facilita la agregación plaquetaria y, cuando se activa mediante la trombina, forma polímeros de fibrina, que son la base de formación del coágulo66. La hemorragia grave implica pérdida de factores de coagulación, incluyendo FBN. La reanimación intensa con soluciones hidroelectrolíticas diluye los factores de coagulación existentes y, como resultado, los pacientes sangrantes presentan bajos niveles plasmáticos de FBN y del resto de los factores de coagulación. Además, los coloides pueden interferir en la formación de un coágulo eficaz, al alterar su firmeza y estabilidad. Ambos mecanismos (pérdida y dilución de factores de coagulación) conducen a coagulopatía. La presencia de esta es un factor independiente de mal resultado clínico62–66.
El FBN es el primer factor plasmático en deplecionarse en la hemorragia activa; además, los niveles prequirúrgicos de FBN son predictivos del sangrado periquirúrgico66,95,96. Hay 3 formas de aportar FBN: PFC, crioprecipitado y concentrado de FBN. El compuesto más comúnmente usado en España es el concentrado de FBN, que también es un derivado del plasma, pero a diferencia del PFC y del crioprecipitado, no requiere pruebas cruzadas y se administra rápidamente (hasta 6g pueden administrarse en menos de 3min)97,98.
Pacientes con traumatismos sangrantesRecomendamos la administración de FBN para disminuir el sangrado y/o la tasa transfusional. 1C.
Las guías europeas sobre hemorragia en trauma recomiendan (nivel de evidencia 1C) administrar FBN en todos los casos de sangrado grave, siempre que la TEG muestre déficit de FBN y/o los niveles plasmáticos del mismo sean inferiores a 2g/L99. Revisiones recientes de estudios retrospectivos en pacientes con traumatismo sangrante concluyen que la administración de FBN con/sin CCP y guiada por TEG reduce la tasa transfusional y puede mejorar el resultado clínico62–67,95,96,100,101.
Pacientes quirúrgicosSugerimos la administración de FBN para disminuir el sangrado y la tasa transfusional. 2B.
En pacientes sometidos a cirugía de reparación de aneurisma abdominal sangrante, la administración masiva de PFC redujo significativamente la mortalidad del 39 al 15%, sugiriendo que la administración precoz de factores de coagulación puede mejorar el resultado clínico102. Además, la infusión preoperatoria y postoperatoria de altas dosis de FBN (6g en 2min) incrementó la firmeza del coágulo y disminuyó significativamente el sangrado y los requerimientos transfusionales de estos pacientes102. En un estudio retrospectivo que incluyó más de 3.000 pacientes intervenidos de cirugía cardiaca, la administración de FBN y CCP, guiada por TEG, redujo significativamente las tasas transfusional y de fenómenos tromboembólicos65. Un reciente RCT documentó que se debe administrar FBN y PFC para restaurar eficazmente la hemostasia103, mejor que el PFC solo. Un RCT que incluyó 20 pacientes sometidos a cistectomía radical documentó una disminución significativa de la tasa transfusional en el grupo tratado con FBN104. Solo una serie de 6 casos ha documentado que el FBN, junto con otros productos sanguíneos, puede controlar el sangrado en pacientes con hemorragia obstétrica105.
DosisEl PFC contiene aproximadamente 2g/L de FBN, por lo que se requieren grandes volúmenes de PFC (2L) para aumentar los niveles de FBN en 1g/L. El crioprecipitado es un derivado del plasma que contiene más altas concentraciones de FBN que el PFC66,95. No hay acuerdo sobre una dosis estándar de FBN. Se han administrado dosis profilácticas de 2g antes de la cirugía y de 6g en sangrados instaurados graves97,100, aunque la dosis publicada más habitual es entre 2 y 4g. La siguiente fórmula66 puede ser útil para calcular la dosis de FBN a administrar: dosis de FBN=incremento de FBN deseado (g/L)×volumen plasmático (L).
El volumen plasmático puede estimarse en 0,04L/kg. Como ejemplo, en un paciente sangrante de 70kg con FBN plasmático de 1g/L, que se quiere incrementar hasta 3g/L, la dosis a administrar sería 2×0,04×70=5,6g.
SeguridadEn general, el FBN es un fármaco seguro96. Sin embargo, su uso se ha asociado a mayor riesgo de isquemia coronaria66 y de fenómenos tromboembólicos arteriales y venosos solo cuando se administran dosis altas (hasta 12g)106. A pesar de derivar del PFC, no se han descrito infecciones transmitidas por FBN.
ResumenEl nivel de FBN es crítico para una hemostasia eficaz, siendo el factor que primero se depleciona en la hemorragia grave. Estudios observacionales y series de casos sugieren que la administración precoz de FBN puede ser eficaz en disminuir la tasa transfusional. Con frecuencia, se administra junto a PFC y CCP, lo que impide una valoración adecuada de su eficacia. Idealmente, la administración de FBN debería ser guiada por tromboelastometría, a la cabecera del paciente, en lugar de guiada por las pruebas de laboratorio convencionales107. No obstante, se precisan de estudios controlados con amplias series de sujetos, antes de recomendar la administración indiscriminada de FBN para el tratamiento del déficit adquirido de FBN en la hemorragia crítica108.
AntifibrinolíticosDentro de este grupo farmacológico se analiza la eficacia y seguridad del empleo de AXN y ¿-ACA. No consideramos el uso de aprotinina al haber sido retirada del mercado. El ATX y el ¿-ACA son análogos sintéticos de la lisina, que inhiben competitivamente la unión del plasminógeno a los residuos de lisina en la superficie de fibrina, evitando la conversión del plasminógeno a plasmina. El ATX es 10 veces más potente que el ¿-ACA.
Cirugía ortopédica mayorSugerimos el tratamiento con ATX para disminuir el sangrado y/o la tasa transfusional. 2A.
El análisis de los estudios con protocolo de transfusión muestra que en PTC109 y PTR110 la administración iv de ATX redujo hasta un 25% el volumen del sangrado perioperatorio y las necesidades de TSA. La administración tópica de ATX, mediante irrigación o inyección intraarticular, también reduce el sangrado postoperatorio, pero su efecto en la reducción de TSA es menos evidente111. En cirugía de columna vertebral, mayoritariamente escoliosis, la administración de ATX, en combinación con otras técnicas, reduce de forma dosis dependiente los volúmenes del sangrado y de TSA, pero generalmente no afecta al porcentaje de pacientes que reciben TSA112–114. No recomendamos la administración de ¿-ACA para disminuir el sangrado y/o la tasa transfusional. 1B.
Los resultados de un metaanálisis no muestran un efecto beneficioso sobre la disminución de TSA en pacientes de cirugía ortopédica (RR: 0,73; IC 95% 0,20-1,73)115.
Cirugía cardiacaRecomendamos el tratamiento con ATX para disminuir el sangrado y/o la tasa transfusional. 1A.
En comparación con el placebo, el ATX redujo la tasa transfusional y el riesgo de reoperación por sangrado persistente o recurrente en pacientes sometidos a cirugía cardiaca con CEC116. En cirugía de revascularización miocárdica sin CEC, la administración de ATX redujo el riesgo de recibir TSA117. La administración tópica de ATX redujo el sangrado postoperatorio, pero no las necesidades de TSA118. Recomendamos el tratamiento con ¿-ACA para disminuir el sangrado y/o la tasa transfusional. 1B.
En cirugía cardiaca con CEC, la administración de ¿-ACA redujo los requerimientos de TSA y las reexploraciones por sangrado116. Por otra parte, en el estudio BART, ¿-ACA y ATX mostraron una eficacia similar en la reducción del sangrado y de los requerimientos de TSA119. Además, ambos agentes producen estos efectos incluso en pacientes en tratamiento con ácido acetilsalicílico120.
Cirugía hepáticaRecomendamos el tratamiento con ATX para disminuir el sangrado y/o la tasa transfusional. 1B.
En trasplante hepático, la administración de dosis altas de ATX iniciales y de mantenimiento redujo los requerimientos de TSA, mientras que la infusión continua de dosis bajas de ATX redujo la fibrinólisis, pero no los requerimientos transfusionales121. En un RCT de 214 pacientes sometidos a resección de tumores hepáticos, la administración de ATX redujo el sangrado intraoperatorio y la duración de la cirugía, y suprimió la necesidad de TSA122.
Otras cirugíasSugerimos el tratamiento con ATX para disminuir el sangrado y/o la tasa transfusional en pacientes sometidos cirugía ginecológica o urológica. 2A.
En cesárea electiva, un RCT con 660 pacientes mostró que la administración de ATX reduce el volumen de sangrado, el porcentaje de mujeres con un sangrado>1.000mL y la necesidad de administrar agentes uterotónicos123. En prostatectomía radical retropúbica, un RCT que incluyó 200 pacientes mostró que la administración de ATX redujo el sangrado intraoperatorio y el porcentaje de pacientes con TSA124.
Pacientes politraumatizados con hemorragia significativaRecomendamos el tratamiento con ATX para disminuir el sangrado y/o la tasa transfusional. 1B.
El resultado del estudio CRASH-2, un RCT de más de 20.000 pacientes realizado en 274 hospitales de 40 países, mostró que la administración de ATX en las primeras 8h siguientes al traumatismo redujo la mortalidad por todas las causas (14,5 vs. 16%), incluyendo la mortalidad por sangrado (4,9 vs. 5,7%)125. Más recientemente, un estudio retrospectivo de 896 heridos en combate mostró una asociación entre la administración de ATX y menores incidencias de coagulopatía y de mortalidad, especialmente entre los pacientes que necesitaron transfusión masiva126.
Hemorragia gastrointestinalSugerimos la administración de ATX para disminuir las pérdidas de sangre y mejorar el resultado clínico. 2A.
En un metaanálisis que incluyó pacientes con ulcus y erosiones de mucosas tratados con ATX iv se observó una reducción del sangrado recurrente, de la necesidad de cirugía y de la mortalidad. A pesar de estos excelentes resultados, se usa poco debido a la eficacia de otros fármacos y los tratamientos endoscópicos127.
DosisAcorde con los estudios analizados, las dosis más frecuentemente utilizadas fueron:
- -
PTR y PTC: una dosis inicial de 10-15mg/kg perioperatoriamente, seguida o no de la infusión de 1mg/kg/h durante 4-6h o de la repetición de la dosis inicial en el postoperatorio.
- -
Columna: una dosis inicial de 20-100mg/kg, seguida de la infusión de 10mg/kg/h durante 4-6h.
- -
Cirugía cardiaca con CEC y trasplante hepático: dosis inicial de 30mg/kg seguida de la infusión de 16mg/kg/h hasta el final de la cirugía (más 2mg/kg en el circuito de CEC).
- -
Cirugía cardiaca sin CEC: dosis inicial de 1g, seguida de la infusión de 200-400mg/h hasta el final de la cirugía.
- -
Uso tópico en cirugía cardiaca y ortopédica de 1-3g.
- -
Trasplante hepático: dosis inicial de 30mg/kg seguida de la infusión de 16mg/kg/h hasta el final de la cirugía.
- -
Cesárea: 1g preoperatorio.
- -
Prostatectomía: dosis inicial de 500mg/20min seguida de la infusión de 250mg/h hasta el final de la cirugía.
- -
Politraumatismos: 1g en 10min en las primeras 8h del traumatismo, seguido de la infusión de 1g en 8h.
- -
Hemorragia gastrointestinal: 3-6g/día iv durante 3 días.
Por su parte, el ¿-ACA solo parece eficaz en cirugía cardiaca. En el estudio BART se utilizó una dosis inicial de 10g seguida de la infusión de 2g/h hasta el final de la cirugía (no se añadió medicación al circuito de CEC)119.
SeguridadEn lo que se refiere a la seguridad, a pesar de que se ha atribuido a estos agentes riesgo trombogénico basándose en aportaciones individuales a la literatura médica, los estudios anteriormente analizados no han demostrado que el uso de antifibrinolíticos aumente el riesgo de episodios trombóticos, incluyendo infarto de miocardio, accidente cerebrovascular, trombosis venosa o embolia pulmonar, ni de mortalidad. Se ha descrito un incremento de la frecuencia de convulsiones postoperatorias en pacientes de cirugía cardiaca que recibieron dosis altas de ATX, especialmente en aquellos con antecedentes de disfunción renal128,129.
ResumenLos agentes antifibrinolíticos sintéticos (ATX y ¿-ACA) se utilizan en un amplio abanico de condiciones hemorrágicas o de riesgo hemorrágico. Han mostrado eficacia en la reducción de las pérdidas sanguíneas, de las necesidades transfusionales y del número de reintervenciones por sangrado en cirugía y politraumatismos. Con la excepción de la cirugía cardiaca, la eficacia del ATX parece superior a la del ¿-ACA. Sin embargo, los estudios aleatorizados no han demostrado que el uso de antifibrinolíticos aumente el riesgo de episodios trombóticos, ni de mortalidad. En cirugía ortopédica se necesitan más estudios de seguridad antes de establecer una recomendación definitiva de estos fármacos, donde su uso está fuera de las indicaciones aprobadas.
DesmopresinaLa desmopresina (DDAVP) es un análogo sintético de la vasopresina que muestra propiedades hemostáticas derivadas de su capacidad de incrementar la adhesividad plaquetaria (aumenta la expresión del receptor GPIb plaquetario) y de incrementar los niveles plasmáticos de los factores viii y von Willebrand desde sus lugares de producción en las células endoteliales.
Pacientes sometidos a cirugía electivaNo recomendamos el tratamiento con DDAVP para disminuir el sangrado y/o la tasa transfusional en pacientes sometidos a cirugía electiva sin enfermedad de von Willebrand. 1A.
Un metaanálisis realizado sobre 18 estudios con un total de 1.295 pacientes ha determinado que la administración de DDAVP no redujo las pérdidas sanguíneas ni la tasa transfusional130.
DosisEl incremento de los niveles plasmáticos de factor von Willebrand se produce unos 60min después de la administración de 0,3μg/kg-1 de DDAVP, independientemente de su vía de administración (iv, subcutánea o nasal), pudiéndose mantener su efecto 5-10h. No obstante, debe recordarse que este fármaco produce taquifilaxia, o sea, el agotamiento de las reservas del factor von Willebrand endotelial por la reiteración de dosis con pérdida de efectividad a las 24h1.
SeguridadNo se han observado efectos estadísticamente significativos sobre la mortalidad, el infarto de miocardio, o la tasa de reintervención por sangrado, en los pacientes tratados con DDAVP, en comparación con el grupo control130.
ResumenLa DDAVP incrementa la adhesividad plaquetaria y los niveles plasmáticos de los factores viii y von Willebrand. Se utiliza con éxito en la prevención y control de la hemorragia en pacientes afectos de enfermedad de von Willebrand leve o moderada, pero fuera de este contexto, su eficacia no está demostrada. Por tanto, no se recomienda la administración preoperatoria de DDAVP en pacientes quirúrgicos sin trastornos hemorrágicos congénitos, ya que no disminuye el volumen de sangrado ni las TSA.
Factor vii activado recombinanteEl rFviia es un preparado con propiedades procoagulantes, que fue desarrollado inicialmente para el tratamiento de la hemorragia en pacientes hemofílicos con inhibidores contra los factores viii y ix, y en pacientes con hemofilia adquirida. En Europa, la autorización se extiende a pacientes con deficiencia selectiva de factor vii y trombastenia de Glanzmann.
Pacientes con hemorragia refractaria a la hemostasia quirúrgica y soporte hemoterápicoSugerimos el uso de rFviia para el tratamiento de hemorragia grave refractaria. 2C.
El rFviia se ha empleado en pacientes con hemorragia crítica en el contexto de diferentes procedimientos quirúrgicos y no quirúrgicos, como trauma, cirugía cardiaca y hepática o hemorragia posparto. Sin embargo, no se ha observado efecto beneficioso sobre la mortalidad y solo un efecto variable sobre la morbilidad y requerimientos transfusionales99,131–133. Si bien se han publicados diversas revisiones y metaanálisis indicando, en algunos casos, una reducción de la necesidad de transfusión, no existe una clara indicación para su uso. Un estudio en pacientes con trauma y hemorragia activa fue suspendido al observarse tasas similares de mortalidad entre los grupos tratado y placebo (12 vs. 11%)134. De forma similar, no se observó efecto beneficioso en pacientes con HIC o secundaria a varices esofágicas135,136.
Una revisión sistemática en la que se evaluó el rFviia en 5 indicaciones: HIC, cirugía cardiaca, trauma, trasplante hepático y prostatectomía, concluyó que no hay evidencia de reducción de la mortalidad con el rFviia y que, en algunas de las indicaciones, aumenta el riesgo de tromboembolismo137.
DosisSi bien las dosis de rFviia varían entre los diferentes estudios (9-100μg/kg), cuando se administra a pacientes con hemorragia crítica refractaria que requieren transfusión masiva, una dosis de 90μg/kg parece razonable.
SeguridadSe han reportado efectos secundarios importantes, sobre todo complicaciones tromboembólicas, con el empleo de rFviia138,139. En un metaanálisis reciente de 35 estudios aleatorizados en más de 4.000 sujetos, la incidencia de eventos trombóticos arteriales fue de 5,5%, y de eventos coronarios, de 2,9%, significativamente superiores al placebo. Esta diferencia fue más acentuada en pacientes mayores de 65 años (9 vs. 4,1%, p=0,02)139.
ResumenNo hay evidencia científica de calidad suficiente que apoye el uso indiscriminado de rFviia en el sangrado grave para prevenir la hemorragia ni reducir los requerimientos tranfusionales. El diseño de varios de estos estudios es complejo y las series son demasiado pequeñas para constatar un claro beneficio. Excepcionalmente, puede plantearse en pacientes con riesgo vital extremo que persiste tras las medidas convencionales para el control de la hemorragia. Considerando la falta de evidencia y que los riesgos pueden exceder los beneficios, debería reservarse la administración de rFviia como terapia en hemorragias intratables de etiología médica o quirúrgica. Por consiguiente, la administración de este producto debe realizarse de manera individualizada atendiendo al cuadro clínico, las características del paciente y el criterio médico, valorando en cada caso la relación riesgo/beneficio.
Alternativas farmacológicas a la transfusión de sangre alogénica para incrementar la eritropoyesisHierroEs bien conocido que el nivel preoperatorio de Hb es el principal factor independiente de riesgo de recibir TSA. La eritropoyesis precisa de una médula ósea sana con un aporte adecuado de diferentes nutrientes (Fe y vitaminas C, B1, B6, B12 y fólico) y hormonas (eritropoyetina, tiroideas y esteroideas). Ante la falta de información sobre otros hematínicos, solo se analiza el posible beneficio de la administración de Fe oral e iv para evitar o reducir la tasa transfusional. No se recomienda la vía intramuscular.
Hierro oralCirugía de cáncer de colon u ortopédica. Tratamiento preoperatorioSugerimos el tratamiento con Fe oral para mejorar el nivel prequirúrgico de Hb y reducir la tasa transfusional. 2B.
Cirugía de cáncer de colon. En pacientes anémicos, la administración de sales ferrosas, entre 14 y 30 días antes de la cirugía, mejora el nivel de Hb y disminuye la tasa transfusional140,141.
Cirugía ortopédica. En pacientes programados para PTR o PTC, la administración de Fe, junto con la aplicación de un protocolo transfusional restrictivo, mejoró la Hb, redujo la tasa transfusional y, en algunos casos, la estancia hospitalaria142,143.
Pacientes quirúrgicos. Tratamiento postoperatorioNo recomendamos el tratamiento con Fe oral para mejorar el nivel postoperatorio de Hb y disminuir la tasa transfusional. 1B.
Cirugía (mix). Los resultados de diversos RCT en pacientes sometidos a PTR, PTC, fractura de cadera y revascularización miocárdica mostraron que la administración de Fe oral no acelera la corrección de la anemia ni reduce la tasa de transfusión, pero incrementa los efectos adversos144-146.
Pacientes críticos (quirúrgicos y quemados). La administración de Fe oral disminuye la tasa transfusional, aunque solo cuando se incluyen pacientes con transfusiones previas147.
Hierro intravenosoPacientes quirúrgicos. Tratamiento preoperatorioSugerimos el tratamiento con Fe iv en pacientes anémicos, para mejorar los niveles de Hb y reducir la tasa transfusional. 2B.
Cirugía (mix). En pacientes anémicos programados para cirugía ortopédica, ginecológica o digestiva, la administración de Fe iv sacarosa o carboximaltosa corrigió la anemia y redujo la tasa de TSA148. En un estudio sobre 437 pacientes con cáncer colorrectal, el tratamiento multidisciplinar y temprano de los pacientes anémicos (74% con Fe iv) permitió optiminzar la Hb preoperatoria y reducir la TSA149. Sin embargo, en un RCT en cáncer de colon, la administración de Fe iv sacarosa no aumentó el nivel de Hb, aunque sí hubo una tendencia a una menor tasa transfusional150.
Pacientes quirúrgicos. Tratamiento perioperatorioSugerimos el tratamiento con Fe iv en pacientes con alta probabilidad de desarrollar anemia perioperatoria grave para reducir la tasa transfusional. 2B.
Cirugía ortopédica. En pacientes con fractura de cadera, la administración preoperatoria de Fe iv y la aplicación de terapia transfusional restrictiva mejora la tasa transfusional y la morbilidad postoperatoria, especialmente en pacientes no anémicos o con fractura subcapital151-153. En pacientes anémicos con fractura de cadera, la administración conjunta de Fe iv y rHuEPO (una dosis de 40.000UI) parece más eficaz en disminuir la tasa transfusional que la de Fe iv solo154,155. Del mismo modo, la administración de Fe iv (más 40.000UI de rHuEPO si Hb<13g/dl) redujo significativamente la tasa transfusional en pacientes sometidos a PTR156.
Pacientes quirúrgicos. Tratamiento postoperatorioSugerimos el tratamiento con Fe iv para mejorar los niveles de Hb y reducir la tasa transfusional. 2C.
Cirugía cardiaca. La administración de Fe iv con o sin rHuEPO no mejoró los niveles de Hb ni redujo la tasa transfusional. Sin embargo, se incrementaron los niveles de ferritina y de reticulocitos157.
Cirugía ortopédica. En PTC158 y cirugía de escoliosis infantil159, la administración de Fe iv mejoró los niveles de Hb y/o redujo la tasa transfusional.
Cirugía ginecológica tumoral o cesárea. La administración de Fe iv mejoró significativamente los niveles postoperatorio de Hb160,161.
Anemia posparto moderada o graveRecomendamos el tratamiento con Fe iv para la corrección de la anemia y la disminución de la tasa transfusional. 1B.
La administración de Fe iv sacarosa162,163 o carboximaltosa164,165 mejoró la anemia, los niveles de ferritina, la calidad de vida y la tasa transfusional.
Pacientes con enfermedad inflamatoria intestinalRecomendamos el tratamiento con Fe iv para la corrección de la anemia y la ferropenia, y reducir la tasa transfusional. 1B.
La administración de Fe iv sacarosa166,167 o carboximaltosa168, en comparación con Fe oral, es más eficaz en la corrección de la anemia y la reposición de los depósitos de Fe, produciendo, además, una menor tasa de efectos secundarios. El tratamiento con Fe carboximaltosa se ha mostrado superior al tratamiento con Fe sacarosa169.
Paciente oncológicoSugerimos la administración de Fe iv, sin agentes estimulantes de la eritropoyesis, para prevenir el descenso de Hb producido por la quimioterapia/radioterapia y reducir la tasa transfusional. 2B.
Los datos acumulados de 2 estudios realizados en 134 pacientes afectas de cáncer ginecológico y tratadas con quimioterapia y/o radioterapia asociadas, mostraron que la administración de Fe iv mejoró los niveles de Hb y redujo la tasa transfusional170,171. Recomendamos el tratamiento con Fe iv, como coadyuvante del tratamiento con agentes estimuladores de la eritropoyesis (AEE), para la corrección de la anemia inducida por quimioterapia y mejorar la tasa transfusional. 1A.
Un metaanálisis172 documentó que la administración de Fe iv más AEE corrige la anemia y mejora la tasa transfusional, sin aumentar los efectos adversos. Además, puede ser coste-efectivo, porque permite disminuir las dosis de AEE173.
DosisFe oral. Existe una enorme variabilidad en el contenido de Fe elemental entre las distintas formulaciones de Fe oral. Para el tratamiento de la anemia preoperatoria recomendamos una dosis de 100mg de Fe elemental/día durante 2-6 semanas, en función del tiempo disponible hasta la cirugía. En pacientes críticos, el único RCT publicado utilizó sulfato ferroso 325mg/día147.
Fe iv. Se debe administrar la cantidad de Fe necesaria para cubrir la deficiencia total de Fe (DTH), utilizando la fórmula de Ganzoni (DTH=[Hb objetivo-Hb actual]×peso×0,24+500), añadiendo 200mg más por cada 500ml de sangre perdida. La dosificación dependerá del preparado utilizado:
- -
Fe sacarosa: 3mg/kg/sesión, máximo 200mg/sesión, máximo 600mg/semana.
- -
Carboximaltosa de Fe: 20mg/kg/sesión, máximo 1.000mg/sesión, máximo 1.000mg/semana.
- -
Fe dextrano de bajo peso molecular: hasta 20mg/kg/sesión.
No se han descrito efectos adversos graves, aunque el número de pacientes quirúrgicos incluidos en los ensayos es insuficiente para extraer conclusiones. La frecuencia de efectos adversos graves con el Fe iv no dextrano es extremadamente baja174 y significativamente inferior a los efectos adversos de la transfusión convencional175. Una pequeña proporción de enfermos tratados con Fe dextrano presentan reacciones anafilácticas y, en mayor medida, anafilactoides. Respecto al riesgo de infección, en 32.566 pacientes en hemodiálisis no hubo correlación entre la administración de Fe iv e infección o mortalidad176. Por el contrario, el tratamiento con Fe iv en pacientes sometidos a cirugía con bajos niveles prequirúrgicos de ferritina se asoció a incremento de la tasa de infecciones periquirúrgicas177,178. Pendiente de nuevos datos, sería aconsejable evitar la administración de Fe iv en pacientes con infección activa.
ResumenLa deficiencia de Fe y la ferropenia son frecuentes entre los pacientes médicos, quirúrgicos y críticos. Por ello, la administración de suplementos de Fe contribuye significativamente a la corrección de la anemia y/o la reducción de la tasa transfusional. En principio, siempre que sea posible y se disponga del tiempo necesario, estos se deberán aportar en forma Fe oral (por ejemplo, sulfato ferroso) por su bajo coste, fácil administración y aceptable tolerancia. Sin embargo, si existe malabsorción, mala tolerancia o es necesario acelerar la respuesta al tratamiento, estaría plenamente justificado el uso de Fe iv, con el que se consiguen una respuesta medular y una repleción de los depósitos de Fe más completas y rápidas. Con la excepción del Fe dextrano de alto peso molecular, la administración de Fe iv presenta un muy buen perfil de seguridad y no incrementa el riesgo de infección, aunque no parece aconsejable en pacientes con infección activa.
EritropoyetinaLa rHuEPO, obtenida por ingeniería genética, fue inicialmente autorizada para tratar la anemia de la insuficiencia renal crónica. Tras su administración por vía subcutánea o iv, mimetiza los efectos de la eritropoyetina endógena estimulando la eritropoyesis, al inhibir la apoptosis de los precursores eritroides y promover su proliferación y maduración a eritrocitos. En la actualidad, sus indicaciones se han ampliado para corregir la anemia y evitar la TSA de pacientes con quimioterapia, en neoplasias no mieloides, en programas de donación preoperatoria de sangre autóloga y en cirugía ortopédica programada.
Cirugía ortopédica programadaRecomendamos la administración preoperatoria o perioperatoria de rHuEPO para reducir la tasa transfusional, siempre que la anemia sea moderada (Hb entre 10 y 13g/dL), y el riesgo de sangrado lo sea también. 1A.
En un metaanálisis sobre 3 ensayos aleatorizados sobre 684 pacientes con anemia moderada y candidatos a cirugía protésica, la administración preoperatoria de rHuEPO redujo significativamente el riesgo de recibir TSA179. Posteriormente, 2 RCT (896 pacientes)180,181 y un estudio de casos y controles (770 pacientes)182 han documentado una reducción similar del riesgo de recibir TSA.
Otras cirugíasSugerimos la administración de rHuEPO para reducir la tasa transfusional en pacientes anémicos sometidos a cirugía mayor. 2A.
Cirugía cardiaca. En un metaanálisis de RCT sobre el uso de eritropoyetina en pacientes anémicos candidatos a cirugía cardiaca con CEC, la administración de rHuEPO redujo la tasa transfusional183. Más recientemente, 3 RCT han demostrado la utilidad de la administración de una dosis única de rHuEPO en el preoperatorio inmediato para reducir los requerimientos transfusionales en intervenciones con o sin CEC184–186. Sin embargo, no hay evidencia de que la rHuEPO acelere la recuperación de anemia postoperatoria en estos pacientes157.
Cáncer gastrointestinal. Varios RCT, principalmente en pacientes con cáncer colorrectal, han mostrado un aumento de los niveles de Hb y una disminución de la TSA, aunque las dosis de rHuEPO y la duración del tratamiento variaban de unos estudios a otros. No obstante, pudo comprobarse que la eficacia de rHuEPO se incrementó con el tratamiento adyuvante con Fe iv187–189.
Pacientes críticosNo recomendamos el uso de rHuEPO para tratar la anemia y reducir la tasa transfusional en pacientes que no tengan una indicación previa, con la posible excepción de aquellos con traumatismos, especialmente con traumatismo craneoencefálico grave. 1A.
Se ha documentado que cuando existe un criterio restrictivo de transfusión, la administración de rHuEPO solo disminuye discretamente los requerimientos transfusionales, sin mermar la mortalidad190. Además, solo se observó un incremento neto de Hb en un estudio en el que se administró terapia coadyuvante con Fe iv191. No obstante, los pacientes críticos más jóvenes (<55años), con menores índices de gravedad inicial, diagnóstico de politraumatismo y tratados con eritropoyetina, presentaron mejores índices de supervivencia192. Algo similar ocurre en el caso de pacientes anémicos con traumatismo craneoencefálico grave193.
DosisCirugía ortopédica. Se han aprobado 2 protocolos distintos de administración de rHuEPO en cirugía ortopédica: 4 dosis de 600UI/kg/semana subcutáneas comenzando 3 semanas antes, o 15 dosis de 300UI/kg/día empezando 10 días antes de la intervención y continuando 4 días después de la misma. Protocolos similares se han utilizado en cirugía cardiaca y oncológica. Aunque la eficacia de estos 2 protocolos ha sido plenamente contrastada, se desconoce cuál es la dosis mínima eficaz de rHuEPO para reducir las TSA en estos pacientes, y otros autores han observado resultados similares con dosis más bajas156,180,183–185,194,195, especialmente con terapia coadyuvante con Fe iv.
SeguridadDiversas agencias gubernamentales (FDA, EMEA y AEMPS) han emitido alertas sobre la asociación entre el uso de rHuEPO y el incremento del riesgo de fenómenos tromboembólicos y de la mortalidad, en pacientes con tratamientos a largo plazo por anemia debida a insuficiencia renal crónica o quimioterapia por cáncer, así como en pacientes de cirugía ortopédica sin profilaxis tromboembólica196. Sin embargo, los RCT analizados sobre la seguridad de la administración de rHuEPO en pacientes quirúrgicos y críticos han documentado que no hay diferencias significativas con respecto a la tasa de trombosis venosa profunda y a otros eventos trombóticos de relevancia clínica, entre el grupo control y el grupo tratamiento con rHuEPO, siempre que los pacientes recibieran profilaxis antitrombótica farmacológica. No obstante, hay que recordar que, salvo en los pacientes de cirugía ortopédica programada y los incluidos en un programa de donación autóloga, el uso de la rHuEPO es una indicación «off-label». Por tanto, los datos disponibles sugieren que sería necesario ajustar la dosis de rHuEPO, administrando además Fe preferentemente por vía iv, así como prestar especial atención a la profilaxis antitrombótica y quizás antiagregante plaquetaria191,197,198.
ResumenLa rHuEPO está indicada para corregir la anemia y evitar la TSA de pacientes de cirugía ortopédica programada, y para facilitar el cumplimiento de los programas de donación preoperatoria de sangre autóloga cuando se soliciten≥3 unidades. La máxima eficacia del tratamiento con rHuEPO para reducir la TSA se consigue en los pacientes con niveles de Hb entre 10 y 13g/dl, en los que además este no parece inducir un aumento en la incidencia de complicaciones trombóticas. No obstante, debe tenerse en cuenta la baja incidencia de estos efectos adversos, y que la mayoría de los estudios con rHuEPO se han realizado en pacientes sin patología cardiovascular. Por ello, sería recomendable ajustar la dosis de rHuEPO individualmente, asegurando el suministro de Fe a la médula ósea y proporcionando una profilaxis antitrombótica adecuada. La rHuEPO también podría utilizarse en el tratamiento de la anemia de pacientes quirúrgicos no ortopédicos, aunque se trataría de uso «off-label», pero no se recomienda su utilización en pacientes críticos que no tengan una indicación previa para este fármaco, con la posible excepción de los pacientes con traumatismos, especialmente traumatismo craneoencefálico grave.
Alternativas a la transfusión de sangre alogénica para incrementar el transporte de oxígenoCristaloides y coloidesLa corrección de la hipovolemia mediante la administración iv de cristaloides y/o coloides es prioritaria y constituye la primera ATSA a considerar ante cualquier tipo de anemia aguda o subaguda de origen hemorrágico, ya que la tolerancia del organismo a la hipovolemia es mucho menor que a la anemia. Los cristaloides más empleados son la solución salina isotónica al 0,9%, la solución de Ringer y otras soluciones «balanceadas», como la de Hartmann (Ringer lactato). Habitualmente solo el 25% del volumen administrado permanece en el espacio intravascular. Son baratas, no alteran la hemostasia ni la función renal, y hay una gran experiencia en su empleo, sobre todo con la salina isotónica al 0,9%. Las soluciones cristaloides hipertónicas (ClNa 1,8-7,2%) pueden mejorar la hipovolemia y tendrían las teóricas ventajas de una corrección más rápida de la hipovolemia y una mejoría en la corrección del edema cerebral. Sin embargo, no existen pruebas concluyentes de su eficacia y pueden dar lugar a hipernatremia. Los coloides disponibles son los hidroxietil almidones (HEA), las gelatinas y la albúmina humana. La infusión de albúmina al 5% produce una expansión plasmática igual al 75% del volumen infundido. Las gelatinas, dado su bajo peso molecular, tienen una vida media intravascular corta (2-3h) y su capacidad expansora es limitada (70-80%). Los HEA al 6% tienen una vida intravascular media más larga (6-8h) y mayor capacidad expansora (80-120%). Los HEA son, en la actualidad, los coloides más usados para la expansión de volumen199.
Pacientes con pérdidas leves o moderadas de sangreRecomendamos el tratamiento inicial con fluidos (cristaloides y/o coloides) para disminuir la tasa transfusional. 1C.
Los pacientes con hemorragia leve o moderada (menos del 30% de la volemia o menos de 1.300cc), sin datos de sangrado adicional, pueden ser manejados con cristaloides120,201. La adecuada reposición del volumen circulante, y por tanto del gasto cardiaco, permite el mantenimiento del aporte de oxígeno a los tejidos. Los coloides podrían reservarse para los pacientes con inestabilidad hemodinámica a pesar de la infusión de cristaloides202,203.
Pacientes con pérdidas graves de sangreRecomendamos el tratamiento inicial con fluidos (cristaloides y/o coloides) para disminuir la tasa transfusional. 1C.
Los pacientes con hemorragia grave (pérdida del 30-40% de la volemia) pueden ser manejados inicialmente con cristaloides200,201. Se ha recomendado la infusión de bajos volúmenes de Ringer lactato, conteniendo solo el isómero L del lactato, con el objetivo de mantener una presión arterial sistólica de 80-90mmHg (hipotensión controlada o permisiva)204. No obstante, parece justificado añadir coloides y/o fármacos vasoactivos, tras la reanimación inicial con cantidades moderadas de cristaloides. Una vez restablecida la volemia, se valorará la necesidad de TSA según pruebas complementarias y pérdidas estimadas. Un metaanálisis que comparó varios almidones concluyó que la administración de HEA 130/04 puede reducir significativamente las necesidades transfusionales en cirugía mayor205.
Pacientes con sangrado críticoSugerimos el tratamiento inicial con fluidos (cristaloides y/o coloides), seguido de la transfusión de hemocomponentes y derivados plásmaticos, para disminuir la tasa transfusional. 2B.
Para los pacientes con hemorragia crítica (más del 40% de la volemia), que no responden a la infusión inicial de 2L de fluidos, presentan sangrado grave con deterioro hemodinámico o una pérdida de sangre de 150ml/min, se recomienda la transfusión inmediata de hemoderivados206. El pronóstico de estos pacientes empeora sensiblemente cuando presentan la tríada letal de coagulopatía, acidosis e hipotermia. Clásicamente, se pensaba que la coagulopatía era de origen tardío y debida a la pérdida de factores de coagulación por la hemorragia, junto con la dilución de los ya existentes por la infusión de fluidos. Ello justificaba la transfusión de hemoderivados con bajas ratios de transfusión, concentrado de hematíes:plasma de 6:1 y de hematíes: plaquetas de 10:1.
Estudios recientes han documentado que la coagulopatía puede ser muy precoz, y hasta un tercio de los pacientes presentan coagulopatía en el momento de la admisión, antes de la infusión de fluidos64. La presencia de coagulopatía se asocia a mal pronóstico64. Se ha sugerido que la administración precoz de hemoderivados en ratio 1:1:1 (cantidades equiparables de concentrados de hematíes, plasma y plaquetas, el así llamado protocolo de transfusión masiva [PTM]), en lugar de grandes cantidades de fluidos, aumenta la supervivencia64,83. Sin embargo, debe recordarse que: 1) Esta práctica se basa en análisis retrospectivos, sujeta a una serie de limitaciones y sesgos; así, algunos estudios de tipo observacional han demostrado una asociación entre la administración inicial del PTM y buen resultado clínico, incluyendo disminución de la tasa transfusional y aumento de la supervivencia64,83,207, aunque otros no84,208,209; 2) el diseño del PTM en el traumatismo sangrante se realizó con datos provenientes del contexto militar, que es a menudo muy distinto del civil, y 3) no se ha demostrado de forma concluyente que el PTM disminuya la morbilidad o mejore la supervivencia en el paciente civil con traumatismo hemorrágico84,208,210,211. En una reciente revisión sistemática sobre este tema, los autores concluyen que faltan pruebas suficientes para indicar el uso de la ratio fija 1:1:1210. The European Massive Transfusion Guidelines99 y recientes revisiones de guías de práctica clínica84,208,210,211 no aportan recomendaciones específicas relativas a la ratio 1:1:1.
Hasta que no se publiquen nuevos estudios controlados, debería tenerse en cuenta que el enfoque tradicional, basado en la reposición de volumen, el control de la hemostasia y la transfusión de los hemocomponentes adecuados, puede ser válido para la inmensa mayoría de los pacientes sangrantes.
DosisSe recomiendan dosis iniciales de 3mL de cristaloides por mL de sangre perdida con una velocidad de infusión de 60-80mL/kg/h de cristaloides (preferiblemente Ringer lactato), mientras se controla la fuente de la hemorragia. El objetivo debe ser mantener una PAS de 90mmHg (hipotensión permisiva)204. Pacientes con traumatismo craneoencefálico pueden precisar de la infusión de mayores cantidades de fluidos para mantener la PAS.
Las soluciones de salino hipertónicas tienen el riesgo potencial de hipernatremia, por lo que solo se puede administrar una dosis única. Para la solución de ClNa al 7,2%, con o sin HEA, la dosis es de 4ml/kg. Su uso no está extendido.
Para los coloides, la dosis es de 1mL por mL de sangre perdida. La dosis máxima de HEA es de 20mL/kg/día para HEA 200/0,5 y de 50mL/kg/día para HEA 130/0,4. Para las gelatinas no existe en principio dosis máxima, dado que no se acumulan en el organismo, pero se recomienda no sobrepasar los 20mL/kg/día200,204.
SeguridadLa infusión de grandes cantidades de cristaloides (básicamente salino isotónico) se asocia a un aumento de la incidencia de náuseas, vómitos, edemas generalizados, disfunción pulmonar y acidosis metabólica hiperclorémica204. El Ringer lactato, en condiciones normales, se metaboliza rápidamente a bicarbonato, pero algunas observaciones clínicas y modelos animales han mostrado que no siempre se metaboliza correctamente, probablemente por una mala perfusión hepática en el shock, y podría dar lugar a acidosis metabólica. En condiciones ideales, el 25% del volumen de cristaloides infundido permanece en el compartimento vascular, mientras que el resto se distribuye por todo el compartimento extravascular. Un aumento de la permeabilidad capilar puede hacer que el volumen retenido en el compartimento vascular sea menor y aumente el edema intersticial.
Los efectos adversos de los coloides incluyen reacciones anafilactoides, prurito, coagulopatía y reacciones hemorrágicas, con incidencias diferentes según el tipo de coloide. Mientras las gelatinas producen más reacciones anafilactoides, los almidones pueden asociarse a prurito y coagulopatía. Los almidones de alto peso molecular pueden alterar la función renal en casos de enfermedad renal preexistente, sobre todo en pacientes sépticos. Aunque en general pueden inducir alteraciones en las pruebas de hemostasia, y disminuir la fortaleza del coágulo, es infrecuente que los de bajo peso molecular produzcan alteraciones con significación clínica que se traduzcan en complicaciones hemorrágicas. El almidón puede causar un descenso, dependiente de la dosis, de la actividad del factor viii, disfunción plaquetaria discreta y prolongación del tiempo de tromboplastina parcial activado. Aunque estos cambios parecen ser de etiología dilucional, se han descrito incrementos en el sangrado, sobre todo en pacientes con cirugía cardiaca. El pentalmidón tendría menores efectos (del peso molecular y grado de sustitución). Una reciente revisión de la Biblioteca Cochrane Plus concluyó que en los 63 RCT analizados no hay datos que demuestren que la reanimación con coloides, en lugar de cristaloides, reduzca el riesgo de muerte en pacientes con traumatismos, quemaduras o después de una cirugía212. Los pacientes sépticos reanimados con coloides, en lugar de cristaloides, tuvieron tasas más elevadas de mortalidad y fracaso renal213.
ResumenLas soluciones cristaloides son baratas, no alteran la hemostasia, no lesionan el riñón y hay gran experiencia en su empleo, aunque solo el 25% del volumen administrado permanece en el espacio intravascular. Las evidencias disponibles indican que los cristaloides son las soluciones de elección en el tratamiento inicial de la anemia aguda en la mayoría de los pacientes con hemorragia moderada a grave, siendo la solución salina isotónica la más empleada. En la hemorragia grave, se ha recomendado también la infusión de bajos volúmenes de Ringer lactato (60-80mL/kg/h), conteniendo solo el isómero L del lactato, con el objetivo de mantener una PAS de 80-90mmHg (hipotensión controlada o permisiva) No hay evidencia de que las soluciones coloides sean superiores a los cristaloides como ATSA. Se utilizan en casos de hemorragias graves e inestabilidad hemodinámica, asociadas a los cristaloides. Los almidones son los coloides más utilizados como ATSA, seguidos de las gelatinas, mientras que no se recomienda el uso de albúmina como expansor del plasma.
Perfluorocarbonados y hemoglobinas modificadasLos perfluorocarbonados (PrFC) son compuestos hidrocarbonados lineales, cíclicos o policíclicos, en los que los átomos de hidrógeno han sido sustituidos por átomos de fluorina. Se caracterizan por tener una alta capacidad de disolución de gases (O2, CO2, N y NO). Son biológicamente inertes y su capacidad para fijar y liberar oxígeno se basa en la solubilidad. La cantidad de oxígeno disuelto está directamente relacionada con la fracción de oxígeno inspirada por el paciente. Las HBOC son compuestos con capacidad transportadora de oxígeno, basados en la Hb (humana, animal o recombinante) y libres de elementos celulares.
Pacientes sangrantes y/o con necesidad de transfusión de sangre alogénica. Uso de perfluorocarbonadosNo es posible hacer ninguna recomendación relacionada con el uso de PrFC como alternativa a la transfusión de concentrado de hematíes. 0.
Se han publicado muy pocos estudios, la mayoría de los cuales muestran un incremento de efectos adversos asociados al uso de PrFC214–216. Actualmente no existe ningún PrFC aprobado en la Unión Europea para su uso como sustituto de la transfusión de sangre. En Rusia, Ucrania y México está autorizado el uso de Perftoran®. En un ensayo clínico realizado en México con Perftoran®, que incluyó 30 pacientes de cirugía cardiaca, no se encontraron diferencias significativas en ahorro de transfusión alogénica asociado a su uso217.
Pacientes sangrantes y/o con necesidad de transfusión de sangre alogénica. Uso de hemoglobinas modificadasNo es posible hacer ninguna recomendación relacionada con el uso de HBOC como alternativa a la transfusión de concentrado de hematíes. 0.
En un ensayo clínico en cirugía ortopédica, en el que se incluyeron 688 pacientes, se observó un descenso de las transfusiones alogénicas y un incremento de los efectos adversos en el grupo que recibió Hemopure®218. Del mismo modo, aunque hay casos publicados en los que la administración de PolyHeme® ha podido contribuir a la supervivencia de pacientes en circunstancias extremas219, un reciente ensayo clínico ha demostrado que su administración no aporta ninguna ventaja en cuanto a supervivencia ni en ahorro de transfusiones, presentando incluso una mayor tasa de efectos adversos220. Un ensayo clínico, diseñado como estudio de seguridad con Hemospan®, no ha detectado efectos adversos importantes221, sin embargo, en la actualidad no hay ningún producto aprobado en la Unión Europea para su uso como sustituto de la transfusión de sangre.
DosisNo es posible hacer recomendaciones referentes a las dosis.
SeguridadInicialmente la administración de HBOC se acompañaba de vida media intravascular muy corta y efectos adversos importantes, entre los que destacaban dolor abdominal, hipertensión y nefrotoxicidad. Actualmente, los productos disponibles, mediante técnicas de estabilización de las moléculas, presentan vida media intravascular más larga y aunque han reducido considerablemente la incidencia de efectos adversos, persisten notificaciones de hipertensión y fallo renal agudo asociado a su uso10,222. En general, la toxicidad relacionada con los PrFC incluye trombocitopenia, activación del complemento y liberación de citocinas, bloqueo del sistema reticuloendotelial, síntomas gripales y efectos a nivel del sistema nervioso central.
ResumenDe acuerdo con la evidencia científica disponible, el papel actual de las Hb sintéticas y de los coloides transportadores de oxígeno es mínimo, limitándose, en la práctica, a situaciones puntuales, y a suplir a las transfusiones de hematíes en casos de falta de disponibilidad de componentes sanguíneos humanos. Aunque el papel actual de los sustitutos artificiales de los hematíes es poco relevante, es probable que en un futuro no muy lejano las líneas de investigación abiertas den sus frutos y se consiga un producto capaz de incrementar la oxigenación tisular con un buen perfil de seguridad.
Conflicto de interesesLos autores han declarado recibir honorarios y/o ayuda de cualquier tipo, durante los 5 últimos años solo se recogen los intereses de los coordinadores y jefes de bloque: Santiago R. Leal-Noval (SEMICYUC): Octopharma, Baxter y Vifor-Uriach; Manuel Múñoz (SETS): Vifor Pharma, PharmaCosmos, Wellspect HealthCare y Roche; Maria Asuero (SEDAR): no conflicto; Enric Contreras (SEHH): no conflicto; José A. García-Erce (SETS): Amgen,Vifor-Uriach, Janssen, Novartis, Astra-Tech de Aztra Zeneca y Roche; Victoria Moral (SEDAR): no conflicto; Juan V. Llau (SEDAR): Baxter, CSL-Behring, Janssen, Fresenius-Kabi y Octapharma; José A. Páramo (SETH): no conflicto; Manuel Quintana (SEMICYUC): no conflicto.
Los autores agradecen a las Sociedades científicas y a sus presidentes, Dr Fernando Gilsanz (SEDAR), Dr José L Póveda (SEFH), Dra Carmen Burgaleta (SEHH), Dr José Cunyat (SEMICYUC), Dr Pascual Marco (SETH) y Dr Ramón Plá (SETS) el aval concedido al documento y la lectura crítica del mismo.
| S.R. Leal-Noval, C. Ferrándiz, V. Arellano, E. Fernández-Hinojosa y A. Puppo. Cuidados Intensivos, Hospital Virgen del Rocío, Sevilla. |
| M. Múñoz. Hematología, Medicina Transfusional, Universidad de Málaga. |
| M. Asuero. Anestesiología Ramón y Cajal, Madrid. |
| E. Contreras. Hematología, Banc de Sang i Teixits, Hospital Joan XXIII, Tarragona. |
| J.A. García-Erce. Hematología, Hospital S. Jorge, Huesca. |
| J.V. Llau. Anestesiología, Hospital Clínico de Valencia. |
| V. Moral, P. Paniagua, J.A. Fernández. Anestesiología, Hospital Sant Pau, Barcelona. |
| J.A. Páramo. Hematología, Clínica de Navarra. |
| M. Quintana, A. García de Lorenzo. Cuidados Intensivos, Hospital La Paz, Madrid. |
| M. Basora, C. Gomar. Anestesiología, Hospital Clinic Barcelona. |
| F.J. Bautista Paloma. Farmacia, Hospital Virgen Rocío, Sevilla. |
| E. Bisbe. Anestesiología, Consorcio Parc de Salut Mar. |
| J.L. Bóveda, J.C. Ruiz. Cuidados Intensivos, Hospital Vall d’Hebron, Barcelona. |
| A. Castillo Múñoz. Agencia Tecnología Sanitaria, Junta de Andalucía, Sevilla. |
| M.J. Colomina Anestesiología, Hospital Vall d’Hebron, Barcelona. |
| C. Fernández. Hematología, Hospital Cabueñes, Asturias. |
| E. Fernández-Mondéjar. Cuidados Intensivos, Hospital Virgen de las Nieves, Granada. |
| A. Gómez Luque. Anestesiología, Virgen de la Victoria, Málaga. |
| M. Izuel. Farmacia, Hospital Miguel Servert, Zaragoza. |
| V. Jiménez Yuste. Farmacia, Hospital La Paz, Madriz. |
| E. López-Briz. Farmacia, Hospital La fe, Valencia. |
| M.F. López-Fernández. Hematología, Hospital Rio Ortega, Valladolid. |
| J.A. Martín Conde. Farmacia: Hospital La Candelaria, Tenerife. |
| B. Montoro-Ronsano. Farmacia. Hospital Vall d’Hebron. |
| J.A. Romero Garrido. Farmacia, Hospital La Paz, Madrid. |
| R. Salinas-Argente. Hematología: Hospital mutua de Terrassa, Barcelona. |
| C. Sánchez. Anestesiología, Hospital de Elda, Alicante. |
| P. Torrabadella. Cuidados Intensivos, Hospital Trias i Pujol, Barcelona. |
| A. Candela. Farmacia, Hospital de Elche. |
Los autores y filaciones están relacionados en el anexo1.
Este documento se publica simultáneamente en Revista Española de Anestesiología y Reanimación, Medicina Intensiva, Farmacia Hospitalaria y Blood Transfusion.
Avalado por las Sociedades Españolas (orden alfabético): Anestesiología, Reanimación y Terapéutica del dolor (SEDAR), Farmacia Hospitalaria (SEFH), Hematología y Hemoterapia (SEHH), Medicina Intensiva Crítica y Unidades Coronarias (SEMICYUC), Transfusión Sanguínea (SETS), Trombosis y Hemostasia (SETH).