Evaluar la precisión diagnóstica de los criterios empleados para detectar al paciente realmente portador de microrganismos multirresistentes (MMR).
DiseñoEstudio prospectivo, observacional de mayo de 2014 a mayo de 2015.
ÁmbitoUnidad de cuidados intensivos polivalente.
PacientesCohorte de pacientes ingresados de forma consecutiva que cumplían los siguientes criterios de aislamiento preventivo basados en el proyecto «Resistencia Zero»: hospitalización de más de 4 días en los últimos 3 meses («hospital»); antibioterapia durante una semana en el último mes («antibiótico»), pacientes institucionalizados o en contacto con cuidados sanitarios («institución o cuidado»); portador de MMR los últimos 6 meses («MMR previo»).
VariablesVariables demográficas, resultados de los cultivos obtenidos con presencia o no de MMR y tiempo de aislamiento. Se realizó un análisis multivariable con regresión logística múltiple entre cada uno de los factores de riesgo y el que el paciente fuera portador de MMR.
ResultadosDurante el periodo de estudio ingresaron 575 pacientes y cumplieron los criterios de aislamiento un 28%. De los 162 pacientes con criterios 51 (31%) eran portadores de MMR y de los que no cumplían criterios 29 (7%) sí que eran portadores. En el análisis multivariable la única variable asociada de forma independiente con el ser portador fue «MMR previo», con una OR 12,14 (IC 95%: 4,24–34,77).
ConclusionesEl único criterio que se asoció de forma independiente con la capacidad de detectar los pacientes con MMR al ingreso en la UCI fue haber presentado un «MMR previo».
To assess the diagnostic accuracy of the criteria used to detect patients carrying multiresistant microorganisms (MRMs).
DesignA prospective observational study was carried out from May 2014 to May 2015.
SettingPolyvalent Intensive Care Unit.
PatientsA cohort of consecutively admitted patients meeting the following criteria for preventive isolation according to the “Zero Resistance” project: hospital length of stay>4 days in the last three months (“hospital”); antibiotherapy during one week in the last month (“antibiotic”); institutionalized patients or recurrent contact with healthcare (“institution or care”); MRM carrier in the last 6 months (“previous MRM”).
VariablesDemographic data, culture results and isolation time. A multivariate analysis was performed using multiple logistic regression between each of the risk factors and patient MRM carrier status.
ResultsDuring the study period, 575 patients were admitted, of which 28% met the isolation criteria (162). Fifty-one (31%) were MRM carriers. Of the patients who did not meet the criteria, 29 (7%) were carriers. In the multivariate analysis, the only variable independently associated to carrier status was “previous MRM”, with OR=12.14 (95%CI 4.24-34.77).
ConclusionsThe only criterion independently associated with the ability to detect patients with MRMs upon admission to the ICU was the existence of “previous MRM”.
Las infecciones producidas por microorganismos multirresistentes (MMR) son un problema creciente que ocupa las primeras posiciones entre las causas más importantes de muerte1. Esta situación ha sido reconocida por la Organización Mundial de la Salud, que afirmó que la resistencia a los antimicrobianos era una de las mayores amenazas para la salud pública mundial1,2.
El conjunto de medidas de aislamiento de contacto (lavado de manos, bata y guantes de un solo uso y cuando sea posible habitación individual) aplicadas de forma preventiva a aquellos pacientes que tengan factores de riesgo para ser portadores de MMR, son una medida básica para evitar su diseminación3–6. En la UCI, dadas las características de los pacientes ingresados y el uso de aparataje complejo que pueden hacer de vector o reservorio, existe un alto riesgo de transmisión cruzada de MMR y, por este motivo, en este medio, esas medidas de aislamiento preventivo pueden ser de mayor importancia7–9.
Sin embargo, estudios observacionales sugieren que las medidas de aislamiento preventivo son costosas, reducen las interacciones de los trabajadores de atención sanitaria con los pacientes y aumentan la ansiedad y la depresión entre los pacientes10. Por este motivo consideramos necesario minimizar el número de pacientes con aislamientos preventivos innecesarios.
La hipótesis de nuestro trabajo es que algunos criterios empleados inducen a la indicación de aislamientos preventivos no necesarios. El objetivo de este estudio es evaluar la precisión diagnóstica de los criterios empleados para detectar pacientes portadores de MMR y detectar el número de aislamientos no necesarios en nuestra población.
Pacientes y métodosEstudio prospectivo, observacional para evaluar la capacidad de detección del paciente portador de MMR de los distintos criterios de aislamiento preventivo en una UCI médico-quirúrgica de 10 camas de un hospital de nivel 2 de 250 camas.
Se realizó un cálculo de tiempo de reclutamiento necesario para alcanzar una cifra de al menos 150 aislamientos en función de los datos de los aislamientos preventivos realizados en la unidad en los años previos. Realizamos un análisis de una cohorte de pacientes ingresados de forma consecutiva durante un año (mayo de 2014 a mayo de 2015) que cumplían los siguientes criterios de aislamiento preventivo planteados por el proyecto «Resistencia Zero»11: hospitalización de más de 4 días en los últimos 3 meses («hospital»); antibioterapia intravenosa u oral durante al menos una semana en el último mes («antibiótico»), pacientes institucionalizados o en contacto con cuidados sanitarios (oncológicos, diálisis…) («institución o cuidado»); portador de MMR en algún momento en los últimos 6 meses («MMR previo»). En el caso de que el paciente se encontrara en planta de hospitalización en el momento del ingreso en la UCI y que su criterio de aislamiento fuera «MMR previo» solo se consideraba el aislamiento preventivo si existía alguna muestra negativa entre la positiva y el ingreso en la unidad; en caso contrario se realizaba aislamiento de contacto no preventivo. Los microorganismos considerados como MMR fueron el Staphylococcus aureus resistente a meticilina (SAMR), Enterococcus sp. resistente a vancomicina, enterobacterias productoras de betalactamasa de espectro extendido, enterobacterias productoras de carbapemenasas, enterobacterias resistentes a 3 o más familias utilizadas de forma habitual para su tratamiento; Pseudomonas spp. resistentes a 3 o más familias de antibióticos utilizados de forma habitual para su tratamiento; Acinetobacter spp. independientemente de su sensibilidad; Stenotrophomonas spp. independientemente de su sensibilidad.
Como parte del protocolo habitual de la Unidad se toman muestras de vigilancia a todos los pacientes mediante exudados nasales, faríngeos, rectales y de ostomías (colostomía, ileostomía, traqueotomía…) al ingreso y una vez a la semana hasta el alta de la UCI. En el caso de exudado nasal solo se analizaba el estado de portador de SARM. Las muestras clínicas quedan a criterio del médico responsable del paciente.
Las medidas de aislamiento incluían la higiene de manos obligatoria en los 5 momentos: a) antes del contacto con el paciente; b) antes de realizar una tarea aséptica; c) después del riesgo de exposición a líquidos corporales; c) después del contacto con el paciente; y d) después del contacto con el entorno del paciente12 con agua y jabón antiséptico si las manos están manchadas o con solución de base alcohólica si aparentemente están limpias3,13. En el momento de entrar en las habitaciones individuales el personal debía ponerse guantes y bata, y solo se usaba mascarilla quirúrgica si se iba a estar en contacto con la vía aérea del paciente3. El aislamiento se retiraba si la primera muestra de vigilancia (o clínica si la hubiera) del ingreso era negativa, o en caso de ser positiva se esperaba a tener 2 muestras negativas. En el caso de reingreso el paciente se consideraba como un nuevo caso.
Se analizaron las siguientes variables demográficas: edad, sexo, Simplified Acute Physiology Score 3 como score de gravedad al ingreso en la UCI, tipo de paciente (médico vs. quirúrgico considerándose paciente quirúrgico aquel que proviene de quirófano tras cirugía programada o urgente), estancia en UCI, mortalidad en UCI, mortalidad hospitalaria y tiempo de aislamiento.
Se definió el aislamiento preventivo innecesario cuando no se identifica un MMR en las muestras iniciales.
El estudio obtuvo la aprobación del comité de ética e investigación local.
Se exploró la normalidad de las variables continuas mediante el test de Kolmogorov. Las variables continuas se expresan como mediana y rango intercuartílico (p25-p75), dado que la mayoría no tiene una distribución normal. Las variables categóricas se expresan como número total y porcentaje. Se realizó un análisis de sensibilidad y especificidad de cada una de las variables y un análisis multivariable con regresión logística múltiple, con punto de corte 0,5, α 5% p<0,05 para entrar o salir del modelo entre cada uno de los factores de riesgo y el que el paciente fuera realmente portador de MMR.
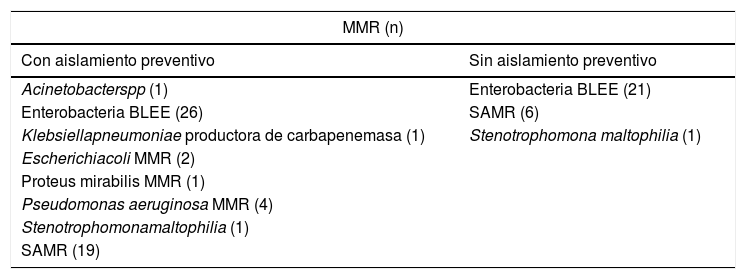
ResultadosDurante el periodo de estudio ingresaron 575 pacientes de los cuales cumplieron los criterios de aislamiento preventivo 162, que corresponde a un 28% del total de pacientes ingresados durante ese periodo. Las variables demográficas de los pacientes con aislamiento preventivo se exponen en la tabla 1. Los MMR detectados en los pacientes portadores, con o sin aislamiento preventivo, se muestran en la tabla 2.
Variables demográficas de los pacientes con necesidad de aislamiento preventivo
| Variables demográficas n=162 | |
|---|---|
| Edad, años mediana (p25-p75) | 66 (56-75) |
| Sexo mujer n (%) | 71 (44) |
| SAPS 3 mediana (p25-p75) | 50 (41-61) |
| Pacientes médicos, n (%) | 79 (49) |
| Estancia UCI, días, mediana (p25-p75) | 4 (3-8) |
| Mortalidad UCI, n (%) | 7 (4) |
| Mortalidad hospitalaria, n (%) | 17 (11) |
| Tiempo de aislamiento total, días, mediana (p25-p75) | 4 (3-5) |
| Estancia previa ingreso en UCI, días, mediana (p25-p75) | 1 (1-6) |
UCI: unidad de cuidados intensivos; SAPS 3: Simplified Acute Physiology Score 3.
MMR aislados en pacientes portadores
| MMR (n) | |
|---|---|
| Con aislamiento preventivo | Sin aislamiento preventivo |
| Acinetobacterspp (1) | Enterobacteria BLEE (21) |
| Enterobacteria BLEE (26) | SAMR (6) |
| Klebsiellapneumoniae productora de carbapenemasa (1) | Stenotrophomona maltophilia (1) |
| Escherichiacoli MMR (2) | |
| Proteus mirabilis MMR (1) | |
| Pseudomonas aeruginosa MMR (4) | |
| Stenotrophomonamaltophilia (1) | |
| SAMR (19) | |
BLEE: productora de betalactamasa de espectro extendido; MMR: multirresistente; SAMR: Staphilococcus aureus resistente a meticilina.
De los 162 pacientes con criterios de aislamiento preventivo 51 (31%) eran finalmente portadores de MMR al ingreso, independientemente de si era en una muestra clínica, de vigilancia o de ambas. En cuanto a los pacientes que no cumplían criterios de aislamiento preventivo (n=413) 29 pacientes sí que estaban colonizados y/o infectados por MMR al ingreso, lo que corresponde a un 7% (fig. 1).
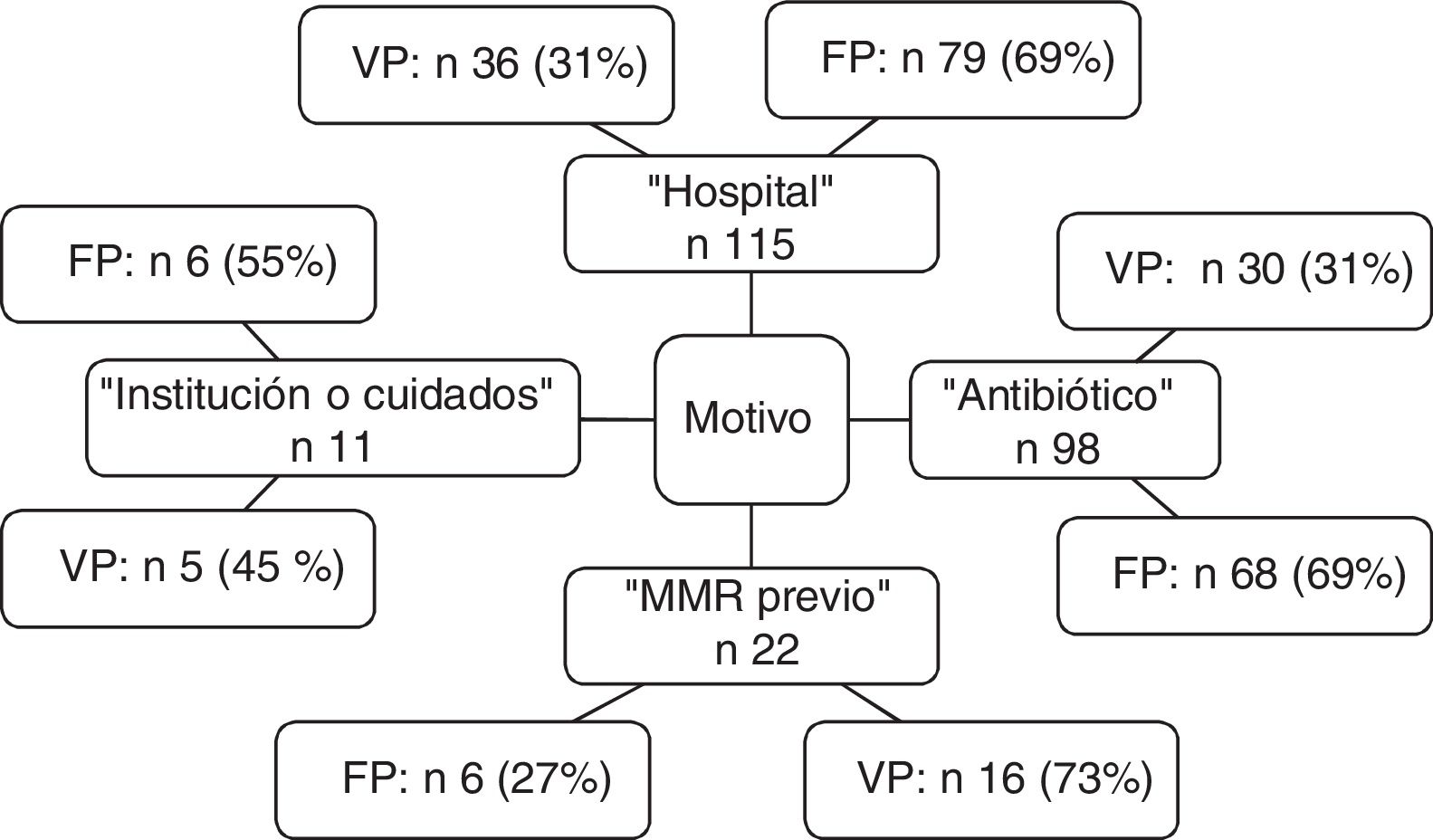
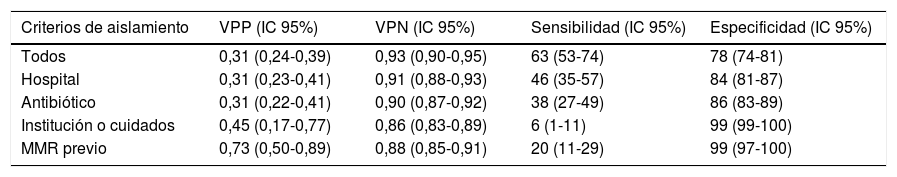
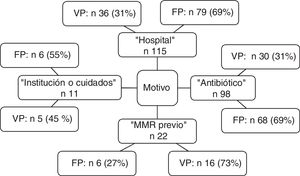
En cuanto a la distribución de los criterios de tener un MMR que llevaron al aislamiento preventivo se muestra en la figura 2. Es de destacar que el criterio «hospital» fue motivo de aislamiento en 115 pacientes, de los cuales se aislaron de forma innecesaria 79 (69%) pacientes, y en el caso de «antibiótico» de los 98 pacientes que se aislaron por cumplir con ese criterio 68 (69%) no eran portadores de MMR. La sensibilidad y la especificidad, así como los valores predictivo positivo y negativo de cada criterio se muestran en la tabla 3.
Análisis de sensibilidad y especificidad
| Criterios de aislamiento | VPP (IC 95%) | VPN (IC 95%) | Sensibilidad (IC 95%) | Especificidad (IC 95%) |
|---|---|---|---|---|
| Todos | 0,31 (0,24-0,39) | 0,93 (0,90-0,95) | 63 (53-74) | 78 (74-81) |
| Hospital | 0,31 (0,23-0,41) | 0,91 (0,88-0,93) | 46 (35-57) | 84 (81-87) |
| Antibiótico | 0,31 (0,22-0,41) | 0,90 (0,87-0,92) | 38 (27-49) | 86 (83-89) |
| Institución o cuidados | 0,45 (0,17-0,77) | 0,86 (0,83-0,89) | 6 (1-11) | 99 (99-100) |
| MMR previo | 0,73 (0,50-0,89) | 0,88 (0,85-0,91) | 20 (11-29) | 99 (97-100) |
IC 95%: intervalo de confianza 95%; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
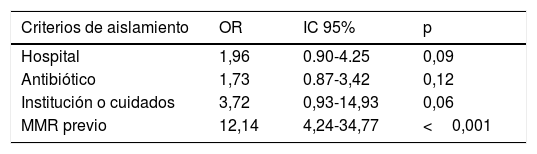
En el análisis multivariable la única variable asociada de forma independiente con el ser portador fue «MMR previo», con una OR 12,14 (IC 95%: 4,24–34,77) (tabla 4).
DiscusiónEn nuestro estudio observamos que los criterios utilizados para estimar el riesgo de que un paciente que ingresa en UCI sea portador de MMR conllevan un 69% de aislamientos preventivos innecesarios. Por el contrario, el porcentaje de pacientes que sin cumplir esos criterios estaban colonizados y/o infectados por MMR al ingreso es del 7%.
En nuestra unidad, en la que previamente ya se realizaban aislamientos preventivos de acuerdo a un protocolo local, se adoptaron los criterios de aislamiento del protocolo «Resistencia Zero»11. Este programa también se encuentra integrado en las recomendaciones para la estandarización del tratamiento de los pacientes críticos seleccionadas por un panel de expertos de los 13 grupos de trabajo de SEMICYUC, y entre ellos el de enfermedades infecciosas y sepsis14.
Las medidas de aislamiento preventivo, según criterios de alto riesgo de ser portador de MMR, están bien establecidos basándose en la transmisión cruzada a través fundamentalmente del personal sanitario15. Estas medidas son recomendadas por el European Centre for Disease Prevention and Control4, y han mostrado su eficacia en diferentes estudios, así An et al.16 encontraron que el instaurar vigilancia activa seguido de aislamiento y precauciones de contacto estaban inversamente relacionadas con la adquisición y consiguiente infección por Acinetobacter baumanii resistente a carbapenem en una UCI. En la misma línea Zhou et al.17, en una UCI de neonatos con un brote de Klebsiella productora de carbapemenasa, aplicaron entre otras medidas el aislamiento de los neonatos, con lo que consiguieron controlar el brote. En el trabajo de Matsumisha et al.7, después de detectar que los pacientes en la UCI tenían un riesgo 8 veces mayor de acabar siendo portadores de SAMR, aplicaron precauciones de contacto preventivo a todos los pacientes intubados, comparándolo con un periodo previo donde solo se aislaban si se confirmaba su estado de portador; encontraron que con el cambio la tasa de infección por SAMR se redujo de forma significativa (12,2% a 5,6%).
Sin embargo, otros estudios no encontraron una asociación entre el aislamiento y el control de la transmisión de los MMR, considerando que sería solo suficiente con un buen cumplimiento de las medidas básicas. A modo de ejemplo el estudio de McKinnell et al. comparó las medidas de aislamiento de contacto con solo lavado con clorhexidina para la prevención de la transmisión de SAMR, no encontrando un aumento de la adquisición de SARM entre los pacientes de la UCI. O como el de Ho et al.18, que determinaron la eficacia de las políticas de precaución de contacto universales en la resistencia antimicrobiana sobre la colonización o infección por MMR antes y después de la implementación de las medidas en el paciente quemado no encontrando diferencias. Incluso se observó en un estudio19 que realizó un análisis de coste-efectividad de 3 estrategias de prevención, incluida la descolonización universal, la descolonización dirigida y el cribado y el aislamiento encontrando que la descolonización dirigida y universal es menos costosa y más efectiva que la detección y el aislamiento para prevenir infección por SAMR.
Aparte de la controversia planteada en cuanto a la efectividad del aislamiento preventivo, para evitar la diseminación de los MMR es de destacar que los aislamientos de contacto realizados a los pacientes con sospecha de ser portadores de MMR no están exentos de efectos adversos. En un estudio reciente Searcy et al.20 encontraron que los pacientes con aislamiento, aunque no recibieron mayor sedación, sí que tuvieron mayor estancia en UCI y mayor tiempo de ventilación mecánica. Morgan et al. mostraron que el aislamiento de contacto se asociaba a que el personal sanitario entraba con menor frecuencia a la habitación del paciente, a una menor satisfacción por parte del paciente y a un mayor número de efectos adversos prevenibles, incluido caídas, úlceras de decúbito e hipoglucemia21–23.
Esto nos lleva a pensar si realmente son necesarias las medidas de aislamiento y si mantener unas medidas básicas adecuadas, como el lavado con clorhexidina universal o sobre todo el lavado de manos, que disminuye la transmisión cruzada y sobre la que no existe controversia en su utilidad, sería suficiente24. Sin embargo, ante los resultados contradictorios nos planteamos que debíamos asegurarnos de que los aislamientos preventivos innecesarios fueran los menos posibles, y para ello la necesidad de averiguar qué criterios eran los más adecuados para evitarlos. Álvarez de Lerma et al. comprobaron el impacto de un protocolo consensuado de aislamiento preventivo al ingreso en una UCI, consiguiendo reducir significativamente los aislamientos preventivos no indicados correctamente25. Cuando analizamos los criterios de forma individual se aprecia que aunque significativamente son capaces de detectar pacientes portadores de MMR, también presentan un número muy elevado de falsos positivos, y en consecuencia aislar un número significativo de pacientes que no hubiera sido preciso. El número de pacientes en los que se realizó este aislamiento «no necesario» en nuestra población fue de 111 (19% de los pacientes ingresados en este período) con un tiempo medio de aislamiento de 5 días, lo que supuso 555 estancias con aislamiento no preciso. Este dato no es desdeñable si tenemos en consideración los posibles efectos adversos mencionados previamente asociados al aislamiento de los pacientes. Este hecho podría reducirse con el uso de técnicas de laboratorio de detección precoz que nos permita retirar el aislamiento de forma temprana en los pacientes no portadores26. Cabe destacar que los criterios «hospital» y «antibiótico» presentan un 69% de falsos positivos, cifra no desdeñable si recordamos los efectos negativos asociados a un aislamiento innecesario.
Con todo ello consideramos que ajustar los criterios para realizar un aislamiento preventivo adecuado solo a los pacientes con alto riesgo de ser portadores de MMR es de suma importancia. En nuestro estudio el único criterio que se asoció de forma independiente con el riesgo de ser portador de MMR fue «MMR previo», con un porcentaje de verdaderos positivos del 73%.
Como debilidad de nuestro estudio destacar que se trata de un trabajo realizado en un solo centro, con un número limitado de pacientes y con una ecología local específica. Por otra parte se han incluido tanto los pacientes portadores de MMR en muestra clínica o de vigilancia o en ambas, lo que por una parte aumenta la capacidad de detección, pero como las muestras clínicas son dependientes del médico responsable del paciente podría llevar a un sesgo. En el momento de retirar el aislamiento, y por lo tanto el tiempo del mismo en el caso de que se tratara de portador en muestra clínica y no en muestra de vigilancia, se esperaba a la negativización de 2 muestras de vigilancia para no tener que someter al paciente a nuevas punciones, como ocurre en el caso de los hemocultivos, todo ello podría ser un factor de confusión. Con nuestros resultados observamos, por lo tanto, que ajustando los criterios se podría reducir tanto el número total como las estancias de pacientes aislados innecesariamente. Sería útil realizar un estudio en este sentido para asegurar que al reducir los criterios de aislamiento no se aumente de forma significativa los pacientes sin criterio, pero portadores de MMR.
ConclusiónEl protocolo de aislamiento preventivo conllevó un 69% de aislamientos no necesarios y no detectó la presencia de MMR en el 7% de los pacientes sin criterios de aislamiento. El único criterio que se asoció de forma independiente con la capacidad de detectar los pacientes con MMR al ingreso en la UCI fue haber presentado un MMR en los últimos 6 meses.
AutoríaFederico Gordo y Ana Abella han efectuado el diseño del estudio.
Todos los autores han contribuido a la recogida de datos.
Federico Gordo, Ana Abella y David Varilla ha realizado e análisis de los resultados. Ana Abella y Federico Gordo han elaborado el manuscrito. Todos los autores han contribuido a la revisión crítica del manuscrito.
Conflicto de interesesNinguno.