Editado por: F. Baigorri-González y J.º. Lorente Balanza
Última actualización: Abril 2005
Más datosANTECEDENTES
La sepsis es la respuesta sistémica a la infección y se reconoce a través de una constelación de signos clínicos, hemodinámicos, hematológicos, bioquímicos e inflamatorios, que son consecuencia de la liberación de una gran cantidad de mediadores inflamatorios. La sepsis, el shock séptico y el síndrome de disfunción multiorgánica (SDMO) se han convertido en la primera causa de muerte en las Unidades de Cuidados Intensivos. En los Estados Unidos, por ejemplo, desarrollan sepsis unos 751.000 pacientes anualmente, tres casos por 1.000 habitantes y año, con una mortalidad global del 28,6%. En Europa Occidental, se diagnostican entre 400.000 y 500.000 casos de sepsis anualmente, de los que un 40%-70% desarrollan shock séptico con una mortalidad del 40% cuando existe bacteriemia. Si la sepsis se asocia a hipotensión, la mortalidad asciende al 50% y alcanza el 70%-90% de mortalidad en enfermos con SDMO. En España, se producen alrededor de 74.000 casos de sepsis al año, de los que un 40% presenta shock séptico con una mortalidad asociada a la sepsis del 35%.
La respuesta inflamatoria comienza con el reconocimiento celular de uno o varios de los componentes del microorganismo, lo que trae como consecuencia la activación de la célula y la síntesis de proteínas que modifican la respuesta efectora de la célula inmunitaria. En la respuesta inmune a la infección, estos mediadores provocan el reclutamiento de las células adyacentes a través de un proceso paracrino. Cuando la liberación de mediadores excede las fronteras locales, se diseminan y distribuyen a través de los linfáticos o la sangre, produciendo una activación celular generalizada de tipo endocrino, que se corresponde con el cuadro clínico del síndrome de respuesta inflamatoria sistémica (SIRS). El SIRS es un mecanismo de defensa del huésped del que forma parte el proceso de reparación tisular.
La respuesta sistémica aguda muy precoz debida a una infección ha quedado caracterizada en trabajos experimentales y clínicos. Para que la defensa contra la infección se inicie de manera eficaz es necesaria la participación de citocinas con función fundamentalmente proinflamatoria. Estas citocinas proinflamatorias son el factor de necrosis tumoral alfa (TNF-α), la interleucina 1 beta (IL-1 ß), la interleucina 12 (IL-12), el interferón-γ (IFN-γ) y, posiblemente, la interleucina 6 (IL-6). Un exceso de producción de alguna de estas citocinas en una primera fase de la sepsis se ha correlacionado con el desarrollo de fracaso multiorgánico y con un incremento de la mortalidad1.
La respuesta proinflamatoria inicial está controlada por moléculas inmunorreguladoras como los inhibidores específicos y los receptores solubles de las citocinas. Las principales citocinas antiinflamatorias son el antagonista del receptor de la IL-1 (IL-1 ra), el factor transformador del crecimiento beta (TGF-ß) y las interleucinas 4, 6, 10, 11 y 13. Los receptores específicos para la IL-1, el TNF y la IL-18 se comportan como inhibidores de sus respectivas citocinas proinflamatorias. En condiciones fisiológicas, todas estas moléculas sirven como inmunomoduladoras y por lo tanto, limitan el efecto potencialmente dañino de la reacción inflamatoria. Sin embargo, en condiciones patológicas, la respuesta antiinflamatoria puede ser insuficiente para contrarrestar la actividad inflamatoria o, por el contrario, ser sobrecompensadora e inhibir el sistema inmune y dejar al huésped a merced de la infección. Un aspecto que complica nuestra comprensión de la fisiopatología de la sepsis es que, a excepción del IL-1 ra, las citocinas antiinflamatorias también tienen propiedades proinflamatorias. Su acción depende del momento de su liberación, del lugar en el que actúan, de la presencia de otros elementos competitivos o sinérgicos, de la densidad de sus receptores y de la capacidad de respuesta de ese tejido a cada citocina.
Hasta ahora, la mayoría de las nuevas terapias contra la sepsis, el shock séptico y el síndrome de disfunción multiorgánica, se han basado en frenar la inflamación masiva y descontrolada asociada al proceso séptico. Se han realizado importantes ensayos clínicos con glucocorticoides, anticuerpos monoclonales antiendotoxina, terapias anti-TNF, anti-IL-1, antiprostaglandinas, antibradicininas y contra el factor activador de las plaquetas (PAF). A pesar de resultados experimentales muy esperanzadores, ninguna de estas estrategias ha demostrado reducir la mortalidad. Eichacker et al2 encuentran en un análisis de metarregresión que los estudios preclínicos mostraron una eficacia mayor cuando el riesgo de muerte era elevado. Con este tratamiento estadístico y teniendo en cuenta la estratificación del riesgo, el efecto de la administración del IL-1 ra y del receptor p-55 del TNF en los estudios fase III sería beneficioso en el grupo de enfermos más graves, e ineficaz, o incluso perjudicial, en los enfermos menos graves. Por lo tanto, es posible que un mayor conocimiento de la respuesta endógena pro y antiinflamatoria permitiera establecer las indicaciones y el tipo de intervenciones inmunomoduladoras a realizar. Además, el diseño de posibles estrategias inmunomoduladoras se complica porque la sepsis es un proceso dinámico, en donde el tiempo es un factor a tener muy en cuenta.
EL BALANCE PRO Y ANTIINFLAMATORIO
La cinética aguda de los niveles plasmáticos de las moléculas pro y antiinflamatorias se ha estudiado exhaustivamente. Mientras que en una primera fase predominan los mediadores de efecto proinflamatorio, en fases posteriores predominan fenómenos antiinflamatorios asociados a un descenso de la producción de óxido nítrico3.
Factor de necrosis tumoral alfa
Las primeras investigaciones sobre la patogénesis de la sepsis giraron en torno al TNF-α. Esta citocina es producida por monocitos y macrófagos y actúa a nivel celular a través de los receptores de tipo I o p55 y de tipo II o p75. Los receptores se unen a la molécula de TNF-α para iniciar diferentes señales transmembrana que activan enzimas intracelulares que, a su vez, fosforilan el inhibidor del factor de transcripción NF-κB (IκB). De esta manera, se activa el NF-κB, lo que le permite la translocación nuclear para iniciar la síntesis del ARN mensajero que codifica la síntesis de TNF-α, de IL-1 ß y de enzimas proinflamatorias, como la sintetasa inducible del óxido nítrico y la ciclooxigenasa-2. En un reciente trabajo de investigación en 40 pacientes con sepsis ingresados en la Unidad de Cuidados Intensivos del Hospital Universitario Príncipe de Asturias, realizado en colaboración con el Laboratorio de Inmunología del Departamento de Medicina de la Universidad de Alcalá de Henares (datos no publicados), observamos que los niveles de TNF-α en pacientes sépticos se mantuvieron elevados en comparación con un grupo de voluntarios sanos en todos los momentos evolutivos analizados. La concentración de TNF-α descendió paulatinamente, aunque permaneció elevada cuando los pacientes ya no presentaban datos clínicos de SIRS. En nuestra serie, las concentraciones altas de TNF-α predicen el desarrollo de fracaso renal agudo, aunque no otros fallos orgánicos o el SDMO, ni tampoco la mortalidad. Mientras que en pacientes con meningitis bacteriana fulminante los niveles de TNF-α elevados se correlacionan con la mortalidad4, en una población de pacientes con sepsis de origen variado no se confirma esta correlación5. Los modelos experimentales aportan algunos datos a esta aparente contradicción. Por ejemplo, se ha comprobado que la infusión de lipopolisacárido (LPS) produce un pico precoz de TNF-α a las 1-2 horas, que es indetectable a las 4-6 horas. Este mismo patrón ha sido documentado en la sepsis humana y sólo se detecta en cuadros clínicos fulminantes con signos inflamatorios intensos.
Los receptores solubles de TNF-α, TNFR-I y TNFR-II, tienen capacidad para bloquear los efectos perjudiciales de la molécula y se forman mediante la siembra desde la superficie celular en respuesta a los mismos estímulos que inducen la producción de TNF-α. Se han identificado otros receptores solubles, T-BP-1 y T-BP-2, que derivan de los receptores de membrana y actúan impidiendo que el TNF-α se una a R-I y R-II, inhibiendo así su actividad. La densidad de los receptores del TNF-α aumenta por la acción de los interferones α, ß y γ y disminuye por la de IL-1.
En determinadas circunstancias, los receptores de TNF-α actúan como agonistas. La unión de TNF-α al p75 en la circulación produce un incremento en su vida media y una prolongación de sus efectos en la circulación general, si bien este efecto es muy débil. Se ha demostrado una mayor supervivencia en ratones knockout para los receptores p55 y p75 con peritonitis.
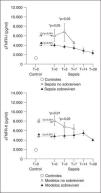
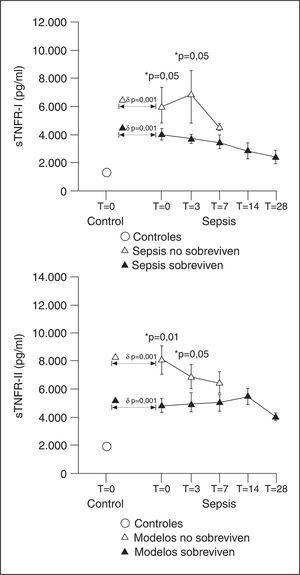
La función de los receptores de TNF-α durante los procesos inflamatorios parece variar con el momento, el órgano diana del proceso inflamatorio y el tipo celular. Su cinética plasmática se ha estudiado fundamentalmente en modelos de perfusión de miembros aislados. Se ha podido comprobar que a los 7 minutos de la aparición del TNF-α comienzan a detectarse sus receptores, identificándose posteriormente tres picos: a la hora, a las 8-12 horas y a las 48-72 horas, con una mayor cantidad de p75 en el primer pico, que es proporcional a los niveles de TNF-α. La presencia de receptores solubles prolonga la vida media del TNF durante 2,5-6 horas. En nuestros pacientes sépticos (fig. 1, datos no publicados), hemos encontrado concentraciones de receptores solubles de TNF-α superiores a las de referencia durante toda la evolución de la sepsis, incluida la fase de recuperación de la enfermedad. Además, los valores elevados se relacionan con el pronóstico y predicen el desarrollo de SDMO, aunque están muy elevados sea cual sea el fallo orgánico: hemodinámico, respiratorio, renal o hematológico. Estos resultados coinciden con los de otros autores. Goldie et al6 estudiaron el balance entre mediadores inflamatorios (endotoxina, TNF-α e IL-1 β) y sus respectivos antagonistas endógenos (anticuerpos anti-core de la endotoxina, receptores I y II del TNF-α y el antagonista del receptor de la IL-1) en 146 enfermos con sepsis grave. La concentración de los antagonistas siempre fue del orden de 30 a 100.000 veces más alta que la de los mediadores. Es más, en los enfermos que fallecieron, los niveles de TNFR-I soluble, de TNFR-II soluble y de anticuerpos anti-core de la endotoxina fueron más altos que en los supervivientes. Se ha comprobado que en los enfermos con sepsis, los niveles de los receptores solubles al TNF-α se correlacionan con la puntuación APACHE III, con la supervivencia y el shock. En otros estudios, se ha observado que existe una relación significativa entre la cinética de TNFR-I y R-II y las puntuaciones APACHE II y de fracaso multiorgánico y la mortalidad, así como entre los niveles de TNFR-I soluble y de cortisol.
Figura 1. Niveles de receptores solubles del factor de necrosis tumoral (TNFR-I y TNFR-II).
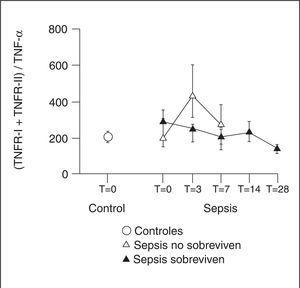
El balance entre el TNF-α y sus receptores solubles ha quedado definido en diferentes modelos de inflamación experimental y clínica llevados a cabo por Van Zee et al7. En voluntarios sanos, la administración de 20 unidades/ml de endotoxina produjo un pico de TNF-α seguido de un pico de sus receptores solubles, que fue más importante para el TNFR-I y se mantuvo más allá de las tres horas, momento en el que el TNF-α era indetectable. La duración fue superior a 24 horas. En un pequeño grupo de enfermos críticos, el TNF sólo fue detectado por ELISA en el 37% de las muestras de su evolución, mientras que la citotoxicidad era del 20%. Sin embargo, en el 94% y el 89% de las muestras, se detectó TNFR-I y TNFR-II respectivamente. Las concentraciones de estas moléculas fueron del mismo orden de las encontradas en el experimento previo. En el plasma de los voluntarios sanos a los que se administró endotoxina, demostraron que al añadir 5 ng/ml de TNFR-I o 500 ng/ml de TNFR-II redujo más del 50% de la citotoxicidad mediada por TNF-α. Se calcula que para neutralizar más del 80% de la actividad citotóxica de 1,5 ng/ml de TNF-α, se necesitarían 500 ng/ml de TNFR-I, es decir, un exceso de 300 molar. Esto significa que los niveles de TNFR-I encontrados en los enfermos críticos son capaces de inhibir al menos parcialmente la actividad del TNF-α. Esto no ocurriría con el TNFR-II soluble. En otro experimento del mismo estudio, se añadió TNF-α recombinante al plasma de los voluntarios que habían recibido endotoxina. Este TNF-α actúa como una proteína secuestradora del TNFR-I soluble y libre en plasma. La cantidad media de TNFR-I soluble detectada fue del 42%, lo que significa que aproximadamente el 60% del TNFR-I soluble está unido al TNF-α. Tanto en los voluntarios como en los pacientes críticos, los complejos TNFα-TNFR-I se detectan en ausencia de TNF-α libre. En nuestros pacientes sépticos (fig. 2), la relación sTNF-RI + sTNF-RII/TNF-α varió entre 294 a las 48 horas del comienzo del cuadro y 126 el día 28 de evolución. Según estos datos, el TNF-α está inhibido casi al 80% en su actividad citotóxica en los enfermos con sepsis a las 48 horas del ingreso en la Unidad de Cuidados Intensivos (UCI). Hemos observado, además, una mayor inhibición del TNF-α en los enfermos con sepsis que van a desarrollar síndrome de distrés respiratorio agudo (SDRA) respecto a los que no lo desarrollan nunca.
Figura 2. Ratio molecular de los receptores del factor de necrosis tumoral (TNFR) tipo I y tipo II con respecto al TNF-α.
Algunos estudios sugieren que el cociente TNF-α/ TNFR-I y TNFR-II solubles es mayor en los pacientes sépticos más graves, que presentan un pico de TNF-α y/o una secreción de receptores solubles de TNF-α insuficiente.
Interleucina 1 beta
Los monocitos, fundamentalmente los macrófagos activados, son la fuente principal de secreción de IL-1 ß. Las interleucinas 1 (α y ß) comparten y compiten por los dos tipos de receptores: tipo I y tipo II. La unión IL-1 ß a su receptor induce la activación de la proteína nuclear de activación de factores de transcripción 1 (AP-1) y el NF-κB. La síntesis de IL-1 ß puede estar inducida por otras citocinas como el TNF-α, el IFN-α, el IFN-ß y el IFN-γ, así como por endotoxinas bacterianas, virus, mitógenos y antígenos. De forma similar al TNF-α, la infusión de IL-1 ß en animales de experimentación causa hipotensión e infiltración leucocitaria en el pulmón. Tras la infusión de LPS no siempre se detecta IL-1 ß y cuando se detecta es a concentraciones muy bajas. En nuestros pacientes sépticos encontramos niveles elevados de IL-1 ß que descienden a lo largo de la evolución del cuadro clínico, aunque se mantienen altos incluso en la fase de recuperación, cuando la clínica de SIRS ha desaparecido. Las concentraciones de IL-1 ß tuvieron valor predictivo solamente en los pacientes en shock, pero no discriminaron el desarrollo de SDMO, ni de otros fallos orgánicos, ni se relacionaron con la mortalidad, aunque algunos autores sí han encontrado relación con la mortalidad.
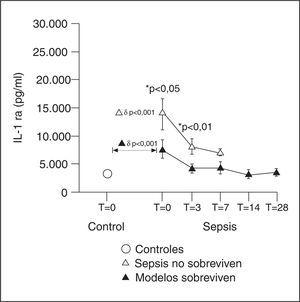
El IL-1 ra es una proteína plasmática que inhibe la acción de IL-1 y compite con los receptores celulares, tanto de IL-1 α como de IL-1 ß. A pesar de compartir un 30% de homología en su molécula y de unirse al receptor de membrana celular tipo I, no presenta ninguna actividad agonista con la IL-1. La unión IL-1 ra a la IL-1 ß supone que ésta no se une a su receptor y la señal intracelular no se llega a producir. Esta proteína es secretada por las mismas células que producen la IL-1. Existen otros estímulos para su secreción, que son fundamentalmente las mismas citocinas que inhiben la secreción de la IL-1, es decir, IL-4, IL-6, IL-10 e IL-13. Un ratón deficiente para IL-1 ra es más susceptible de padecer los efectos letales de la endotoxina y, por el contrario, un animal transgénico que produzca IL-1 ra en exceso estará más protegido. Las descripciones apuntan a que en los procesos inflamatorios, como la sepsis, los niveles circulantes de IL-1 ra ascienden más tarde que los de IL-1 ß y en una cantidad que supera las 100 veces. Ésta es la misma secuencia temporal que se conoce de los receptores solubles del TNF-α y representa un mecanismo de control de la inflamación. De hecho, la administración de IL-1 ra previene el desarrollo de SIRS durante la sepsis por gramnegativos en animales de experimentación. Su administración a voluntarios sanos a los que se les había administrado endotoxina, redujo la gravedad de los síntomas. Existen discrepancias sobre el valor pronóstico de los niveles plasmáticos de IL-1 ra. Mientras que algunos autores encuentran que tiene valor predictivo en discriminar supervivientes de no supervivientes8, otros autores sólo lo han relacionado con el desarrollo de shock. En nuestro estudio, los niveles de IL-1 ra mostraron un comportamiento similar al de los receptores solubles del TNF-α. Detectamos niveles muy altos de IL-1 ra desde el principio hasta el final del proceso séptico e incluso en la fase de convalecencia de la enfermedad (fig. 3). Se comporta como un buen índice pronóstico, identificando a los pacientes con diferentes fallos orgánicos y a aquellos que van a fallecer.
Figura 3. Niveles de antagonista del receptor de la interleucina 1 (IL-1 ra).
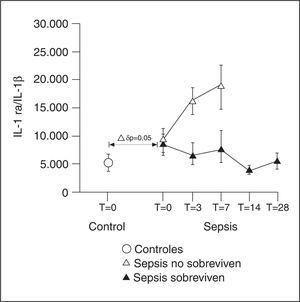
Los ratio a nivel molar entre los niveles de IL-1 ra y los de IL-1 ß sugieren que existe un nivel de inhibición muy elevado durante las fases precoces de la enfermedad que no se relacionó con la mortalidad (fig. 4).
Figura 4. Ratio molecular entre el antagonista del receptor de interleucina 1 (IL-1 ra) y la IL-1β.
Interferón γ
El IFN-γ es producido por células T y natural killer (NK) activadas por antígenos, mitógenos o aloantígenos. Su síntesis y liberación es inducida, entre otros estímulos, por la IL-2 y presenta un gran número de receptores que son expresados por todas las líneas celulares humanas. También se ha descrito un receptor soluble que tiene una función inhibitoria y reguladora, como el de otras moléculas. El IFN-γ es un modulador del crecimiento y de la diferenciación de los linfocitos T. En monocitos y macrófagos, el IFN-γ induce la secreción de TNF-α y estimula la liberación de radicales libres de oxígeno. En la sepsis no sólo no se ha encontrado elevación de esta molécula en los estudios realizados, sino que incluso parece que su producción in vitro es menor que en voluntarios sanos. Tal vez estos protocolos de estudio abarcan poco tiempo de la evolución del proceso séptico. De hecho, nosotros hemos medido niveles altos de IFN-γ a partir de la segunda semana del episodio de sepsis, una etapa en la que la inmunidad específica celular empieza a tomar protagonismo. La inmunosupresión que presentan los enfermos con sepsis revierte con la administración de IFN-γ, debido a que restaura la producción de TNF-α por parte del macrófago y mejora la supervivencia.
Interleucina 6
La IL-6 clásicamente ha sido clasificada como citocina proinflamatoria debido a que su secreción es inducida por un gran número de estímulos como el LPS, el TNF-α y la IL-1 ß. Esta producción se lleva a cabo por varios tipos celulares, entre los que destacan los monocitos-macrófagos activados, los linfocitos T y B activados, las células endoteliales y los fibroblastos. Su receptor soluble potencia la actividad de la IL-6. Como le pasa a otras muchas citocinas, la IL-6 tiene propiedades tanto anti como proinflamatorias. Es un potente inductor de proteínas reactantes de fase aguda, pero inhibe la síntesis de citocinas proinflamatorias tales como TNF-α, IL-1 ß, factor de crecimiento de las colonias granulocito-macrófago (GM-CSF), IFN-γ y proteína inflamatoria del macrófago tipo 2 (MIP-2). Además, promueve la síntesis de IL-1 ra, de los receptores solubles del TNF-α y de glucocorticoides, de manera que su efecto neto parece ser antiinflamatorio. La mayoría de las investigaciones sugieren una relación entre los niveles plasmáticos de IL-6 y la mortalidad de los pacientes con sepsis9,10. En nuestro estudio (datos no publicados), la concentración de IL-6 no se relacionó con la mortalidad, sino con el desarrollo de SDMO, sobre todo en presencia de fallo hemodinámico, respiratorio o renal. Aunque los niveles de IL-6 están elevados en la sepsis durante toda su evolución e incluso cuando el cuadro clínico de SIRS ha remitido, la IL-6 probablemente no sea un mediador directo de la sepsis o del SDMO. La inyección de IL-6 en el animal de experimentación, por ejemplo, no induce los típicos cambios hemodinámicos asociados a la sepsis, por lo que se ha sugerido que se trata más bien de un marcador del grado de inflamación sistémica, consecuencia de los efectos producidos previamente por el TNF-α y el IFN-γ, y no de un responsable directo del proceso.
Interleucina 10
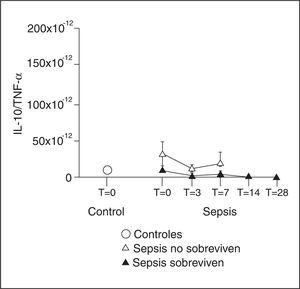
La IL-10 es la citocina antiinflamatoria más importante en la respuesta inmune. Es un potente inhibidor de las citocinas proinflamatorias, incluyendo TNF-α, IL-1ß, IFN-γ, IL-2, IL-6, IL-8, IL-12, IL-18, G-CSF, MIP-1α, MIP-2α, RANTES, e incluso, de sí misma. Además, degrada el ARN mensajero encargado de la síntesis de estas citocinas. Atenúa la expresión celular del receptor para el TNF-α y promueve la siembra de estos receptores a la circulación sistémica. También inhibe la expresión en superficie del complejo mayor de histocompatibilidad clase II, de moléculas accesorias B7 y el reconocimiento de la LPS por el CD14; la producción de neutrófilos y de células NK y la síntesis de óxido nítrico, gelatinasa y colagenasa, y la translocación del NF-κB que ocurre como consecuencia de la estimulación por LPS. La IL-10 bloquea la apoptosis de los linfocitos T y la inhibición de la apoptosis de los neutrófilos inducidas por la endotoxinemia. La IL-10 nace de manera proporcional a la intensidad del estímulo inflamatorio. Todos los trabajos apuntan al TNF-α como el principal estímulo para su secreción. La administración de TNF-α a voluntarios sanos produjo una respuesta monofásica a los 45 minutos de su administración, y sin embargo, si se administran anticuerpos anti-TNF-α al animal de experimentación con endotoxinemia, la respuesta de la IL-10 se atenúa en más del 60%. Los niveles séricos de IL-10 durante la sepsis grave encontrados en el estudio realizado en nuestra UCI siguen una cinética muy singular. Inicialmente, en los enfermos que fallecen, los niveles están elevados de forma significativa respecto a los controles y a los supervivientes. De manera brusca, los niveles caen por debajo de los niveles normales y se mantienen por debajo de dichos niveles durante toda la evolución de la sepsis e incluso después, en la fase de recuperación, permanecen descendidos. Esta caída brusca se produce a las 48 horas y es tan llamativa que es capaz de discriminar el pronóstico, de tal manera que los pacientes que fallecieron normalizaron sus valores, mientras que los supervivientes mostraron niveles significativamente bajos. Los niveles basales fueron más elevados en los enfermos que padecieron shock, SDRA, fracaso renal agudo o coagulopatía, que en aquellos que no aquejaron estos fallos orgánicos. La relación entre los niveles de IL-10 y TNF-α ha sido utilizada como un índice pronóstico al ingreso en enfermos con diferentes infecciones11,12 y en nuestra serie hemos podido detectar su asociación con la mortalidad (fig. 5). La IL-10 también ha sido estudiada como agente terapéutico. Su administración a voluntarios a los que se les había administrado endotoxina, 30 minutos antes o inmediatamente después, causa un bloqueo en la sintomatología y en la aparición de TNF-α, IL-6, IL-8 e IL-1 ra, así como una reducción del sistema fibrinolítico. Sin embargo, la administración más tardía es menos eficaz13. Los resultados sobre la eficacia en los animales de experimentación también son variables. Si bien en estudios iniciales14 el tratamiento con IL-10 mejoraba el pronóstico o su inhibición lo empeoraba, trabajos más recientes no han confirmado estos datos. Se ha demostrado que los animales de experimentación son más susceptibles a la infección si el sistema de la IL-10 está bloqueado.
Figura 5. Ratio molecular de la relación de los niveles de interleucina 10 (IL-10) y de factor de necrosis tumoral alfa (TNF-α).
Receptor soluble de interleucina 2
El receptor soluble de la IL-2 (sIL-2R) es un fragmento del receptor celular conocido como antígeno TAC (T-cell activation antigen), que es secretado de forma continua por los linfocitos activados. Por este motivo, se le considera una molécula antiinflamatoria. Sus concentraciones varían de una patología a otra y son altas en la sepsis. Los escasos datos disponibles sugieren que sus niveles están elevados en pacientes con SDMO frente a los que no lo padecen15. También se detectan concentraciones más altas de sIL-2R en enfermos que van a desarrollar shock con respecto a los que permanecen hemodinámicamente estables. Nosotros observamos niveles de sIL-2R elevados en la sepsis grave desde el comienzo del cuadro y que apenas descienden durante su evolución, permaneciendo altos incluso en la fase de recuperación. Si bien estos niveles no parecen relacionarse con la mortalidad, sí discriminan a los enfermos que sufren SDMO respecto a los que no, sobre todo cuando el fallo es cardiovascular o respiratorio.
Factor transformador del crecimiento
El TGF-ß es un regulador muy importante de la proliferación celular, la diferenciación y la formación de la matriz extracelular. Es sintetizado como precursor inactivo y presenta 5 isoformas diferentes. Es el inhibidor del crecimiento más potente que se conoce. Sus actividades biológicas dependen no sólo del tipo celular sobre el que actúen y de su concentración, sino también de la presencia de otros factores locales. El TGF-ß es capaz de convertir un sitio de inflamación activa en un lugar donde domine la resolución y la reparación. Este factor tiene la capacidad de exhibir una alta actividad inmune a nivel local, mientras que actuaría como una molécula inmunosupresora a nivel sistémico. Su catalogación como una citocina antiinflamatoria viene de la mano de los trabajos en animales, en donde los ratones que carecen de TGF-ß sufren reacciones inflamatorias descontroladas. El TGF-ß suprime la proliferación y la diferenciación de las células T y B y limita la producción de IL-2, IFN-γ y TNF-α y actúa como un desactivador del monocito/macrófago, de manera similar a la IL-10, aunque menos potente16. En nuestro estudio, los niveles séricos de TGF-ß no ascienden hasta el decimocuarto día de la evolución y se mantienen altos hasta el vigesimooctavo. Por lo tanto, estamos de acuerdo con otros autores en que carece de valor pronóstico al principio del cuadro17,18. Sin embargo, a partir del séptimo día sus niveles sí se han visto relacionados con la mortalidad. Por lo tanto, parece claro que en enfermos con sepsis, a diferencia de los enfermos con traumatismo grave o grandes quemados, el TGF-ß parece implicado en la segunda fase evolutiva en donde predominan los fenómenos antiinflamatorios y que se podría denominar como síndrome de respuesta antiinflamatoria compensadora y que la literatura anglosajona denomina como CARS (compensatory anti-inflammatory response syndrome)19. El único valor pronóstico precoz ha sido encontrado en pacientes con shock séptico en donde los niveles están bajos respecto a voluntarios sanos. Se está ensayando en animales de experimentación la administración de TGF-ß como molécula antiinflamatoria y podría ser de utilidad, puesto que se ha demostrado que reduce la dosis letal de LPS necesaria, reduce la mortalidad y reestablece la presión arterial a través de la inhibición de la sintetasa del óxido nítrico.
Aunque los niveles de la mayoría de las citocinas pro y antiinflamatorias están elevados en pacientes con sepsis grave respecto a los valores normales, desde el principio del cuadro hasta el vigesimooctavo día y cuando ya ha desaparecido la clínica de SIRS, el balance global entre las moléculas pro y antiinflamatorias estudiadas apunta hacia un incremento muy importante de estas últimas, incluso en las fases más precoces de la enfermedad. El papel del TNF-α y de la IL-1 ß en la sepsis parece ser el de desencadenante, pero ambas carecen de valor patogénico posteriormente, puesto que fisiopatológicamente están muy inhibidas a través de los receptores solubles y del IL-1 ra, respectivamente. El sTNFR-I, sTNFR-II e IL-1 ra tienen un gran valor pronóstico y sus niveles se relacionan con el desarrollo de SDMO y con cada fallo de órganos. Niveles elevados de IL-10 y de TGF-ß también se relacionan con la mortalidad, aunque de modo más tardío.
En el SDMO, hay niveles de citocinas antiinflamatorias exageradamente elevados como son los de la IL-6, los receptores solubles tipo I y tipo II del TNF, el IL-1 ra y el receptor de la IL-2. Con respecto a cada fallo de órgano, es de destacar el papel que el TNF-α desempeña en el desarrollo de fracaso renal agudo y el que tiene la IL-1ß en discriminar enfermos con fallo circulatorio.
También es importante destacar que la aparición del IFN-γ, de la IL-10 y del TGF-ß pasados los primeros días de la sepsis tiene un gran valor fisiopatológico, que puede servir para entender mejor los mecanismos íntimos de este proceso.
Futuras intervenciones terapéuticas deberán tener en cuenta que la sepsis es un proceso dinámico y considerar el momento de la evolución de la enfermedad con respecto a la respuesta inmune. En ese caso el tratamiento posiblemente deberá ser individualizado y adaptado al balance pro y antiinflamatorio. Las características del proceso inmunológico dependen del polimorfismo genético de la persona que padece la enfermedad, del momento en el que nos encontremos en la evolución de la misma y de las características particulares del patógeno responsable de la infección.