INTRODUCCIÓN
La sepsis es una patología muy frecuente cuya incidencia está aumentando y se espera que lo siga haciendo. El shock séptico es la complicación más grave de la sepsis y es lo que determina su mortalidad, que va aumentando en relación directa con el número de órganos disfuncionantes. En los últimos años se han aportado interesantes novedades que han sido fundamentales para entender su fisiopatología y de esta forma intentar contribuir a un mejor tratamiento1.
El shock séptico es un estado de hipoperfusión tisular en el contexto de un síndrome de respuesta inflamatoria sistémica, caracterizado clínicamente por vasodilatación excesiva y el requerimiento de agentes vasopresores para mantener la presión de perfusión orgánica.
El volumen intravascular efectivo está reducido en los pacientes sépticos y es una de las causas fundamentales de su inestabilidad hemodinámica. Existe también una disminución del tono vascular que afecta tanto al lecho arterial como venoso, dando lugar a congestión de los vasos de gran capacitancia. Los cambios en el tono varían de un lecho vascular a otro, resultando en una distribución anómala del flujo sanguíneo. A todo lo anterior se suma una disminución de la sensibilidad a catecolaminas que da lugar a un aumento en la liberación de las mismas y a una regulación a la baja de los receptores alfa-adrenérgicos. En todas las formas de shock distributivo las concentraciones de catecolaminas plasmáticas están muy elevadas y el sistema reni-na-angiotensina está activado. Por tanto, parece que la vasodilatación excesiva que se experimenta en el shock séptico se debe a la pérdida de la capacidad del músculo liso vascular para contraerse.
Es muy posible que los mecanismos que producen vasodilatación y resistencia a los vasopresores sean hasta cierto punto comunes en todos los tipos de shock distributivo. Existen tres mecanismos que se consideran especialmente implicados2:
1. La activación de la forma inducible de la sintetasa del óxido nítrico (NO), con un aumento en la producción de NO, que causa vasodilatación arteriolar e hipotensión.
2. La deficiencia relativa de vasopresina que parece debida, al menos en parte, a una depleción de los depósitos de la hormona en la neurohipófisis.
3. Alteraciones en el potencial de membrana de las células del músculo liso vascular, mediante la activación de los canales de potasio sensibles al ATP.
IMPORTANCIA DE LOS CANALES IÓNICOS
Nuestra habilidad para hacer ejercicio, para percibir un mundo de colores o para procesar el lenguaje recae en la rapidez de comunicación entre células. Tal señalización, la más rápida de nuestro cuerpo, implica mensajes eléctricos producidos por la apertura y cierre de canales iónicos en las membranas celulares. Los canales iónicos son proteínas de membrana que permiten el paso de iones a través de la membrana plasmática, de forma selectiva y a favor de un gradiente electroquímico. Son responsables, entre otras funciones, del mantenimiento del potencial de membrana, de la contracción muscular, modulan el tono de la musculatura lisa vascular, permiten la regulación del volumen celular, participan en diversas vías de señalización y son los encargados de la generación y propagación del impulso nervioso.
Nuestro conocimiento de la fisiología de los canales iónicos ha aumentado tremendamente en los últimos 15 años, gracias a dos avances técnicos:
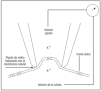
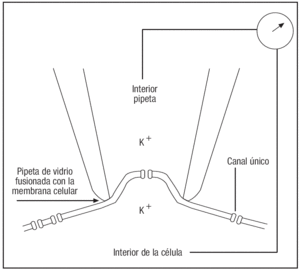
1. Técnicas de monitorización de canales únicos, que han permitido la medición de corrientes procedentes de canales iónicos individuales en una variedad de tejidos. En este sentido, hay que destacar el gran avance que se produjo en el campo de la electrofisiología cuando Erwin Neher y Bert Sakmann consiguieron desarrollar la metodología que permitía registrar pequeñas áreas de membrana, el patch clamp3,4. En 1981 estos autores muestran cómo las pipetas de vidrio pueden fusionarse con las membranas celulares, formando sellos de alta resistencia y estabilidad mecánica. Utilizando esta técnica se podían registrar las corrientes totales en células pequeñas, y lo más impactante, registrar la actividad de un canal único (fig. 1). Ambos autores recibieron el premio Nobel de Medicina en 1991.
Figura 1. Registro de pequeñas áreas de membrana mediante la técnica de patch clamp.
2. La clonación molecular, que provee información secuencial sobre la composición estructural de las proteínas que componen un canal iónico.
Al igual que las enzimas, los canales iónicos tienen sustratos específicos: canales de potasio, sodio, calcio y cloro. Estos iones atraviesan la membrana por difusión simple, pero los canales permiten selectivamente su paso. Durante los últimos cuatro años se han logrado impresionantes avances en la comprensión de la estructura y función de los canales de potasio. Utilizando canales iónicos purificados de bacterias los investigadores demostraron que los canales de potasio presentan un poro, «con forma de tienda india invertida», que sobresale a través de la membrana celular y que es altamente selectivo para el potasio. Dependiendo del tipo de canal de potasio (tabla 1) existe generalmente un mecanismo de «compuerta», es decir, un mecanismo que abre el poro del canal en respuesta a un ligando químico como el calcio, o en respuesta a un cambio de voltaje a través de la membrana celular. El equipo de investigación liderado por Roderick MacKinnon, investigador del Instituto Médico Howard Hughes, en la Universidad Rockefeller, publicó la forma en la que el «poro» del canal de potasio se abre para permitir que éste fluya a través de la membrana celular. Roderick MacKinnon es uno de los dos científicos que fueron galardonados con el Premio Nobel de Química en el 2003 por sus descubrimientos sobre los canales de las membranas celulares5.
CANALES DE POTASIO SENSIBLES A ATP
Los canales de potasio sensibles a ATP (canales Katp), deben su nombre a la regulación inhibitoria conferida por el ATP intracelular, por lo que un descenso en la concentración de este nucleótido favorece la activación del canal. Estos canales fueron descritos por primera vez en miocitos cardíacos6, pero ya se han encontrado en una gran variedad de tejidos y células excitables, incluyendo a las células ß del páncreas7, células del músculo liso8 y esquelético9 y neuronas centrales10. En todas las células los canales Katp acoplan el estado metabólico celular con la actividad eléctrica de la membrana plasmática11. Estos canales además de regular el potencial de reposo también modulan el potencial de acción, y esto puede desempeñar un importante papel en los procesos fisiológicos12.
En los miocitos cardíacos se ha propuesto que estos canales funcionan como un mecanismo de defensa celular, ya que se activan en condiciones de hipoxia e isquemia, causando una hiperpolarización de las células, disminuyendo su excitabilidad y reduciendo así sus demandas metabólicas10.
Cuando comemos algo y los niveles de glucosa suben, los canales Katp que están presentes en la membrana de la célula βdel páncreas se cierran, y esto produce una entrada de calcio al interior de la célula que estimula la secreción de insulina. Si estamos en ayunas, dichos canales permanecen abiertos, no hay entrada de calcio y, como resultado, tampoco hay secreción de insulina. Las sulfonilureas incrementan la secreción de insulina por parte de la célula ß del páncreas de una manera similar a la acción de la glucosa plasmática. Dichos fármacos se unen a receptores específicos en la membrana celular e inducen el cierre de los canales Katp y, en consecuencia, aumenta el contenido intracelular de potasio, con el subsiguiente cambio del potencial eléctrico de la célula. Ello facilita la apertura de canales específicos para el calcio, y como resultado del aumento de las concentraciones citoplasmáticas de dicho elemento aumenta la liberación de insulina a partir de los gránulos maduros.
En el sistema nervioso central los canales de Katp han sido implicados en varios fenómenos fisiológicos neuronales, dentro de los que se incluyen la excitabilidad neuronal y la liberación de neurotrasmisores y metabolitos de la glucosa13. Además, se ha sugerido que los canales de Katp se activan y regulan la liberación de glutamato inducida por una isquemia o hipoxia cerebral, y por ello podrían desempeñar un importante papel en el acoplamiento excitabilidad-metabolismo celular14.
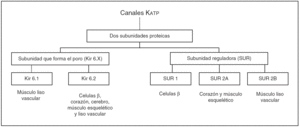
Los canales Katp están formados por dos tipos de subunidades:
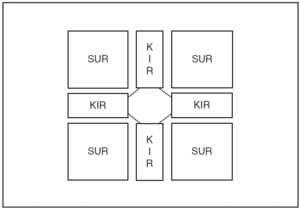
1. La primera subunidad es una proteína que pertenece a la superfamilia de los canales Katp con rectificación interna Kir 6.X15,16. Estos canales Kir presentan dos subtipos Kir 6.1 y Kir 6.2, que se diferencian por su conductancia unitaria y por sus diferentes propiedades funcionales17. El Kir 6.2 se expresa predominantemente en las células ß del páncreas, corazón, cerebro y músculo esquelético, y forma el poro del canal Katp en estos tejidos. Se ha postulado que tanto el Kir 6.1 como el Kir 6.2 forman el poro de los canales Katp en el músculo liso (fig. 2).
Figura 2. Diferentes subunidades que conforman el canal Katp.
2. La segunda subunidad del canal Katp es un receptor para las sulfonilureas (SUR) que fue purificado y clonado en base a su afinidad a la glibenclamida18. Estos receptores SUR presentan dos subtipos, SUR 1 y SUR 2, que a su vez se clasifican en dos isoformas SUR 2A y SUR 2B. SUR 1 se encuentra de forma predominante en las células ß del páncreas y en algunos tipos de neuronas, mientras que la subunidad SUR 2A se encuentra en el músculo cardíaco y esquelético, y la SUR 2B en el músculo liso (fig. 2).
El canal Katp debe tener ambas subunidades asociadas y se coensamblan para formar un canal octamérico que sea funcional (fig. 3). La relación entre estas dos subunidades es 1:1 (SUR/Kir 6.X). En el canal Katp completo la subunidad Kir 6.X forma el poro del canal, mientras que el receptor SUR regula su actividad19. Las diferentes combinaciones de las subunidades Kir y SUR dan lugar a diferentes subtipos de canales Katp tejido-específicos: canales Katp cardíacos, canales Katp pancreáticos y canales Katp del músculo esquelético y liso vascular (tabla 2). A pesar de que los diferentes canales de Katp comparten la misma estructura básica, difieren de forma sustancial en sus propiedades funcionales.
Figura 3. Estructura octomérica de un canal Katp.
CANALES DE POTASIO Y SHOCK SÉPTICO
Se ha involucrado a la activación de canales Katp subtipo SUR 2B del músculo liso vascular en la patogénesis del shock séptico. Pero para entender la vasodilatación patológica y la resistencia a los fármacos vasopresores que caracterizan al shock séptico es preciso realizar una aproximación al papel del potencial de membrana en la regulación del tono vascular.
El potencial de reposo de la membrana de la célula del músculo liso vascular oscila entre -30 y -60 mV, dependiendo del tipo de células. La despolarización de la membrana celular (potencial más positivo) abre los canales de calcio voltaje-dependientes, aumentando la concentración de calcio citoplasmático e induciendo vasoconstricción. Consecuentemente, la hiperpolarización cierra estos canales, disminuyendo la concentración de calcio en el citoplasma provocando vasodilatación. Las sustancias vasoconstrictoras requieren que el calcio extracelular entre a la célula. La hiperpolarización de la membrana previene la vasoconstricción en presencia de vasoconstrictores.
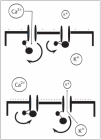
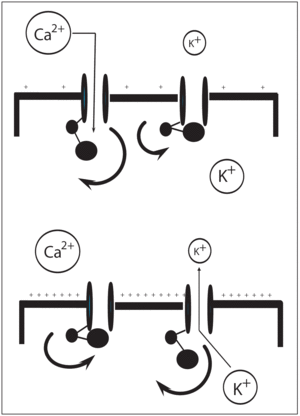
Una variedad de transportadores de iones y canales, particularmente canales de potasio, contribuyen con el potencial de membrana de la célula del músculo liso vascular. Se conocen 4 tipos de canales de K en la membrana plasmática de la célula del músculo liso vascular: Katp de rectificación interna (Kir), canales de K sensibles al calcio citoplasmático (KCa2+) y canales de K dependientes de voltaje (KV). De estos diferentes tipos de canales de potasio el canal Katp es el mejor conocido y tiene un papel crítico en la patogénesis del shock séptico. La apertura de los canales Katp permite una salida de potasio, esto hiperpolariza la membrana plasmática y previene la entrada de calcio a la célula, dando lugar a una relajación de la musculatura lisa vascular. Esto explica por qué la activación farmacológica de los canales Katp con diazóxido, por ejemplo, inhibe la vasoconstricción inducida por las catecolaminas o angiotensina II. Los canales Katp son fisiológicamente activados por la disminución de la concentración de ATP en la célula y un aumento de las concentraciones celulares de hidrógeno y de lactato, un mecanismo que enlaza el metabolismo celular con el tono vascular y el flujo sanguíneo19. Esto se evidencia en condiciones normales de reposo, donde los canales Katp están cerrados y sus inhibidores tales como las sulfonilureas no causan vasoconstricción. Sin embargo, en condiciones de aumento del metabolismo tisular o hipoxia tisular, la activación de estos canales causa vasodilatación, la cual puede ser revertida con una sulfonilurea (fig. 4).
Figura 4. Interacción entre los canales de K+ y de Ca2+. Imagen superior: en condiciones normales de reposo, los canales de K sensibles a ATP (canales Katp) permanecen
La activación de los canales Katp en las arteriolas es un mecanismo crítico en la hipotensión y vasodilatación características del shock séptico20,21. Los activadores neurohormonales de los canales Katp pueden estar también involucrados en algunas formas de shock séptico. Por ejemplo, el péptido natriurético auricular, la calcitonina y la adenosina pueden activar los canales Katp. La concentración plasmática de estas sustancias está marcadamente elevada en el shock séptico. El canal Katp puede ser también activado por un incremento del óxido nítrico (NO) a través de guanosinmonofosfatociclasa (GMPc)22. En resumen, muchas condiciones que comprometen la oxigenación tisular y conllevan a acidosis láctica probablemente activan los canales Katp en el músculo liso vascular, causando vasodilatación y shock séptico2.
MANIPULACIÓN TERAPÉUTICA DE LOS CANALES DE POTASIO
Más allá del aumento en la información específica sobre canales de K en los niveles celular y molecular, hay una conciencia emergente del potencial de la manipulación farmacológica y potencialmente terapéutica de los canales de K. Determinadas situaciones clínicas, tales como la sepsis y el shock séptico, la inmunología del transplante y el vasoespasmo, podrían ser tratadas gracias a la modulación y bloqueo de los canales de K.
Numerosos estudios realizados en modelos animales de vasodilatación y shock séptico han demostrado que la administración de bloqueantes de canales Katp mejoran las variables hemodinámicas y son capaces de restaurar la respuesta vasopresora23-25. Muchos de estos estudios han utilizado glibenclamida, un agente hipoglucemiante oral del grupo de las sulfonilureas, que es un bloqueante eficaz de los canales Katp subtipos SUR 1 y SUR 226.
Pero otros autores en este intento de modulación de los canales de K han utilizado fármacos distintos, como los corticoides, y algunos modelos animales sugieren un efecto beneficioso de la dexametasona en ratas endotoxémicas, que pudiera ser debido, al menos en parte, a su capacidad para interferir con la activación de los canales Katp inducida por el lipopolisacárido (LPS). Esta interacción puede explicar la mejoría de la reactividad vascular a fenilefrina, mediada por dexametasona, en ratas tratadas con LPS, poniendo de relieve una nueva actividad farmacológica a la ya bien conocida propiedad antiinflamatoria de los glucocorticoides27.
Sobre estas bases de manipulación farmacológica de los canales de K, se ha publicado recientemente el efecto del bloqueo de los canales de K en humanos, que no había sido estudiado hasta el momento actual28. El objetivo de los autores responsables de este trabajo ha sido estudiar si la administración de bloqueantes de canales Katp es capaz de restaurar la respuesta a norepinefrina en pacientes con shock séptico. Para ello han utilizado glibenclamida en un estudio con diseño randomizado, doble ciego, cruzado y controlado por placebo. Han estudiado un total de 10 pacientes con shock séptico y necesidad de infusión de norepinefrina para mantener una adecuada presión arterial media. Tras la administración de glibenclamida como bloqueante de los canales Katp, los requerimientos medios de norepinefrina descendieron de 13 a 4 µg/min comparado con un descenso de 19 a 7 µg/min después de administrar placebo. Ambos cambios representan un descenso del 78,9% y 71,1% respectivamente (p = 0,57). Tampoco se objetivaron cambios significativos en las cifras de frecuencia cardíaca, presión arterial media y concentración de lactato. Sin embargo, la glibenclamida produjo un descenso significativo de la concentración media de glucosa en sangre comparado con placebo (5,4 mmol/l frente a 7,0 mmol/l; p < 0,0001), incrementando la necesidad de administración parenteral de glucosa. A la vista de estos resultados, los autores concluyen que la glibenclamida no es capaz de conseguir un descenso en la dosis de norepinefrina superior a placebo en pacientes con shock séptico, a pesar de que la glibenclamida induce bloqueo de los canales Katp, como demuestra la significativa reducción en la concentración de glucosa sanguínea, sugiriendo que en estos pacientes el bloqueo de los canales Katp no tiene un gran efecto sobre el tono vasomotor.
¿Debemos por tanto perder la esperanza que se había puesto en el bloqueo de los canales Katp, para intentar restaurar la respuesta vasopresora en el shock séptico? Aunque es complicado responder a esta pregunta, probablemente no debamos perder totalmente la esperanza y, en este sentido, es conveniente realizar ciertas consideraciones, algunas de las cuales ya han sido apuntadas por los propios autores del trabajo:
1. Se trata del primer estudio clínico sobre bloqueo de canales Katp en el shock séptico, y se han reclutado solamente 10 pacientes, por lo que la capacidad para detectar pequeñas diferencias en las necesidades de norepinefrina entre los dos períodos de tratamiento es limitado, incluso aunque el diseño sea cruzado.
2. En los estudios realizados previamente en modelos animales de shock séptico, donde el bloqueo de los canales Katp sí es capaz de restaurar la respuesta vasopresora, la administración del tratamiento se realiza justo después de la inducción del shock séptico con endotoxina. Sin embargo, el retraso entre el comienzo del insulto séptico y el tratamiento es inevitable en la práctica clínica. Con mucha frecuencia nuestros enfermos con shock séptico son personas mayores con muchas comorbilidades, no es de extrañar, por tanto, que en estos pacientes el comienzo de la clínica sea insidioso, la presentación del shock séptico tardía y que exista un retraso en el diagnóstico, dando como resultado un estado de compromiso fisiológico muy diferente al visto en modelos animales de shock vasodilatador.
3. Algunos autores han sugerido la posibilidad de que la subunidad SUR del canal Katp pueda estar alterada en los estados de sepsis, como se ha demostrado in vitro en segmentos de endotelio intacto de arteria mesentérica de rata, incubados con LPS29. Estos autores han comprobado que los inhibidores de la subunidad que forma el poro del canal Katp, como el cloruro de bario (BaCl), revierten de forma significativa la hiporreactividad inducida por el LPS, mientras que la administración de bloqueantes de la subunidad SUR, como glibenclamida y tobultamida, fueron ineficaces.
4. Dado que la glibenclamida bloquea tanto subunidades SUR 1 y SUR 2, existe la posibilidad de que la hipoglucemia sea un factor limitante para conseguir la dosis y concentración adecuada que permita el efecto deseado sobre el tono del músculo liso vascular. De hecho, la afinidad de las sulfonilureas por la subunidad SUR 2 es más baja que por la subunidad SUR 130. Por ello, la hipoglucemia observada tras la administración de glibenclamida no asegura que exista suficiente concentración para inhibir el canal de Katp en el músculo liso vascular.
5. Los pacientes de este estudio no presentaban un shock séptico severo, como demuestra la baja mortalidad intraUCI (uno de los 10 pacientes), la baja dosis de norepinefrina requerida para mantener las cifras de tensión arterial y la presencia de acidosis solamente en grado moderado (concentración de lactato medio a la randomización 2,19 mmol/l). Existe, por tanto, la posibilidad de que en estas circunstancias los canales de Katp pudieran no haberse activado, ya que como hemos visto con anterioridad estos canales son fisiológicamente activados, además de por la disminución en la concentración de ATP en la célula, por un aumento en las concentraciones celulares de hidrógeno y de lactato.
6. Aunque el papel que desempeña el canal Katp en la patogénesis del shock séptico es el mejor conocido, no hay que olvidar que en la membrana plasmática de la célula del músculo liso vascular existen otros tipos de canales de K cuyo papel exacto estamos empezando a conocer. En este sentido, hay que destacar algunos trabajos que indican que el canal KCa2+ es un importante mecanismo vasodilatador31. Estos canales pueden ser directamente activados por el NO, y dicha activación probablemente pueda contribuir a la vasodilatación e hiporreactividad vascular que se observa en el shock séptico. Sobre estos datos sería muy atractivo centrar futuras investigaciones en la posibilidad de bloquear específicamente la activación de los canales de potasio en el músculo liso vascular, producida por el NO, y de esta forma intentar restaurar la respuesta vasopresora. De hecho, la hiporreactividad vascular a norepinefrina inducida por la endotoxina puede ser revertida parcialmente por inhibidores de canales KCa2+32.
7. Para complicar aún más las cosas, algunos datos preliminares obtenidos en estudios recientes sugieren que los metabolitos del ácido araquidónico, producidos por la citocromo P450, pueden ser un factor que contribuye a la hipotensión inducida por el LPS33. El sistema citocromo P450 metaboliza el ácido araquidónico liberado de los fosfolípidos de la célula endotelial para formar ácidos epoxieicosatrienoicos (EET). Se ha demostrado con anterioridad que los EET causan hiperpolarización de la membrana de la célula del músculo liso vascular por la apertura de canales KCa2+34. Sobre la hipótesis de que los EET son responsables de la activación de canales de K y de la fase de hipotensión transitoria del shock endotóxico inducido por LPS, estos autores estudian específicamente si la inhibición de canales de K o citocromo P450 atenúa dicha fase de hipotensión durante el shock endotóxico in vivo, y determinan si esta intervención mejora las tasas de supervivencia en su modelo de shock endotóxico en ratas. La inhibición de los canales de K con tetraetilamonio (TEA) no tiene efecto sobre la fase de hipotensión inducida por el LPS comparado con salino. Proadifen o ketoconazol, inhibidores de citocromo P450, atenúan de forma significativa la hipotensión inducida por LPS comparado con salino, mejorando las tasas de supervivencia. Estos datos sugieren que los metabolitos del ácido araquidónico producidos por citocromo P450 pueden contribuir a la fase transitoria de hipotensión inducida por el LPS, y que estos efectos no parecen estar mediados por la activación de canales de K.
En definitiva, antes de perder completamente la esperanza sobre el bloqueo de los canales K como medida terapéutica en el shock séptico, deben realizarse estudios más amplios, con mayor número de pacientes, buscando fármacos que puedan bloquear de forma selectiva los canales Katp subtipo SUR2B, o incluso que bloqueen de forma específica la subunidad que conforma el poro del canal Katp. No hay que olvidar que solamente con un conocimiento más profundo de los canales Katp se pueden desarrollar nuevas moléculas con fines terapéuticos que sean seguras, más eficaces y que nos permitirán prevenir fallos de estos agentes en el futuro.
Por último, hay que recordar que las alteraciones cardiovasculares y hemodinámicas que se producen en el shock séptico se deben a la interacción de multitud de factores y mediadores, y que, por tanto, además de continuar con la atractiva investigación del bloqueo de los canales Katp, se pueden abrir otras vías de investigación, como intentar bloquear la activación de los canales de KCa2+ producida por el NO, o profundizar en el papel que desempeña el sistema citocromo P450 y los metabolitos del ácido araquidónico en la hipotensión que se objetiva en el shock séptico.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
Correspondencia: Dr. L. Tamayo.
C/ Estadio, 7, 4º A.
47006 Valladolid.
Correo electrónico: med020147@saludalia.com
Manuscrito aceptado el 29-IX-2006.