INTRODUCCIÓN
Numerosos estudios publicados muestran una gran variabilidad en la incidencia de complicaciones neurológicas detectadas durante el postoperatorio de cirugía cardíaca1-4. El tipo de cirugía analizado en los diferentes estudios ha contribuido en gran medida a la variedad de resultados: las embolias cerebrales continúan siendo más frecuentes en las cirugías intracardíacas5, realizadas bajo circulación extracorpórea (CEC), y en mayor medida aún cuando se trata de cirugías combinadas (valvulares más revascularización miocárdica)6-8. Algunos autores, sin embargo, señalan la tendencia a un incremento en la disfunción neurológica en los pacientes sometidos a by-pass aortocoronarios, justificado por el aumento progresivo, durante los últimos años, en la edad de estos pacientes, lo que conlleva una enfermedad aterosclerótica más avanzada a todos los niveles (incluidos los vasos carotídeos y cerebrales), cirugías más complicadas con mayores tiempos de circulación extracorpórea, así como una comorbilidad en términos generales más acusada7.
Otro de los principales factores implicados en la variabilidad existente entre los estudios es el distinto concepto y definición que en cada uno de ellos se establece de disfunción neurológica. Además, es común objetivar la ausencia de una metodología aplicada al diagnóstico de secuela neurológica, hecho que puede contribuir a la diversidad de planteamientos comentada previamente; de esta forma, conceptos como encefalopatía, delirium, agitación, déficit de memoria, crisis o ictus carecen generalmente de una definición estandarizada que permita reconocer cada una de las situaciones en contextos diferentes, que elimine la variabilidad de nomenclatura existente entre los distintos estudios y que haga posible la reproducción y comparación de los resultados.
Teniendo en cuenta este inconveniente, el Grupo Multicéntrico de Estudio de la Isquemia Perioperatoria5 ha presentado recientemente una clasificación que sistematiza la presentación clínica revisada, considerando, de esta forma, la existencia de dos grandes grupos: tipo I, con peor pronóstico, que incluye a los pacientes con accidente cerebrovascular agudo (ACVA), accidente isquémico transitorio (AIT) y pacientes con coma o estupor al alta, y tipo II, que engloba a los pacientes con deterioro cognitivo, déficit de memoria y crisis convulsiva. Dicha clasificación pretende ser una propuesta para unificar y sistematizar diagnósticos y salvar así el obstáculo que supone la falta de estudios comparativos entre diferentes grupos y series analizadas.
PRESENTACIÓN CLÍNICA
Aunque el ictus y la encefalopatía hipóxica grave constituyen probablemente las presentaciones más agresivas y de las que se derivan las mayores discapacidades funcionales, son las disfunciones psicológicas y cognitivas, más sutiles y en muchas ocasiones difíciles de diagnosticar, las alteraciones neurológicas más comunes tras la cirugía cardíaca9. Mientras que la incidencia de deterioro neuropsicológico oscila entre el 60 y el 80% en las distintas series10-12, los estudios más recientes describen una incidencia de ictus que varía desde 0,4 a 13,8%3,13.
La embolización de placas de ateroma o restos de calcio desprendidos durante la manipulación quirúrgica o las embolias secundarias a arritmias cardíacas durante el período postoperatorio han sido las causas más frecuentemente reconocidas de los ictus detectados durante el postoperatio de cirugía cardíaca. Los ictus precoces, manifestados durante las primeras horas de la cirugía como déficits sensitivo-motores (pudiendo coincidir con un despertar en estado estuporoso o comatoso, o incluso que el paciente no se despierte o que presente crisis convulsiva durante el postoperatorio más inmediato), son los más frecuentes, y han sido atribuidos a embolias intraoperatorias o períodos de hipoperfusión cerebral grave. Cuando la manifestación del ictus es más tardía, la causa más frecuente son las arritmias cardíacas (siendo la fibrilación auricular la más habitual)1,6,7 o el desprendimiento de fragmentos de placas de ateroma aórtico14.
En otras ocasiones el paciente presenta una recuperación lenta de la anestesia, persistiendo un estado estuporoso que alterna, en ocasiones, con períodos de agitación, con reflejos pupilares que pueden estar más lentificados. Estos casos, que han recibido la denominación por algunos autores de encefalopatía post-CEC, han sido atribuidos al desarrollo de isquemia neuronal más o menos prolongada, que provoca una disfunción cerebral difusa de duración variable y que puede evolucionar hacia la regresión del cuadro y curación o al deterioro cognitivo e incluso exitus del paciente8,9,12.
Las disfunciones neuropsicológicas, atribuidas a períodos de perfusión cerebral insuficiente y al efecto de microembolias liberadas durante la CEC, consisten fundamentalmente en déficits de la atención, dificultad para la concentración, alteraciones en la memoria o del carácter; en la mayoría de los pacientes se trata de alteraciones transitorias, aunque hasta en un 35% de los casos dicha disfunción puede persistir al cabo de un año9,15. Newman et al16 describieron la presencia de este tipo de alteraciones en el 53% de los pacientes que fueron sometidos a cirugía de revascularización miocárdica con circulación extracorpórea, quedando esta cifra reducida a un 24% en la valoración realizada 6 meses después. Asumiendo, por tanto, cierto grado de reversibilidad, destaca al mismo tiempo el incremento de pacientes con deterioro cognitivo nuevamente revisados a los 5 años, cuya cifra ascendía al 42%.
Las crisis convulsivas son otra manifestación de la isquemia cerebral, pudiendo evolucionar a estatus epiléptico en los casos de hipoxia o alteraciones metabólicas graves, alteraciones cerebrovasculares previas o supresión de la medicación anticonvulsivante habitual14; descritas en el 0,6% de los pacientes intervenidos de cirugía cardíaca3, suponen un gran incremento en el metabolismo cerebral, por lo que es preciso su control.
FACTORES DE RIESGO
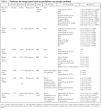
La tabla 1 muestra las variables que han destacado como predictores independientes de ictus en los estudios más relevantes. A pesar de que los factores estudiados difieren en los distintos grupos, y al margen de las diferencias relativas al tipo de estudio o al grupo de pacientes, destaca la presencia sistemática de una de las variables que se constituye como factor de riesgo: el antecedente de ictus2,3,13,17. La presencia de enfermedad cerebrovascular previa aumenta en un 8,5% la posibilidad de presentar un nuevo episodio de ictus durante el período postoperatorio, y el riesgo de que empeore la sintomatología previa es del 35%18. El componente hemorrágico constituye un riesgo adicional de progresión del daño neurológico, favorecido fundamentalmente por la heparinización durante la CEC y la necesidad de anticoagulación posterior en determinadas cirugías. Si la situación lo permite, retrasar la cirugía un mínimo de 4 semanas puede disminuir el riesgo de progresión de la sintomatología neurológica postquirúrgica19.
Roach et al3, en su estudio prospectivo y multicéntrico sobre 2.108 pacientes, y al que ya nos hemos referido previamente, demuestran que el factor con mayor significación estadística en su estudio para el desarrollo de ictus es la aterosclerosis de la aorta ascendente. Wareing et al20 analizaron una serie de 1.200 pacientes sometidos a cirugía de revascularización miocárdica y/o valvular, con el objetivo de examinar la relación existente entre una aorta aterosclerótica y el desarrollo de ictus perioperatorio; sus resultados muestran cómo la presencia de ictus se correlaciona con el grado de severidad de aterosclerosis en la aorta ascendente: 1,1% en los pacientes sin aterosclerosis o en grado leve, 3% en los pacientes con enfermedad aterosclerótica moderada y 4,8% de los pacientes con aterosclerosis severa en la aorta ascendente21.
La estenosis de los vasos carotídeos es otro factor que aumenta el riesgo de ictus perioperatorio22 mediante varios mecanismos: como causa adicional de ateroembolismo o tromboembolismo, limitando la perfusión cerebral distal a la obstrucción (durante la CEC o episodios de hipotensión arterial), o simplemente como indicador de enfermedad cerebrovascular aterosclerótica avanzada. Con estenosis carotídeas por encima del 70%, el riesgo de complicaciones neurológicas es del 2,9%, aunque aumenta hasta un 18,2% si el paciente ha presentado un ACVA previo18. Archbold refiere un mayor riesgo de ictus tanto en la población general como en el postoperatorio de cirugía cardíaca, en los pacientes con antecedentes de ictus o AIT, aquellos con soplo carotídeo y en todos los pacientes con estenosis carotídea, sintomáticos o no23. Una estenosis hemodinámicamente significativa se asocia hasta con un 30% de los ACVA ocurridos tras la cirugía de revascularización miocárdica. Cuando la estenosis carotídea es menor del 50% el riesgo de ACVA perioperatorio es de un 2%; con estenosis del 50-80% el riesgo aumenta hasta un 10%, alcanzando el 11-18,8% en los pacientes con estenosis por encima del 80%. Si la estenosis carotídea es severa bilateral, el riesgo de ACVA se eleva al 20%19.
A pesar de la ausencia de síntomas atribuibles a la enfermedad carotídea, una estenosis carotídea del 75% en un paciente asintomático es un factor predictor independiente de ACVA tras la cirugía de revascularización19,24.
Es evidente, y diferentes estudios así lo ratifican, que los factores predictores de aterosclerosis (edad avanzada, diabetes mellitus [DM] tipo 2, enfermedad vascular periférica e hipertensión arterial [HTA])3,5,13,25-27 están implicados en la génesis del daño neurológico. La edad avanzada ha demostrado una capacidad predictiva independiente para ACVA en la mayoría de los trabajos. Así mismo, los pacientes ancianos tienen mayor probabilidad de desarrollar enfermedad aterosclerótica en la aorta y a nivel carotídeo, factores que por sí solos suponen un incremento en el riesgo de presentar complicaciones neurológicas. La HTA y la DM son factores igualmente considerados como predisponentes de complicaciones neurológicas postoperatorias3,13. La curva de autorregulación cerebral, que en estos pacientes se encuentra desplazada a la derecha, puede justificar un flujo sanguíneo cerebral insuficiente en determinados momentos de la cirugía, principalmente durante la fase de recalentamiento28.
Numerosos autores han publicado sus propias series, con resultados que pueden diferir en mayor o menor medida con los estudios previamente comentados21. La afectación aterosclerótica severa se constituye, sin embargo, en el denominador común de los factores de riesgo demostrados más significativos.
Existen otra serie de factores, más dependientes de la técnica quirúrgica empleada, que suponen un incremento en el riesgo de disfunción neurológica postcirugía, como es el tipo de cirugía realizado. Las cirugías cardíacas abiertas, realizadas bajo CEC, cuentan con un mayor riesgo de embolia cerebral que las cirugías de revascularización miocárdica o las llevadas a cabo sin CEC. De la misma forma, la duración de la CEC y un tiempo prolongado de clampaje aórtico son otros factores estrechamente correlacionados con un pronóstico neurológico adverso14.
ETIOPATOGENIA
La mayoría de los autores coinciden en la etiología multifactorial de la disfunción neurológica postquirúrgica2,4,6,7,13,22,25. A continuación se detallan los principales mecanismos etiopatogénicos implicados:
Aterosclerosis aórtica
Los émbolos procedentes de la manipulación de una aorta ascendente con lesiones ateroscleróticas ulceradas son una de las causas más importantes de ictus en los pacientes sometidos a intervenciones cardíacas1,3,5,9,12,17,19,22,23,25,29,30. La identificación de una placa móvil de ateroma por ecografía transesofágica (ETE) en pacientes que van a ser sometidos a cirugía de revascularización miocárdica se ha asociado con un 33% de riesgo de ACVA, frente a un 2,7% en aquellos pacientes en los que no se detectan31. Tanto en las cirugías intracardíacas como en las extracardíacas existe conformidad sobre el hecho de que estos macroémbolos, asociados con la disrupción de la placa aterosclerótica, son los responsables de la mayoría de las alteraciones neurológicas postquirúrgicas, principalmente como déficits focales.
Estudios realizados con doppler transcraneal (DTC) a nivel de la arteria cerebral media (ACM), efectuado durante el procedimiento quirúrgico, han revelado una importante liberación de émbolos en el momento de inyección de la cardioplejía, canulación aórtica y en el inicio o finalización del by-pass cardiopulmonar21. El clampaje y desclampaje aórtico (especialmente este último) supone el origen de más del 60% de los émbolos detectados9,17,19,23,25. Los émbolos liberados de la aorta ascendente tienden a desplazarse hacia la circulación anterior (ramas de la ACM) y zonas «frontera» entre ACM/arteria cerebral posterior (ACP), así como a la circulación posterior, afectando el lóbulo occipital, cerebelo y tronco encefálico4,23. Aquellos otros émbolos de diámetro más pequeño suelen dirigirse hacia las zonas «frontera» de la ACM/ACP y ACM/arteria cerebral anterior (ACA), lo que en muchas ocasiones asemeja lesiones producidas por hipoperfusión.
Los datos procedentes de series autópsicas confirman de igual forma el origen aórtico como la causa más probable de embolia cerebral. Así, en 221 necropsias realizadas sobre pacientes sometidos a cirugía cardíaca, Blauth et al26 detectaron ateroembolismos sistémicos en el 37% de los pacientes con aterosclerosis de la aorta ascendente, y en el 2% de los pacientes sin enfermedad de la aorta ascendente. Moody et al32 describen igualmente la presencia de múltiples émbolos localizados en pequeñas arteriolas y capilares cerebrales de pacientes tras cirugía de revascularización miocárdica: de ellos, un 50% aparecen como material birrefringente, sugestivo de material ateromatoso, siendo el resto atribuidos a émbolos grasos o gaseosos.
Hipoperfusión
El fenómeno de hipoperfusión que tiene lugar durante el período perioperatorio ha sido considerado como el segundo mecanismo implicado en la generación de déficits neurológicos.
A pesar de los flujos empleados durante la CEC, más reducidos que los fisiológicos, la circulación cerebral cuenta con un mecanismo de autorregulación gracias al cual se mantiene el flujo sanguíneo cerebral bajo un amplio margen de presión arterial media, que oscila entre 50-150 mmHg12. Este flujo cerebral depende además de otros factores, como son la técnica anestésica, el método de medida, la temperatura, la pCO2 arterial y la hipoxemia11. Existen situaciones, sin embargo, en las que el cerebro se ve comprometido, particularmente a nivel de determinadas áreas más susceptibles a una disminución de la perfusión global: son las denominadas áreas «frontera»17. Este fenómeno es particularmente frecuente en la región parieto-occipital. Un ejemplo lo constituyen los pacientes hipertensos, con una especial vulnerabilidad a las presiones arteriales más reducidas y a una consiguiente lesión isquémica6,12. Aunque estos pacientes mantienen la curva de autorregulación del flujo cerebral, ésta se encuentra desviada a la derecha, por lo que precisan presiones de perfusión más elevadas que la población normal. Este fenómeno ocurre de la misma manera en pacientes diabéticos, ancianos y en aquellos con enfermedad cerebrovascular previa, de forma que una presión arterial media adecuada en otras circunstancias puede motivar un estado de hipoperfusión por flujo sanguíneo cerebral (FSC) insuficiente22.
La pCO2 es otro factor importante que actúa sobre el mecanismo de autorregulación cerebral, fundamentalmente mediante mecanismos de vasodilatación (hipercapnia) o vasoconstricción (hipocapnia). La suma de una presión arterial media insuficiente e hipocapnia en los pacientes con curva de autorregulación desplazada hacia la derecha puede agravar aún más el riesgo de hipoperfusión cerebral11. Un mecanismo que mantiene el FSC en un margen relativamente constante es la técnica alfa-stat de manejo ácido-base12,19. La incidencia de alteraciones neurocognitivas a los dos meses con el empleo de esta técnica es significativamente menor que con la técnica alternativa (pH-stat): 27% de pacientes frente al 44%, (p = 0,04733).
También en el período de recalentamiento durante la CEC se acentúa la disminución de FSC, tal y como lo demuestra el descenso en la SvO2 objetivado en el golfo de la yugular durante esta fase, en el estudio que realizan Croughwell et al34. Estos autores interpretan las modificaciones en la monitorización de SvO2 como datos sugerentes de hipoperfusión cerebral, correlacionando estos hallazgos con la presencia de alteraciones cognitivas detectadas durante el período postoperatorio.
La hipoperfusión secundaria a una presión de perfusión insuficiente, durante el acto quirúrgico o durante el período postoperatorio inmediato, puede ser causa de lesiones múltiples (infartos multifocales bihemisféricos) detectadas en las pruebas de imagen23.
Respuesta inflamatoria sistémica
Las investigaciones más actuales tienden a considerar un tercer mecanismo, la respuesta inflamatoria sistémica, como partícipe del daño neurológico que sigue a la cirugía. En la revisión que realiza Taylor expone los resultados de su estudio piloto en el que compara imágenes de resonancia magnética (RM) realizadas sobre 6 pacientes, 24 horas previas a la cirugía de revascularización coronaria, con las imágenes obtenidas en RM realizadas inmediatamente tras la cirugía (una hora tras la CEC, como paso previo al ingreso en la Unidad de Cuidados Intensivos [UCI]). Las imágenes postquirúrgicas muestran datos de edema cerebral agudo, con pérdida de los surcos, siendo interpretadas por los autores como consecuencia de una respuesta inflamatoria a nivel cerebral12. Los estudios al respecto de Taylor et al se centran en la activación de plaquetas y leucocitos y la denominada «cascada» de adhesión leucocitaria-célula endotelial, que se han revelado como eslabones fundamentales en la respuesta inflamatoria sistémica que tiene lugar en el contexto de la CEC12,25,35. Con la participación de selectinas e integrinas (moléculas de adhesión), las células blancas activadas se adhieren al endotelio vascular produciéndose su transmigración a los tejidos adyacentes, con el consiguiente inicio de la respuesta inflamatoria12.
ESTRATEGIAS EN EL DIAGNÓSTICO Y TRATAMIENTO
Como ya se ha expuesto con anterioridad, el Grupo Multicéntrico de Estudio de la Isquemia Perioperatoria5 ha presentado una clasificación basada en la presentación clínica neurológica, hecho que facilita en gran medida la sistematización en los diagnósticos y la posibilidad de un abordaje precoz. Por otra parte, y con el objeto de establecer una metodología que permita una valoración más completa y unificada, otros autores como Baker et al8 proponen una evaluación neurológica detallada que incluya:
1. Una exploración neurológica exhaustiva, punto clave en la detección de alteraciones neurológicas, que debería realizarse al paciente que va a ser sometido a una cirugía cardíaca, previa y posteriormente a la intervención, y que permita así el diagnóstico de hallazgos de nueva aparición atribuibles a la intervención quirúrgica36. De esta forma, propone una valoración neurológica estructurada que incluya una evaluación del estado mental, pares craneales, presencia de anomalías motoras o sensitivas, datos de disfunción cerebelosa, reflejos tendinosos y existencia de reflejos primitivos.
2. Evaluación neuropsiquiátrica/psicológica y cognitiva del paciente en el período postoperatorio, aspecto en el cual los autores reconocen la gran dificultad de análisis e interpretación, así como la escasez de protocolos aplicables y proponiendo el empleo de tests como el Mini-Mental State Examination o el Mental Status Questionnaire.
3. Técnicas de imagen: tomografía axial computarizada (TAC) craneal o RM en aquellos pacientes con clínica compatible de disfunción neurológica tras la cirugía.
4. Marcadores bioquímicos que, liberados a la circulación en casos de complicaciones neurológicas, pueden ser útiles en el diagnóstico de las mismas. Como marcadores más recientemente estudiados destacan la enolasa neuro-específica (NSE) y la S-100 ß14-26. Los autores concluyen haciendo un llamamiento a la necesidad de crear unas guías y tests de cribado estandarizados que permitan un diagnóstico más preciso y la posibilidad de comparación de resultados.
En función de los factores de riesgo implicados y de los mecanismos etiopatogénicos propuestos para el desarrollo de estas lesiones, se hace preciso el establecimiento de una serie de estrategias con la finalidad de disminuir o minimizar en la medida de lo posible el daño neurológico. Para ello es preciso identificar, en primer lugar, a la población con riesgo elevado de disfunción neurológica postquirúrgica. Teniendo en cuenta los marcadores seleccionados como factores de riesgo más significativos, nos permitirá la aplicación de métodos diagnósticos y la modificación de determinadas actitudes que pueden reducir o prevenir la lesión cerebral. El diagnóstico de una aorta aterosclerótica merece, igualmente, especial atención. La ecografía epiaórtica ha demostrado ser una técnica altamente sensible en la determinación de la extensión y severidad de la aterosclerosis de la aorta ascendente, con excelente correlación de sus resultados con los hallazgos quirúrgicos o necrópsicos20,29. Esta técnica ha mostrado su superioridad sobre la maniobra clásica de palpación de la aorta ascendente e incluso sobre la ETE22,37. La palpación manual puede detectar tan sólo un tercio de las lesiones ateroscleróticas identificadas por ecografía epiaórtica. Existen estudios prospectivos que comparan la ecografía epiaórtica con la ETE y la palpación37, en los que se concluye que a pesar de que las técnicas de ultrasonidos son más sensibles que la palpación directa, tanto la ETE como la palpación infraestiman la frecuencia y la severidad de la aterosclerosis aórtica. También Konstadt et al y Sylviris et al defienden el empleo de la ecografía epiaórtica frente a la palpación o la ETE, basándose en una menor incidencia de embolismo cerebral38,39. Dada su alta sensibilidad y especificidad para la identificación de una aorta de alto riesgo, la ecografía epiaórtica se ha convertido en un importante avance y es actualmente empleada en muchos centros para diagnóstico intraoperatorio y minimizar así el riesgo de ACVA post-cirugía19.
Sin embargo, el manejo quirúrgico más apropiado de aquellos pacientes con aterosclerosis aórtica severa sigue siendo controvertido. Basándose en los datos obtenidos de estas exploraciones, el cirujano puede realizar modificaciones en la técnica quirúrgica25,29. De esta forma, en pacientes con una pared aórtica menor o igual a 3 mm, puede recurrirse a las técnicas habituales; sin embargo, cuando la aorta muestra un grosor superior a 3 mm se proponen modificaciones en el lugar de la canulación aórtica, localización del clamp o la situación de las anastomosis proximales de los injertos aortocoronarios19,22. Se han propuesto diversas técnicas para evitar el clampaje aórtico, como la canulación de la arteria femoral, inserción de la anastomosis proximal del injerto a la arteria mamaria interna, la endarterectomía aórtica extensa o incluso el recambio de la aorta ascendente mediante hipotermia profunda y parada circulatoria en casos concretos22,29,40. Deben considerarse así mismo formas alternativas de revascularización, como el empleo de técnicas mínimamente invasivas o la revascularización vía percutánea. La cirugía de revascularización sin CEC debería plantearse como una alternativa en aquellos pacientes en los que se demuestre una enfermedad aterosclerótica significativa en la aorta ascendente13,19, a pesar de que también en estos casos se ha detectado la presencia de microémbolos, principalmente durante la implantación de injertos en la cara posterior.
Aunque el debate se prolonga desde hace más de dos décadas, hasta hace poco tiempo no ha existido un consenso acerca del mejor manejo diagnóstico o terapéutico de la enfermedad carotídea3,29,41. Berens et al, en un estudio sobre 1.184 pacientes, exponen que la realización de doppler carotídeo como método de cribado únicamente en los pacientes con uno o más de los factores de riesgo publicados (antecedentes de enfermedad neurológica, enfermedad vascular periférica, tabaquismo, sexo femenino y enfermedad de la arteria coronaria descendente anterior) identificaría al 95% de los pacientes con estenosis carotídea superior al 80%42,43. Archbold et al, tras una revisión de la literatura, sugieren que debería realizarse doppler carotídeo a todos aquellos pacientes con historia de ictus o AIT, a los que se detecte un soplo carotídeo y a todos los pacientes con edades por encima de los 65 años30. En las últimas guías publicadas por la American Heart Association se propone la realización de test de cribado carotídeo en los pacientes mayores de 65 años, estenosis de la arteria descendente anterior (ADA), enfermedad vascular periférica, tabaquismo, antecedentes de AIT o ACVA o soplo carotídeo a la exploración (recomendación clase IIa, nivel de evidencia C)19.
La edad límite inferior en la cual la realización de un test de cribado carotídeo resultaría coste-efectiva no está bien definida, aunque en la mayoría de los centros someten a dicho estudio a todos aquellos pacientes coronarios, susceptibles de cirugía, por encima de los 65 años. Sin embargo, los pacientes con enfermedad de la arteria descendente anterior y aquellos con antecedentes de AIT o ACVA constituyen un subgrupo en el que debe realizarse cribado mediante doppler carotídeo, independientemente de la edad19.
Varios estudios multicéntricos han demostrado la superioridad del abordaje quirúrgico frente al tratamiento médico en los pacientes con estenosis carotídea significativa, sean éstos sintomáticos o no22. En la actualidad se recomienda la realización de endarterectomía carotídea, previa a la cirugía de revascularización miocárdica o de forma simultánea, en aquellos pacientes con una estenosis carotídea sintomática, o en los pacientes asintomáticos con estenosis carotídea unilateral o bilateral por encima del 80% (clase IIa, nivel de evidencia C)19.
La endarterectomía carotídea realizada previamente o durante el mismo acto quirúrgico de revascularización miocárdica implica un descenso en la mortalidad (3,5%) y en el riesgo de ACVA durante el post-operatorio inmediato por debajo del 4%44. Una excepción a este hecho lo constituyen los casos en los que es preciso una cirugía de by-pass aorto-coronario urgente45.
Neuroprotección
El concepto de neuroprotección equivale a mejorar la tolerancia de las células cerebrales a la isquemia, interviniendo así en el proceso de recuperación funcional46. Aunque diferentes agentes farmacológicos han demostrado eficacia en el terreno de la neuroprotección en modelos animales, existen hasta la fecha muy pocos avances aplicables al área clínica25. Diversos agentes han sido estudiados en ensayos clínicos sobre pacientes con ACVA (bloqueantes del receptor del glutamato, antagonistas del N-metil-D-aspartato [NMDA], agonistas GABA, bloqueantes de los canales del calcio o del sodio, antioxidantes, estabilizadores de membrana, inhibidores de la adhesión leucocitaria o factor de crecimiento, etc.), aunque los resultados preliminares de estos estudios han sido, hasta el momento, desalentadores. Se ha evaluado igualmente la eficacia neuroprotectora de otros fármacos sobre pacientes que van a ser sometidos a cirugía cardíaca, entre los que figuran los barbitúricos, el nimodipino, el gangliósido GM1 y el remacemide (antagonista del receptor NMDA), aunque ninguno de ellos ha mostrado hasta la fecha resultados favorables significativos22,25,46.
La aprotinina, un inhibidor de la proteasa con propiedades antifibrinolíticas y pro-actividad plaquetaria, utilizado habitualmente en los procedimientos cardíacos, ha surgido recientemente como fármaco neuroprotector25,45,46. Aunque su mecanismo de actuación no está claramente determinado, se le atribuyen efectos neuroprotectores a través de su actividad antiinflamatoria, mediada por diferentes mecanismos como la inhibición de la kalicreína, inhibición de la trombina a través del PAR (protease activation receptor) o la disminución de la necesidad de transfusión de plaquetas45. Estos hechos han sido recientemente corroborados por Frumento et al, quienes en un estudio retrospectivo realizado sobre 1.524 pacientes sometidos a cirugía cardíaca con elevado riesgo de ACVA concluyen que la administración de dosis completas de aprotinina (dosis de carga de 280 mg previo al inicio de la CEC, 280 mg durante el cebado, seguido de perfusión de 70 mg/ hora), frente a mitad de dosis y a la no administración de aprotinina, se asocia con una menor incidencia y severidad de ictus45. Un metaanálisis reciente, que incluye 7 estudios doble ciego, randomizados y controlados, de pacientes intervenidos de by-pass aorto-coronario que recibieron aprotinina a dosis completas frente a placebo, confirma igualmente estos resultados, mostrando una menor incidencia de ictus estadísticamente significativa en el grupo de pacientes tratados con aprotinina25.
PRONÓSTICO
Los pacientes que desarrollan complicaciones neurológicas tras la cirugía cardíaca presentan un ingreso en UCI más prolongado (observándose, además, mayor incidencia de insuficiencia respiratoria, necesidad de reintubación y movilizaciones más demoradas), una mayor estancia hospitalaria, así como tasas más elevadas de morbilidad y mortalidad1,5,6,9,13. Las consecuencias económicas derivadas de todo lo anterior son igualmente significativas. Wolman et al, en su estudio multicéntrico, describen una mortalidad durante la estancia hospitalaria 4 veces mayor en los pacientes con complicaciones pertenecientes al tipo I, y una estancia posoperatoria en UCI una semana mayor para ambos tipos (I y II). En los pacientes con complicaciones tipo II la estancia postoperatoria media era de 15 días, pudiendo el 85% de los pacientes abandonar finalmente el hospital, frente a estancias medias de un mes en los pacientes tipo I, en los que es posible el alta hospitalaria en menos de un tercio de los casos5.
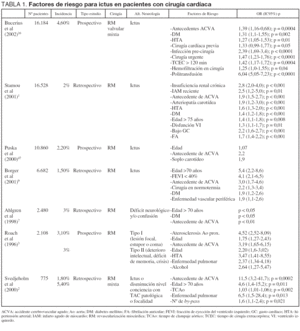
En esta misma línea, Salazar et al4, en un estudio prospectivo sobre 5.971 pacientes intervenidos, realizan una comparación de los pronósticos a corto y largo plazo de los pacientes que presentan clínica compatible con ACVA frente al resto de los pacientes. La tabla 2 muestra los resultados con significación estadística obtenidos tras el análisis de 33 variables, y en la que se exponen los marcadores independientes para mortalidad hospitalaria, mortalidad quirúrgica (hasta el día 30) y mortalidad tardía. Los autores enfatizan el profundo impacto que supone el desarrollo de un ACVA tras la cirugía cardíaca, basándose en términos de mortalidad, estancia en UCI y estancia hospitalaria, costes económicos, así como las graves repercusiones derivadas de una discapacidad mantenida a largo plazo.
EXPERIENCIA PROPIA
Se realizó un estudio prospectivo, observacional y analítico durante 17 meses (mayo 2002-septiembre 2003) en la Unidad de Cuidados Postoperatorios de Cirugía Cardíaca de un hospital terciario. Se consideraron complicaciones neurológicas aquellas que cursaron como ictus (isquémicos o hemorrágicos), encefalopatía (disminución del nivel de conciencia y/o agitación psicomotriz), crisis comiciales o muerte encefálica, tomando como base las definiciones emitidas por la Society of Thoracic Surgeons8.
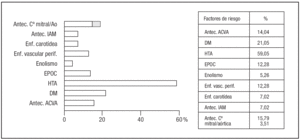
De los 688 pacientes ingresados, 57 (8,28%) presentaron algún tipo de complicación neurológica, si bien es cierto que la mayoría fueron complicaciones leves y con recuperación completa al alta hospitalaria. La edad media fue de 65 ± 11,3 años (rango 37-83), siendo el 50,88% mujeres. Las características preoperatorias descriptivas de este subgrupo de enfermos se muestran en la figura 1. La figura 2 expone los tipos de cirugía realizados.
Figura 1. Factores de riesgo.Antec. ACVA: antecedente de accidente cerebrovascular agudo; Ao: aórtica. Cª: cirugía. DM: diabetes mellitus; Enf. vasc. perif: enfermedad vascular periférica; EPOC: enfermedad pulmonar obstructiva crónica; IAM: infarto agudo de miocardio; HTA: hipertensión arterial.
Figura 2. Tipo de cirugía.Ao: aórtica; CIA: comunicación interauricular; Mi: mitral; RM: revascularización miocárdica; Sustituc. valv: sustitución valvular; TX card: trasplante cardíaco; Valv: valvular; VI: ventrículo izquierdo.
Respecto a los tiempos quirúrgicos, el de clampaje aórtico (TCAo) medio fue de 92 ± 43,3 minutos (rango 20-243), el de CEC (TCEC) de 122,3 ± 54,2 minutos (rango 41-290) y se realizó parada circulatoria en 4 pacientes (media de 53,5 minutos).
El 3,6% del total de pacientes (25 pacientes) presentaron clínica compatible con ictus, 20 de ellos con disminución del nivel de conciencia asociado al déficit motor. En 3,5% de los pacientes (24) la presentación clínica fue en forma de encefalopatía, con distinto grado de alteración del nivel de conciencia, asociado o no a la presencia de agitación psicomotriz. El 2,9% de los pacientes (20) presentaron crisis comiciales, 5 de ellos como hecho aislado y el resto en el contexto de ictus o encefalopatía. Se produjo muerte cerebral en dos pacientes que llegaron de forma urgente a la cirugía y en situación de shock cardiogénico (0,29%), y en un caso (0,15%) un hematoma en fosa posterior.
Se realizó TAC craneal en 50 pacientes durante las primeras 48 horas de evolución postoperatoria (del resto, 6 pacientes presentaron leve deterioro del nivel de conciencia y rápida recuperación, y uno una única crisis convulsiva parcial). Sólo un estudio mostró hemorragia cerebral, y en 35 pacientes (70%) no se objetivaron hallazgos que justificaran la clínica. En todos ellos se repitió una nueva TAC craneal de control a los 7-10 días, y en 18 pacientes con déficit motor focal y TAC inicial y de control sin hallazgos, se realizó además una RM craneal. En estos casos, exceptuando tres pacientes con clínica de encefalopatía severa en los que se detectaron áreas de múltiples infartos a nivel cortical, y otro estudio que no mostró alteraciones significativas, se evidenciaron áreas de infarto agudo o subagudo, fundamentalmente de pequeño tamaño y de distribución periférica, compatible con los hallazgos clínicos.
El tiempo de ventilación mecánica (VM) fue de 106,8 ± 210,4 horas y la estancia en UCI de 10,4 ± 15,4 días, ambos más prolongados que en aquellos pacientes sin complicación neurológica, de forma estadísticamente significativa (p = 0,0001 y p = 0,01, respectivamente). Se produjo el exitus en UCI en 5 pacientes (8,8%), dos de ellos por muerte cerebral y tres por causas ajenas al problema neurológico.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
Correspondencia: Dra. M. Rubio Regidor.
Unidad de Postoperatorio Cardíaco.
Hospital Universitario 12 de Octubre.
Avda. de Córdoba, s/n.
28041 Madrid.
Correo electrónico: rubiomer@yahoo.es
Manuscrito aceptado el 19-VI-2006.