INTRODUCCIÓN
En el paciente dependiente de ventilación mecánica, la frecuencia respiratoria y el volumen corriente deben de ser ajustados para provocar la menor sobrecarga mecánica (sobredistensión y atrapamiento aéreo). En adultos sanos en respiración espontánea, estos parámetros oscilan alrededor de 17 respiraciones/min y 0,4 l1. Durante la ventilación mecánica, el tubo endotraqueal, los circuitos del respirador y la válvula espiratoria aumentan las resistencias espiratorias2-4 y el tiempo necesario para completar la espiración3. Las primeras recomendaciones sobre la frecuencia respiratoria durante la ventilación mecánica estuvieron basadas en las necesidades metabólicas de pacientes sin insuficiencia respiratoria y ventilados con presión negativa5. Estos parámetros no son apropiados para pacientes con lesión pulmonar ventilados a presión positiva. Estudios realizados en pacientes anestesiados demuestran que el atrapamiento aéreo se produce a frecuencias ventilatorias superiores a 20 respiraciones/min, y a 12 respiraciones/min en presencia de un aumento de las resistencias respiratorias6. Las actuales recomendaciones de la frecuencia respiratoria durante la ventilación mecánica están basadas en las alteraciones fisiopatológicas que presente el paciente. Sin embargo, estas recomendaciones difieren según el autor y no están adecuadamente explicadas7.
La constante de tiempo espiratorio (tau) indica el tiempo necesario para que el sistema respiratorio alcance un "estado estable" al final de la espiración. Esta variable puede ser calculada analizando la fase espiratoria de la respiración6. Este método ha sido utilizado en pacientes anestesiados para predecir la respuesta a la ventilación a altas frecuencias8, pero no hay ningún estudio en pacientes críticos con fallo respiratorio agudo. Clínicamente, es atractivo describir con un número la mecánica respiratoria, pero debemos considerar que la complejidad del sistema respiratorio no puede quedar reflejada en una única variable9. En el análisis de la constante de tiempo asumimos que la mecánica del sistema respiratorio se comporta de forma lineal, con un solo compartimiento. Sin embargo, en el paciente crítico con lesión pulmonar, la mecánica respiratoria es más compleja; sobre todo las resistencias y la elastancia no son lineales10. Es decir, este método implica un error cuya magnitud dependerá de las características del paciente.
Nuestro objetivo es estudiar si el análisis de la constante de tiempo durante la ventilación mecánica del paciente crítico puede ser útil para evitar o disminuir la auto-PEEP (presión positiva telespiratoria) estática.
PACIENTES Y MÉTODO
Pacientes
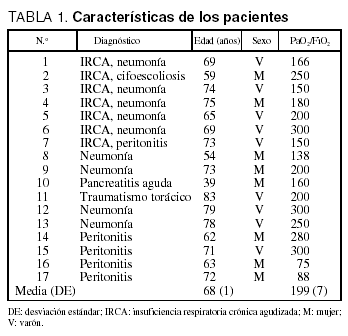
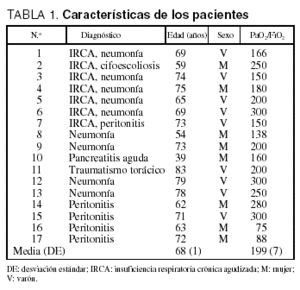
Realizamos un estudio prospectivo en 17 pacientes ingresados en la unidad de cuidados intensivos (UCI) que precisan ventilación mecánica por lesión pulmonar aguda o insuficiencia respiratoria crónica agudizada (IRCA) (tabla 1). El diagnóstico de enfermedad pulmonar obstructiva crónica está basado en la historia clínica previa, y el de lesión pulmonar aguda en la Conferencia de Consenso. Todos los pacientes estaban intubados por vía orotraqueal (Hi-lo Evac; Mallinckrodt Labs, Athlone, Irlanda) con un tubo de diámetro interno de 7,5 a 8,5 mm. La ventilación mecánica fue realizada con un respirador ciclado por volumen (Ventilador Servo 900C; Siemens, Solna, Suecia). El control incluye frecuencia cardíaca, electrocardiografía, presión arterial invasiva y monitorización continua de la saturación de oxígeno mediante pulsioximetría (HPM 1020; Hewlett Packard, Palo Alto, California). Los pacientes recibían tratamiento con midazolan-fentanilo. Comprobamos clínicamente la ausencia de esfuerzos respiratorios en el registro de flujo y presión de la vía aérea. Antes de la realización del estudio comprobamos que todos los pacientes estaban en situación cardiorrespiratoria estable. Ningún paciente presentaba barotrauma, traumatismo craneal grave, más de 10 cmH2O de PEEP, óxido nítrico o ventilación en prono. Comprobamos la ausencia de fugas en el circuito y neumotaponamiento mediante los cambios en la presión de la vía aérea tras una maniobra de Valsalva en la que se utilizaron los dispositivos del respirador. Con anterioridad al estudio se realizó una rigurosa aspiración de las secreciones traqueobronquiales, y durante el registro de las señales retiramos el humidificador.
Mediciones
El flujo se midió con un neumotacógrafo (Fleisch n.º 2, Metabo, Epalinges, Suiza) entre la "Y" del circuito del respirador y el tubo endotraqueal. Se calentó el neumotacógrafo para evitar la condensación en los capilares. El cambio de presión a través del neumotacógrafo se midió con un transductor de presión diferencial. El volumen se midió integrando la señal de flujo. Para evitar la derivación tras la integración, realizamos una corrección automática en la señal de flujo, de manera que la zona inferior de la curva de volumen se situara en una línea de regresión con pendiente cero. La presión en la vía aérea se midió entre el tubo endotraqueal y la "Y" del circuito del respirador, mediante un transductor de presión diferencial (Sensym SCX-E2, Sensymtronics, Francia) con referencia a la presión atmosférica. Las señales de presión y flujo fueron amplificadas y filtradas a una frecuencia de 100 Hz (Urelab DS-II, Biostec, Begues, España), registradas por un convertidor analógico digital de 12-bit (DT2810-A, Data Translation, Marlborugh, MA), muestreadas a una frecuencia de 100 Hz y almacenadas en un ordenador para su posterior análisis con el programa Anadat (RTH-Infodat, Montreal, Quebec, Canadá).
Protocolo
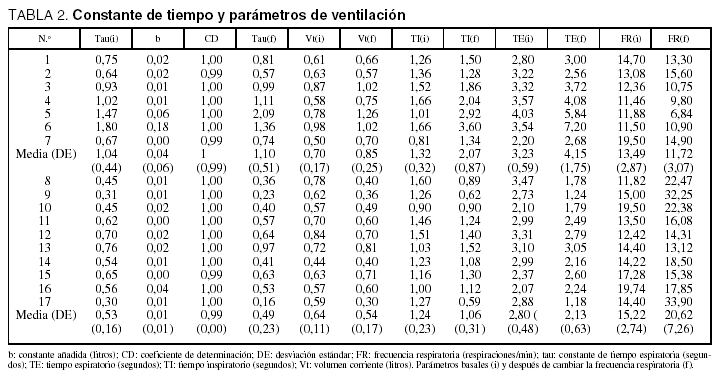
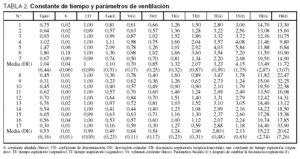
El paciente inicialmente fue ventilado con flujo inspiratorio constante, de forma controlada, FiO2 de 1 y PEEP = 0. En pacientes con insuficiencia respiratoria crónica agudizada (IRCA), el volumen de la corriente inicial era de 10 ml/kg, y de 8 ml/kg en el grupo con lesión pulmonar aguda. Después de monitorizar la presión en la vía aérea modificamos el volumen y la frecuencia respiratoria para evitar una sobredistensión del sistema respiratorio11 y acidemia respiratoria (tabla 2). Para medir la constante de tiempo y la mecánica respiratoria realizamos 3 registros de presión en la vía aérea y de flujo durante 40 s. Manteniendo el volumen por minuto constante, cambiamos a la frecuencia respiratoria calculada según la constante de tiempo, y después de 15 min repetimos las mediciones.
Cálculos
La constante de tiempo fue calculada con el método de Bergman et al6. Si asumimos que la mecánica del sistema respiratorio se comporta de forma lineal, la fase espiratoria de la respiración puede ser expresada por una ecuación con un exponencial que describe el cambio de volumen en función del tiempo espiratorio
V (t) = V0 e (t/RC)
donde V(t) es el volumen en un determinado tiempo espiratorio, V(0) es el volumen sobre la capacidad residual funcional, e es la base del logaritmo neperiano (2,718), R es la resistencia, C es la elasticidad, y t es el tiempo en segundos. El producto RC es la constante de tiempo del sistema respiratorio (resistencias x elasticidad = tiempo, [cmHsO/l/s x l/cm/H2O = s]). La constante de tiempo representa el tiempo necesario para que el 36,7% del volumen al final de la inspiración quede dentro del sistema respiratorio. Según esto, el descenso del volumen durante la espiración es progresivo y teóricamente continúa hasta infinito. En la práctica, el 98% del volumen inspiratorio final es espirado en 4 constantes de tiempo y el sistema respiratorio alcanza un estado estable. Por tanto, el tiempo espiratorio puede ser calculado como 4 veces la constante de tiempo. A la ecuación anterior añadimos una constante (V[t] = V0 e [t/RC] + b) que permite mejorar el ajuste y cuantificar en litros la desviación de los datos reales respecto al modelo, unidades más fáciles de interpretar en clínica que las estadísticas. La curva de volumen estudiada fue la señal promediada de los ciclos respiratorios registrados durante 40 s. Este método permite eliminar artefactos, como los derivados de la transmisión del latido cardíaco.
Frecuencia respiratoria
Se calculó considerando una relación inspiración:espiración de 1:2.
Mecánica respiratoria
Medimos la elasticidad y las resistencias mediante el método de los mínimos cuadrados y utilizamos un modelo con un solo compartimiento formado por un componente resistivo y otro elástico:
P (t) = E x V (t) + R x V'(t) + P0
donde la presión es la variable dependiente [P (t)], y el flujo [V'(t)] y el volumen [V (t)] son las variables independientes. P0 es la presión en la que comienza la integración del flujo y, por tanto, representa la auto-PEEP dinámica. En el modelo incluimos el ciclo respiratorio completo y obtuvimos el valor promedio de todos los ciclos respiratorios incluidos en el tiempo de registro cuyo coeficiente de determinación (R2) fue superior a 0,9.
La auto-PEEP estática se midió mediante la utilización de los dispositivos del respirador. Realizamos una oclusión de 5 segundos al final de la espiración para asegurar que la presión meseta puede ser identificada en todos los casos. Realizamos 4 mediciones de auto-PEEP y obtuvimos el valor promedio, entre cada medición esperamos entre 10 y 15 ciclos respiratorios.
Análisis estadístico
El coeficiente de determinación fue utilizado para estudiar la exactitud en el cálculo de los parámetros de la mecánica respiratoria y de la constante de tiempo. El análisis estadístico se realizó mediante el test no paramétrico de Kruskal-Wallis y el test de la U de Mann-Whitney. La asociación entre las variables fue analizada con el coeficiente de correlación de Spearman. Los resultados son expresados en forma de media (desviación estándar). Consideramos diferencias estadísticamente significativas cuando el valor de p ≤ 0,05.
RESULTADOS
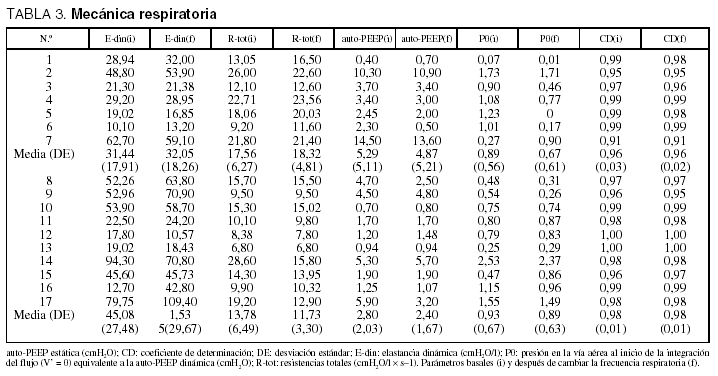
Comparamos la constante de tiempo obtenida en nuestro estudio respecto a la ecuación estándar (V[t] = V0 x e [1/RC]t ), sin que se obtuvieran diferencias significativas (0,67 [0,26] frente a 0,74 [0,40]; p = 0,12), mejorando significativamente el ajuste con el método utilizado (coeficiente de determinación [CD] = 0,993 [0,004] frente a 0,996 [0,003]; p = 0,001). En un paciente (n.o 17), la pendiente espiratoria volumen-flujo fue no lineal (CD = 0,83).
En pacientes con IRCA, la tau fue mayor (1,04 [0,44] s) que en los pacientes con lesión pulmonar aguda (0,53 [0,16]; p = 0,02; tabla 2). El valor de la constante b (0,02 [0,04]) se correlacionó con el de la tau (r = 0,8).
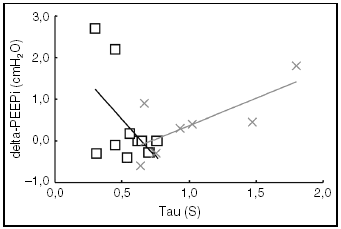
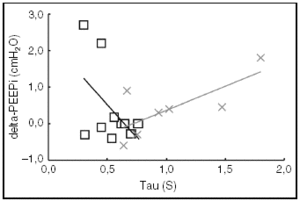
Considerando a todos los pacientes estudiados, no encontramos diferencias entre la frecuencia respiratoria inicial (FRi) y la final (FRf) (14,51 [2,84] frente a 16,64 [7,70] respiraciones/min; p = 0,2). En los pacientes con IRCA, la FRi fue más alta que la FRf (13,49 [2,87] frente a 11,72 [3,07] respiraciones/min; p = 0,06). Este cambio en la frecuencia respiratoria no estuvo asociado a cambios significativos en la auto-PEEP (5,29 [5,11] frente a 4,87 [5,21] cmH2O; p = 0,2). En los pacientes con lesión pulmonar aguda, la frecuencia respiratoria se incrementó desde 15,22 (2,74) a 20,62 (7,26) respiraciones/min, (p = 0,05), pero este aumento no se asoció a cambios significativos en la auto-PEEP (2,80 [2,03] frente a 2,40 [1,67] cmH2O; p = 0,2; fig. 1). Al estudiar a todos los pacientes, la tau no se relaciona con el cambio en la auto-PEEP (r = 0,1; p = 0,6). Sin embargo, en el grupo con enfermedad pulmonar obstructiva crónica (EPOC), el valor de tau tiende a relacionarse de forma positiva con el cambio en la auto-PEEP (r = 0,7; p = 0,06; fig. 2).
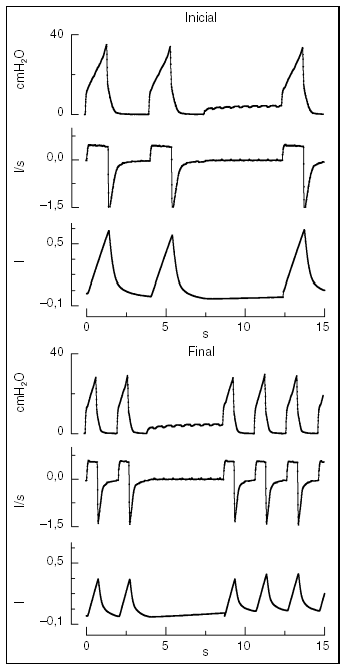
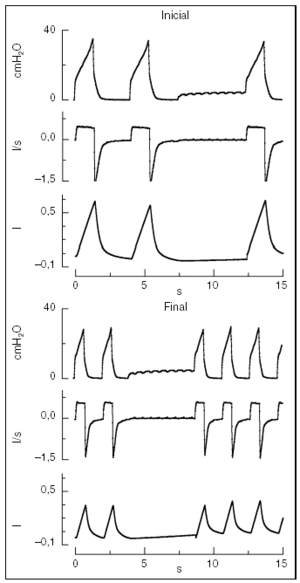
Figura 1. Presión en la vía aérea, flujo y volumen (derecha) y después de cambiar la frecuencia respiratoria (izquierda) en un paciente con lesión pulmonar aguda secundaria a neumonía (n.o 9). Tau = 0,31 s, la frecuencia respiratoria se incrementó desde 15,0 a 32,3 respiraciones/min, sin cambios significativos en la auto-PEEP (4,5 a 4,8 cmH2O).
Figura 2. Relación entre la constante de tiempo (tau) y el cambio de auto-PEEP estática tras cambiar la frecuencia respiratoria (delta-PEEPi). Síndrome de distrés respiratorio agudo (SDRA) (r = 0,5, p = 0,1), x enfermedad pulmonar obstructiva crónica (EPOC) (r = 0,73, p = 0,06).
En los pacientes con IRCA, el volumen corriente tuvo que ser aumentado desde 0,70 (0,17) a 0,85 (0,25) l (p = 0,1); esto representa 12,2 (2,4) ml/k. En el paciente 6 no se pudo realizar los cambios calculados, ya que el volumen corriente se tendría que haber aumentado a 2,04 l, el V(t) fue de 1,02 l y la FRf fue de 10,9 en lugar de 5,5 respiraciones/min. En pacientes con lesión pulmonar aguda se redujo el V(t) desde 0,64 (0,11) a 0,54 (0,17) l (p = 0,04). En ningún paciente fue necesario aumentar el V(t) según los cálculos (tabla 2).
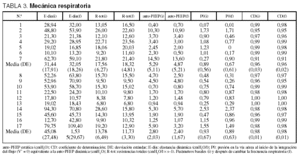
Los cambios en el volumen corriente no provocaron variaciones significativas en la mecánica respiratoria ni en la constante de tiempo (tabla 3). En el grupo con IRCA, el valor de tau aumentó desde 1,04 (0,4) a 1,08 (0,5) s (p = 0,7), mientras que en el grupo con lesión pulmonar aguda (LPA) disminuyó desde 0,53 (0,1) a 0,49 (0,2) s (p = 0,1).
DISCUSIÓN
En el paciente crítico que precisa ventilación mecánica, la mecánica del sistema respiratorio habitualmente tiene un comportamiento no lineal. Sin embargo, los métodos que se utilizan en la clínica para caracterizar las propiedades mecánicas (elasticidad y resistencias) están basados en modelos lineales. Esto es debido a que es difícil extrapolar a la clínica, las variables incluidas en modelos mecánicos complejos, no lineales o con múltiples parámetros12. El método que utilizamos para el análisis de la constante de tiempo deriva de la ecuación de movimiento del sistema respiratorio con un grado de libertad13. Éste es el método más simple, pero presenta varias limitaciones. La espiración completa se representa mejor mediante un modelo con 2 compartimientos, cada uno con una constante de tiempo14-17. La constante rápida corresponde a la espiración de la mayor parte del volumen corriente, influida principalmente por resistencias extratorácicas. La constante lenta corresponde a la viscoelasticidad y/o desigual distribución de la ventilación. En pacientes con síndrome de distrés respiratorio agudo (SDRA) ventilados con PEEP, el compartimiento representado por la constante lenta representa el 14 (5%) del volumen de insuflación (volumen corriente más el volumen atrapado por la PEEP), mientras que el compartimiento representado por la constante rápida corresponde a más del 80% del volumen y requiere al menos 1,5 s15. En nuestro estudio, el análisis fue realizado sin interrumpir la ventilación. De este modo, creemos que no se ha alcanzado el volumen de relajación del sistema respiratorio y la participación del compartimiento con constante lenta es menor18. Sin embargo, en el grupo de pacientes estudiado con LPA, el tiempo espiratorio inicial fue más prolongado que el tiempo espiratorio calculado. Por tanto, en este grupo de pacientes, el compartimiento con constante de tiempo lenta puede haber intervenido al final de la espiración. En los pacientes con IRCA, con una constante de tiempo más prolongada, es poco probable que el compartimiento con una constante de tiempo lenta sea importante durante la ventilación mecánica no interrumpida.
Otro factor que debe de ser considerado en el análisis de la constante de tiempo es la limitación al flujo espiratorio (LFE). El mecanismo responsable en pacientes con LPA es el cierre de pequeñas vías aéreas, especialmente durante la ventilación sin PEEP19. En los pacientes con IRCA, la presencia de hiperinsuflación dinámica casi siempre se asocia a una LFE20,21. En estos casos, el flujo espiratorio no depende del gradiente de presión transpulmonar; la relación presión-flujo puede ser no lineal y, por tanto, la fase espiratoria no puede ser representada por una única variable. En esta situación hay varias aproximaciones para obtener valores representativos de la mecánica respiratoria22. En nuestro estudio no analizamos la presencia o no de LFE, si bien encontramos un buen ajuste entre el modelo utilizado y la fase espiratoria del volumen, y el valor de la constante añadida fue pequeño; solamente en un paciente el ajuste fue menos útil. Por tanto, creemos que si este factor estuvo presente, no tuvo la suficiente magnitud para invalidar el análisis. Estos resultados pueden sorprender debido al carácter multicompartimental de la mecánica respiratoria en el paciente con SDRA o IRCA. Sin embargo, estudios previos demuestran que el modelo lineal puede ser útil en pacientes con LPA3,23. De este modo, aunque los pacientes con SDRA con frecuencia presentan un aumento en las resistencias del sistema respiratorio, éste es compensado por una alta presión de retroceso elástico. De esta forma, la relajación pasiva es similar al sistema respiratorio sano y, por tanto, un único valor de constante de tiempo puede ser representativo de la fase espiratoria3,24.
En los pacientes con IRCA, la fase espiratoria se caracteriza por un comportamiento exponencial, con un pico espiratorio precoz25. Éste puede subestimar el valor de la constante de tiempo, pero el volumen correspondiente a este pico de flujo suele ser pequeño4. Después de este pico inicial, el flujo muestra un característico descenso exponencial. Sin embargo, en el grupo de pacientes estudiado, la relación flujo-volumen muestra un patrón prácticamente lineal en casi todos los casos. Esto es debido a que el flujo espiratorio es modulado por el tubo endotraqueal y las propiedades elásticas del sistema respiratorio. En el grupo de pacientes con IRCA destaca una elasticidad mayor a la descrita en estudios previos26,27.
En el grupo de pacientes con LPA, la constante de tiempo medida fue similar a la descrita previamente. Dall'Ava-Santucci et al28 describen, durante la ventilación con y sin PEEP, valores de 0,79 (0,21) y 0,56 (0,14) s, respectivamente. Guttmann et al3 encuentran valores de 0,69 (0,2) s. En pacientes con IRCA, el valor de la constante de tiempo descrita depende del método empleado y del estadio evolutivo de la enfermedad. Con la "técnica interrupter", la constante fue de 2,88 (1,61) a 1,02 (0,4) s, dependiendo de la gravedad de la enfermedad4. Se han descrito valores más prolongados (3,9 [2,2] s) al utilizar en el análisis la segunda mitad de la espiración29. En nuestro estudio, los valores de tau son menores y creemos que esto se debe en algunos de los pacientes a la alta presión de retroceso elástico del sistema respiratorio, si bien no podemos especificar el grado de deterioro de la función respiratoria previo al ingreso en la UCI.
En el estudio de la constante de tiempo utilizamos la fase espiratoria de la curva de volumen, pero también puede ser calculada en la pendiente flujo-volumen23, en la curva de flujo o en la presión de la vía aérea. Este último método ha sido recomendado por la facilidad de registro y porque puede indicar la presencia de hiperinsuflación30. El valor de la constante añadida a la ecuación exponencial está directamente relacionado con el valor de la constante de tiempo. En estos pacientes con una constante elevada, esto puede estar relacionado con la presencia de LFE o no linealidad de la mecánica respiratoria. En estos pacientes, el valor de la constante de tiempo debe ser utilizado con precaución.
El principal resultado de nuestro estudio fue la ausencia de cambios en la auto-PEEP estática tras modificar la frecuencia respiratoria. En los pacientes con IRCA habitualmente se recomienda utilizar 12-15 respiraciones/min31 o < 12 respiraciones/min7. En los pacientes estudiados, la frecuencia inicial estaba dentro de estos límites y el cambio de frecuencia no fue significativo. De este modo, cabe esperar que la auto-PEEP no se modificara de forma significativa. Esto se debe a que el flujo al final de la espiración es muy escaso, por lo que pequeñas variaciones en el tiempo espiratorio no modificarán el volumen de atrapamiento32. Además, el efecto del tiempo espiratorio en la auto-PEEP estática depende del retroceso elástico y de las resistencias al flujo33. Marini34 demostró en este tipo de pacientes que el efecto de la frecuencia respiratoria en la auto-PEEP estática depende de la distensibilidad estática, y que cambios en la relación V(t)/frecuencia respiratoria tienen escaso efecto en la auto-PEEP cuando la distensibilidad es normal. Pero cuando la distensibilidad está disminuida, el efecto es muy significativo. Sin embargo, a frecuencias ventilatorias menores de 15 respiraciones/min, como la utilizada en este estudio, los cambios adicionales en la frecuencia tienen poca repercusión en la auto-PEEP34.
Puede resultar interesante determinar si un descenso adicional en la frecuencia respiratoria puede disminuir la auto-PEEP. En contra de esto, nuestros resultados están de acuerdo con el concepto de Rossi et al33 de que la auto-PEEP está influida por el tiempo espiratorio si éste es menor de 3 s, pero prolongar el tiempo espiratorio sobre este valor tiene poco efecto en la auto-PEEP. Además, la constante de tiempo no es independiente del volumen espirado; duplicar el volumen corriente en pacientes con IRCA aumenta el tiempo espiratorio necesario en 1,5 veces6. En nuestro estudio, este efecto se observó en un paciente. Tras aumentar de forma significativa el volumen corriente, la constante de tiempo se incrementó. Sin embargo, el resultado global en este grupo de pacientes es similar al descrito por Tuxen y Lane35 en pacientes con obstrucción grave al flujo espiratorio. En la ventilación mecánica controlada, estos autores demostraron que si se mantiene el volumen por minuto constante, el aumento del volumen corriente y del tiempo espiratorio no modifica el atrapamiento aéreo.
En el grupo de pacientes con LPA, la frecuencia respiratoria se aumentó de forma importante. Esto modificó la mecánica respiratoria (dependencia de la frecuencia), con un aumento de la elastancia dinámica y un descenso de las resistencias totales36. Sin embargo, hay que considerar el cambio de elasticidad estática dependiente de la posición del volumen corriente en la curva volumen-presión37. Estos cambios deben ser considerados, pues tienden a disminuir la constante de tiempo, compensar el descenso en el tiempo espiratorio y evitar el cambio en la auto-PEEP estática. En pacientes con LPA grave se recomienda disminuir el volumen corriente para evitar aumentar la lesión pulmonar. Esta estrategia puede provocar acidosis respiratoria, que se puede reducir aumentando el volumen por minuto mediante cambios en la frecuencia respiratoria38. Esto puede incrementar la auto-PEEP, en especial a frecuencias superiores a 24 respiraciones/min38. En 2 de los pacientes (casos 9 y 17) con una constante muy corta (tau = 0,31 y 0,30), se incrementó la frecuencia en cerca de 30 respiraciones/min sin que aumentara la auto-PEEP; por ello, aunque el número de pacientes estudiado es reducido, creemos que el análisis de la constante de tiempo puede indicar cambios de frecuencia respiratoria no asociados al aumento de auto-PEEP.
En nuestro estudio hay varias limitaciones. Para medir la auto-PEEP, el método de elección es realizar la medición cerca del paciente, evitando el circuito del respirador. Nosotros utilizamos los dispositivos del respirador porque es el método habitual en la clínica, pero en este caso, la presión medida puede subestimar el verdadero valor de auto-PEEP debido a la distensibilidad del circuito39.
En nuestro protocolo de estudio no realizamos gasometría después de modificar la frecuencia respiratoria. Esto es debido a que el volumen por minuto no se modificó, y se ha demostrado que en pacientes con LPA, el descenso del volumen corriente se asocia con un mayor transporte de oxígeno40 y, por otro lado, en los pacientes con IRCA, el aumento del volumen corriente tiende a disminuir la relación Vd/V(t)41.
En conclusión, en el grupo de pacientes con EPOC agudizada encontramos que el análisis de la constante de tiempo espiratorio no permite optimizar la frecuencia respiratoria en relación con las clásicas recomendaciones. Sin embargo, creemos que este método puede ser útil, en presencia de LPA, para aumentar la frecuencia respiratoria sin modificar de forma significativa la auto-PEEP.