INTRODUCCIÓN
La meningitis infecciosa es una enfermedad habitual en nuestro medio, presente a cualquier edad, aunque con una mayor prevalencia en la población joven. Pese al tratamiento, en algunos casos los pacientes llegan a situaciones críticas, con grave afección del nivel de conciencia y/o sistémica, motivo por el que requieren su ingreso en las unidades de medicina intensiva. El requerimiento de sedación y de ventilación mecánica dificulta el seguimiento clínico de su situación neurológica.
Se han descrito alteraciones en el flujo sanguíneo arterial cerebral en estos pacientes. Con frecuencia se halla un flujo sanguíneo cerebral elevado, si bien también se han descrito situaciones de flujo normal e incluso disminuido. La sonografía Doppler trancraneal (DTC) es un método útil para describir y controlar las alteraciones del flujo sanguíneo cerebral y parece poder aportar, en el caso de las meningitis infecciosas, un método más de seguimiento de la evolución clínica, en especial en los pacientes sometidos a protocolos de sedación y ventilación mecánica, en los que no siempre es posible valorar de manera correcta su evolución neurológica.
El objetivo de este estudio es analizar la posible utilidad del DTC en el seguimiento de los pacientes con meningitis grave, a partir del análisis de la velocidad del flujo sanguíneo cerebral e índice de pulsatilidad y de sus cambios, en relación con el curso clínico de la enfermedad.
PACIENTES Y MÉTODO
Diseño
Estudio observacional prospectivo.
Pacientes
Se ha analizado a todos los pacientes ingresados consecutivamente entre el primero de enero de 1998 y el mes de abril de 2002 en la unidad de cuidados intensivos (UCI) del Hospital Donostia con el diagnóstico de meningitis de cualquier etiología que requirieron al menos 72 horas de ingreso. Todos los casos fueron adquiridos en la comunidad. Se excluyeron las meningitis secundarias a otros procesos y las nosocomiales.
Variables
Se estudiaron la edad, el sexo, el microorganismo causante, la puntuación en la escala de coma de Glasgow (Glasgow Coma Score [GCS]) al ingreso, la puntuación de la GCS al alta de la UCI, las secuelas neurológicas al alta de la UCI --entre las que se incluyeron la puntuación de la GCS al alta < 14, algún tipo de déficit motor, hipoacusia y mortalidad--, y la causa de fallecimiento.
Doppler transcraneal
La medición de la velocidad de los flujos arteriales cerebrales se realizó con el modelo TC 2-64 (EME) Transcranial Doppler.
Se midieron la velocidad media de flujo en la arteria cerebral media (ACM) en ambos lados y el índice de pulsatilidad (velocidad sistólica menos la velocidad diastólica dividido por la velocidad media) durante las primeras 24 h del ingreso.
La segunda medición se realizó en el momento del alta, o al cabo de 7 días en los casos que requirieron un ingreso más prolongado. Las mediciones fueron realizadas por un mismo investigador, bajo un estricto control de la presión arterial media y de la PaO2. Se han considerado normales los valores de la velocidad del flujo en la ACM entre 45 y 70 cm/s, y entre 0,7 y 1,3 en el índice de pulsatilidad. Se ha valorado, además, la asimetría entre las ACM de ambos lados. Consideramos que había asimetría si la diferencia de velocidad entre ambas ACM era ≥ 20 cm/s.
Análisis estadístico
Las variables cuantitativas se expresan en forma de media, mediana, rango y desviación estándar, y las cuantitativas en forma de proporciones. Las diferencias entre las proporciones fueron analizadas con la prueba de la χ2 o el test exacto de Fisher para muestras pequeñas. Para la comparación de medias que no cumplían el supuesto de normalidad analizada con la prueba de Kolmogorov-Smirnov modificada por Lilliefors, se usaron los tests no paramétricos (prueba de la U de Mann-Whitney y prueba de Kruskal-Wallis). La igualdad de varianzas se comprobó con el test de Levene. La significación estadística se definió como un valor de p < 0,05. El análisis se realizó con el programa SPSS 9.0 para Windows.
RESULTADOS
Se incluyó en el estudio a 23 pacientes. En uno de ellos no se obtuvo un registro fiable de la ACM derecha.
Datos de ingreso
La distribución por sexos fue de 16 varones (70%) y 7 mujeres. La edad media fue de 48 años (rango, 19-78 años). Los agentes etiológicos detectados fueron: neumococo en 11 casos (48%), meningococo en 7 casos (30%), virus en 3 casos (13%), enterococos en un caso, y un último paciente en el que se aisló un bacilo gramnegativo no identificado causado por la mordedura de un perro. La puntuación media al ingreso de la GCS fue de 10 puntos (rango, 6-15 puntos).
Datos al alta
Secuelas
Un total de 18 pacientes (78%) tenía una puntuación en la GCS de 14-15 (situación neurológica normal o ligera desorientación). De ellos, 3 presentaban un cierto grado de hipoacusia y uno de ellos una ligera paresia en el brazo izquierdo (que recuperó días más tarde del alta de la UCI). Ninguno presentó crisis convulsivas.
Tres pacientes (13%) fueron dados de alta con un nivel de conciencia deprimido (uno de etiología neumocócica, otro meningocócica y el último viral).
Mortalidad
Dos pacientes (9%) fallecieron (ambos con meningitis neumocócica): uno por muerte cerebral y el otro tras desarrollar un fracaso multiórgano (FMO) en una situación neurológica no valorable al encontrarse con sedación profunda.
Doppler transcraneal
Inicial
Cinco pacientes (22%) presentaron flujos e índices de pulsatilidad normales.
En los 18 pacientes restantes (78%) se apreció, en el estudio DTC realizado dentro de las primeras 24 h de ingreso en UCI, una velocidad de flujo y un índice de pulsatilidad patológico en al menos uno de los hemisferios cerebrales. Trece de ellos tenían un flujo disminuido con un índice de pulsatilidad elevado (incluso en alguno de ellos con valores y morfología de onda cercanos a un patrón de muerte cerebral) y los otros 5 pacientes tenían una velocidad de flujo elevada, aunque ninguno sobrepasó los 125 cm/s.
Seguimiento
Los 5 pacientes que presentaron velocidad de flujo e índice de pulsatilidad normales en el momento del ingreso mantuvieron valores normales al alta, excepto en un caso que presentó velocidad elevada e índice normal. Pese a presentar estos valores normales, 2 de ellos tenían hipoacusia, uno paresia de brazo izquierdo con una tomografía computarizada (TC) normal, y otro que ingresó por meningitis viral presentaba un nivel de conciencia muy alterado (GCS = 5) al alta de la UCI.
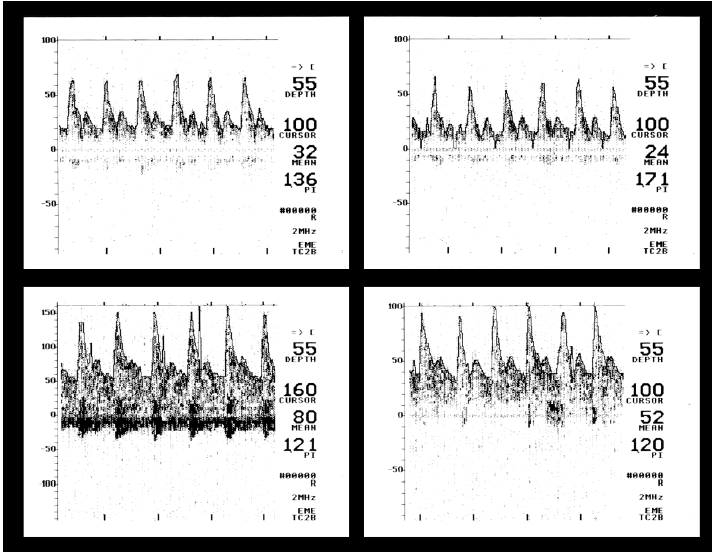
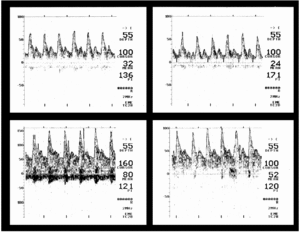
En cuanto a los 13 pacientes con flujos bajos, en 2 las velocidades de flujo disminuidas o muy disminuidas fueron persistentes (uno falleció por muerte cerebral y el otro presentaba una severa alteración del nivel de conciencia [GCS = 10] en el momento del alta de la UCI). Los otros 11 pacientes con una velocidad de flujo disminuida en el momento del ingreso presentaron con posterioridad valores normales o elevados (fig. 1); de ellos, 9 tuvieron una recuperación completa, uno falleció por causas sistémicas ya descritas y el último presentaba un nivel de conciencia alterado [GCS = 11] al alta de la UCI.
Figura 1. Meningitis meningocócica. Arriba: velocidad de flujo disminuida al ingreso (GCS = 7) en ambas arterias cerebrales medias. Abajo: velocidad de flujo normal o elevada al alta (GCS = 14). GCS: escala de coma de Glasgow.
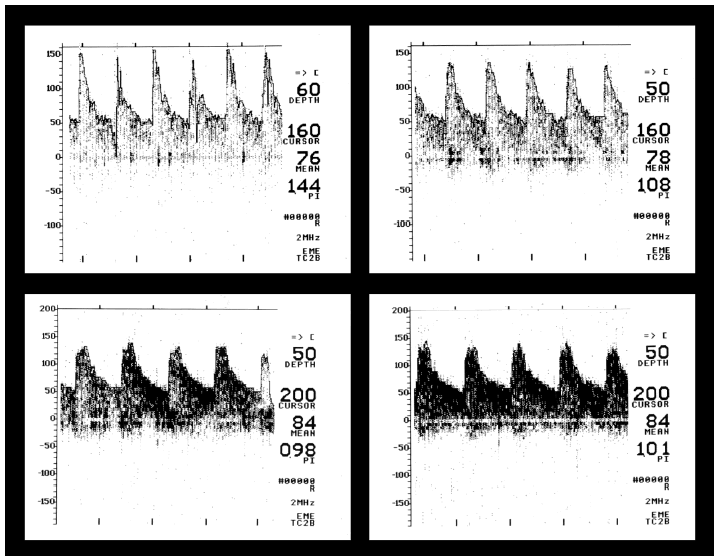
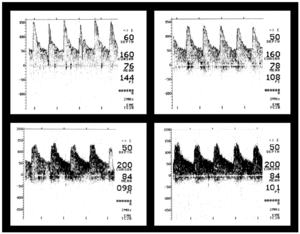
En los 5 pacientes que presentaban una velocidad de flujo elevada al ingreso, ésta continuó elevada al alta, pero con un índice de pulsatilidad normal o más cercano a valores normales (fig. 2). Uno de ellos alcanzó una velocidad de flujo máxima en el seguimiento de 134 cm/s en la ACM derecha (basal de 80 cm/s). Todos quedaron sin secuelas neurológicas excepto uno, que presentó hipoacusia.
Figura 2. Meningitis por enterococo. Arriba: velocidad de flujo elevada al ingreso (GCS = 6). Abajo: velocidad de flujo que persiste elevada al alta (GCS = 14). GCS: escala de coma de Glasgow.
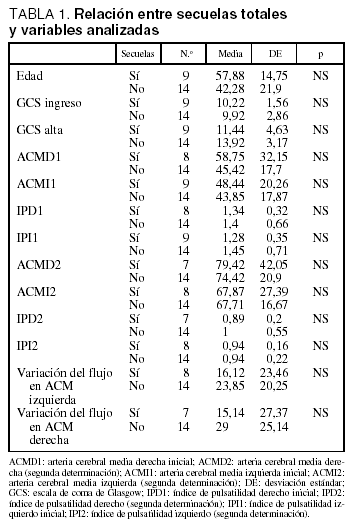
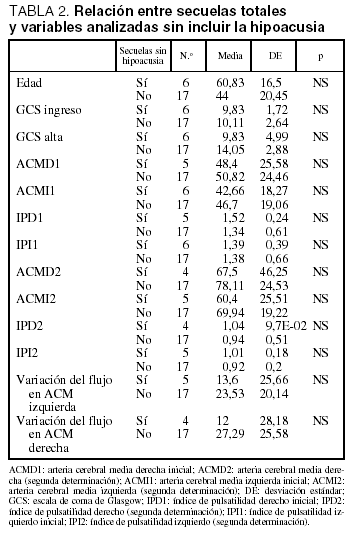
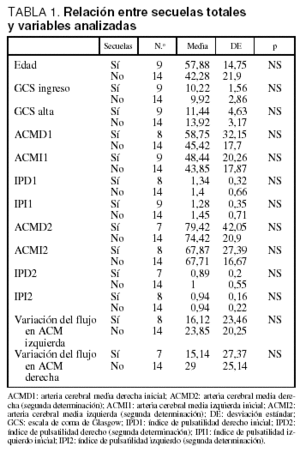
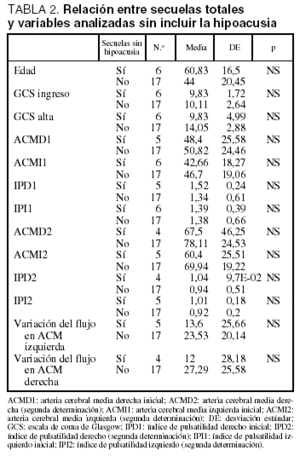
No se encontraron diferencias estadísticamente significativas en la velocidad de flujo entre los pacientes que presentaban secuelas y los que no las presentaban (tabla 1). En los pacientes con secuelas, cuando se excluyó a los que presentaban hipoacusia, sí se objetivó una tendencia a presentar velocidades de flujo menores en ACM que en el resto, aunque las diferencias no alcanzaron significación estadística, probablemente debido al reducido tamaño de la muestra (tabla 2).
Tampoco hubo diferencias significativas al estudiar las variaciones en la velocidad de flujo entre la primera y la segunda determinación, aunque se pudo apreciar un menor cambio en los pacientes con secuelas (tablas 1 y 2). No hubo diferencias significativas en cuanto a la edad, el sexo y la puntuación en la GCS al ingreso entre los pacientes con y sin secuelas (incluida o no la hipoacusia).
No hubo diferencias en el número de secuelas entre los diferentes microorganismos causantes de la infección.
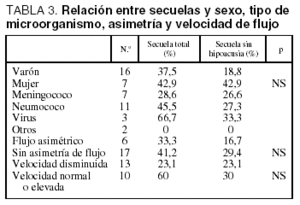
En 6 pacientes se encontró una asimetría entre la velocidad de flujo de la ACM derecha e izquierda, pero no se encontró una relación estadísticamente significativa entre la asimetría y las secuelas. Tampoco alcanzó significación estadística la relación entre la aparición de secuelas y las velocidades de flujo en el estudio inicial (tabla 3).
DISCUSIÓN
La generalización del uso del DTC como método de seguimiento sencillo e incruento de la evolución de la situación hemodinámica cerebral en diferentes enfermedades neurológicas1 ha aportado una nueva herramienta para el control y el seguimiento de estos procesos2.
La presencia meníngea de microorganismos, con la consiguiente inflamación y reacción leucocitaria, ha sido considerada como causa de la presencia en la sangre y en el líquido cefalorraquídeo (LCR) de mediadores proinflamatorios humorales con capacidad vasoactiva, que podrían ser causantes del aumento de la velocidad del flujo sanguíneo en los vasos cerebrales. Fassbender et al3 encontraron una correlación entre los valores elevados de citocinas proinflamatorias, interleucina-1 beta, interleucina-6, prostaciclina y recuento leucocitario alto y las velocidades de flujo elevadas; otros estudios han correlacionado la velocidad de flujo elevada con el recuento leucocitario4. También5 se ha observado una presencia significativa en el LCR de productos finales del metabolismo de óxido nítrico a concentraciones elevadas sin correlación con el recuento leucocitario, las proteínas o el factor de necrosis tumoral alfa. Estas sustancias vasodilatadoras no han sido halladas en cantidades significativas en las meningitis asépticas6,7.
Por otra parte, estudios radiológicos y necroscópicos revelan que otros factores diferentes pueden influir o ser causantes de los cambios en la velocidad de flujo en los vasos cerebrales en la meningitis. Además de los fenómenos de vasodilatación descritos, es posible encontrar zonas con estenosis de tipo inflamatorio en vasos arteriales cerebrales que incluso podrían evolucionar a estenosis orgánica tras la fase de reparación8. Estos fenómenos vasculíticos suelen ser locales y reversibles, auténticos fenómenos de vasospasmo con una patogenia similar a la descrita en la fase aguda de la hemorragia subaracnoidea, atribuidos a un fenómeno irritativo periarterial --material purulento en este caso-- que afectarían a toda la pared arterial y provocarían un estrechamiento del vaso y, secundariamente, elevaciones muy graves en la velocidad del flujo en la arteria afectada; no es infrecuente la aparición posterior de un área radiológica hipodensa en el territorio irrigado por dicha arteria9, como ocurre en un caso de nuestro estudio.
En otro estudio que valoraba las alteraciones cerebrovasculares y su relación con el flujo sanguíneo cerebral en la meningitis se han comunicado hallazgos similares. Ries et al10 encontraron una velocidad de flujo elevada, sobre todo entre el tercer y el sexto día del comienzo de los síntomas. Incluso en 7 pacientes de los 23 estudiados, la velocidad superaba los 210 cm/s, dato muy sugestivo de un importante estrechamiento de la luz arterial y en el rango de vasospasmo grave (mayor de 180 cm/s), lo que se asoció a la presencia de lesiones cerebrovasculares y a un peor resultado clínico. La evolución de estos procesos sugiere que pueden producirse diferentes fases en la situación hemodinámica cerebral a lo largo del tiempo y que, por tanto, se trata de un proceso dinámico donde el calibre arterial puede sufrir variaciones y, en ocasiones, llegar a situaciones de isquemia e infarto cerebral11.
La presencia de una situación de isquemia, provocada por un flujo sanguíneo cerebral insuficiente, puede también detectarse en cualquier fase de la evolución de la meningitis como consecuencia de una escasa situación hemodinámica sistémica, con una presión arterial media excesivamente baja, o en situaciones de hipertensión intracraneal que provocan una velocidad de flujo disminuida y un índice de pulsatilidad elevado. Los casos que presentan sepsis o una importante afección sistémica asociada tienen, por tanto, un mayor riesgo de isquemia cerebral.
Las meningitis graves son a menudo tratadas con fármacos vasoactivos para mantener una adecuada presión arterial. Con la administración de noradrenalina en la fase evolutiva más precoz, Muller et al12 mostraron que la autorregulación cerebrovascular estaba habitualmente alterada; se conseguía un significativo incremento en la velocidad de flujo en ambas arterias cerebrales medias al elevar la presión arterial media y una mejoría en la diferencia arterioyugular de oxígeno. La mayoría de los pacientes, tras recuperar la autorregulación días más tarde, presentaba una buena evolución. Lo contrario sucedía en los pocos casos que no la recuperaban12. Esta pérdida de autorregulación se atribuye a la dilatación arteriolar cerebral y en ocasiones se recupera parcialmente tras la hiperventilación mecánica13-15.
Los cambios en la hemodinámica cerebral durante el curso clínico de la meningitis no siguen en todos los casos un patrón evolutivo similar. De hecho, en un estudio de Muller realizado mediante DTC en pacientes con meningitis de etiología bacteriana, viral y fúngica, las velocidades de flujo en todas las arterias de la base del cráneo presentaban en la fase más precoz, dentro de las primeras 12 h del ingreso, una buena correlación con la puntuación en la GCS al ingreso. Los pacientes con velocidad de flujo disminuida e índice de pulsatilidad elevado presentaban un peor nivel de conciencia, con una puntuación en la GCS de 3-9, y eran los pacientes en situación de coma profundo los que presentaban unos valores más patológicos en el DTC. Los pacientes con velocidad de flujo elevada presentaban la mejor situación neurológica. No se encontraban alteraciones en los registros de DTC entre los pacientes que presentaban una puntuación en la GCS entre 10 y 13. No se observó ninguna diferencia importante entre las distintas arterias en un mismo paciente, y todas ellas seguían un patrón similar16. En nuestro estudio no se aprecia una correlación tan marcada con el estudio Doppler inicial, sino más bien con el de seguimiento.
Las complicaciones isquémicas de las meningitis, que determinan en gran parte el pronóstico de los pacientes, no se corresponden necesariamente con un mismo patrón de DTC. Una velocidad de flujo insuficiente con un índice de pulsatilidad elevado puede ser provocada por hipertensión intracraneal, con efectos más graves en los casos en los que observamos la persistencia de un patrón similar en los sucesivos controles17. Los registros de DTC, especialmente la velocidad diastólica (y, por tanto, el índice de pulsatilidad), son más patológicos cuanto mayor sea la elevación de la presión intracraneal18. Por otra parte, la excesiva velocidad de flujo en el rango del vasospasmo sugiere un importante estrechamiento en la luz del vaso que podría desembocar en similares consecuencias. En ambas circunstancias, la detección precoz de estos flujos patológicos sería útil para tomar medidas de cara a intentar evitar lesiones isquémicas irreversibles.
En nuestra serie observamos en la fase más temprana un elevado número de casos con un patrón de DTC en el rango de isquemia cerebral, con una gran variabilidad evolutiva en los registros de control; lo más frecuente es encontrar un llamativo paso a una velocidad de flujo elevada, con un índice de pulsatilidad normalizado, en un plazo relativamente breve y coincidiendo con la recuperación neurológica. Los pacientes que presentaban un patrón de DTC hiperémico mantuvieron un patrón con menos variaciones y se mantuvieron en el mismo rango hiperémico durante su evolución. Se detectó mediante tomografía computarizada un único caso que presentaba una probable lesión isquémica cerebral que coincidía con el paciente que desarrolló la velocidad de flujo más elevada, con una marcada asimetría respecto a la arteria contralateral, lo que sugería un estrechamiento de la luz del vaso, probablemente por vasospasmo (mayor de 130 cm/s); sin embargo, a pesar de ello, no se le detectaron secuelas. Otros casos de asimetría en los registros no se acompañaron de déficit neurológicos por tratarse, tal vez, de situaciones de hiperemia con diferencia regional de flujo o, más probablemente, de estrechamientos unilaterales poco significativos. No se observaron alteraciones significativas en el DTC ni asimetrías en el paciente que sufría una paresia leve y reversible en un brazo. El estudio radiológico tampoco mostró lesiones isquémicas cerebrales.
La predicción de la evolución neurológica y de las secuelas en la meningitis es complicada en fases iniciales. La edad, el grado de coma, el tipo de microorganismo, el diagnóstico precoz y el rápido inicio del tratamiento son, sin duda, factores determinantes en el pronóstico inmediato y en la posibilidad de secuelas futuras19,20. La incidencia de secuelas es más elevada en la meningitis neumocócica21.
La detección de una velocidad de flujo baja en el momento del ingreso16 o muy elevada, sugestiva de estrechamiento arterial, detectada con mayor frecuencia entre el tercer y octavo días pero, sobre todo, cuanto menos tarde en producirse, está relacionada con un peor pronóstico22,23.
El índice de pulsatilidad también se ha relacionado con el pronóstico de la meningitis. La elevación de este índice, especialmente entre el tercer y el octavo días de evolución del proceso agudo, se relacionó con las secuelas presentadas varios meses después en una población pediátrica24,25.
En nuestro estudio, la evolución de una velocidad de flujo excesivamente baja y de un índice de pulsatilidad elevado, a un patrón con velocidad de flujo normal o elevada y a una normalización del índice de pulsatilidad, se siguió en general de una recuperación neurológica en casi todos los casos, con independencia de la puntuación en la GCS inicial, mientras que el pronóstico fue sombrío si este cambio no se producía. Un paciente en situación de isquemia mantenida en el patrón DTC evolucionó a muerte cerebral. Por otra parte, los pacientes con una velocidad de flujo elevada en el momento del ingreso evolucionaron a una recuperación neurológica normal. Un patrón de DTC normal en la fase inicial no se asoció necesariamente a un buen pronóstico.
El agente etiológico causante de la meningitis también podría ser un factor determinante del tipo de patrón sonográfico de DTC. Las meningitis bacterianas se asocian a una mayor velocidad de flujo que las virales26 y a un índice de pulsatilidad más elevado, especialmente si son neumocócicas27. El reducido número de nuestra muestra no permite confirmar estos hallazgos en nuestro estudio.
Considerando que la hipoacusia sea, tal vez, provocada por causas etiopatogénicas diferentes del resto de las secuelas, decidimos valorarlas de forma independiente en nuestro estudio. La pérdida de audición se produce en meningitis de cualquier etiología28 y es una de las secuelas más frecuentes29,30. En nuestros casos no encontramos ninguna asociación con los diferentes tipos de registro de DTC.