Recopilar la información publicada sobre estabilidad de los fármacos usados en el paciente crítico, evaluar la calidad de los datos publicados y generar una tabla de compatibilidad con información actualizada.
Diseño1) Se realizó una búsqueda sistemática en las bases de datos Medline, Stabilis, Handbook on Injectable Drugs y Micromedex, para completar y actualizar la información disponible. Se incluyeron los estudios publicados entre 1990 y 2017 redactados en inglés, español y francés; 2) se analizó la calidad de los artículos según los criterios indicados en las guías de práctica para estudios de estabilidad; 3) se construyó una tabla de compatibilidades con los datos hallados para las combinaciones binarias de 44 fármacos de uso frecuente en unidades de cuidados intensivos (UCI).
ÁmbitoUCI de hospitales españoles e internacionales.
ResultadosLa revisión sistemática incluyó 29 artículos (27 originales y 2 revisiones). Ningún estudio cumplió todos los criterios de calidad establecidos, aunque el 93% garantizaba una correcta reproducibilidad. La tabla final aporta datos de compatibilidad fisicoquímica de 475 de las 945 combinaciones posibles (50,3%), de las cuales 366 (77,1%) son compatibles y 80 (16,8%) son incompatibles.
ConclusionesSe proporciona una actualización de las compatibilidades entre los fármacos habitualmente empleados en las UCI, con la intención de contribuir a la administración segura de medicamentos en pacientes críticos.
To gather all published information about the stability of drugs commonly used in Intensive Care Units (ICU); evaluate the methodology of published data; and generate a compatibility table.
Designi) A systematic review was conducted searching the following databases: Medline, Stabilis, Handbook of Injectable Drugs and Micromedex. Articles published from 1990 to 2017 in English, Spanish and French were included. ii) Article quality was analyzed according to the stability studies practice guidelines. iii) A compatibility table was produced with data for 44 binary combinations of drugs frequently used in the ICU.
ScopeSpanish and international hospital ICU.
ResultsThe systematic review included 29 studies (27 originals, 2 reviews). None of the included studies followed all the methodological requirements. However, 93% guaranteed correct reproducibility. Accordingly, drug stability knowledge was available for 50.3% of the studied admixtures, in which 77.1% of the binary combinations proved compatible and 16.8% proved incompatible.
ConclusionsThis review provides new reliable evidence about the physicochemical stability of drugs commonly used in the critical care setting. The study contributes to the safe administration of intravenous drugs in critical patients with a view to avoiding adverse events in this frail population.
Los pacientes ingresados en unidades de cuidados intensivos (UCI) requieren frecuentemente la administración intravenosa de múltiples fármacos. Entre los grupos terapéuticos más usados encontramos los fármacos vasoactivos, los analgésicos y los sedantes, que se suelen administrar en infusión continua.
Según una revisión sistemática realizada por Moyen et al. en las UCI se producen una media de 1,7 errores/día relacionados con el proceso de administración de la medicación1. Por otra parte, los datos reportados por Merino et al., en un estudio realizado en UCI de hospitales españoles, son algo mejores (1,13 errores de medicación por cada 100 pacientes/día)2. Aun así, los errores de medicación en las UCI son frecuentes y requieren la atención de los profesionales sanitarios para su minimización.
Los errores en la administración de medicamentos en la UCI se deben a múltiples factores: el uso de medicamentos de alto riesgo (fármacos vasoactivos, inótropos, sedantes, etc.) que se suelen administrar en bajas dosis por su elevada potencia, requiriendo dilución y un cálculo previo a la administración, las prescripciones de dosis en unidades de medida diferentes o el elevado número de medicamentos que se han de administrar para cada paciente. El uso de bombas de infusión inteligentes, pese a suponer un avance importante en la seguridad, también se ha asociado con un importante número de errores de administración por fallos en la programación de las mismas3.
La combinación de estos factores de riesgo aumenta la probabilidad de cometer un error en pacientes que, además, tienen mayor vulnerabilidad por su condición de gravedad. A menudo, los pacientes críticos disponen de accesos venosos limitados, lo que supone que los diferentes fármacos se deben administrar a través de una misma vía, incrementando así el riesgo de mezclar medicamentos incompatibles entre sí. La mezcla de fármacos incompatibles es un error de medicación que puede tener consecuencias graves para el paciente, como fallo terapéutico, microembolismos o toxicidad4.
La administración de 2 fármacos en «Y» requiere, al menos, que ambos sean físicamente compatibles5. Esta condición se da cuando al mezclarlos en proporciones 1:1 no se observan signos visibles de incompatibilidad como, por ejemplo, precipitación o cambio de color. Por otra parte, para administrar de forma segura 2 fármacos en un mismo diluyente es necesario que la mezcla sea, además, químicamente estable, por lo que es necesario demostrar que no se ha producido un cambio sustancial en la concentración de ninguno de los fármacos presentes en la mezcla6.
Entre las medidas más útiles para prevenir los errores de medicación en las UCI se encuentra la estandarización de la concentración de las soluciones para infusión, especialmente de los medicamentos de alto riesgo, por su mayor potencial para causar un daño grave y por constituir el grupo con mayor incidencia de errores.
Otra medida muy recomendable para la administración segura de medicamentos consiste en disponer de información fiable sobre la compatibilidad de los fármacos de uso común en el paciente crítico. Sin embargo, la información sobre compatibilidad es escasa y, en muchas ocasiones, difícil de interpretar debido a la variabilidad de concentraciones utilizadas, a la omisión de información sobre las técnicas utilizadas para la valoración o a la dudosa calidad técnica de las fuentes. La falta de información acerca de la mezcla segura de 2 fármacos genera dificultades en el trabajo diario de los equipos de enfermería en las UCI. Además del riesgo de complicaciones asociadas a la administración de 2 moléculas incompatibles, la falta de información puede llevar a la enfermera a la necesidad de obtener nuevos accesos venosos para la administración de los fármacos por separado, incrementando así el riesgo de complicaciones infecciosas o tromboembólicas.
Esta revisión tiene como objetivo recopilar la información publicada sobre la compatibilidad fisicoquímica de los medicamentos más comúnmente usados en las UCI al administrarlos en «Y», evaluar la calidad de los datos publicados y generar una tabla de compatibilidades con información fiable y actualizada que contribuya a mejorar la seguridad en la administración de medicamentos en el paciente crítico.
MetodologíaEstrategia de búsquedaSe realizó una búsqueda sistemática en las bases de datos Medline, Stabilis, Handbook on Injectable Drugs y Micromedex para identificar artículos originales, artículos de revisión y metaanálisis sobre compatibilidad fisicoquímica de fármacos. Se excluyeron los estudios de casos por su enfoque clínico y carencia de metodología para la determinación de la estabilidad fisicoquímica. Se tomaron como base las revisiones publicadas por Kanji et al. y López-Cabezas et al.5,7, focalizando la búsqueda en las combinaciones de fármacos para las que estos autores no encontraron o no buscaron información. Los años de publicación de los estudios abarcaron desde 1990 hasta diciembre de 2017 y los idiomas incluidos fueron inglés, español y francés. La estrategia de búsqueda consistió en utilizar términos múltiples que describían la información de interés y combinarlos con el operador booleano «OR», para luego refinar la búsqueda utilizando el operador «AND». Los términos que se usaron fueron: physical compatibility, drug stability, y-site, y-injection, intravenous drug, además de los nombres y sinónimos de los fármacos de interés.
Los fármacos seleccionados para la revisión son todos de uso común en las UCI y, además, suelen administrarse en perfusión continua. Las concentraciones que se tomaron como referencia son las estandarizadas en nuestro centro7 para estos medicamentos y coinciden con las que se usan normalmente en la mayoría de UCI (tabla 1). En caso de que la información encontrada sobre compatibilidad para una determinada molécula hiciera referencia a un intervalo de concentraciones distinto, se especificó en la tabla 2. El proceso de búsqueda bibliográfica para cada fármaco fue realizado por 2 investigadores de forma paralela.
Fármacos de estudio y concentraciones utilizadas como referencia para la búsqueda bibliográfica
| Fármaco | Concentración estandarizada | Fármaco | Concentración estandarizada |
|---|---|---|---|
| Adrenalina | 40mcg/ml | Isoproterenol | 4mcg/ml |
| Amiodarona | 3,6mg/ml | Ketamina | 50mg/ml |
| Argatrobán | 1mg/ml | Labetalol | 2mg/ml |
| Bicarbonato | 1mmol/l | Magnesio sulfato | 15mg/ml |
| Calcio cloruro | 10mg/ml | Meropenem | 30mg/ml |
| Calcio gluconato | 10mg/ml | Metadona | 0,2mg/ml |
| Ceftazidima | 24mg/ml | Midazolam | 4mg/ml |
| Cisatracurio | 2mg/ml | Milrinona | 0,2mg/ml |
| Clonidina | 7,5mcg/ml | N-acetilcisteína | 50mg/ml |
| Cloruro mórfico | 1mg/ml | Naloxona | 8mcg/ml |
| Dexmedetomidina | 4mcg/ml | Nitroglicerina | 0,2mg/ml |
| Diltiazem | 1mg/ml | Nitroprusiato | 0,2mg/ml |
| Dobutamina | 8mg/ml | Noradrenalina | 0,32mg/ml |
| Dopamina | 8mg/ml | Pantoprazol | 0,32mg/ml |
| Esomeprazol | 0,32mg/ml | Piperacilina-tazobactam | 64mg/ml |
| Fenilefrina | 0,2mg/ml | Potasio cloruro | 120mEq/l |
| Fentanilo | 30mcg/ml | Propofol | 10mg/ml |
| Flumazenilo | 40mcg/ml | Remifentanilo | 20mcg/ml |
| Furosemida | 2mg/ml | Somatostatina | 24mcg/ml |
| Heparina sódica | 50UI/ml | Vecuronio | 0,2mg/ml |
| Insulina | 1UI/ml | Verapamilo | 0,1mg/ml |
Combinaciones de fármacos compatibles fisicoquímicamente, pero a una concentración inferior a la marcada como referencia
| Fármaco 1 | Concentración máxima compatible | Fármaco 2 | Concentración máxima compatible |
|---|---|---|---|
| Adrenalina | 32mcg/ml | Pantoprazol | 0,8mg/ml |
| 2mcg/ml | Verapamilo | 0,08mg/ml | |
| Amiodarona | 4mg/ml | Fenilefrina | 0,04mg/ml |
| 6mg/ml | Furosemida | 1mg/ml | |
| 15mg/ml | Nitroprusiato | 0,3mg/ml | |
| Calcio cloruro | 4mg/ml | Dobutamina | 4mg/ml |
| Calcio gluconato | 4mg/ml | Dobutamina | 4mg/ml |
| Ceftazidima | 120mg/ml | Dobutamina | 1mg/ml |
| 120mg/ml | Dopamina | 0,4mg/ml | |
| 125mg/ml | Ketamina | 10mg/ml | |
| Dobutamina | 1mg/ml | Heparina | 50UI/ml |
| 4mg/ml | Magnesio sulfato | 40mg/ml | |
| 4mg/ml | Potasio cloruro | 60mEq/l | |
| Dopamina | 3,2mg/ml | Midazolam | 2mg/ml |
| Fentanilo | 12,5mcg/ml | Remifentanilo | 0,25mg/ml |
| Heparina | 20UI/ml | Verapamilo | 0,08mg/ml |
| Isoproterenol | 4mcg/ml | Magnesio sulfato | 1mg/ml |
| 200mcg/ml | Potasio cloruro | 40mEq/l | |
| 4mcg/ml | Vecuronio | 0,1mg/ml | |
| 10mcg/ml | Verapamilo | 0,08mg/ml | |
| Meropenem | 22mg/ml | Potasio cloruro | 40mEq/l |
| Naloxona | 0,8mcg/ml | Verapamilo | 0,08mg/ml |
| Nitroglicerina | 0,1mg/ml | Verapamilo | 0,08mg/ml |
| Nitroprusiato | 0,2mg/ml | Vecuronio | 0,1mg/ml |
| 0,1mg/ml | Verapamilo | 0,08mg/ml | |
| Noradrenalina | 0,008mg/ml | Verapamilo | 0,08mg/ml |
| Piperacilina-tazobactam | 40mg/ml | Dexmedetomidina | 4mcg/ml |
| 40mg/ml | Remifentanilo | 250mcg/ml | |
| Potasio cloruro | 100mEq/l | Remifentanilo | 250mcg/ml |
Se corresponden con las casillas grises y especificadas como I/C de la figura 2.
Una vez realizada la búsqueda bibliográfica, 2 revisores diferentes evaluaron la calidad de los estudios mediante un proceso de revisión por pares. La revisión se realizó siguiendo los criterios de calidad basados en la opinión de expertos y guías de práctica detallados a continuación8–11:
- 1.
Reproducibilidad del estudio: descripción del principio activo y diluyente, condiciones de estudio y metodología.
- 2.
Número de test realizados (mínimo por triplicado).
- 3.
Tiempos de toma de muestras en el análisis de estabilidad: se recomienda un muestreo de 5 tiempos, que incluya muestreo a tiempo 0.
- 4.
Ensayos realizados para evaluar la estabilidad de las mezclas: a) transparencia: para partículas visibles, observación con un panel negro, contador automático de partículas o turbidimetría; para partículas subvisibles uso de microscopia óptica, espectrofotometría o turbidimetría; b) cambio de color: inspección visual o espectrofotometría; c) formación de gas: inspección visual; d) pH; y e) Estabilidad química: medida de la variación de la concentración de los 2 fármacos.
Se creó una tabla con todas las combinaciones posibles de los fármacos de interés. Las casillas se asignaron con «C» si la mezcla era compatible, con «I» en caso de incompatibilidad e «I/C» si la estabilidad dependía de condiciones especiales. Las combinaciones de fármacos con ausencia de datos sobre compatibilidad se dejaron en blanco.
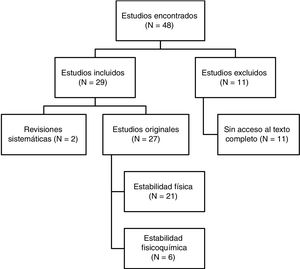
ResultadosRendimiento de la búsqueda bibliográficaSe identificaron un total de 48 artículos. La figura 1 especifica el proceso de selección. De los 29 incluidos en la revisión 4 estaban escritos en español, 3 en francés y 22 en inglés. Respecto a las fechas de publicación 8 artículos fueron publicados entre los años 1990-1999, otros 10 entre los años 2000-2009 y los 11 restantes entre los años 2010-2017.
Calidad de los estudios encontradosNinguno de los artículos evaluados cumplía la totalidad de los criterios de calidad establecidos en esta revisión. No obstante, el 93% de ellos describía con detalle suficiente las condiciones del estudio y la metodología para garantizar su reproducibilidad.
Los análisis se realizaron por triplicado tan solo en un 26% de los casos. En cambio, el 81% de los estudios siguieron la recomendación de tomar muestra a tiempo 0, aunque únicamente 10 obtuvieron una muestra en 5 tiempos diferentes.
En lo referente a los ensayos realizados para evaluar la estabilidad de las mezclas, todos los estudios valoraron la transparencia y un 93% reportaron el cambio de color mediante inspección visual. La utilización de otros métodos para la observación de partículas subvisibles fue realizada en 16 estudios (59%). En el 67% de los estudios se evaluó la formación de gas y solo en 12 se midieron cambios de pH en el tiempo. Únicamente 6 estudios valoraron la estabilidad química de las mezclas, siendo la cromatografía líquida de alta resolución el método empleado en 5 de ellos para medir la concentración de los principios activos de la mezcla.
Los resultados correspondientes a este apartado se encuentran resumidos en la tabla 3.
Resumen de los criterios de calidad de los artículos incluidos
| Indicador de calidad | N.° estudios (%) | Referencias |
|---|---|---|
| Evaluación formación precipitado | 27 (100) | 12,13,16–40 |
| Evaluación cambio de color | 25 (93) | 12,13,16–27,30–40 |
| Medida cambio de pH | 12 (44) | 12,13,16,18,19,22,26,27,29,38,39 |
| Evaluación formación de gas | 18 (67) | 12,13,17,19–21,24–26,31,33–40 |
| Análisis por triplicado | 7 (26) | 18,21,22,29,34,35,38 |
| Descripción de la metodología (incluye número y frecuencia de las observaciones y condiciones del estudio) | 24 (89) | 12,13,17–24,26–33,35–40 |
| Descripción de los diluyentes de todos los fármacos de estudio | 21 (78) | 13,17–29,33,35–40 |
| Descripción del material de los recipientes de estudio | 22 (81) | 12,13,17–31,33,36–39 |
| Estabilidad química | 6 (22) | 16,18,19,22,29,38 |
Se seleccionaron 44 fármacos de uso en UCI en perfusión continua, incluyendo solución para nutrición parenteral con y sin lípidos y 3 antibióticos betalactámicos, la compatibilidad de los cuales se encuentra detallada en la figura 2. Con los datos aportados por las revisiones de Kanji et al. y López-Cabezas et al. se disponía de información de compatibilidad para 393 combinaciones de las 945 posibles5,7. Al finalizar la revisión sistemática fue posible añadir nuevos datos de estabilidad para 82 combinaciones de fármacos. De los nuevos hallazgos 29 combinaciones resultaron ser compatibles, 27 incompatibles y 26 compatibles en condiciones específicas. Por tanto, en la tabla final se dispone de datos de compatibilidad en 475 de las 945 combinaciones posibles de 2 fármacos (50,3%), de las cuales 366 son compatibles (77,1%), 80 combinaciones son incompatibles (16,8%) y 29 son compatibles en condiciones específicas (6,1%), que se detallan en la tabla 2.
DiscusiónGarantizar la seguridad en el uso de los medicamentos se encuentra entre los principales compromisos que tienen los profesionales sanitarios con sus pacientes. En el caso de las UCI, debido a la gran cantidad de fármacos intravenosos que se deben administrar simultáneamente y al número limitado de vías de las que dispone el paciente, esta seguridad se ve comprometida, en ocasiones, debido al riesgo de administrar conjuntamente fármacos que no son compatibles entre sí, en pacientes especialmente vulnerables.
Las bases de datos disponibles online, como Stabilis 4.0, son de gran utilidad para buscar información sobre compatibilidad, pero para el personal que administra los medicamentos es mucho más útil un documento en forma de tabla donde poder consultar de manera rápida la información que interesa en un momento dado. Esto es de especial interés cuando se encuentran ante una situación de urgencia en la que cualquier retraso en la actuación del personal sanitario puede tener consecuencias en el paciente.
La presente revisión se ha centrado en analizar la compatibilidad fisicoquímica de los fármacos intravenosos más utilizados en la UCI, habitualmente administrados en «Y», y resumir la información en una tabla de doble entrada. Los estudios de compatibilidad física son los más habituales a causa de la sencillez en su ejecución, a diferencia de los estudios de estabilidad química, en los que es necesario disponer de técnicas analíticas más sofisticadas para determinar la concentración inicial y final de los fármacos.
Pese a todo, el número de combinaciones de fármacos estudiados sigue siendo insuficiente. Como podemos observar en la figura 2, no ha sido posible encontrar información sobre compatibilidad fisicoquímica de todas las combinaciones planteadas; por ejemplo, en el caso del flumazenilo y de la piperacilina-tazobactam solo se ha conseguido determinar la estabilidad con 4 fármacos, quedando en ambos casos las 39 combinaciones restantes sin información.
Si tenemos en cuenta todas las posibles combinaciones que se contemplaron, y aun añadiendo todos los nuevos datos encontrados, seguimos sin disponer de información sobre la compatibilidad fisicoquímica de 470 combinaciones, lo que supone que solo se cuenta con datos para el 50,3% de las combinaciones de fármacos planteadas.
Las combinaciones que presentan mayores problemas de incompatibilidad son aquellas que incluyen algún fármaco cuya estabilidad está muy ligada al intervalo de pH; tal es el caso del bicarbonato sódico, la furosemida o el pantoprazol. La furosemida, por ejemplo, requiere pH básico para garantizar la estabilidad de la molécula en solución, por lo que la mezcla con fármacos ácidos (pH<4) produce turbidez y precipitación12.
La presencia de adyuvantes en la formulación farmacéutica, la concentración, la exposición a temperaturas extremas o la luminosidad son otros factores relacionados con la incompatibilidad de los fármacos13. En ocasiones una combinación de medicamentos puede ser estable en un diluyente determinado e incompatible en otro; por ejemplo, la dopamina solo es compatible con la amiodarona si ambas se disuelven en suero glucosado al 5% debido a que esta última es inestable en solución salina al 0,9%, por ello, si esta mezcla que a priori es compatible, se realiza en suero fisiológico, puede tener lugar una pérdida de concentración de la amiodarona, con el consiguiente riesgo de falta de respuesta terapéutica.
Por otra parte, la calidad de los estudios publicados también es mejorable en muchos casos. Sería deseable encontrar una mayor uniformidad en los estándares de calidad de este tipo de estudios. Por ejemplo, siendo el pH un factor crítico en la estabilidad de los fármacos en solución, tan solo se ha comprobado en 12 de los 27 artículos. Igualmente es escaso el empleo de técnicas más precisas que la observación visual, como la turbidimetría o la microscopia para la detección de partículas y cambios de color. En los últimos años diversos expertos han publicado guías para el diseño de estudios de estabilidad de fármacos8–11, y es de esperar que ello contribuya a mejorar la calidad global de este tipo de estudios en el futuro.
Anteriormente, otros autores han publicado revisiones de estas características. Por ejemplo, el grupo de Flamein et al.14 han abordado este problema en las UCI neonatales; Knudsen et al.15 aportaron información sobre compatibilidad específicamente del grupo de analgésicos y sedantes. Concretamente, la revisión que presentamos ha tomado como referencia el trabajo de Kanji et al.5 en Canadá y López-Cabezas.7 en España, complementándolo con nueva información disponible sobre fármacos que actualmente se encuentran comercializados en nuestro medio y las concentraciones que más frecuentemente se emplean.
En total se ha encontrado información sobre 82 nuevas combinaciones de fármacos, extraídas de 27 referencias distintas. Entre ellas se incluyen combinaciones de 3 antibióticos betalactámicos (ceftazidima, meropenem y piperacilina-tazobactam) de amplio uso en UCI, y para los que en los últimos años se han comprobado las ventajas farmacocinéticas de la administración en perfusión extendida16–19.
En el paciente crítico a menudo se utilizan perfusiones a concentraciones de fármaco superiores a las habituales. En este sentido, no ha sido posible encontrar datos de todas las combinaciones a las elevadas concentraciones utilizadas en la UCI (tabla 1); sin embargo, en algunos casos sí que se ha obtenido información de concentraciones inferiores a las que se establecieron en esta revisión. Estos casos se han especificado en la tabla de compatibilidades (fig. 2) como compatibilidad condicionada (I/C), esto es, que la combinación había sido estudiada a una concentración diferente a la estandarizada.
Los datos de estabilidad aportados en esta revisión no son extrapolables a otras combinaciones de fármacos o a otras concentraciones distintas de las que se indican. Además, la información aportada hace referencia a combinaciones dobles de fármacos, pudiendo surgir la incompatibilidad si entran en contacto más de 2 fármacos a la vez, lo que es altamente desaconsejable. No obstante, tanto los fármacos como las concentraciones elegidas son las más frecuentemente empleadas en las UCI de adultos de la mayoría de hospitales.
A la espera de nuevos y mejores estudios de compatibilidad que subsanen la falta de conocimiento en este tema, esta revisión proporciona una actualización sobre la evidencia disponible acerca de la compatibilidad entre los fármacos más habitualmente empleados en las UCI, en un formato práctico de fácil consulta. De esta forma, se pretende contribuir a la administración segura de los medicamentos en pacientes que, por su condición de fragilidad, pueden sufrir consecuencias de mayor gravedad.
AutoríaGenís Castells Lao: la concepción y el diseño del estudio, la adquisición de datos, el análisis y la interpretación de los datos; el borrador del artículo o la revisión crítica del contenido intelectual; y la aprobación definitiva de la versión que se presenta.
Montse Rodríguez Reyes: la concepción y el diseño del estudio, la adquisición de datos, el análisis y la interpretación de los datos; el borrador del artículo o la revisión crítica del contenido intelectual; y la aprobación definitiva de la versión que se presenta.
Judit Roura Turet: La adquisición de datos, el análisis y la interpretación de los datos; el borrador del artículo o la revisión crítica del contenido intelectual; la aprobación definitiva de la versión que se presenta.
Marta Prat Dot: la adquisición de datos, el análisis y la interpretación de los datos; el borrador del artículo o la revisión crítica del contenido intelectual; la aprobación definitiva de la versión que se presenta.
Dolors Soy Muner: la concepción y el diseño del estudio; el borrador del artículo o la revisión crítica del contenido intelectual; la aprobación definitiva de la versión que se presenta.
Carmen López Cabezas: la concepción y el diseño del estudio, la adquisición de datos; el borrador del artículo o la revisión crítica del contenido intelectual; la aprobación definitiva de la versión que se presenta.
Conflicto de interesesTodos los autores declaramos no tener conflicto de intereses respecto al presente manuscrito.