INTRODUCCIÓN
La nutrición enteral (NE) es una técnica de utilización cada vez más extendida cuando se plantea el soporte nutricional del paciente crítico1,2. Ello es debido al hecho de que las indicaciones actuales de la NE contemplan su empleo en pacientes que previamente eran tratados con nutrición parenteral y a la constatación de que cada vez son más evidentes las pruebas de la contribución positiva de la NE a la evolución de los pacientes3,4.
No obstante, aunque la experiencia alcanzada en el empleo de la NE ha permitido disminuir el número de complicaciones asociadas, persisten todavía problemas que, no tanto por su gravedad sino por su frecuencia, pueden limitar su utilización en los pacientes críticos5,6.
Las complicaciones clásicamente asociadas a la NE son englobadas en cuatro grandes grupos: mecánicas, infecciosas, metabólicas y gastrointestinales. Este último grupo es el que se presenta con mayor frecuencia y el que constituye el motivo de la presente revisión.
El estudio COMGINE (Complicaciones Gastrointestinales de la Nutrición Enteral), llevado a cabo por el Grupo de Trabajo de Metabolismo y Nutrición de la SEMICYUC, nos permitió establecer la frecuencia de dichas complicaciones en las UCI de nuestro entorno. La reciente publicación del estudio7 vuelve a poner de actualidad el tema y nos lleva a revisar los factores relacionados con cada una de las complicaciones, actualizando, de este modo, publicaciones previas8.
Frecuencia de las complicaciones gastrointestinales
Cuando la NE se aplica mediante sonda nasogástrica, como en la gran mayoría de nuestras UCI, las complicaciones gastrointestinales que pueden aparecer son: aumento del residuo gástrico, estreñimiento, diarrea, vómitos, regurgitación de la dieta y distensión abdominal.
A pesar de los avances en este campo, es todavía difícil poder comparar los resultados de diferentes grupos debido, fundamentalmente, a la falta de criterios homogéneos para definir dichas complicaciones. Además, el interés y la experiencia en el manejo de la NE influyen en los resultados comunicados sobre la importancia de las complicaciones.
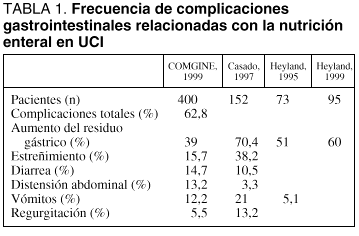
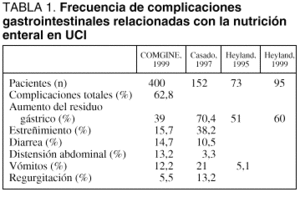
Los datos más recientes indican que la frecuencia global de las complicaciones gastrointestinales relacionadas con la NE sigue siendo elevada, encontrándose cercana al 50% de los pacientes tratados (tabla 1). No obstante, del mismo modo que es importante considerar la elevada frecuencia de complicaciones gastrointestinales, debe tenerse en cuenta que el manejo de las mismas mediante protocolos adecuados hace que pueda mantenerse la NE en la mayoría de los casos, siendo necesario recurrir a la retirada definitiva de la NE en, aproximadamente, un 15% de los pacientes tratados.
Implicaciones clínicas de la presencia de complicaciones gastrointestinales asociadas a la NE
1. Disminución del volumen aportado. La presencia de complicaciones gastrointestinales supone una disminución de la ingesta de nutrientes por vía enteral9-11 y puede conducir al compromiso nutricional de los pacientes afectados. En muchas ocasiones, la suspensión transitoria de la dieta o la disminución del ritmo de infusión, indicados para el control de las complicaciones, se mantienen de manera incorrecta y son responsables del descenso en el aporte de nutrientes6.
2. Efecto pronóstico. En varios trabajos7,12 puede encontrarse una relación entre la tolerancia a la dieta enteral y la evolución de los pacientes: parámetros como la estancia en UCI y la mortalidad son mayores en el grupo que presenta complicaciones gastrointestinales. Aunque los datos existentes no proceden de estudios diseñados específicamente para este fin, parece que la intolerancia a la dieta es un indicador pronóstico en los pacientes críticos.
3. Complicaciones infecciosas. La NE es considerada como un factor de riesgo para el desarrollo de neumonía asociada a la ventilación mecánica13. La teoría de la "vía gastropulmonar" para explicar el paso de gérmenes al árbol bronquial como consecuencia de un reflujo gastroesofágico no ha sido suficientemente sustentada aunque, por el momento, es la hipótesis más probable.
COMPLICACIONES GASTROINTESTINALES
Aumento del residuo gástrico
El aumento del residuo gástrico (ARG) es la complicación más frecuente de la NE en los pacientes críticos que reciben la dieta por vía gástrica7,10,14-16. Se define como "la presencia de un volumen residual superior a 200 ml obtenido en cada valoración del contenido gástrico"7. Esta cifra es la que puede encontrarse con más frecuencia en la bibliografía17, aunque se han referido valores comprendidos entre 60 y 300 ml. La determinación del volumen residual es el método más utilizado para constatar el vaciamiento gástrico en el entorno clínico, si bien éste sólo permite obtener una información aproximada sobre la motilidad gástrica. Este aspecto ha sido puesto de manifiesto en un reciente estudio que identifica pacientes con aumento del residuo gástrico pero con motilidad gástrica normal según los resultados del test de absorción del paracetamol18. No obstante, y a pesar de ésta y otras limitaciones descritas19, la definición del ARG basada en la cantidad del residuo gástrico debe seguir siendo recomendada hasta que pueda disponerse de pruebas de motilidad gástrica rápidas y aplicables a "pie de cama".
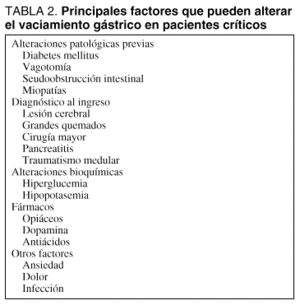
El fenómeno del "íleo gástrico parcial" que acompaña a las situaciones críticas es bien conocido y puede explicar la elevada incidencia de ARG. La causa de esta elevada frecuencia de intolerancia gástrica es multifactorial, dado que los factores que regulan el vaciamiento gástrico son diferentes y que su afectación es casi habitual en las situaciones críticas (tabla 2). Tanto la inestabilidad hemodinámica, como los fármacos de uso frecuente en UCI (sedantes, fármacos vasoactivos) o la ventilación mecánica pueden alterar la motilidad normal del tracto digestivo. En recientes estudios prospectivos puede demostrarse el papel de los opiáceos20 o de la dopamina21 (incluso a dosis bajas de 4 µg/kg/min) en el enlentecimiento de la motilidad gástrica.
Entre el 50 y el 80% de los pacientes críticos presentan alteraciones en la motilidad gástrica. Diversos autores han llevado a cabo estudios para valorar el vaciamiento gástrico en pacientes críticos sometidos a ventilación mecánica. Tanto los métodos manométricos22 como los isotópicos23 o los farmacológicos (test de absorción de paracetamol24) demuestran una importante alteración en el vaciamiento gástrico que puede ser responsable de la elevada frecuencia de ARG. No obstante, la alteración no es del mismo grado en todos los pacientes críticos; factores como el empleo de fármacos, el diagnóstico de ingreso o la gravedad influyen en el nivel de afectación del vaciamiento gástrico25.
En algunos grupos de pacientes se describe una especial incidencia en la alteración del vaciamiento gástrico: éste es el caso de los pacientes con lesión cerebral de diverso origen26,27, que, por tanto, pueden presentar una mayor frecuencia de ARG. En estos pacientes se ha propuesto la utilización precoz de vías de acceso diferentes a la SNG con el objetivo de mejorar la tolerancia a la NE28,29.
Es frecuente que en el manejo inicial de las situaciones de ARG se proceda a la retirada transitoria de la NE. Dada la elevada incidencia del ARG, las modificaciones en el ritmo de administración de la dieta instauradas para el control de esta complicación son responsables, en gran medida, de que la eficacia media de la NE no sea óptima: tanto en el estudio COMGINE como en un trabajo similar de Heyland et al30 se refiere que los pacientes recibieron, como valor medio durante el periodo de estudio, entre el 65 y el 75% de los requerimientos calculados. Como se ha mencionado, el principal responsable de esta "hiponutrición" fue el ARG.
Para el control del ARG pueden emplearse dos tipos de tratamientos, a veces de manera conjunta: a) fármacos procinéticos, y b) vías de acceso transpilóricas.
1. Fármacos procinéticos. La utilización de estos fármacos (metoclopramida, cisaprida, domperidona o eritromicina) es recomendada como método inicial para el control del ARG. Su eficacia en esta indicación se encuentra reflejada en estudios controlados31-35. Los fármacos procinéticos más utilizados son la metoclopramida y la cisaprida. Este último, que parece ser más eficaz que la metoclopramida, cuenta con la desventaja de su efecto arritmogénico (produce una prolongación del intervalo QT) y de que su metabolismo hepático mediado por la vía del citocromo P450 favorece la aparición de interacciones medicamentosas con otros fármacos (como el ketoconazol, la claritromicina o la eritromicina) metabolizados por la misma vía. Por este motivo, algunos autores sugieren la restricción del empleo de cisaprida y la utilización de eritromicina como procinético de elección en los pacientes críticos36.
La utilidad de estos fármacos en la prevención del desarrollo de ARG ha sido recientemente valorada, investigándose si el empleo "preventivo" de fármacos procinéticos podría disminuir el reflujo gastroesofágico y la incidencia de neumonía secundaria a broncoaspiración. No obstante, a pesar de lo atractivo de la hipótesis, los resultados obtenidos no la confirman37.
2. Vías de acceso transpilóricas. Su empleo se encontraría indicado en los pacientes con ARG persistente y no controlado con procinéticos. Las sondas nasogastroyeyunales de doble o triple luz reúnen características ideales para ser empleadas en estas situaciones (con una única sonda se hace posible la administración intrayeyunal de la dieta al mismo tiempo que la vía gástrica puede ser utilizada para valorar la cantidad y el aspecto del contenido gástrico). El empleo de este tipo de sondas permite la administración eficaz de la dieta enteral por vía transpilórica en pacientes que no la toleran por vía gástrica38. Ello previene los riesgos asociados a la nutrición parenteral, que sería la única alternativa de soporte nutricional en los pacientes con ARG persistente. La inserción de la sonda puede realizarse "a pie de cama" mediante alguna de las técnicas de colocación "a ciegas" que han sido descritas39, aunque a veces es necesario recurrir a técnicas adicionales, como la endoscopia digestiva o la radiología, para el paso transpilórico de la misma. Recientemente, se ha descrito una técnica basada en el empleo de un electrocardiógrafo, que parece conseguir buenos resultados en el paso transpilórico de la sonda40.
El tratamiento de la intolerancia gástrica a la NE reviste cierta importancia, no sólo con el objetivo de conseguir el aporte de los requerimientos nutricionales sino también con el fin de impedir el desarrollo de otras complicaciones como la neumonía secundaria a la aspiración de la dieta. El descenso de la motilidad gástrica puede acompañarse de reflujo duodeno-gástrico, sobrecrecimiento bacteriano intraluminal y reflujo gastroduodenal. Aunque el papel de estos factores en la génesis de la neumonía secundaria sigue siendo motivo de controversia, desde un punto de vista teórico sería aconsejable el tratamiento agresivo del ARG con el fin de prevenir el desarrollo de complicaciones infecciosas pulmonares en los pacientes tratados con NE.
Estreñimiento
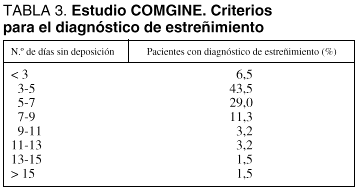
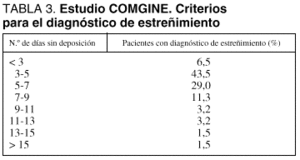
Al menos en nuestra experiencia, el estreñimiento en los pacientes que reciben NE en UCI es una complicación más frecuente que la diarrea. No existe una definición uniformemente aceptada para el estreñimiento en estos pacientes. Cuando se emplea una definición amplia, basada en el criterio del médico responsable del paciente, puede apreciarse una gran disparidad en el número de días sin deposición que son "permitidos" antes del diagnóstico de estreñimiento y de la consecuente introducción de los medios de tratamiento destinados a su control (tabla 3). Parece razonable considerar que existe estreñimiento en los pacientes que no presenten una deposición cada 3 días tras el inicio de la NE.
Dado que el estreñimiento es una complicación poco estudiada en los pacientes críticos, sus causas no han sido aclaradas en estudios controlados. Puede especularse que en la génesis de esta complicación se encuentran factores como: a) alteraciones en la motilidad intestinal secundarias al proceso patológico; b) cambios inducidos por diferentes fármacos de empleo habitual (sedantes, opiáceos, etc.), y c) un aporte de fibra dietética insuficiente en relación con el contenido en la alimentación normal.
En la valoración de los pacientes con estreñimiento deben seguirse las recomendaciones habituales (valoración clínica del abdomen, tacto rectal, exploraciones radiológicas) aunque considerando algunas características especiales. En estos pacientes se ha descrito un patrón específico de acumulación de restos fecales en el colon ascendente y transverso41, por lo que los hallazgos exploratorios (tacto rectal) pueden ser negativos en pacientes con prolongada ausencia de deposición. Además, la impactación fecal puede dar lugar a "diarrea acuosa", por irritación de la mucosa del colon, lo que complica el diagnóstico de estreñimiento.
En la prevención del estreñimiento, el papel de la fibra dietética es importante en pacientes que reciben NE de manera prolongada42. En estos casos, la fibra dietética insoluble, como los derivados de celulosa o el polisacárido de soja, mejora el comportamiento del tránsito intestinal incrementando el bolo fecal y disminuyendo la necesidad de laxantes. En pacientes críticos no se ha investigado de manera controlada el papel de la fibra dietética en la prevención o el tratamiento del estreñimiento asociado a la NE43.
La utilidad de los fármacos procinéticos en la prevención del estreñimiento ha sido valorada en el postoperatorio de cirugía digestiva. En estos casos, el tratamiento con cisaprida favorece la recuperación de la actividad motora del colon y el retorno de la eliminación fecal44,45.
Diarrea asociada a la nutrición enteral
Después de varios años de confusión sobre el tema, con profusión de definiciones distintas para la diarrea que presentan los pacientes tratados con NE, la mayoría de los autores están de acuerdo actualmente en que esta complicación requiere ser definida de manera objetiva, mediante parámetros claramente identificables en el terreno clínico. Según la definición propuesta en el estudio COMGINE, se considera que el paciente presenta diarrea "si el número de deposiciones es igual o superior a 5 en un período de 24 h o si el paciente presenta dos deposiciones de un volumen estimado superior a 1.000 ml/deposición en el mismo período". Esta definición ha sido aceptada en nuestro entorno y permite una valoración adecuada de la magnitud del problema, por lo que puede ser recomendada.
Debido a los problemas de definición indicados, el rango de frecuencia descrito para la diarrea asociada a la NE (DANE) en pacientes críticos es muy amplio (entre el 20 y el 70%). No obstante, según los datos más recientes de los grupos que utilizan definiciones objetivas para la DANE, la incidencia de dicha complicación en estos pacientes queda limitada al 10-18%15,46,47.
La opinión de que la dieta enteral es el único factor responsable de la diarrea se encuentra, todavía, muy extendida. No obstante, el incremento de conocimientos en nutrición enteral indica que la propia dieta no es el principal causante de la diarrea y que deben ser considerados otros factores. Estudios dirigidos a investigar las causas de la diarrea indican que la dieta es considerada responsable en un porcentaje de casos no superior al 25%48.
Los factores que pueden conducir al desarrollo de DANE son múltiples, como se aprecia en el amplio listado que puede confeccionarse considerando los diferentes mecanismos propuestos como productores o favorecedores de la misma49-51 (tabla 4). Cabe destacar que las causas infecciosas de DANE son frecuentes. La infección por Cl. difficile puede ser responsable de la diarrea en un porcentaje de casos que puede llegar hasta el 50%52 y parece ser más frecuente en los pacientes que reciben la dieta por vía transpilórica53. Por otro lado, la contaminación de la dieta puede ejercer un papel de mayor relevancia que otros factores en la presencia de DANE54. El interés de los "sistemas cerrados" para la administración de la NE, con el fin de disminuir la contaminación de la dieta y las complicaciones infecciosas en los pacientes, ha sido destacado55.
El 60% de los casos de diarrea pueden ser producidos por diferentes medicaciones48. Entre ellas, los antibióticos son los que con mayor frecuencia han sido relacionados con la presencia de diarrea, que sería debida principalmente a la alteración del equilibrio ecológico existente en la luz intestinal y a la consecuente disminución en la cantidad producida de ácidos grasos de cadena corta, privando a la mucosa digestiva de una de sus fuentes tróficas predominantes56.
Algunos autores han indicado que la DANE puede ser consecuencia de una alteración en la función del colon inducida de manera refleja por la administración intragástrica de la dieta57,58; consecuentemente, los pacientes que desarrollan diarrea con NE intragástrica deberían beneficiarse del cambio a una vía transpilórica para controlar la diarrea51,59.
Para la prevención de la DANE se ha sugerido el empleo de la fibra dietética y de otras modificaciones destinadas a restaurar el equilibrio microbiológico intraluminal en el tubo digestivo. La fibra dietética desempeña un papel importante en el mantenimiento de la integridad de la mucosa digestiva. La fibra soluble, que es la principal responsable de este efecto beneficioso, puede prevenir la DANE o contribuir a su control una vez presente60-62.
La adición de diferentes sustancias "mucilaginosas"63 a la dieta enteral o la administración conjunta de ciertos tipos de levaduras, como Sacharomyces boulardii64 o Lactobacillus acidophillus65, puede conseguir buenos resultados tanto en la prevención como en el tratamiento de la DANE. El concepto de "econutrición"66 hace referencia al empleo de la fibra y de otros sustratos conjuntamente con diversos tipos de microorganismos (especialmente Lactobacillus) con el objetivo de recuperar el equilibrio ecológico intestinal. Se han diseñado algunas dietas basadas en este concepto y sus resultados son esperanzadores, aunque todavía son necesarios estudios concluyentes sobre su aplicabilidad clínica.
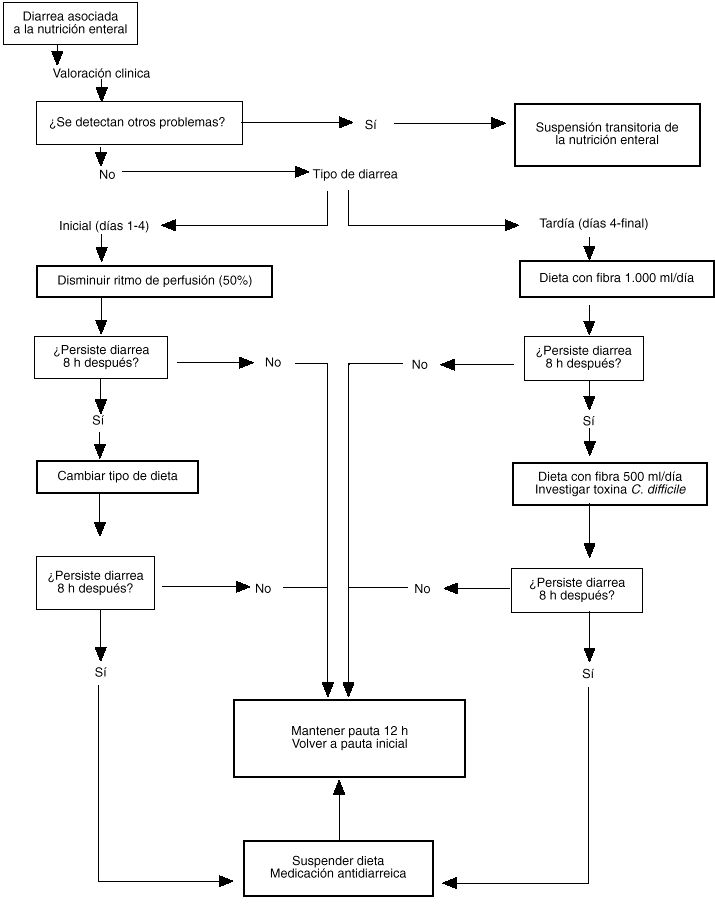
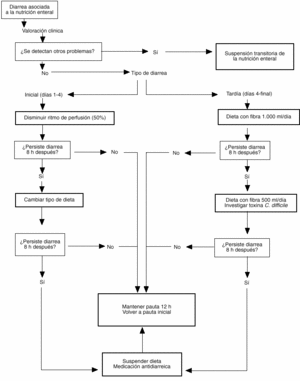
Ante la aparición de diarrea en un paciente tratado con nutrición enteral debe procederse de manera sistematizada para el mejor control del problema. Asumiendo que el diagnóstico de DANE es correcto (para lo cual debe disponerse de una definición objetiva que no dé lugar a equívocos), debe procederse, en primer lugar, a la valoración de las causas probables en cada caso concreto. En este sentido, la revisión de la medicación administrada al paciente y la investigación de probables causas infecciosas permiten descubrir el factor causal en muchas ocasiones. Considerar la propia dieta enteral como responsable de la diarrea debería ser un diagnóstico de exclusión y aceptarse sólo en caso de ausencia de otros factores conocidos que la produzcan. No obstante, antes de proceder a la suspensión completa de la dieta es aconsejable observar el efecto de pasos intermedios como el cambio de dieta, la disminución del ritmo de infusión o, incluso, el cambio a una vía de acceso transpilórica. El manejo protocolizado de estas modificaciones (fig. 1) facilita la labor del grupo de trabajo y permite mantener la NE en muchas ocasiones.
Distensión abdominal
De manera amplia, la distensión abdominal puede ser definida como "el cambio en la exploración abdominal con respecto a la que el paciente presentaba antes del inicio de la NE, con timpanismo y/o ausencia de ruidos peristálticos"7. La distensión abdominal en los pacientes que reciben NE refleja, probablemente, un desequilibrio entre el aporte de nutrientes y la capacidad funcional del sistema digestivo. Este desequilibrio puede ser especialmente significativo en los casos de nutrición intrayeyunal.
En situaciones de hipoperfusión intestinal, como en los pacientes que reciben tratamiento con fármacos vasoactivos, algunos autores consideran que existe una contraindicación para el empleo de la NE67. Algunas complicaciones graves (como la necrosis intestinal no oclusiva) que han sido atribuidas al empleo de la NE68,69 podrían estar relacionadas con una situación de limitación en el flujo sanguíneo del tubo digestivo, lo que daría lugar a cambios isquémicos en la pared intestinal.
No obstante, algunos datos indican que la inestabilidad hemodinámica no supone la anulación funcional del tubo digestivo. En un grupo de pacientes en el postoperatorio de cirugía cardíaca, y hemodinámicamente inestables, la aplicación del test de absorción del paracetamol indicó una ausencia de alteración en la absorción intestinal a pesar de la situación hemodinámica20.
Los datos existentes sobre las características motoras del tubo digestivo en pacientes críticos son escasos. Los estudios manométricos indican que, a pesar de que la motilidad intestinal se encuentra presente en la mayoría de los casos, la propagación de las ondas de presión no sigue un patrón normal en un porcentaje elevado de los pacientes70. Dicho de otro modo, la existencia de actividad motora en el intestino delgado no significa que la organización o la modulación de las contracciones intestinales sea normal. Este hecho debe tenerse en cuenta a la hora de iniciar o mantener la NE en situaciones como la inestabilidad hemodinámica o la hipoperfusión intestinal, en las que pueda anticiparse un "elevado riesgo" para el desarrollo de distensión abdominal.
La distensión abdominal constituye, en cualquier caso, una señal de alarma que, presumiblemente, indica una incapacidad del tubo digestivo para procesar los sustratos infundidos. Dicha incapacidad puede ser debida a una hipofunción secundaria al proceso patológico global, sin enfermedad intestinal subyacente, o a la existencia de enfermedad intrabdominal. En cualquier caso, la presencia de distensión abdominal obliga a la suspensión de la dieta y a la valoración del paciente, tanto desde el punto de vista local (abdominal) como en su situación general. La dieta podrá ser de nuevo instaurada tras descartar alteraciones significativas.
Han sido aplicados diferentes fármacos para normalizar las alteraciones de la motilidad intestinal en pacientes críticos. Los resultados no son concluyentes, por lo que se requieren estudios controlados para definir la utilidad del tratamiento farmacológico de la hipomotilidad intestinal en estos casos71.
Vómitos. Regurgitación de la dieta
Se considera regurgitación a la "presencia de dieta en las cavidades oral o nasal del paciente, con o sin exteriorización de la misma"7. Es frecuente que esta complicación sea notificada por el personal de enfermería, tras apreciarla en el transcurso de los cuidados higiénicos habituales a los pacientes.
En ocasiones, la regurgitación es consecuencia de la localización supradiafragmática de la sonda nasogástrica, extremo que puede ser constatado con la valoración cuidadosa de la radiografía de tórax. No obstante, en la mayoría de los casos tanto la regurgitación como el vómito son indicadores de alteración en el vaciamiento gástrico, asociándose además una disfunción del esfínter esofágico inferior que puede estar motivada por diversas causas. Los estudios isotópicos realizados por Ibáñez et al23,72 y por Torres et al73 han permitido demostrar que el empleo de sondas de grueso calibre o la posición en decúbito supino favorecen en gran medida el reflujo gastroesofágico de la dieta y la neumonía secundaria. De acuerdo con ello, la posición semisedante (45°) de los pacientes y la utilización de sondas nasogástricas de calibre fino (< 8 F) serían medidas efectivas para reducir el reflujo.
Los vómitos y la regurgitación no desaparecen con el empleo de sondas transpilóricas. En estos casos, la presencia de dichas complicaciones sería expresión de obstrucción intestinal, como la producida por impactación fecal, e iría acompañada generalmente de otra sintomatología como la distensión abdominal74.
La presencia de vómitos o regurgitación obliga a la suspensión transitoria de la NE con el fin de evitar la broncoaspiración. Al mismo tiempo, deben investigarse las posibles causas de dichas complicaciones, procediendo a la corrección de las alteraciones apreciadas (posición de la sonda, posición del paciente, estreñimiento, etc.). En caso de no encontrar un claro factor determinante, puede iniciarse un tratamiento con fármacos procinéticos, controlando la evolución posterior del paciente.