INTRODUCCIÓN
Se define el edema pulmonar como la presencia de líquido en los espacios extravasculares (intersticial y alveolar) del pulmón en cantidad superior a la fisiológica. En condiciones normales esta cantidad representa unos 500 mililitros (para una persona de 70 kg) y se encuentra en fase «gel» distribuida en un 90% en el espacio intersticial y el resto corresponde a agua intracelular.
El edema pulmonar es una causa frecuente de insuficiencia respiratoria aguda, ya que conduce a alteraciones de la relación ventilación-perfusión (fundamentalmente efecto shunt), que condicionan el deterioro del intercambio gaseoso y de la mecánica pulmonar. Estas alteraciones alcanzan relevancia clínica cuando la cantidad de agua pulmonar aumenta al doble de la normal, por lo que como en otras áreas del organismo, existe una reserva fisiológica que permite la adaptación a ciertas variaciones.
En esta revisión abordamos los nuevos conocimientos que se han ido desarrollando en los últimos años en este campo, especialmente en lo que concierne a los mecanismos fisiopatológicos, a las nuevas técnicas de cuantificación y a los estudios sobre posibles tratamientos.
FISIOPATOLOGÍA
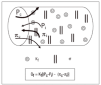
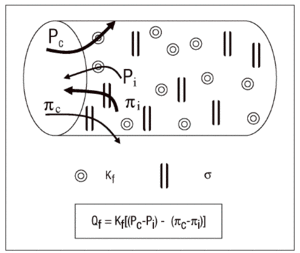
El movimiento de fluidos a través de la membrana alveolo-capilar se rige por la conocida ley de Starling (fig. 1). Estas fuerzas condicionan el fenómeno de producción en un doble sentido, de tal manera que conforme se va generando el edema actúan como freno del mismo. Otro mecanismo de protección lo constituyen las presiones negativas durante la fase inspiratoria, que se comportan a modo de bomba de succión. El líquido es extraído desde el intersticio alveolar a los manguitos peribroncovasculares y de éstos al mediastino y pleuras. Así pues, antes de inundarse de líquido los alveolos, el espacio intersticial se transforma en un gran reservorio. A ello se añade el aumento del flujo linfático como drenaje del exceso de fluido, aunque la importancia de su contribución todavía es controvertida.
Figura 1. Ecuación de Starling. Kf: coeficiente de filtración; Pc y Pi: presiones hidrostáticas capilar e intersticial; *: coeficiente de reflexión oncótica;¼c y ¼i: presiones coloidosmóticas capilar e intersticial.
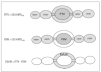
Además de estos mecanismos pasivos, existe un proceso activo de reabsorción, localizado fundamentalmente en la vertiente epitelial de la membrana, que ha sido bien caracterizado a lo largo de la última década1,2. De forma resumida se trata de un transporte activo de sodio al que acompaña el agua (fig. 2). Tiene lugar en las células epiteliales tipo 2 cuyas membranas plasmáticas están dotadas de canales de sodio en su zona apical y de bombas de Na+-K+-ATPasa en las áreas basolaterales. Estas últimas son las encargadas de generar el gradiente entre ambos espacios (alveolar e intersticial). El papel de las aquaporinas, que parecen estar restringidas al epitelio de las vías aéreas, se considera de momento marginal. Al lector interesado en profundizar en este tema lo remitimos a la reciente revisión publicada en esta misma revista3.
Figura 2. Proceso de reabsorción activa del edema de pulmón. K: potasio; Na: sodio; ATPasa: adenosintrifosfatasa.
La presencia de edema pulmonar provoca una serie de consecuencias sobre el intercambio gaseoso y la mecánica tóraco-pulmonar. La principal es el desarrollo de hipoxemia, producida por el trastorno de la difusión de oxígeno y finalmente, cuando el alveolo se inunda, por un efecto shunt. Con relación a las características mecánicas del pulmón, el edema produce una reducción en los volúmenes pulmonares y una disminución de la complianza. La curva presión-volumen (P-V) se encuentra desplazada hacia la derecha, con la aparición de un punto de inflexión inferior. Inicialmente éste se interpretó como consecuencia de la apertura de alveolos y vías aéreas de las zonas dependientes del pulmón que se encontraban colapsadas (atelectasias) por el propio peso de las áreas supra-adyacentes (teoría de la esponja). Esta explicación ha sido cuestionada por otros autores4 que piensan que se debe a la entrada forzada de aire en unidades alveolares rellenas de líquido (teoría del edema).
TIPOS DE EDEMA PULMONAR
Clásicamente el edema pulmonar se clasifica en dos grandes grupos atendiendo al mecanismo de producción5. El primero, denominado hidrostático, se debe a cambios en los factores (presión capilar, intersticial u oncótica) que afectan al movimiento de fluidos a través de una membrana semipermeable intacta. El segundo grupo lo compondrían aquellos cuyo origen se encuentra en un daño primario de la membrana alveolocapilar, con la consiguiente alteración de la permeabilidad. A pesar de la aparente simplicidad y rigor en el criterio utilizado, el problema es determinar con precisión, para cada condición clínica, cuál es el mecanismo principal implicado. Es por ello que muchos se agrupan en un gran cajón de sastre denominado de tipo mixto (tabla 1). La novedad en este campo proviene de haberse resuelto la incógnita sobre algunos de los modelos de edema de pulmón que estaban asignados a este último grupo. Así, los edemas neurogénico6 y por re-expansión7 se consideran actualmente como predominantemente hidrostáticos. Especialmente significativo ha sido el caso del edema de pulmón asociado a las alturas (HAPE en su acrónimo inglés), que tras una serie de estudios bien diseñados8,9 se ha concluido que es del tipo hidrostático, consecuencia de una vasoconstricción hipóxica de carácter heterogéneo, que conduce a un incremento regional de las presiones capilares. Además, y su notoriedad deriva en gran parte de ello, ha sido el tipo de edema sobre el que se ha ensayado alguno de los tratamientos más prometedores en este ámbito.
DETECCIÓN, CUANTIFICACIÓN Y MONITORIZACIÓN DEL EDEMA PULMONAR (DIAGNÓSTICO)
Lo deseable sería determinar parámetros relacionados directamente con la lesión de la membrana10, pero éstos son difíciles de realizar a la cabecera de los pacientes, por lo que su uso queda restringido al área de la investigación. Entre estos parámetros sobresale el coeficiente de ultrafiltración, que se mide sobre pulmones aislados mediante técnica gravimétrica y por tanto utilizable exclusivamente en el ámbito experimental. El índice de permeabilidad, determinado mediante métodos isotópicos de doble trazador (hematíes marcados con 99mTc y transferrina marcada con 67Ga), puede ser empleado en clínica pero su sensibilidad y especificidad han sido ampliamente cuestionadas11.
Para la cuantificación del edema disponemos de las siguientes técnicas:
Agua pulmonar extravascular
Doble indicador
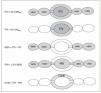
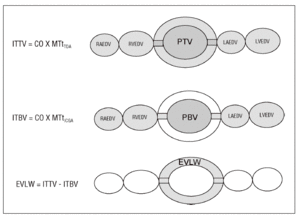
Se fundamenta en la utilización de dos sustancias que actúan como marcadores del espacio intravascular (indicador no difusible) y extravascular (indicador difusible). El volumen de distribución de los indicadores es proporcional, a flujo constante, al tiempo medio de tránsito obtenido de sus respectivas curvas de dilución. Para ello es necesaria la introducción de los indicadores, en forma de bolo intravenoso, en la circulación pulmonar a través de un catéter venoso central y la recogida de las señales al final de la aorta torácica. El agua pulmonar extravascular (APE) es el resultado de la sustracción de un volumen respecto del otro (fig. 3).
Figura 3. Método del doble indicador. ITTV: volumen de fluidos intratorácico; CO: gasto cardíaco; MTtTDA: tiempo medio de tránsito del indicador térmico (difusible); ITBV: volumen sanguíneo intratorácico; MTtICGA: tiempo medio de tránsito del indicador no difusible; EVLW: agua pulmonar extravascular; PTV: volumen de fluidos pulmonar; PBV: volumen sanguíneo pulmonar; RAEDV: volumen telediastólico de aurícula derecha; RVEDV: volumen telediastólico de ventrículo derecho; LAEDV: volumen telediastólico de aurícula izquierda; LVEDV: volumen telediastólico de ventrículo izquierdo.
Termodilución transpulmonar
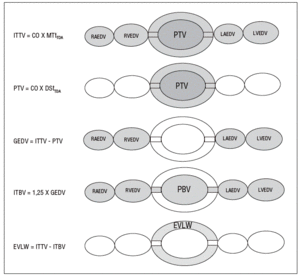
Debido a que la utilización de dos indicadores hace de la aplicación de la técnica anterior un proceso relativamente complejo y caro, se ha desarrollado una versión simplificada en la que se emplea exclusivamente el frío como indicador. Este método se basa en la asunción de que la relación entre el máximo volumen alojado en el corazón (GEDV) y el contenido en la circulación pulmonar (PBV) es constante y cuatro veces superior (fig. 4). La derivación de esta fórmula se ha obtenido tanto de estudios experimentales12 como clínicos13 y la comparación con los métodos de doble indicador y gravimétrico (considerado el gold-standard) ha sido excelente14. Existen algunos factores que influyen en la precisión de la medida del APE, como los parámetros ventilatorios utilizados (volumen corriente o presión positiva telespiratoria [PEEP]) o la cantidad de edema15, pero el grado de sesgo (bias) cae en los límites de lo clínicamente aceptable16. Por otra parte, el método de termodilución transpulmonar ha demostrado una alta exactitud para detectar pequeños incrementos del agua pulmonar (entre un 10-20%), lo que permite detectar edema pulmonar incipiente, capacidad que no tiene ningún otro método utilizable en clínica17.
Figura 4. Método de termodilución transpulmonar. ITTV: volumen de fluidos intratorácico; CO: gasto cardíaco; MTtTDA: tiempo medio de tránsito del indicador térmico (difusible); PTV: volumen de fluidos pulmonar; DStTDA: tiempo de la pendiente exponencial del indicador térmico (difusible); GEDV: volumen telediastólico cardíaco y global; ITBV: volumen sanguíneo intratorácico; EVLW: agua pulmonar extravascular; PBV: volumen sanguíneo pulmonar; RAEDV: volumen telediastólico de aurícula derecha; RVEDV: volumen telediastólico de ventrículo derecho; LAEDV: volumen telediastólico de aurícula izquierda; LVEDV: volumen telediastólico de ventrículo izquierdo.
Técnicas de imagen
Radiografía de tórax
Continúa siendo el método más ampliamente utilizado en la práctica clínica, debido a su carácter no invasivo, su amplia disponibilidad y bajo coste. Sin embargo, presenta importantes limitaciones que disminuyen su utilidad. Así, se ha demostrado que se ve influida notablemente por el grado de aireación, y por tanto por variaciones en los parámetros ventilatorios (especialmente la PEEP), y que presenta un pobre acuerdo interobservador18. Si se realiza bajo estrictos criterios de estandarización técnica y se forma al personal en su interpretación se ha demostrado que aumenta extraordinariamente su utilidad, especialmente en cuanto a los cambios temporales y como guía en el balance de fluidos19.
Tomografía axial computarizada
Desde el punto de vista cualitativo la tomografía axial computarizada (TAC) permite distinguir varios patrones de distribución del edema. En el tipo hidrostático, los infiltrados son de predominio central (alrededor de los hilios pulmonares), aunque si es de suficiente intensidad acaba por hacerse difuso. En el edema por aumento de permeabilidad se han descrito dos patrones fundamentales: focal o difuso20. El primero presenta consolidación bibasal (dorsal si se encuentra el paciente en supino) de acuerdo al gradiente gravitacional. En el segundo los infiltrados se presentan tanto en las áreas superiores como inferiores. Independientemente de la distribución de los infiltrados, la presencia de edema se caracteriza por un incremento en el tejido pulmonar y pérdida importante de la aireación. Y lo que es más importante, ambos (tejido y gas) pueden ser medidos a través del análisis de las densidades radiológicas21. Resumidamente se trata de asignar a cada unidad de volumen (voxel) una densidad expresada en unidades Hounsfield (H), que se corresponde con el porcentaje de tejido y gas que se encuentra en dicho volumen. Conociendo el volumen de ambos pulmones y el porcentaje de tejido y gas global (la media de todos los voxel) mediante software específicos, podemos derivar la cantidad de tejido pulmonar. No obstante, se trata de una estimación del edema, porque en el tejido pulmonar, además del agua extravascular, también se hallan los elementos estructurales, la sangre, y los productos inflamatorios.
Otras técnicas de imagen
La resonancia magnética nuclear (RMN) en conjunción con el empleo de determinadas sustancias y la tomografía por emisión de positrones (PET) presentan resultados de gran exactitud, pero la complejidad y las dificultades de realización en pacientes críticos impiden su uso en la práctica clínica. Una técnica mucho más accesible y que evita el traslado de los pacientes es la ecografía torácica. Aunque se ha descrito la presencia de imágenes en «cola de cometa» como específicas de la existencia de edema de pulmón, son necesarios más estudios para validar su utilidad en la cuantificación del mismo22.
MEDIDAS PARA LA PREVENCIÓN Y RESOLUCIÓN DEL EDEMA PULMONAR (TRATAMIENTO)
Habida cuenta de que no se dispone aún de ningún tratamiento farmacológico que actúe restableciendo a la normalidad la permeabilidad de la membrana alveolo-capilar lesionada, éstas se dirigen a minimizar la cantidad de edema. Lo hacen a través de dos mecanismos generales, siguiendo la fisiopatología revisada (tabla 2). El primero consiste en la reducción en la formación de edema, evitando el paso de más líquido del espacio vascular alveolar. El segundo se vale de la activación de los procesos normales de aclaramiento del edema una vez ya producido.
Reducción de la formación
Se logra a través de la modulación de las variables hemodinámicas y osmóticas que intervienen en el movimiento de fluido transpulmonar.
Respecto de las primeras, continúa existiendo controversia sobre la relativa importancia del flujo (gasto cardíaco) frente a las presiones del circuito pulmonar. La discusión no carece de importancia ya que hasta hace no mucho tiempo se preconizaba el aumento del gasto cardíaco (y por tanto del transporte de oxígeno a los tejidos periféricos) como terapia para evitar la disfunción orgánica; causa más frecuente de fallecimiento en los pacientes con lesión pulmonar. El gasto cardíaco produciría un incremento en el APE a través del aumento de la superficie vascular, bien mediante la distensión de los capilares ya funcionantes, bien por el reclutamiento de nuevos previamente colapsados. Sin embargo nuestra posición, extraída de varios trabajos experimentales del grupo de investigación de Granada23,24, es que para que esto suceda (al menos en el rango de flujos de la clínica) debe existir un incremento paralelo en las presiones a lo largo del circuito pulmonar (presión arteria pulmonar, presión capilar pulmonar). En este sentido coincidimos con las teorías explicativas del edema de pulmón que se produce en relación con las alturas (HAPE).
Además de con fármacos inotrópicos y vasoactivos, los parámetros hemodinámicos pueden modificarse con el uso de la fluidoterapia, ajustando el balance neto. Para ello se pueden emplear dos terapias separadas o conjuntamente: la restricción de fluidos y el uso de diuresis agresiva. Esta estrategia se revela de un gran interés por dos motivos. El primero por la gran prevalencia que se ha demostrado en los pacientes con síndrome de distrés respiratorio agudo (SDRA) de elevaciones de la presión capilar pulmonar25. El segundo, y más importante aún, por la posible traducción clínica en términos de mejor evolución y menor mortalidad. Esto último sólo se ha comunicado hasta la fecha en análisis retrospectivos26, pero se está a la espera de los resultados de un gran ensayo clínico promovido por los institutos de salud norteamericanos a través de la red de estudio del SRDA (ARDS network). En este ensayo27, denominado FACTT, los pacientes se dividen en dos grupos de tratamiento según la estrategia de administración de fluidos sea «restrictiva» o «liberal».
Con relación al papel de la presión oncótica, el grupo de la Escuela de Medicina de Atlanta ha llevado a cabo una serie de estudios concatenados. El primero28, de tipo observacional, sugirió que la hipoproteinemia es no sólo un factor de riesgo de desarrollo de distrés en una población de enfermos críticos con sepsis intensa, sino que se comporta como un marcador de gravedad. Esta observación se complementa con los resultados de otro estudio sobre la utilidad de este simple parámetro (proteínas totales) en el diagnóstico diferencial del edema de pulmón, en el que se compara favorablemente con el índice de permeabilidad medido con doble trazador isotópico29. Más espinosa es la utilización de coloides para tratar de modificar la disminución de la presión oncótica que presentan estos pacientes. Desde un punto de vista teórico, se puede objetar que el coloide administrado pasa al otro lado de la membrana, al espacio intersticial y alveolar. Ello causaría el efecto contrario al que se pretende, con el desarrollo de mayor cantidad de edema. Para analizar si este fenómeno sucede realmente se realizó un ensayo clínico sobre pacientes hipoproteinémicos con lesión pulmonar aguda30, comparando el uso combinado de diuréticos (furosemida en perfusión intravenosa) y albúmina frente a placebo. El pequeño tamaño muestral impidió obtener conclusiones sobre variables clínicas relevantes, pero fue significativa la proporción de pacientes que a los cuatro días dejaban de cumplir los criterios de oxigenación de lesión pulmonar aguda (LPA)/SDRA.
Aumento del aclaramiento
Como ya comentamos en el apartado de fisiopatología, el aclaramiento del edema alveolar depende fundamentalmente del transporte activo de sodio. Este proceso puede ser estimulado por hormonas suprarrenales (cortisol y aldosterona) y tiroideas, a través de la regulación al alza de los canales de sodio situados en la zona apical de la membrana de las células epiteliales tipo II. No obstante, estas terapias no se han trasladado a la práctica clínica, al no demostrarse beneficio clínico en las fases iniciales del SDRA. Algunos autores argumentan que ello se debe a que para que puedan hacer efecto debe primero producirse la reparación de la membrana alveolo-capilar31.
Más ampliamente estudiados han sido los mecanismos dependientes de catecolaminas. Entre ellos destacan los agonistas beta-adrenérgicos, que actúan potenciando la acción de la bomba Na+-K+-ATPasa de las áreas basolaterales. La prueba más evidente de la eficacia del uso de beta-agonistas procede de un ensayo clínico realizado para la prevención del edema pulmonar de altitud32. Treinta y siete montañeros que ya habían experimentado este problema fueron aleatorizados para recibir profilácticamente 125 µg cada 12 horas de salmeterol vía inhalatoria frente a placebo. Tras ser expuestos a una altitud superior a los 4.500 metros en menos de 24 horas, los del grupo de salmeterol desarrollaron en menor proporción edema pulmonar que los del grupo placebo (33 frente a 74%, p = 0,02).
Muy recientemente se han comunicado los resultados del primer ensayo clínico sobre pacientes con LPA/SDRA siguiendo esta estrategia. Se trata del estudio BALTI (Beta Agonist Lung Injury Trial)33, en el que se incluyeron 40 pacientes aleatorizados para recibir salbutamol en perfusión intravenosa (15 µg/kg/h) frente a placebo. La variable principal fue la cantidad de APE al séptimo día de tratamiento, que fue significativamente menor en el grupo que recibió el salbutamol por vía intravenosa (9,2 frente a 13,2 ml/kg, p = 0,038). La contrapartida del uso del beta agonista fue la mayor incidencia de taquicardias supraventriculares, aunque sin repercusión clínica importante. Aun con las limitaciones del tamaño muestral y la elección de una variable surrogada de mortalidad como es el APE, creemos que este estudio consolida una de las direcciones de la investigación en este campo.
IMPLICACIONES CLÍNICAS
Lógicamente los principales esfuerzos de investigación en el área de la lesión pulmonar aguda deben ir encaminados a resolver los enigmas que permanecen en los niveles celulares, moleculares (y por qué no, genéticos) de la membrana alveolo-capilar, así como a encontrar substancias o factores que influyan positiva o negativamente en la reabsorción del edema pulmonar. El edema no deja de ser una consecuencia del daño de ésta, pero parece que su presencia y mantenimiento pueden contribuir a perpetuar y agravar la insuficiencia respiratoria y multiorgánica derivada y con ello a un peor desenlace.
Las preguntas a contestar de forma secuencial serían las siguientes:
1. ¿Es el edema un marcador de gravedad de la lesión pulmonar aguda? Depende de la variable que consideremos, el daño pulmonar o la supervivencia de los pacientes. Aunque existe cierta unanimidad en considerar que el grado del edema se relaciona con la intensidad de la lesión de la membrana, algunos autores sostienen que son fenómenos independientes e incluso pueden, paradójicamente, cursar en dirección contraria. Brigham et al34, estudiando un modelo animal de lesión pulmonar por instilación intratraqueal de ácido clorhídrico, no halló relación entre el índice permeabilidad-superficie vascular y el APE. Es más, los animales que sobrevivían eran aquellos que disminuían el APE para el mismo grado de lesión, teorizando que lo lograban reduciendo el flujo sanguíneo a las áreas dañadas mediante mecanismos de vasoconstricción. Sin embargo, más relevante sería conocer si el grado de edema se relaciona con el desenlace final. En este sentido, existen varios estudios que así lo atestiguan, aunque ninguno de ellos ha sido realizado con carácter prospectivo, lo que les resta contundencia. El más importante a este respecto es el de Sakka et al35, que analizaron 373 pacientes afectos de distintos tipos de patología crítica (shock séptico, SDRA, traumatismo craneoencefálico (TCE), shock hemorrágico, etc.) observando que el APE se correlacionaba directamente con la supervivencia y era un factor pronóstico independiente. Además, y aunque lógicamente el APE estaba más elevado en el grupo de pacientes con SDRA, éste se comportó incrementando la mortalidad en todos los grupos diagnósticos. El punto de corte fue establecido en 15 ml/kg. Otro estudio aún más reciente proviene de los investigadores europeos sobre presencia de sepsis en pacientes agudos36. Sobre un total de 3.147 enfermos sépticos un 12,5% de ellos presentaban LPA o SDRA. Un análisis multivariante de factores pronósticos demostró que, además de las comorbilidades, el grado de disfunción multiorgánica y la estrategia ventilatoria con volúmenes corrientes altos (más de 7,4 ml/kg); un balance de fluidos positivo (que podemos considerarlo como asociado a mayor grado de edema) se comportaba como factor independiente de mortalidad en la Unidad de Cuidados Intensivos (UCI).
2. ¿Es útil el APE como marcador del edema de pulmón? En el apartado de métodos de medida hemos realizado algunas consideraciones con relación a esta cuestión. En este sentido, la determinación del APE por TAC es aceptada como un método fiable sin reservas, no obstante las dificultades para su realización de forma seriada impiden su generalización. Los métodos basados en la dilución de indicadores tienen la limitación de ser perfusión dependientes, aunque presentan un muy alto valor predictivo positivo. Por ahora no se incluyen como un criterio definitorio más de la LPA/SDRA, pero podrían servirnos para complementar los criterios de la conferencia de consenso, especialmente en la inclusión de pacientes en estudios de investigación, para seleccionar grupos de pronóstico homogéneo. En este sentido Michard et al37 han demostrado que un 35% de pacientes diagnosticados de LPA/SDRA por los criterios de la conferencia de consenso presentaban valores de APE medidos por termodilución en el rango de la normalidad.
3. ¿Disponemos de técnicas fiables y sencillas de aplicar en los pacientes críticos para la determinación del APE? El método de referencia para la cuantificación del APE es el gravimétrico. Ampliamente utilizado en investigación experimental, ha permitido validar las diferentes técnicas de doble indicador e isotópicas. No obstante, estas últimas no han llegado a extenderse en la práctica clínica debido a la complejidad en su uso. El desarrollo de la metodología y tecnología de la termodilución transpulmonar ha producido un renovado interés en este campo, al ir además unida a la determinación de otros parámetros hemodinámicos (gasto cardíaco continuo, volúmenes intratorácicos, respuesta a fluidoterapia) y consideramos que puede tener un gran papel en la monitorización de la evolución del edema y en la respuesta a los tratamientos.
4. ¿Tiene relevancia clínica la reducción terapéutica ara el empleo de estas terapias es la proposición de que al reducir el edema pulmonar mejorarán los parámetros de fisiología pulmonar y con ello se acortará la duración de la ventilación mecánica y sus complicaciones asociadas, especialmente la neumonía y la lesión sobreañadida. Sin embargo, y a pesar de su aparente lógica y eminentes defensores, la evidencia clínica en la que se apoya es escasa. Los dos únicos ensayos clínicos de que disponemos por el momento38,39 se remontan a aproximadamente dos décadas, están realizados por el mismo grupo de investigación, y comprenden un número escaso de pacientes, por lo que sus conclusiones no han dejado de considerarse provisionales. En ambos ensayos (48 y 101 pacientes respectivamente) la administración de fluidos fue guiada en el grupo control según los resultados hemodinámicos del catéter de arteria pulmonar y en el grupo experimental por los valores de APE. En ambos estudios se logró con esta última estrategia un menor balance positivo de fluidos, que tuvo como resultado reducciones del edema pulmonar, menor tiempo de ventilación mecánica, menor estancia en la UCI y una tendencia a la mejora de la supervivencia. Los detractores de esta opción terapéutica de reducción de fluidos proclaman que puede conducir a descensos del gasto cardíaco, perfusión periférica y transporte de oxígeno a los tejidos, y que los pacientes con LPA/SDRA no fallecen de hipoxemia refractaria sino de fracaso multiorgánico. Esta vieja controversia puede tener los días contados cuando se publiquen los resultados del mencionado estudio de la ARDSnet, ya finalizada la inclusión de pacientes y comenzado el análisis de los resultados.
Podemos concluir que si se demostrase con alguno de los estudios en fase de realización que la actuación sobre el edema conlleva un mejor resultado en la atención a los pacientes críticos afectos de insuficiencia respiratoria, el interés por su estudio y aplicación de técnicas de monitorización cobrarían un nuevo auge. Esperamos que esta revisión contribuya en este sentido.
Nota de los autores
Tras la aceptación del manuscrito han sido publicados
los resultados del ensayo clínico del grupo ARDSnetwork (N Eng J Med. 2006;354:2564-2575). La estrategia
de restricción de fluidos condiciona una mejoría
en los parámetros respiratorios, sin comprometer
otras funciones orgánicas. Aunque no consigue
demostrar una reducción de la mortalidad a los 60 días,
sí logra disminuir los tiempos de ventilación mecánica
y de estancia en la UCI.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún
conflicto de intereses.