INTRODUCCION
En el paciente ingresado en una Unidad de Cuidados Intensivos (UCI), la aparición de fracaso renal agudo (FRA) es frecuente, supone un elevado consumo de recursos y ensombrece el pronóstico1,2. En nuestro país, la incidencia de FRA en la UCI es aproximadamente del 5% (8% si no se consideran los ingresos coronarios) y más del 35% de los pacientes requerirán alguna técnica de depuración extrarrenal (TDE)3.
Durante la aplicación de cualquier TDE la sangre entra en contacto con una superficie extraña, y ello provocará la activación de diferentes factores de la coagulación, derivando en la coagulación del filtro4. La anticoagulación del circuito es, por tanto, necesaria para asegurar una adecuada duración del mismo, pero a la vez es necesario tener presente que los problemas de sangrado son la complicación más importante del uso de las TDE. Por lo tanto, a la hora de seleccionar el régimen anticoagulante hay que valorar la eficacia en el mantenimiento de la permeabilidad frente al riesgo de sangrado. En el momento actual, el anticoagulante ideal aún no se ha desarrollado y no existe consenso sobre el mejor régimen para el mantenimiento de estos circuitos5.
El anticoagulante más usado sigue siendo la heparina no fraccionada (HnF), pero dados los problemas secundarios a su uso se han empleado diferentes alternativas, como las heparinas de bajo peso molecular (HBPM), el citrato trisódico, la heparinización regional con HnF-protamina o las prostaciclinas5.
El objetivo de este estudio es comunicar nuestra experiencia con el uso de epoprostenol en el mantenimiento de la permeabilidad de los filtros para técnicas continuas de reemplazo renal (TCRR), tanto en forma aislada en pacientes con riesgo de sangrado o contraindicación para el uso de HnF, como asociado a HnF en dosis bajas en pacientes con problemas de coagulación precoz de los filtros.
PACIENTES Y MÉTODO
Hemos realizado un estudio prospectivo de cohortes de todos los pacientes ingresados en nuestra UCI tratados mediante TCRR desde el año 1994. La UCI es una unidad polivalente de 42 camas que asiste a pacientes adultos de todas las patologías y el postoperatorio de cirugía mayor, incluido el de trasplante hepático. Se obtuvo información sobre los siguientes aspectos: datos epidemiológicos (edad, género, motivo de ingreso, APACHE II al ingreso); datos clínicos durante la TCRR (APACHE II al inicio, órganos disfuncionantes considerando la definición de fracaso multiorgánico de Knaus6, motivo del tratamiento, motivo de la retirada, duración y recuperación del FRA -definido como una elevación de la creatinina sérica por encima de 2 mg/dl o al doble de la creatinina basal o bien oliguria mantenida más de 24 horas pese a reposición adecuada de volumen-, necesidad posterior de diálisis, estancia en la unidad y el hospital, causa de la muerte); datos referidos a la técnica (tipo de TCRR, complicaciones, número de filtros usados, dosis pautada y dosis media «real» de depuración administrada, recuento de plaquetas, creatinina y urea séricas, porcentaje de actividad de protrombina, y tiempo de cefalina diarios); y datos específicos de cada filtro (membrana, anticoagulante y dosis, horas de duración, motivo de retirada del filtro, flujo de sangre (Qb), flujo de ultrafiltrado (Quf), flujo de dializador (Qd), sangrado definido como leve si sólo se detectaba de forma aislada y autolimitada en puntos de punción o herida quirúrgica, moderado si aparecía en más de una localización o era persistente, y grave cuando para su control se requirió cirugía o transfusión de concentrados de hematíes).
El protocolo de uso de TCRR es el siguiente: a) acceso venoso con catéter de doble luz y 12 French, de preferencia en vena femoral; b) desde 1994 hasta 1999 usamos un monitor Gambro AK® para hemodiálisis o un monitor Hospal BSM32®, posteriormente se usó un monitor Hospal Prisma® en HDFVVC con filtro de 0,9 m2 y membrana capilar de AN69 con reposición prefiltro; c) el Quf se intenta mantener por debajo del 20% del Qb (FF menor del 20%) para evitar hemoconcentración en el filtro y retardar su coagulación; d) la reposición se realiza prefiltro y e) la retirada programada del filtro se realiza cuando la monitorización del sistema indica coagulación inminente (caída de presión del filtro superior a 125 mmHg o presión del efluente menor o igual a -70 mmHg) o en caso de duración mayor de 72 horas si se detecta un descenso de la capacidad depurativa (elevación de las cifras de urea/creatinina plasmáticas).
La anticoagulación se realizaba hasta 1999 con HnF, en dosis de 10 U/kg/h; con posterioridad a esta fecha se disminuyó la dosis a 5 U/kg/h, elevándola a 7,5 U/kg/h si aparece coagulación frecuente de los filtros, pero si no se soluciona el problema (consumo de más de un filtro diario durante más de dos días), la dosis se disminuye a 2,5-3 U/kg/h y se asocia epoprostenol a 4-5 ng/kg/min. En pacientes con recuento plaquetario entre 50.000 y 75.000/mm3 o coagulopatía (tiempo de cefalina > 45'' o protrombina < 75%) se usa epoprostenol aislado en la dosis mencionada. Si existe trombopenia menor de 50.000/ mm3 o, en opinión del clínico responsable, riesgo elevado de hemorragia, no se administra anticoagulante.
La anticoagulación mediante HnF se realiza de forma continua en la entrada del circuito en dosis de 5 a 7 U/kg/h. El epoprostenol se aplica protegido de la luz en una dilución del 50% de la original, mediante bomba del circuito, prefiltro y en perfusión continua, en dosis de 4-5 ng/kg/min. La dilución se cambia cada 8 horas, manteniendo en frío el resto de la preparación hasta un máximo de 24 horas. El total de la dosis final decidida para cada paciente se alcanza en tres etapas, administrando inicialmente un tercio de la dosis y comprobando el efecto sobre la presión arterial del paciente. Tras un intervalo de 5 minutos, si no se evidencia una alteración se eleva la dosis en otro tercio y se repite la secuencia. Finalmente, tras una espera de otros 5 minutos, se alcanza la dosis máxima predeterminada.
Al menos cada 24 horas se realiza un recuento de plaquetas y un control del estado de la coagulación del paciente mediante tiempo de cefalina y actividad de protrombina.
Hemos realizado un análisis de los pacientes para describir la población, pero para analizar el efecto anticoagulante hemos analizado filtros y no pacientes, estudiando en cada filtro su duración, motivo de retirada (coágulo, problema de vía, retirada programada, otro motivo), existencia de coagulopatía, número de plaquetas, aparición de sangrado, anticoagulante usado (HnF, epoprostenol, ambos, nada) y dosis.
En nuestra Unidad existe una hoja de consentimiento informado en la que se solicita a los pacientes o familiares su consentimiento para el uso con fines de investigación clínica de los datos clínicos no personales que se registran durante su proceso asistencial.
Análisis estadístico
Los datos se expresan como media ± error estándar de la media para las variables cuantitativas, número absoluto y porcentaje para las cualitativas y mediana con el rango intercuartil para las variables que expresan tiempo. Para el análisis univariante se usó «t» de Student para las variables cuantitativas y la ji cuadrado para las cualitativas. En todos los casos se exige un nivel de significación del 95%. Para comparaciones múltiples de variables cuantitativas se realizó un test de ANOVA para el nivel de significación mencionado, usando el test de Bonferroni para el análisis post-hoc.
Para el análisis de la duración de los filtros se realizó inicialmente un análisis de supervivencia usando como variable resultado la retirada del filtro por cualquier causa para hacer un descriptivo de toda la serie y detectar las variables que pueden afectar de forma general a la duración de los filtros. Posteriormente, para valorar de forma específica el efecto de las distintas variables a estudio y específicamente la anticoagulación sobre los fenómenos de coagulación en el filtro, se realizó un análisis de supervivencia incluyendo una vez más todos los filtros, pero usando como variable resultado la retirada de los mismos motivada por coagulación. El análisis univariante para detectar variables con influencia sobre la duración de los filtros se realizó mediante Log-rank test y para el nivel de significación mencionado.
RESULTADOS
Durante el período de estudio 389 pacientes fueron tratados con TCRR. Las características de esta población se ajustaron a las propias de una UCI, tratándose de pacientes con una edad media de 53,2 ± 0,8 años, un predominio de hombres (66%), con un nivel de gravedad elevado (APACHE II 22,1 ± 0,4 puntos), y una mediana de estancia en UCI prolongada (14 días, rango intercuartil: 7-25). La mortalidad global en UCI fue del 64% (251 pacientes).
En el momento del inicio de la TCRR, 217 (56%) pacientes presentaban fallo de 3 o más órganos y un APACHE II de 23,3 ± 0,4 puntos. El retraso para el inicio del tratamiento tras la aparición del FRA fue de 2 días como mediana (rango intercuartil: 1-3). La dosis media de aclaramiento aplicada (dosis real considerando ultrafiltrado más dializador y calculando las horas perdidas de tratamiento) fue de 1.909 ± 36 cc/hora.
El consumo total de filtros fue de 2.322 (6 ± 0,4 filtros/paciente). En total se ha realizado un seguimiento de 66.957 horas de tratamiento. Respecto al motivo de retirada de los filtros, en un 46% de los casos éstos no llegaron a coagularse y en un 19% la pérdida se debió a problemas técnicos diferentes a la coagulación (tabla 1).
Como anticoagulante usamos HnF con una dosis media de 606 ± 7,4 U/hora en 1.726 (74%) filtros, epoprostenol con una dosis media de 4,97 ± 0,05 ng/kg/min en 147 (6%) filtros, una terapia combinada de HnF y epoprostenol con una dosis media de 365,6 ± 31,9 UI/hora de heparina en 105 (4%) filtros y, por último, en 344 (15%) filtros no se usó ningún anticoagulante.
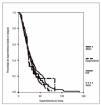
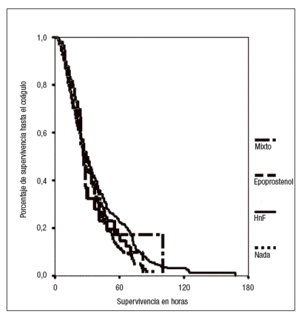
El efecto de los diferentes regímenes de anticoagulación sobre la duración de los filtros no muestra diferencias significativas (tabla 2 y fig. 1).
Figura 1. Efecto del anticoagulante sobre la supervivencia de los filtros. HnF: heparina no fraccionada.
La supervivencia hasta la coagulación de los filtros en los que se empleó epoprostenol como anticoagulante fue de 32 horas como mediana (rango intercuartil: 17-48). La dosis aplicada no mostró ninguna relación con la supervivencia de los filtros, aunque el rango de variabilidad fue muy estrecho.
Se detectó una caída de la tensión arterial en 2 (1,4%) filtros del grupo epoprostenol; en ninguno de los casos motivó la suspensión del tratamiento y la tensión arterial se normalizó rápidamente tras la disminución de la dosis del anticoagulante, alcanzando en estos dos casos la dosis fijada en un tiempo superior al resto de los filtros. En ningún filtro se han detectado alteraciones graves en la oxigenación medidas mediante control de saturación de oxígeno por pulsioximetría.
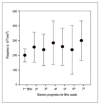
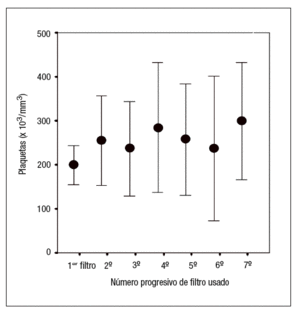
Se ha analizado posteriormente un grupo de 23 pacientes en los que, a consecuencia de un consumo elevado de filtros, se optó por realizar una terapia combinada de epoprostenol en dosis habituales más HnF en dosis bajas. El consumo medio de filtros en estos pacientes fue significativamente más elevado comparado con el uso de otros regímenes anticoagulantes (9 ± 1,9 filtros/paciente frente a 5,8 ± 0,4 para la HnF y 7,4 ± 1,6 para el epoprostenol aislado, p < 0,05). Por otra parte, estos pacientes presentaron cifras elevadas de plaquetas previamente al cambio a la terapia combinada (259,3 ± 31,8 x 103/mm3 frente a 175 ± 128 x 103/mm3 en el resto de pacientes, p < 0,001) (fig. 2).
Figura 2. Cambios en el recuento plaquetario durante el tratamiento con heparina no fraccionada antes del inicio de la terapia combinada. Los valores se expresan como media ± desviación estándar.
El uso de esta terapia combinada se realizó en 105 (5%) filtros, aplicando epoprostenol más HnF en una dosis media de 365,6 ± 31,9 U/h de HnF y obteniendo una supervivencia hasta la coagulación de 27 horas como mediana (rango intercuartil: 19-41).
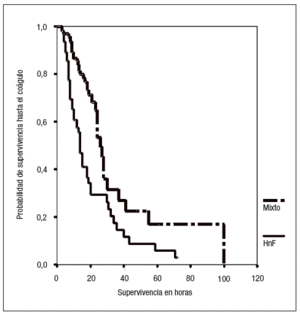
En este grupo de pacientes, los filtros usados en la fase inicial del tratamiento y que fueron anticoagulados con HnF en las dosis habituales (la dosis media de HnF previa al inicio de terapia mixta era de 694,7 ± 337 U/h, p < 0,001) mostraron una supervivencia hasta el coágulo de 14 horas (rango intercuartil: 8-31) frente a las ya mencionadas 27 horas cuando se empleó la terapia combinada (p < 0,001) (fig. 3).
Figura 3. Efecto de la anticoagulación mixta sobre la supervivencia de los filtros (Log rank test, p < 0,001).
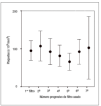
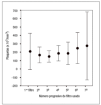
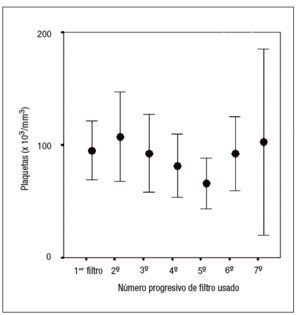
No se ha detectado un descenso significativo de la cifra de plaquetas con el uso de epoprostenol (figs. 4 y 5).
Figura 4. Relación entre la cifra de plaquetas y el uso de epoprostenol. Los valores se expresan como media ± desviación estándar.
Figura 5. Relación entre la cifra de plaquetas y el uso de anticoagulación mixta. Los valores se expresan como media ± desviación estándar.
La hemorragia se presentó como complicación durante el uso de 269 (12%) filtros, siendo leve en 235 (10%) filtros, moderada en 59 (2%) y grave en 29 (1%).
Para valorar el posible efecto del régimen anticoagulante sin variables que puedan artefactuar los resultados hemos analizado de forma separada aquellos filtros en los que no existía coagulopatía ni trombopenia (1.236 filtros, 53%). De éstos, 1.170 fueron tratados con HnF, presentando sangrado leve en 90 (8%), moderado en 11 (1%) y grave en 8 (1%), en tanto que 66 filtros fueron tratados con epoprostenol, presentando sangrado leve en 2 (3%), sin detectarse ningún caso de sangrado moderado ni intenso.
DISCUSION
Tras el desarrollo hace más de tres décadas de las TCRR7, éstas se han constituido en el tratamiento de suplencia renal de elección para pacientes críticos en nuestro país2. Desde el inicio de su uso se observó la necesidad de realizar la anticoagulación del circuito para lograr una adecuada duración de los sistemas8. Durante un tratamiento con TDE, la sangre del paciente se pone en contacto durante un largo período de tiempo con una superficie extraña al organismo. La activación de la vía intrínseca de la cascada del complemento y la activación de las plaquetas secundarios a este contacto9 finalmente provocan la activación secuencial de los factores de la coagulación3, lo cual debe considerarse por tanto un fenómeno inevitable. Existen además otros factores que pueden exacerbar esta tendencia, como el tipo de membrana usado9,10, la fragmentación de las plaquetas producida por un flujo sanguíneo elevado11 o factores dependientes del paciente12,13. Se ha demostrado la relación entre la cifra de plaquetas y la duración de los filtros13, así como con un hematocrito elevado o la transfusión de concentrados de hematíes12.
La disminución consiguiente de la vida media de los filtros condiciona, en parte, el elevado coste de las TDE y la principal medida para prolongar la duración de los mismos es una correcta anticoagulación del circuito14, aunque no debemos olvidar que un importante porcentaje de filtros son retirados por diferentes motivos antes de que se inicie su coagulación (alrededor del 45% según nuestros resultados), por lo que otras medidas de optimización no farmacológicas también deberán ser tomadas en consideración.
El anticoagulante ideal debería prevenir la coagulación del sistema sin inducir hemorragia, tener una vida media corta y una acción limitada al interior del circuito. Su monitorización debería ser fácil de realizar, estar libre de efectos secundarios y, por último, disponer de un antagonista eficaz15. Por desgracia, ningún régimen anticoagulante en la actualidad presenta todas las características referidas, y este factor ha contribuido de forma definitiva a que no exista consenso sobre el mejor anticoagulante para uso en TDE5.
La disponibilidad de la HnF y la experiencia acumulada con su uso en hemodiálisis intermitente la ha situado como el principal agente16. No obstante y dado que la génesis del coágulo es de origen predominantemente plaquetario17, la HnF no es suficiente para evitar su aparición, y cuando lo hace, la elevación de la dosis se acompañará de una elevación excesiva del riesgo de sangrado. Por otra parte, muchos pacientes críticos presentan niveles bajos de antitrombina III condicionados por su proceso patológico de base, por lo que el efecto de la heparina en estos casos se verá disminuido18. También debemos considerar los problemas secundarios a su uso, especialmente la trombopenia inmune inducida por heparina19.
El citrato se presenta como alternativa a la HnF20-23. Su efecto se basa en su capacidad quelante sobre el calcio, por lo que la infusión de calcio a la salida del circuito neutraliza su efecto, limitándolo al circuito. Se ha usado en diferentes series con excelentes resultados24 y con una frecuencia muy baja de complicaciones hemorrágicas25,26, pero la necesidad de emplear soluciones de reposición modificadas y de realizar un estrecho control metabólico durante su empleo dificulta su manejo de forma significativa27, limitándolo a centros con elevada experiencia.
Dado que el contacto de la sangre con la membrana activa la agregación plaquetaria, el uso de un fármaco como la prostaciclina, que es un potente agente antiplaquetario, puede resultar apropiado. La prostaciclina se produce a partir del ácido araquidónico en el tejido vascular e inhibe la vía final de todos los mecanismos de activación celular que desembocan en la adhesión de la plaqueta. Este efecto está mediado por un incremento en los niveles intracelulares de adenosinmonofosfato cíclico (AMPc) secundarios a la activación de receptores adenil-ciclasa específicos de la membrana28.
El epoprostenol, un derivado de la prostaciclina, inhibe de forma efectiva y reversible la agregación plaquetaria al producir el descenso de los receptores de fibrinógeno en la plaqueta. Kozek-Langenecker et al29 han demostrado que la expresión de glucoproteínas IIb-IIIa y P-selectinas en plaquetas activadas con difosfato de adenosina es inhibida reversiblemente por la prostaciclina en circuitos experimentales de TCRR. Esta inhibición no parece acompañarse en la práctica de un descenso de la cifra de plaquetas ni de la alteración de las pruebas de coagulación30, y aunque los datos de este estudio muestran una caída inicial de las plaquetas con elevación posterior, este resultado puede ser explicado por el perfil de pacientes en que ha sido usado (pacientes con trombopenia en los que se pretendía evitar el uso de HnF).
De hecho, el efecto sobre las plaquetas puede ser citoprotector, pues por una parte no afecta a su número y, por otra, parece disminuir el efecto del contacto de la membrana con la activación plaquetaria31. Canaud et al32 han demostrado que la liberación de factor plaquetario 4 está disminuida cuando se usa epoprostenol como anticoagulante. El epoprostenol interfiere con la cascada de la coagulación y no mostrará alteraciones en el estado de la misma.
Se han descrito efectos hemodinámicos secundarios al uso de prostaciclina debidos a su efecto vasodilatador sistémico28,30. Este efecto ha sido referido como significativo en pacientes críticos30, aunque su corta vida media (menor de 1 minuto) limita este efecto negativo28 en tanto que la infusión directa en el circuito permite disminuir los efectos periféricos del epoprostenol33. Diferentes estudios publicados31 y nuestros resultados muestran que en dosis de 4-5 ng/kg/min (con una elevación progresiva de la misma) se puede evitar por completo la aparición de este deterioro. La dosis aconsejada se debe alcanzar de forma progresiva, con incrementos paulatinos y observando el efecto sobre los parámetros hemodinámicos del paciente, para evitar la aparición de efectos vasodilatadores sistémicos.
Existen datos publicados que sugieren una baja eficacia y una elevada frecuencia de complicaciones con su uso (duración de los filtros de 15 horas y una frecuencia de complicaciones hemorrágicas de alrededor del 8%), junto a una frecuente aparición de alteraciones hemodinámicas (hipotensión en el 15,5% de las sesiones)34. Sin embargo, la experiencia publicada por diferentes autores y la que presentamos en este trabajo muestra que en dosis de 4 a 5 ng/kg/ min los efectos adversos no aparecen, permitiendo el mantenimiento de los circuitos durante más de 24 horas32,34-37 y disminuyendo el riesgo de sangrado comparado con la HnF38. Gainza et al39, en un análisis de 16 pacientes sometidos a TCRR en el que se realizó el tratamiento con epoprostenol como anticoagulante único, han comunicado resultados muy similares a los nuestros, con una supervivencia de los filtros de 38,6 horas y con aparición de tan sólo un episodio de hipotensión.
Dado el elevado número de factores que pueden alterar la duración de los filtros no es de extrañar que exista un número de casos en que, pese a una correcta anticoagulación, se siga provocando la coagulación precoz de los mismos. En general, una cifra elevada de plaquetas suele relacionarse con esta coagulación precoz13, pero otros aspectos, como la patología de base, pueden también influir. Es en este contexto donde el uso simultáneo de HnF más epoprostenol, que es de hecho más efectivo cuando se usa como complemento y no como sustituto de la HnF, puede resultar de utilidad, dado que este régimen actúa de forma simultánea sobre la coagulación plasmática y las plaquetas40.
Kozek-Langenecker et al38 compararon en un estudio prospectivo la HnF, la prostaciclina y ambos en 3 grupos de pacientes de la UCI37. La HnF se administró en dosis de 6,0 ± 0,3 UI/kg/h, la prostaciclina en 7,0 ± 0,7 ng/kg/min y en ambos prostaciclina y heparina en 6,4 ± 0,3 ng/kg/min y 5,0 ± 0,4 IU/kg/h. Las pruebas de coagulación sólo se afectaron en el grupo 1 y la duración media de los filtros fue significativamente mayor en el grupo 3 sin aumento de la frecuencia de complicaciones hemorrágicas.
Aunque nosotros realizamos este tratamiento en un grupo seleccionado de pacientes con coagulación excesiva y con una cifra de plaquetas superior al resto de los pacientes, lo que explica una aparente menor eficacia frente a la HnF, hemos podido duplicar la duración de los filtros al pasar de una terapia mediante HnF al uso de tratamiento mixto con dosis bajas de heparina. Este beneficio claro nos permite aconsejar este régimen en pacientes en los que se produce la coagulación precoz de los filtros, sobre todo ante la presencia de un recuento elevado de plaquetas.
Por último, como demuestran Kozek-Langenecker et al38 y se confirma en nuestros resultados, la frecuencia de sangrado es inferior para el epoprostenol frente a la HnF, resultados aún más interesantes en nuestra serie si consideramos que se trata de pacientes con coagulopatía o trombopenia moderada.
El epoprostenol es una alternativa eficaz para el mantenimiento de los circuitos para TCRR en pacientes de UCI cuando existan circunstancias que desaconsejen el uso de HnF, consiguiendo una duración similar de los filtros y disminuyendo el riesgo de sangrado incluso en pacientes de alto riesgo (trombopenia o coagulopatía). Su dosificación escalonada evita la aparición de efectos hemodinámicos adversos. Por otra parte, en pacientes con coagulación precoz de los filtros, el uso de epoprostenol más HnF en bajas dosis aumenta de forma significativa la duración de los filtros.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún
conflicto de intereses