Las recomendaciones actuales centran la terapéutica del traumatismo craneoencefálico grave (TCEG) en el control de la hipertensión endocraneal (HTE) y en la corrección precoz de aquellos factores que desencadenan la lesión cerebral secundaria, fundamentalmente la hipoxia y la hipotensión arterial1. La HTE es deletérea por generar conos de presión y por desencadenar hipoxia cerebral isquémica al descender la presión de perfusión cerebral (PPC), además de tener un indiscutible valor pronóstico2–5. Uno de los principales factores que desencadenan la hipoxia cerebral es el descenso del flujo sanguíneo (FSC); sin embargo, podemos encontrar situaciones de hipoxia tisular sin asociar inexorablemente HTE6.
Las últimas investigaciones han constatado que durante la lesión cerebral traumática, se disparan una serie de cascadas nocivas cuya vía final común es la isquemia, hipoxia tisular y muerte celular de manera similar a lo que sucede en los estados de shock1. Para comprender la fisiopatología y establecer las causas de hipoxia tisular es imprescindible analizar los componentes del sistema de transporte de oxígeno, el cual requiere la compleja y correcta interacción del sistema cardiorrespiratorio y hematológico en un medio interno que brinde el ambiente adecuado7,8.
La disponibilidad de oxígeno cerebral es óptima cuando sus factores determinantes, esto es el FSC y el contenido arterial de oxigeno (CaO2) son adecuados. El CaO2 depende del oxígeno disuelto (correcto intercambio gaseoso a nivel pulmonar) y del unido a la hemoglobina (Hgb), por ello es fundamental su concentración, capacidad de transporte y afinidad de la misma por el oxígeno8. El FSC tiene como determinantes principales la PPC y la resistencia vascular cerebral2,8. Solamente si las variables antedichas son normales se asegura un correcto aporte de sustrato a las células.
El intercambio de oxígeno a los tejidos ocurre en la microcirculación, lo que requiere su integridad anatomo-funcional, para ello es imprescindible que se mantenga un flujo y una permeabilidad adecuadas8. El oxígeno aún debe sortear la dificultad de la distancia que tiene que recorrer hasta llegar a la mitocondria8. Por último es importante tener en cuenta la actividad metabólica celular (la cual, en ocasiones, supera ampliamente las demandas, sobre todo durante la lesión aguda), y la capacidad de la célula para utilizar el oxígeno aportado9. Cuando la célula sufre el aporte inadecuado de sustrato o su actividad metabólica la sobrepasa, se generan metabolitos que en determinadas circunstancias pueden utilizarse como marcadores de sufrimiento o hipoxia tisular5,7,8.
La hipoxia tisular puede sobrevenir como consecuencia de alteraciones a múltiples niveles desde el pulmón hasta la mitocondria. Siggaard-Andersen estableció distintos tipos con sus respectivas características y criterios para definirlas9. Es importante indagar la causa correcta ya que las medidas terapéuticas a adoptar son disimiles. Una revisión publicada previamente desglosa minuciosamente esta situación9.
El método más aceptado para el diagnóstico de isquemia cerebral e hipoxia tisular es la tomografía con emisión de positrones, ya que permite en forma simultánea obtener datos no solo del FSC sino de la actividad metabólica como el consumo o la tasa de extracción cerebral de oxígeno. Sin embargo, requiere traslado del paciente y discontinuidad de los cuidados intensivos no pudiéndose realizar en forma continua, con lo que carece de utilidad para la toma de decisiones8. Otras técnicas como la microdiálisis cerebral permiten la detección de marcadores de hipoxia tisular como el lactato, piruvato, glutamato, sin embargo no ha sido validada en forma universal y es de muy alto costo, limitándose actualmente su uso al ámbito de la investigación5.
La monitorización de la saturación venosa del golfo de la yugular y sus variables asociadas (diferencias arterio-yugulares de oxígeno [O2], lactato) brindan información de carácter global, a veces difíciles de interpretar, requieren calibración permanente, presentan problemas de malfuncionamiento y no aportan datos de lo que sucede a nivel celular1,8.
La implantación de la monitorización de la presión tisular de oxigeno cerebral (ptiO2) ha permitido evidenciar que la hipoxia tisular es un mecanismo que genera lesión cerebral durante el TCEG, independientemente de la presencia o no de HTE6,9,10. Cuanto más profundos y mantenidos en el tiempo sean los descensos de los valores PtiO2, mayores incrementos de marcadores de lesión tisular se generarán. Además, al deterioro de la PtiO2 se asociarán peores resultados funcionales e incremento de la mortalidad6,9,10. Por otra parte, distintas series clínicas han sugerido que el manejo TCEG dirigido a corregir la hipoxia tisular cerebral, incrementando la ptiO2, mejora el metabolismo cerebral y los resultados6,10.
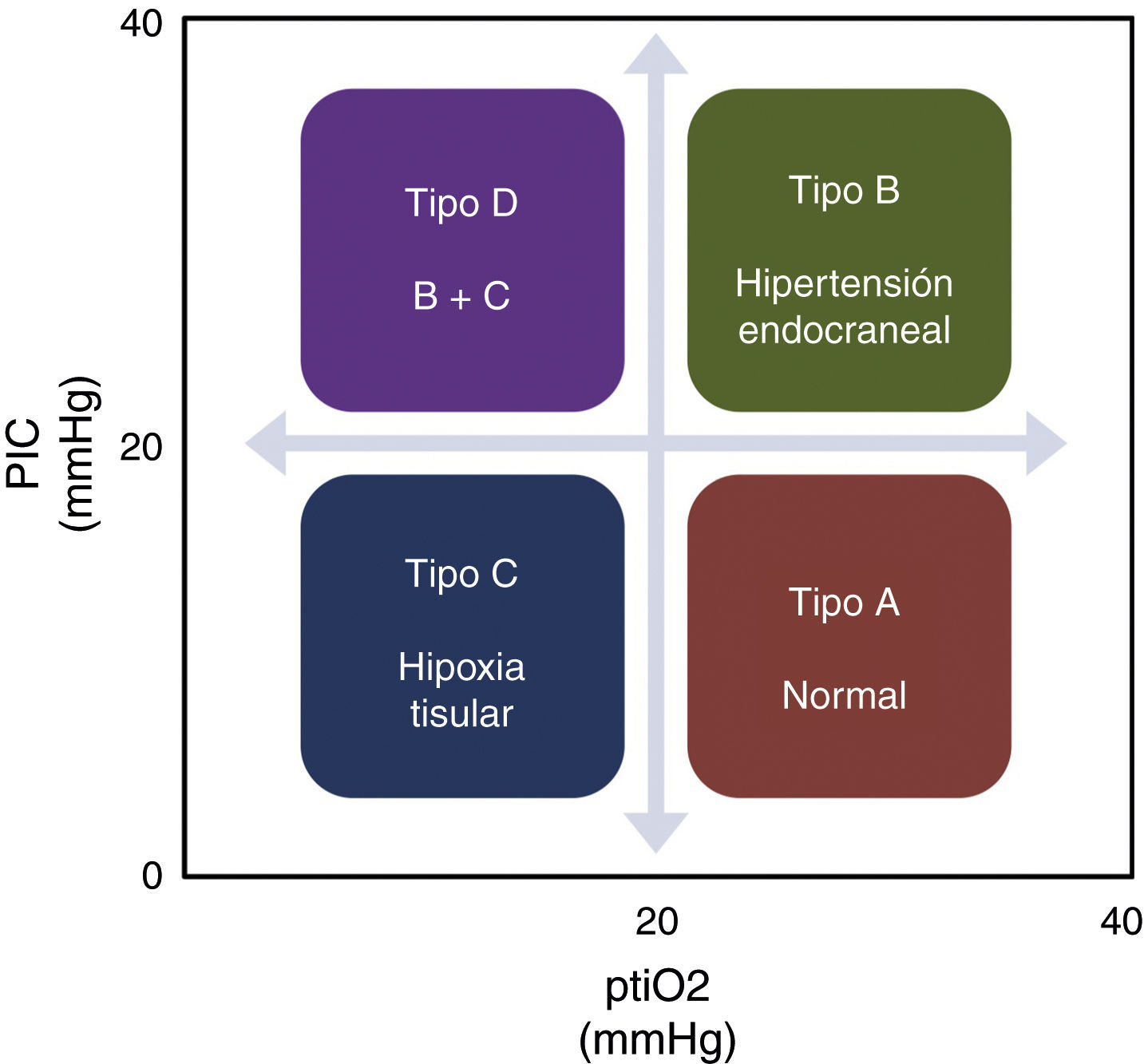
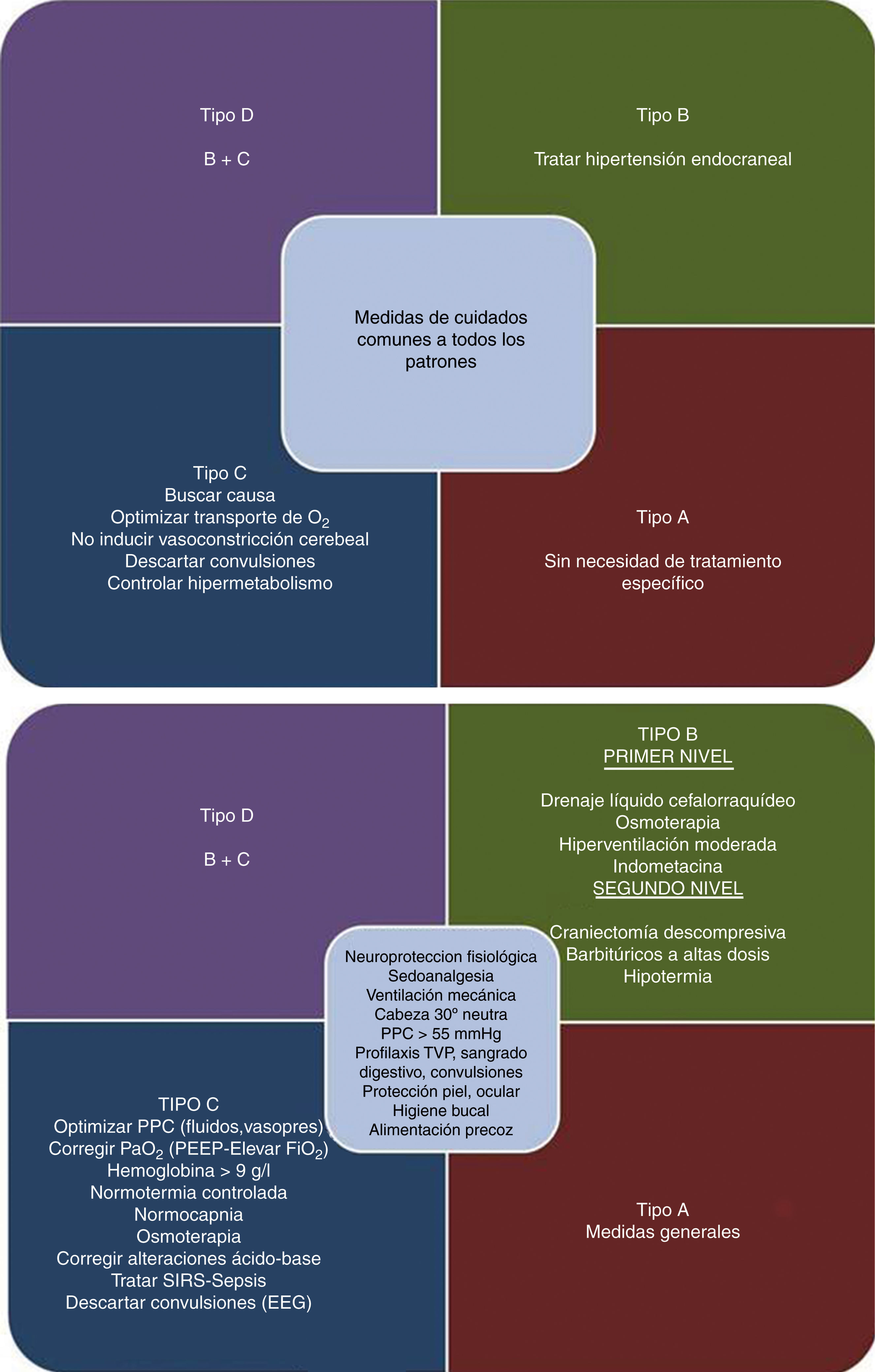
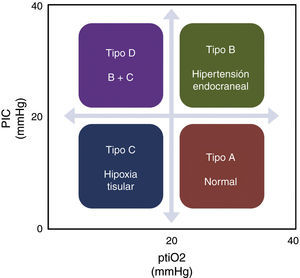
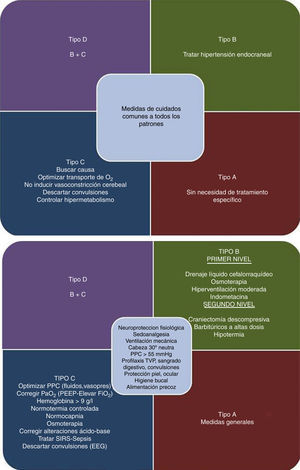
Aunque las guías actuales consideran una opción la monitorización de la ptiO2, consideramos que es una técnica que complementa la información obtenida con otros métodos de monitorización, fundamentalmente la PIC, dando una aproximación fisiopatológica más certera de lo que está sucediendo en el paciente1. La información proveniente de ambos métodos de monitorización, en su conjunto, permiten establecer una serie de patrones fisiopatológicos (fig. 1) que por un lado facilitan la comprensión de los fenómenos que ocurren durante el TCEG y, por el otro, ayudan en la elección de la terapéutica correcta para cada caso, tal y como se muestra en la figura 2.
Enfoque de tratamiento del traumatismo craneoencefálico grave según el patrón fisiopatológico.
EEG: electroencefalograma; FiO2: fracción inspirada de oxígeno; g: gramo; PaO2: presión arterial de oxígeno; PEEP: presión positiva al final de la espiración; PPC: presión de perfusión cerebral: SIRS: síndrome de respuesta inflamatoria sistémica; TVP: trombosis venosa profunda.
En conclusión, los diagramas expuestos muestran de forma sencilla el manejo de este tipo de pacientes integrando las recomendaciones de la Brain Trauma Foundation, con la información disponible para optimizar la ptiO21,9.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.