La alteración del ventrículo derecho (VD) es frecuente en los pacientes críticos y su disfunción se asocia a mayor mortalidad, lo que plantea un reto clínico en su diagnóstico. En esta revisión, pretendemos describir los posibles mecanismos de la biomecánica anormal del VD y los distintos fenotipos de su lesión. La comprensión de la fisiopatología y la historia natural de la lesión del VD puede informar al intensivista sobre el enfoque del diagnóstico y la monitorización de este, así como sobre la aplicación de intervenciones personalizadas con relevancia terapéutica.
Se realiza una descripción de los parámetros de evaluación de la función sistólica y diastólica del VD, junto con la estimación del gasto cardíaco y las presiones del circuito pulmonar mediante ecocardiografía, con énfasis en el diagnóstico del cor pulmonale agudo junto con aplicaciones clínicas en el paciente crítico como en el distrés, shock séptico e infarto de VD.
The impairment of the right ventricle is a common condition in critically ill patients. Right ventricular dysfunction is associated with increased mortality, and its diagnosis remains challenging. In this review, we aim to outline the potential mechanisms underlying abnormal biomechanics of the right ventricle and different phenotypes of injury. A comprehensive understanding of the pathophysiology and natural history of right ventricular injury may be informative for the intensivist in the diagnosis and management of this condition, as well as contributing to the guidance of individualized treatment strategies.
We describe the main recommended parameters to assess right ventricular systolic and diastolic function. We also define how to evaluate cardiac output and pressures of the pulmonary circulation with echocardiography, with a focus on the diagnosis of acute cor pulmonale and relevant applications in critical illnesses such as distress, septic shock, and right ventricular infarction.
Numerosas patologías que afectan a los pacientes críticos repercuten en el ventrículo derecho (VD) y su disfunción se asocia con mayor mortalidad1. Este fenómeno puede derivar de alteraciones en la contractilidad por isquemia coronaria o sepsis, de aumento en la poscarga como en el síndrome de distrés respiratorio agudo (SDRA) o en el tromboembolismo pulmonar (TEP), pero también puede desencadenarse por tratamientos empleados, como fármacos vasoactivos, ventilación mecánica (VM) o la sobrecarga hídrica1–4. La comprensión de la fisiopatología y la historia natural de la lesión del VD, unido a una adecuada monitorización a pie de cama, puede ayudar al intensivista a enfocar el diagnóstico y adecuar el tratamiento para optimizar su función1,5.
La ecografía, gracias a su naturaleza no invasiva y amplia disponibilidad, se ha convertido en una herramienta principal en la evaluación durante la práctica clínica diaria6–8. La afectación del VD es frecuente en el paciente crítico, pero su detección puede llegar a ser un desafío y precisa del conocimiento fisiológico de las patologías cardiorrespiratorias de estos pacientes para un adecuado tratamiento5.
Fisiopatología de la disfunción del ventrículo derecho, importancia de sus alteraciones en cuidados intensivos y la interdependencia ventricularEl VD tiene una forma de semiluna que envuelve al ventrículo izquierdo (VI), compuesto por 3 segmentos: tracto de entrada, cuerpo y tracto de salida. El volumen telediastólico del VD es ligeramente superior al del VI y, en consecuencia, el VD tiene una fracción de eyección (FEVD) ligeramente inferior. La orientación helicoidal de sus miofibrillas produce un patrón contráctil principalmente longitudinal, debido a la menor cantidad de fibras circunferenciales. Su pared es más delgada, siendo menor de 5mm presenta elevada distensibilidad y mala tolerancia al aumento de la presión en el circuito pulmonar9–11. El aumento crónico de poscarga del VD producido por la hipertensión pulmonar (HTP) produce un incremento del grosor de su pared como mecanismo de compensación.
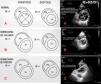
Ambos ventrículos están integrados anatómica y fisiológicamente a través del septo interventricular (SIV). La interdependencia ventricular se define como los cambios producidos en un ventrículo por aumento de presión o de volumen en el otro y se evalúa en el eje corto del plano paraesternal12. En condiciones normales, el SIV es cóncavo hacia el VI durante todo el ciclo cardíaco, y el índice de excentricidad (IE) del VI es 1, el cual se define como el cociente entre los diámetros anteroposterior y septolateral del VI (fig. 1A)13. Cuando el VD presenta una sobrecarga de volumen, se observa una dilatación del VD acompañado de aplanamiento del SIV con una relación del IE>1 durante la diástole (fig. 1B). La precarga excesiva puede provocar un deterioro contráctil y disminución de la presión de perfusión coronaria1. Sin embargo, cuando existe una sobrecarga de presión, se observa una dilatación del VD y desviación septal hacia el VI con IE>1 durante la sístole y diástole, con VI en forma de «D», siendo14 predictor de mal pronóstico (fig. 1C)15. Este hallazgo es conocido como efecto de Berheim inverso9,12.
Interdependencia ventricular. VD: ventrículo derecho; VI ventrículo izquierdo; IE: índice de excentricidad; A. Patrón normal de excentricidad del VI; B. Sobrecarga de volumen, con aplanamiento del septo solo en diástole; C. Sobrecarga de presión, aplanamiento del septo en sístole y diástole; D2: diámetro anteroposterior del VI; D1: diámetro septo-lateral del VI.
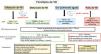
No existe una definición universalmente aceptada de fallo del VD4,5. Recientemente, en pacientes con SDRA se han identificado 3 fenotipos distintos (función normal del VD, dilatación del VD y dilatación del VD con deterioro de la función sistólica) con resultados clínicos diferentes16,17 (fig. 2). La dilatación de VD causa expansión del anillo tricuspídeo y aparición de insuficiencia tricuspídea (IT), la cual puede producir congestión venosa y asociarse a lesiones orgánicas renales y/o hepáticas aumentando la mortalidad18. La congestión se debe evaluar mediante el tamaño de la vena cava inferior (VCI) y su variabilidad respiratoria junto con el patrón venoso de flujo hepático.
Fenotipos del VD. AP: arteria pulmonar; HDFVVC: hemodialfiltración venovenosa continua; PAPs: presión sistólica de la arteria pulmonar; PVC: presión venosa central; SIV: septo interventricular; Tac: tiempo de aceleración de la arteria pulmonar; TAPSE: excursión sistólica del plano sistólico del anillo tricuspídeo; VCI: vena cava inferior; VD: ventrículo derecho; VI: ventrículo izquierdo; VD/VI: relación de las áreas telediastólicas del ventrículo derecho y del ventrículo izquierdo.
La interacción entre el VD y la circulación arterial pulmonar (AP) en diferentes condiciones de carga se denomina acoplamiento VD-AP, que determina la relación entre la contractilidad del VD, medida por la elastancia telesistólica (Ees) y la poscarga de la AP, medida por la elastancia arterial pulmonar (Ea)1,18 (fig. 2). El sistema está acoplado cuando la relación Ees/Ea es >119,20. La disfunción vascular pulmonar aguda debida a múltiples causas, como la trombosis, edema pulmonar, VM y vasoconstricción (provocada por hipoxemia, hipercapnia, acidosis), conduce a HTP aguda, la cual provoca un aumento de la fuerza contráctil intrínseca del VD para compensar el aumento de la poscarga (adaptación homeométrica o mecanismo de Anrep)21, lo cual suele ser reportado como VD hiperdinámico, pero en los enfermos críticos puede verse limitado por la inflamación sistémica y la hipotensión22. Otro mecanismo es la dilatación del VD para preservar el flujo sanguíneo (adaptación heterométrica o mecanismo de Starling)5,23 y la reducción de la relación Ees/Ea<1, causada por la elevación de Ea, pueden conducir a un desacoplamiento VD-PA y a una interacción interventricular diastólica negativa, con una presión telediastólica (PTD) del VD superior a la PTD del VI, lo que afecta negativamente al llenado del VI y al gasto cardíaco5,18.
Cuantificación de las cámaras cardíacas del ventrículo derechoDebido a su anatomía, se debe examinar el VD utilizando múltiples ventanas acústicas, incluyendo el eje paraesternal largo, paraesternal corto (tracto de entrada y salida del VD), apical 4 cámaras (4C), la apical modificada para el VD y la ventana subcostal mediante ecocardiografía transtorácica24,25. El informe debe presentar una evaluación basada en parámetros cualitativos y cuantitativos24, aunque en situaciones de compromiso vital inmediato, existen protocolos guiados por parámetros cualitativos con gran reproducibilidad y correlación en comparación otros métodos de evaluación cardíaca como la resonancia magnética (RM) y ecocardiografía 3D26,27, cuando la exploración es realizada por un operador experto28. La tabla 1 señala los parámetros ecocardiográficos para el estudio básico del VD.
Parámetros de estudio básico ecocardiográfico de ventrículo derecho
| Relación del área del VD y el área del VIMovimiento del SIVEspesor de la pared del VD en plano subcostalTAPSETamaño y colapso de la VCIVmaxIT |
SIV: septo interventricular; TAPSE: excursión sistólica del plano del anillo tricuspídeo; VCI: vena cava inferior; VD: ventrículo derecho; VI: ventrículo izquierdo; VmaxIT: velocidad máxima de la insuficiencia tricuspídea.
Aunque el plano paraesternal eje corto es el mejor para evaluar la interdependencia ventricular, el plano apical 4C es la proyección para realizar las mediciones del tamaño de la aurícula derecha (AD) y el VD. La dilatación del VD se basa en su relación del diámetro transverso o el área telediástolica (ATD) respecto al VI, medido en telediástole. La relación normal es VD/VI <0,6; entre 0,6-1 se considera dilatación moderada, y >1 dilatación grave5,29,30. Los parámetros de cuantificación se describen en la tabla 2 y figura 3.
Parámetros ecocardiográficos de cuantificación de tamaño y función sistólica del ventrículo derecho
| Parámetro | Valor normal | Características |
|---|---|---|
| Espesor de la pared (mm) | <5 | Se mide la pared lateral del VD en el plano subcostalEspesor >5mm indica hipertrofia VD y sugiere sobrecarga de presión en ausencia de otra patología |
| Relación VD/VI | <0,6 | 0,6-1 dilatación moderada de VD>1 dilatación grave de VD |
| Índice de excentricidad | =1 | >1 en diástole sugiere sobrecarga de volumen y >1 en sístole y diástole sobrecarga de presión |
| TAPSE (mm) | >17 | Reproducible, de fácil obtenciónCorrelación buena de la FEVD con RM, FAC y ECO 2DLimitación: dependiente del ángulo |
| FAC (%) | >35 | Menos reproducible, precisa buena imagen 2DBuena correlación con la RMLimitación: dificultad en su cuantificación |
| Onda Ś con TDI (cm/s) | >9,5 | Reproducible, de fácil obtenciónCorrelación buena con ECO 2D, RMLimitación: dependiente del ángulo |
| Índice de TEI | RIMP>0,43 por PW y>0,54 por DTI | Limitación: mediante PW no puede medirse dentro de un mismo latido, con DTI mide el TRIV y TCIV en el mismo latido |
| Strain de la pared libre del VD (%) | >−20% | Precisa imagen de gran calidad 2D, evitar angulaciones de la ventana apical 4CLimitación: requiere software off line para su cálculoDificultad media en su cuantificación |
| Fracción de eyección del VD en 3D (%) | >45% | Medición precisa de volúmenes y FEBuena correlación con la RM, con volúmenes ligeramente inferioresLimitación: pocos estudios en pacientes críticos |
| Speckle-tracking | Independiente del ángulo DopplerPrecisa buena imagen bidimensional, afectado por artefactos de los movimientos cardíacos en planoLimitación: difícil de cuantificarPrecisa software poco disponible en críticos |
DTI: Doppler tisular; FAC: fracción de acortamiento; PW: Doppler pulsado; RM: resonancia magnética; TAPSE: excursión sistólica anterior del plano del anillo tricuspídeo; TCIV: tiempo de contracción isovolumétrica; TRIV: tiempo de relajación isovolumétrica; VD: ventrículo derecho; VI: ventrículo izquierdo.
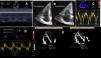
A. TAPSE; B. FAC; C. Doppler tisular. La flecha señala la onda sistólica y la estrella la velocidad de la onda e. D. Índice de TEI: mide el cociente entre los tiempos de contracción y relajación isovolumétricos en relación con la eyección sistólica. Se puede cuantificar con Doppler pulsado o a partir del registro de Doppler tisular. La ventaja del Doppler tisular es que permite recoger toda la información del ciclo cardíaco en el mismo latido y mejora la reproducibilidad de la técnica. Se medirá el tiempo de contracción isovolumétrica (ICT), el tiempo de relajación isovolumétrica (IRT) y el tiempo eyectivo (ET) en el espectro del Doppler tisular pulsado del anillo tricúspide lateral. E. Strain.
- -
Modo M.
- ∘
TAPSE (Excursión Sistólica del Plano del Anillo Triscuspídeo). Representa una medida de la función longitudinal. Se mide en el plano apical 4C con el cursor alineado de manera óptima en el anillo lateral tricuspídeo. Mide el grado de desplazamiento longitudinal del segmento anular de VD desde telediástole hasta el pico sistólico. Poco dependiente de buena calidad de imagen. Tiene valor pronóstico en la HTP31, y un valor <17mm sugiere disfunción sistólica del VD24. Presenta limitaciones en pacientes postoperados de cirugía cardíaca (fig. 3A).
- -
Modo bidimensional (2D).
- ∘
FAC (Cambio del Área Fraccional). Es una estimación de función global ventricular. Se cuantifica en el plano apical de 4C mediante un trazado del área de VD telediastólica (ATD) y telesistólica (ATS), se debe tener cuidado de incluir las trabéculas en la cavidad. Fórmula: (ATD-ATS)/ATD×100, valores <35% indican disfunción sistólica24. Es predictor independiente de insuficiencia cardíaca, muerte súbita, ictus y mortalidad en pacientes con TEP32. Comparado con el TAPSE, el FAC es más preciso para estimar la función sistólica tomando como referencia la RM33 (fig. 3B).
- -
Doppler.
- ∘
Tisular (DTI). Velocidad de la onda sistólica (Ś). Se obtiene en el plano apical de 4C mediante DTI, colocando el cursor del Doppler pulsado (PW) en la porción media del segmento basal del anillo lateral tricuspídeo. Mide la velocidad longitudinal. Aunque disminuye con la edad, un valor <9,5cm/s se considera anormal24 (fig. 3C).
- ∘
Índice de Función Miocárdica del VD (RIMP) o índice de Tei. Es un índice del rendimiento global del VD. Los intervalos de tiempo de contracción isovolumétrica (TCIV), tiempo de relajación isovolumétrica (TRIV) y tiempo de eyección (TE) deben medirse a partir del mismo latido cardíaco utilizando PW o DTI en el anillo lateral tricuspídeo. Es importante asegurarse de que latidos no consecutivos tengan intervalos RR similares. Puede estar infraestimado en condiciones de presiones elevadas de AD, lo que acortará el TRIV. RIMP>0,43 por PW y >0,54 por DTI indican disfunción del VD24 (fig. 3D).
- ∘
Imagen de deformación tisular strain/strain rate. Los datos derivados del estudio con DTI se pueden utilizar para determinar el grado de deformación miocárdica de la pared libre (strain) y la velocidad de deformación miocárdica (strain rate). El strain y el strain rate estiman la función sistólica global y regional del VD, respectivamente. El strain se define como el porcentaje de acortamiento sistólico de la pared libre del VD desde la base hasta el ápex, mientras que el strain rate es la velocidad de este acortamiento24. Ambos tienen buena correlación con la contractilidad miocárdica34, sin embargo, el strain está menos influido por el movimiento del corazón, por lo que se considera un parámetro más fiable, aunque es dependiente de las condiciones de carga. El strain debe medirse desde la ventana apical de 4C sin angulación, con una imagen de gran calidad ya que la reverberación y artefactos pueden afectar en la colocación de los puntos de referencia, e infraestimar su cuantificación. Los puntos de referencia se deben limitar a la pared libre miocárdica excluyendo pericardio, lo que puede resultar difícil dado que la pared libre del VD suele ser delgada. Se considera normal un valor >–20%24 (fig. 3E).
- ∘
Su valor patológico presenta implicaciones pronósticas en pacientes con función normal del VI35. También se asocia a mayor mortalidad en el shock séptico2,36, HTP37, pacientes con asistencias circulatorias ventriculares izquierdas38 y COVID-1939.
- -
Ecocardiografía de seguimiento moteado (speckle-tracking). Se realiza un análisis del movimiento de motas en la imagen bidimensional, es independiente del ángulo Doppler, con posibilidad de cuantificar la dinámica de engrosamiento, acortamiento y rotación de la función cardíaca24,40–42. Existen pocos estudios en críticos.
- -
Ecocardiografía tridimensional (ECO-3D). Proporciona una medición más precisa de los volúmenes y FEVD, aunque los volúmenes cuantificados son ligeramente inferiores a los de la RM27,43. Poca disponibilidad en críticos.
Existe gran variedad de patologías cardíacas (primarias o secundarias) que presentan durante su evolución afectación diastólica del VD (miocardiopatías, valvulopatías del VI, cardiopatías congénitas, artritis reumatoide, vasculitis, SDRA), pero no existe hoy día consenso para su evaluación y cuantificación, y no forma parte de una evaluación ecocardiográfica clínica estándar.
Recientemente se han publicado unas guías13 para su evaluación mediante 4 parámetros: (tabla 3)
- •
Imagen 2D. Aumento del volumen de la AD, dilatación de la VCI con disminución del IC inspiratorio de la VCI y engrosamiento miocárdico del VD.
- •
Cuantificación mediante PW del flujo de entrada tricuspídeo en la zona de máxima apertura de las valvas tricuspídeas. Se determina la onda E, onda A, relación E/A y el tiempo de desaceleración de la onda E (TDE). Este flujo es muy dependiente de la precarga, poscarga y fase respiratoria, recomendándose la media de 5 ciclos. Además, la coexistencia de IT moderada o severa, o fibrilación auricular, infravalora sus mediciones.
- •
DTI en el anillo tricuspídeo lateral. Menos dependiente de la precarga y poscarga que el PW. Se obtiene el tiempo de relajación isovolumétrico (TRIV), onda é, onda á y relación é/á. (fig. 3C y D)
- •
PW en la vena suprahepática. Es muy dependiente del ciclo respiratorio, VM y PEEP, aconsejándose la media de 5 ciclos. Se obtienen 3 ondas: una onda sistólica anterógrada (S), causada por la relajación de la AD; una onda diastólica anterógrada (D), durante el llenado ventricular rápido y una onda de flujo reverso (AR) durante la sístole auricular.
Grados de función diastólica del ventrículo derecho
| Parámetros | Normal | Anormal | Restrictivo |
|---|---|---|---|
| 2D | |||
| Pared del VD | ≤5mm | >5mm | |
| Diámetro VCI y colapso | Dmax VCI≤21mm y ICVCI>50% | Dmax VCI>21mm y ICVCI>50% | |
| Doppler pulsado | |||
| E/A flujo tricuspídeo | 0,8-2,1 | <0,8 | >2,1 |
| TDE tricuspídeo (ms) | 120-229 | >229 | <120 |
| Doppler tisular | |||
| é/á tricuspídeo | ≥1 | <1 | |
| E/é tricuspídeo | ≤6 | >6 | |
| TRIV de VD (ms) | ≤73 | >73 | |
| Flujo venoso hepático | |||
| Onda S/ Onda D | ≥1 | <1 | <1 y onda reversa |
Dmax: diámetro máximo; E/A: ondas de llenado tricuspídeo; é/á: relación de las ondas é y á del TDI del anillo lateral tricuspídeo; E/é: relación entre la onda E del flujo tricuspídeo y la onda é lateral del TDI en el anillo lateral tricuspídeo; ICVCI: índice de colapso respiratorio de la VCI; ms: milisegundo; Onda D: onda diastólica del flujo venoso hepático; Onda S: onda sistólica del flujo venoso hepático; TDE: tiempo de deceleración de la Onda E; TRIV: tiempo de relajación isovolumétrica; VCI: vena cava inferior; VD: ventrículo derecho.
Como en el VI, no existe un parámetro ecocardiográfico que indique por sí solo la existencia o el grado de disfunción diastólica del VD, siendo necesario una integración de todas las determinaciones, recomendando las guías una clasificación de normal o anormal, con evolución a restrictivo en algunas patologías.
Monitorización hemodinámicaEs necesario señalar que para la cuantificación de medidas de gasto cardíaco, y presiones pulmonares o presión venosa central (PVC), precisa colocar un catéter de arteria pulmonar o venoso central, respectivamente; sin embargo, la ecocardiografía transtorácica nos permite estimar estos cálculos de manera no invasiva, ya que, debido a su anatomía y posición retroesternal, su análisis se cuantifica peor con ecocardiografía transesofágica25. Los parámetros ecocardiográficos se representan en la figura 4 y tabla 4.
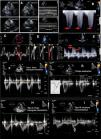
A. Variación de la vena cava inferior. Se muestra la imagen en 2D de inspiración y espiración y en modo M; B. Doppler continuo de la insuficiencia tricuspídea. La flecha roja señala la velocidad máxima de la insuficiencia tricuspídea; C. Tiempo de relajación isovolumétrica (TRIV); D. Tiempo de aceleración de la arteria pulmonar (Tac); E. Doppler pulsado de la insuficiencia pulmonar; las fechas señalan la velocidad máxima protodiastólica del flujo de la insuficiencia pulmonar (VIPpd) y la velocidad máxima del flujo de la insuficiencia pulmonar en telediástole (VIPtd); F. Flujo pulmonar tipo I normal con ascenso y descenso simétrico; G. Flujo de la arteria pulmonar tipo I, con flujo triangular simétrico, flujo normal; H. Flujo pulmonar tipo II con flujo triangular asimétrico, sugiere aumento de presión pulmonar; I. Flujo pulmonar tipo III, con la flecha que señala la incisura mesosistólica por cierre precoz de la válvula pulmonar.
Parámetros ecocardiográficos de cuantificación hemodinámica de cavidades derechas
| Parámetro estimado y parámetro ecocardiográfico | Cuantificación | Características |
|---|---|---|
| Presión de aurícula derecha (PAD) | ||
| VCI | ICVCI=(DmaxVCI – DminVCI / DmaxVCI)×100 | Dmax VCI>21mm y ICVCI <50% (PAD>15)Dmax VCI>21mm y ICVCI>50% (PAD 5-10)Dmax VCI≤21mm y ICVCI <50% (PAD 5-10)Dmax VCI≤21mm y ICVCI>50% (PAD 0-5) |
| E/é tricuspídeo | PAD=1,62 E/e’+2,13 | E/é>6 estima PAD>10mmHg |
| Flujo de las ondas hepáticas | Onda D>Onda SAusencia de onda de flujo sistólico | PAD>20mmHg |
| Presión sistólica de la arteria pulmonar (PAPs) | ||
| IT | PAPs=4× (Vmax IT)2+PAD | |
| DTI | TRIV | TRIV>59ms predice una PAPs> a 40mmHgTRIV <40ms excluiría una PAPs <40mmHg (VPP 100%) |
| Tac AP | Tac>120ms es normalTac<100ms, sugiere HTPSigno 60/60, es el Tac <60ms con Vmax IT≤60mmHg se asocia con PAPs>60mmHg | |
| Presión diastólica de la arteria pulmonar (PAPd) | PAPd=4× (VIPtd)2+PAD | |
| Presión media de la arteria pulmonar (PAPm) | ||
| IP | PAPm=4×(VIPpd)2+PAD | |
| IT | PAPm=0,61×(VmaxIT)2+2mmHg | |
| Tac AP | Si Tac<120ms, PAPm=90 – (0,62×Tac) | Tac <100ms predice una PAPm>25mmHg |
| Resistencias pulmonares (RVP) | RVP=10×(VmaxIT/IVTTSVD)+0,16 | |
Dmax: diámetro máximo; Dmin: diámetro mínimo; DTI: Doppler tisular; IP: insuficiencia pulmonar; ICVCI: índice de colapso respiratorio de la VCI; IT: insuficiencia tricuspídea; IVTTSVD: integral velocidad-tiempo del tracto de salida del ventrículo derecho; onda D: onda diastólica; onda S: onda sistólica; PAD: presión de la aurícula derecha; PAPd: presión diastólica de la arteria pulmonar; PAPm: presión arterial media de la arteria pulmonar; PAPs: presión sistólica de la arteria pulmonar; Tac: tiempo de aceleración de la arteria pulmonar; TRIV: tiempo de relajación isovolumétrica; VCI: vena cava inferior; VmaxIT: velocidad máxima de la insuficiencia tricuspídea; VIPpd: velocidad protodiastólica de la arteria pulmonar; VIPtd: velocidad telediastólica de la arteria pulmonar.
La PAD se calcula mediante la PVC y su estimación se puede realizar mediante los siguientes parámetros:
- •
Índice de colapso de la vena cava inferior (VCI). Se mide la VCI en el plano subcostal a 1-2cm de su unión con la AD, detrás de la vena hepática, en decúbito supino y al final de la espiración. El IC=[Dmax VCI- Dmin VCI]/Dmax VCI). En el paciente crítico hay situaciones donde la dilatación de la VCI sin colapso respiratorio no predice respuesta al aporte de cristaloides44 (fig. 4A).
- •
Cociente E/e’ tricuspídeo. Mediante PW se registra la velocidad protodiastólica de llenado a nivel de la válvula tricúspide (onda E) y por DTI se registra la velocidad de relajación de la pared lateral del anillo tricuspídeo en protodiástole (onda e’). Un cociente E/e’>6 demostró asociarse a una PAD elevada:>10mmHg25. Validado en pacientes ventilados13.
- •
Patrón de flujo de las venas hepáticas: Una relación de ondas S<D se asocia con PAD elevada13,25.
- •
Septo interauricular. Un desplazamiento hacia la AI se asocia con PAD elevadas.
La PAP sistólica, diastólica y media se puede estimar a partir del flujo de la IT o la insuficiencia pulmonar (IP) usando la ecuación de Bernoulli simplificada en ausencia de estenosis pulmonar, al gradiente calculado se suma la PAD.
Presión sistólica de la arteria pulmonar (PAPs)Mediante Doppler color se registra la IT, se coloca el cursor del Doppler de onda continua (CW) con buena alineación para calcular la velocidad máxima de la IT (VmaxIT), la cual equivale al gradiente de presión entre AD y VD. En situaciones de IT masiva, la fórmula no es aplicable ya que el componente inercial no es despreciable. PAPs=4×Vmax IT2+PAD (fig. 4B).
En pacientes sin IT detectable, podemos estimarla a través de:
- •
TRIV. Se debe colocar el DTI con la muestra a nivel de la pared libre del VD en la válvula tricúspide (fig. 4C).
- •
Tiempo de aceleración de la arteria pulmonar (Tac), que es el intervalo de tiempo desde el inicio de la eyección del VD hasta el pico de velocidad de flujo a través de la válvula pulmonar (fig. 4D-G). En el signo de 60/60 se asocia un Tac<60 con un gradiente sistólico tricuspídeo mayor de 30, pero menor de 60mmHg.
Se calcula la velocidad pico de la IP en telediástole (VIPtd) en el plano paraesternal eje corto a nivel de grandes vasos (fig. 4E). Este método es impreciso en presencia de IT masiva.
Presión arterial pulmonar media (PAPm)Para su estimación se han descrito varios métodos:
Resistencias vasculares pulmonares (RVP)Para una medición cuantitativa de las resistencias vasculares pulmonares (RVP) se deben relacionar dos mediciones, la VmaxIT por CW y la integral velocidad-tiempo del tracto de salida del VD (IVTTVSD) mediante PW (fig. 4). Se cuantifica en unidades Woods. RVP=VmaxIT / IVTTSVD×10+0,16.
También se pueden evaluar las RVP de forma semicuantitativa observando la presencia de «muescas» en el espectro PW de la velocidad de flujo en el tracto de salida del VD (fig. 4F-H). Una muesca mesosistólica es indicativa de HTP grave (fig. 4I).
Aplicaciones clínicas en cuidados intensivosLa disfunción aguda del VD es un síndrome heterogéneo, consecuencia de un desacoplamiento entre el VD-AP secundario a entidades con alta incidencia en el paciente crítico4. El desacoplamiento VD-AP se observa generalmente en casos de un rápido aumento de la PAP, en casos de HTP en etapa terminal y con una HTP leve en pacientes con estados inflamatorios pulmonares como SDRA, sepsis e insuficiencia ventricular izquierda, todas ellas condiciones que también están asociadas con efectos inotrópicos negativos. Además, en muchas de estas condiciones los pacientes estarán sometidos a VM, pudiendo intensificar o incluso causar per se un fracaso del VD al provocar un aumento de las RVP. Cuando la VM es usada en pacientes sin patologías cardiorrespiratorias, el volumen corriente no tiene consecuencias hemodinámicas deletéreas. Sin embargo, en presencia de lesión pulmonar, el aumento de la presión transpulmonar aumenta la poscarga del VD y reduce el Tac (fig. 4G).
Hipertensión pulmonar precapilar vs. poscapilarLa causa más común de fracaso del VD es la HTP definida como PAPm≥25mmHg29. El análisis de la IT permite estimar HTP, VmaxIT≤2,8m/s se asocian con una baja probabilidad de HTP, mientras que VmaxIT>3,4m/s se asocian con una alta probabilidad de HTP (fig. 5).
Algoritmo para determinar la probabilidad de presentar hipertensión pulmonar mediante ecocardiografía. a Necesaria la presencia de signos de al menos 2 categorías. b Colapso <50% con la inspiración forzada, <20% con inspiración normal. AD: aurícula derecha; AP: arteria pulmonar; HP: hipertensión pulmonar; PAPs: presión sistólica de la arteria pulmonar; TAPSE: excursión sistólica del plano del anillo tricuspídeo; TSVD: Tracto de salida del ventrículo derecho; VCI: vena cava inferior; VD: ventrículo derecho; VI: ventrículo izquierdo.
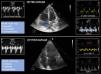
Diagnosticar la causa de la HTP es de vital importancia al determinar el tratamiento adecuado. En este sentido, un primer paso debe diferenciar si la causa es precapilar, presión capilar pulmonar (PCP) ≤15mmHg o poscapilar debido a patología del VI, PCP≥15mmHg. Los hallazgos ecocardiográficos que sugieren una etiología pre- o poscapilar se describen la figura 629. El cálculo de las RVP ayuda en su diferenciación30.
Signos sugestivos mediante ecocardiografía de hipertensión arterial pulmonar pre- y poscapilar. La flecha azul señala el septo interauricular abombado hacia la aurícula izquierda. AI: aurícula izquierda; ePLAR: ecocadiographic pulmonary to left atrial ratio=[VmaxIT/(E/e’) mitral]; HP: hipertensión pulmonar; TSVD: tracto de salida del ventrículo derecho; VI: ventrículo izquierdo.
Un parámetro invasivo que ha demostrado ser útil en la diferenciación de la HTP pre- y poscapilar es el gradiente transpulmonar definido por la diferencia entre la PAPm y la presión de la AI, estimada por la PCP45. Un valor superior a 12mmHg indica un origen precapilar. Recientemente, se ha sugerido que un indicador sustito del gradiente transpulmonar sería la relación ecográfica pulmonar/AI (ePLAR) medido por la relación entre la VmáxIT, como estimado de la presión pulmonar y la relación E/e’ mitral, como estimado de la presión de AI. Valores de ePLAR>0,30m/s serían indicativos de HTP precapilar y <0,25m/s de poscapilar45.
Cor pulmonale agudo y crónicoLa HP precapilar secundaria a una enfermedad pulmonar, hipoxia o una oclusión vascular pulmonar, se conoce clásicamente como cor pulmonale. Dependiendo del tiempo de evolución del aumento de la poscarga del VD, se distingue entre agudo y crónico. El cor pulmonale agudo (CPA) puede ser secundario a un SDRA o TEP y se define por la presencia de dilatación del VD cuantificado por la ratio ATD VD/ ATD VI>0,6 acompañado de movimiento paradójico del SIV46. La forma crónica está causada principalmente por una enfermedad pulmonar obstructiva crónica (EPOC), una fibrosis pulmonar o TEP crónico; todas tienen en común que inducen una hipoxemia crónica y/o una remodelación de la circulación pulmonar47, lo que obliga al VD a adaptarse en compensación por el mayor trabajo mecánico requerido.
Distinguir el CPA del crónico es un desafío en los pacientes críticos; la distinción se basa principalmente en la historia y el examen clínico. Si la ecocardiografía por sí sola es capaz de distinguir una condición de la otra es una respuesta difícil; de hecho, la evidencia actual es escasa y a veces contradictoria.
En general, cuando la poscarga del VD aumenta de forma aguda, los resultados son una dilatación y un deterioro de la función, mientras que cuando el aumento de la presión es gradual, el VD tiene tiempo para adaptarse y es más probable que presente remodelado e hipertrofia48. Sin embargo, el grosor de la pared libre del VD puede duplicarse a las 48h tras del aumento de su poscarga y, por lo tanto, no es un dato del todo específico48.
Hay algunos patrones específicos que pueden ayudar a la distinción, como en el caso del TEP agudo, en el que se puede observar un coágulo en tránsito en la AD o el VD, e incluso en el tronco principal de la arteria pulmonar. Por lo general, el VD es incapaz de generar una presión alta contra los aumentos agudos de la poscarga, por lo que una PAPs>60mmHg sugiere más un proceso crónico. El signo 60/60 y el signo de McConnell, descrito como un vértice del VD relativamente hipercinético en comparación con una pared libre del VD hipocinética o acinética, tienen un alto valor predictivo positivo (VPP) para el diagnóstico de TEP agudo49.
El strain longitudinal global del VI puede ayudar a distinguir entre la forma crónica y la forma aguda50,51. En el contexto agudo, se encuentra alterado, principalmente por el deterioro regional de los segmentos septal, apical y lateral, mientras que, en la enfermedad crónica, el strain longitudinal global del VI se encuentra preservado, con mínima afectación septal.
Síndrome distrés respiratorio agudo (SDRA)Se estima que el 21% de los pacientes con SDRA moderado-grave presentarán CPA51, siendo un factor asociado a una mayor mortalidad52. Teniendo en cuenta que una neumonía como causa del SDRA, una driving pressure ≥18cm H2O, una PaO2/FiO2 <150mmHg y una PaCO2≥48mmHg se han identificado como los factores de riesgo relacionados con el desarrollo de CPA en los pacientes con SDRA no COVID-19 (N-SDRA), se ha desarrollado una puntuación que permite identificar de forma precoz aquellos pacientes en riesgo de CPA, a los que se debería realizar un seguimiento ecocardiográfico8,51.
En los pacientes con SDRA secundario a COVID-19 (C-SDRA) la incidencia de CPA se estima del 18-38%53,54. Sin embargo, los estudios realizados indican que en los pacientes COVID-19 la puntuación de riesgo de CPA no tiene validez, ya que en el C-SDRA, el principal mecanismo asociado al desarrollo de CPA es la presencia de fenómenos tromboembólicos en los vasos sanguíneos pulmonares. Por lo tanto, el hallazgo de CPA en pacientes C-SDRA debería motivar la realización de una tomografía computarizada para descartar la presencia de TEP.
En el CPA, el VD previo a dilatarse por la adaptación homeométrica a la poscarga aumenta la contractilidad para preservar el acoplamiento ventrículo-arterial. Aunque el gold standard para su estudio es la medición de Ees/Ea, el estudio ecocardiográfico mediante la relación TAPSE/PAPs ha demostrado ser un sustituto clínicamente relevante y fiable de las medidas invasivas de Ees/Ea55 (fig. 2). Estudios recientes han demostrado que tanto en el C-SDRA como en el N-SDRA se produce un desacoplamiento VD-AP precoz que podría estar relacionado con el posterior desarrollo de CPA y la mortalidad56,57.
Shock sépticoLa disfunción del VD afecta a un 35% de los pacientes con shock séptico y su fisiopatología es multifactorial, ya que puede deberse a un aumento de la precarga por el exceso de fluidoterapia, una afectación miocárdica directa o al aumento de la poscarga por hipoxemia, hipercapnia o la aplicación de VM.
La disfunción del VD tiene correlación con la mortalidad, aumentando el riesgo más del doble, tanto a corto como a largo plazo58. Estos pacientes presentan cifras de gasto cardíaco y SvO2 más bajas que los pacientes sin disfunción, precisando mayores dosis de vasoactivos y fluidoterapia59. Cabe destacar que este último aspecto puede ser causa o consecuencia, ya que la presencia de disfunción del VD provoca falsos positivos en las pruebas de respuesta a volumen como la variabilidad del VS o de la presión de pulso, induciendo administración errónea de fluidoterapia y por ende balance positivo60.
Aunque se han desarrollado puntos de corte validados para la disfunción VD25, se ha demostrado que tienen una aplicabilidad limitada en pacientes con shock séptico, ya que estos parámetros deben ser contextualizados en las condiciones de precarga y poscarga que pueden verse alteradas de forma dinámica por la utilización de vasopresores, VM y eventualmente, SDRA. En la tabla 5 se muestran los principales estudios ecocardiográficos y los parámetros utilizados para definir la disfunción del VD.
Estudios que han evaluado la relación entre la disfunción del ventrículo derecho y la mortalidad en la sepsis/shock séptico
| Autor/año | Criterio inclusión | N | Tiempo ecografía | Criterio disfunción ventrículo derecho | Incidencia |
|---|---|---|---|---|---|
| Cirulis70, 2018 | Sepsis grave/shock séptico | 146 | 48h | DTD VD/VI>0,9 | 55,5% |
| Furian71, 2012 | Sepsis grave/shock séptico | 45 | 24h | VD-S’ <12cm/s | 31,1% |
| Geri72, 2019 | Análisis post-hoc de Hemosepsis y HemoPred | 360 | 12h | ATD VD/VI>0,8 | 22,5% |
| Mokart73, 2007 | Shock séptico | 45 | 1 día | DTD VD> 30mm+disquinesia septal, VD>VI visual+PAPs>45mmHg | 37,8% |
| Orde2, 2014 | Sepsis grave/shock séptico | 60 | 24h | Criterios ASEa | 71,6% |
| Pulido74, 2012 | Sepsis grave/shock séptico con ETT <24h | 71 | 24h | VD-S’<15cm/s, relación VD/VI, alteraciones regionales de la contracción, opinión de experto | 46,5% |
| Vallabhajosyula75, 2017 | Sepsis grave/shock séptico con ETT <72h | 388 | 72h | Criterios ASEa | 55,1% |
ASE: Sociedad Americana de Ecocardiografía; ATD: área telediastólica; DTD: diámetro telediastólico; ETT: ecocardiografía transtorácica; N: número de pacientes; PAPs: presión sistólica de arteria pulmonar; S’: onda sistólica del Doppler tisular; VD: ventrículo derecho; VI: ventrículo izquierdo.
Criterios de la Sociedad Americana de Ecocardiografía para el diagnóstico de disfunción del ventrículo derecho: criterios semicuantitativos de tamaño y función, Excursión sistólica del anillo tricuspídeo (TAPSE) <16mm, S’ del ventrículo derecho <15 cm/s y Cambio del área de fracción del ventrículo derecho <35%.
Un reciente metaanálisis que evalúa la disfunción del VD y la mortalidad en pacientes con shock séptico encontró que tan solo un TAPSE <16mm se asoció con mayor mortalidad61.
Isquemia del ventrículo derechoLa circulación coronaria del VD presenta peculiaridades distintas a la del VI con flujo en sístole y diástole. El tracto de salida y la pared anterior se irrigan por ramas de la coronaria derecha (CD) y descendente anterior (DA), la pared inferior por la arteria descendente posterior y la pared lateral por la CD. Hasta un tercio de los pacientes con infarto agudo de miocardio (IAM) por lesión en la DA pueden presentar disfunción de VD asociado, debido a la reducción del flujo desde las ramas de la DA a la pared anterior del VD y/o afectación del TIV13. El IAM del VD es usualmente originado por la oclusión proximal de la CD, asociado generalmente a IAM de cara inferior del VI42. La necrosis aislada del VD ocurre <3% de los casos, bien por dominancia izquierda o por oclusión aislada de ramas de la CD62.
En ausencia de hipertrofia y/o HTP, el VD es menos vulnerable a la isquemia que el VI, condicionado por los factores25 descritos en la tabla 6. La severidad de la disfunción depende de la localización de la oclusión de la CD. Por las características descritas anteriormente de resistencia a la isquemia, es común la recuperación espontánea de la disfunción. Por lo tanto, el término IAM de VD incluye un espectro clínico asociado a isquemia transitoria, lesión isquémica o necrosis miocárdica.
Características del ventrículo derecho que determinan su mejor capacidad isquémica
| Menor consumo de oxígeno, debido al menor grosor de su pared miocárdica y contraerse contra un sistema de menor presión |
| Incremento de la extracción de oxígeno en situaciones de isquemia, extrae el 50% en situaciones de reposo |
| Mayor aporte de oxígeno durante el ciclo cardíaco, debido al riego sanguíneo homogéneo desde la arteria coronaria derecha durante sístole y diástole |
| Rápido desarrollo de colaterales tras oclusión de la arteria coronaria derecha, sobre todo provenientes de la arteria de la banda moderadora, rama de la arteria descendente anterior |
| Preservación de la isquemia del infundíbulo, en el 11-30% su perfusión deriva de una arteria independiente con un ostium propio |
Se describen los siguientes parámetros ecocardiográficos de IAM de VD:
- •
TAPSE <10mm tiene un VPP del 75% para el diagnóstico de IAM VD (fig. 3); en dilatación de VD este valor no es fiable, porque aumenta el componente radial.
- •
Doppler color identifica complicaciones mecánicas como rotura de pared, shunt derecha-izquierda a través del foramen oval o IT secundaria por dilatación del anillo y/o isquemia de músculos papilares.
- •
Ś/RIMP. Un nuevo índice que combina el pico de la onda Ś medido por DTI en el anillo tricuspídeo con RIMP mostró buena sensibilidad y especificidad para identificar IAM VD en pacientes con IAM inferior agudo63. Un valor de Ś/RIMP <17 se asocia a disfunción del VD debido a lesión proximal de CD en el contexto de IAM inferior agudo con una sensibilidad del 85% y especificidad del 87%.
- •
Strain/strain rate64. En pacientes con IAM inferior, los valores en segmentos basal y medios de VD son menores cuando se asocian a afectación del VD65.
- •
Ecocardiografía tridimensional. Una FEVD <51% con ECO-3D en paciente con IAM inferior del VI se asocia con compromiso isquémico del VD.
La afectación del VD al ingreso se asocia con peor pronóstico en pacientes con IAM agudo y mayor mortalidad en pacientes con shock cardiogénico66. Su disfunción en pacientes con IAM inferior aumenta los reingresos hospitalarios cuando el parámetro utilizado es TAPSE<15mm62, onda Ś<8cm/s67 o strain longitudinal de VD>22%68.
ConclusiónComprender los mecanismos de la lesión del VD, en particular el desacoplamiento VD-PA, puede informar sobre el tipo y el momento de las intervenciones hemodinámicas y las terapias complementarias aplicadas para proteger y «resucitar» el VD22 (fig. 2). Un enfoque de diagnóstico y monitorización no invasiva a pie de cama puede ayudar a determinar el fenotipo de la lesión del VD y a comprender la respuesta a los tratamientos, a personalizar mejor la asistencia y a enriquecer el pronóstico de las poblaciones de pacientes para futuros estudios.
El tratamiento de la lesión del VD en el SDRA incluye fármacos como agentes vasoactivos que mejoran el acoplamiento VD-PA, vasodilatadores pulmonares para reducir la poscarga y terapias no farmacológicas, como ventilación protectora del VD22, posición prono22 y oxigenación por membrana extracorpórea69.
Conflicto de interesesTodos los autores declaramos no tener conflicto de interés con ninguno de los temas abordados en este capítulo de la serie Puesta al día: «Ecografía en el paciente crítico. Aplicaciones clínicas» de la revista de Medicina Intensiva, ni se ha recibido financiación para la redacción, ni el estudio del manuscrito.
Por último y no menos importante, manifestar el agradecimiento a los editores de la revista de Medicina Intensiva y en especial al anterior redactor jefe, por la realización de la Puesta al día «Ecografía en el paciente crítico. Aplicaciones clínicas» y la invitación para la redacción de este capítulo titulado: «Disfunción del ventrículo derecho en el paciente crítico. Evaluación ecocardiográfica», tema de actualidad con gran utilidad de aplicación en los pacientes críticos, donde se analiza los cambios más relevantes de la evidencia científica en los últimos dos años, con cambios en la monitorización. Agradecer la oportunidad de establecer los parámetros más adecuados en el estudio ecocardiográfico del ventrículo derecho en estos pacientes según la evidencia científica y los cambios en la pauta de ventilación mecánica actual.
El manuscrito ha sido un encargo del Comité Editorial de la revista Medicina Intensiva y los autores han sido seleccionado por este Comité.

















![Signos sugestivos mediante ecocardiografía de hipertensión arterial pulmonar pre- y poscapilar. La flecha azul señala el septo interauricular abombado hacia la aurícula izquierda. AI: aurícula izquierda; ePLAR: ecocadiographic pulmonary to left atrial ratio=[VmaxIT/(E/e’) mitral]; HP: hipertensión pulmonar; TSVD: tracto de salida del ventrículo derecho; VI: ventrículo izquierdo.](https://static.elsevier.es/multimedia/02105691/0000004800000009/v1_202408290622/S0210569124002110/v1_202408290622/es/main.assets/thumbnail/gr6.jpeg?xkr=1dZuESKpnCAWr3yCSGZ24A==)


