La reciente declarada pandemia de COVID-19 por la Organización Mundial de la Salud (OMS) a causa del nuevo coronavirus SARS-CoV-2 identificado en la ciudad de Wuhan (China) en diciembre de 20191, ha conseguido poner a prueba a todos los sistemas de salud mundial. La fisiopatología de esta infección todavía no se conoce con exactitud, y la efectividad de los tratamientos hasta ahora disponibles está aún por demostrar. La insuficiencia respiratoria hipoxémica es causa de la mayoría de los ingresos en las unidades de cuidados intensivos (UCI), con una necesidad de ventilación mecánica invasiva (VMI) de hasta el 88% en algunas series2.
Presentamos el caso de una mujer de 53 años, originaria de Nicaragua y trabajadora en residencia de ancianos, con antecedentes de hipotiroidismo en tratamiento sustitutivo y obesidad con índice de masa corporal de 28kg/m2. Ingresó en nuestra UCI procedente de planta por insuficiencia respiratoria por COVID-19 con sintomatología de 15 días de evolución, habiendo recibido previamente tratamiento con azitromicina, lopinavir/ritonavir, hidroxicloroquina y metilprednisolona a dosis de 1mg/kg/24h. Al ingreso se inició oxigenoterapia de alto flujo con tórpida evolución, requiriendo a las 48h intubación orotraqueal y conexión a VMI por claudicación respiratoria. En ese momento se inició tratamiento con remdesivir durante 10 días. Fue necesario la implementación de medidas como relajación neuromuscular con perfusión de cisatracurio, ventilación en decúbito prono y administración de óxido nítrico inhalado (iNO). A pesar de ello, persistía la imposibilidad de ventilación protectora (Pmeseta >30mbar y driving pressure de 20mbar), manteniéndose la paciente en hipoxemia refractaria (PaO2/FiO2<100) y acidosis respiratoria. Ante esta situación y tras 5 días de VMI, se decidió iniciar tratamiento con membrana de oxigenación extracorpórea veno-venosa (ECMO vv) mediante canulación femoroyugular.
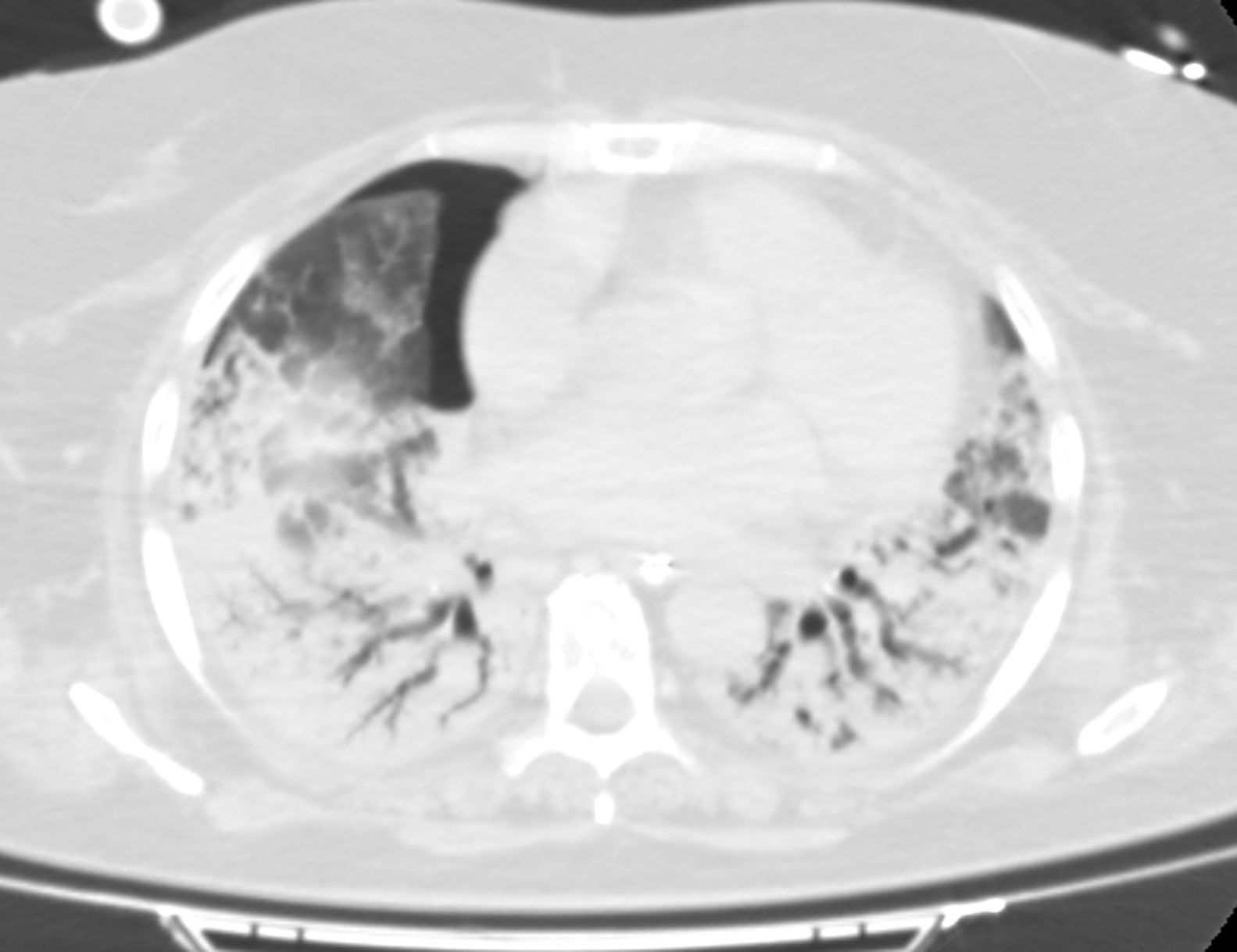
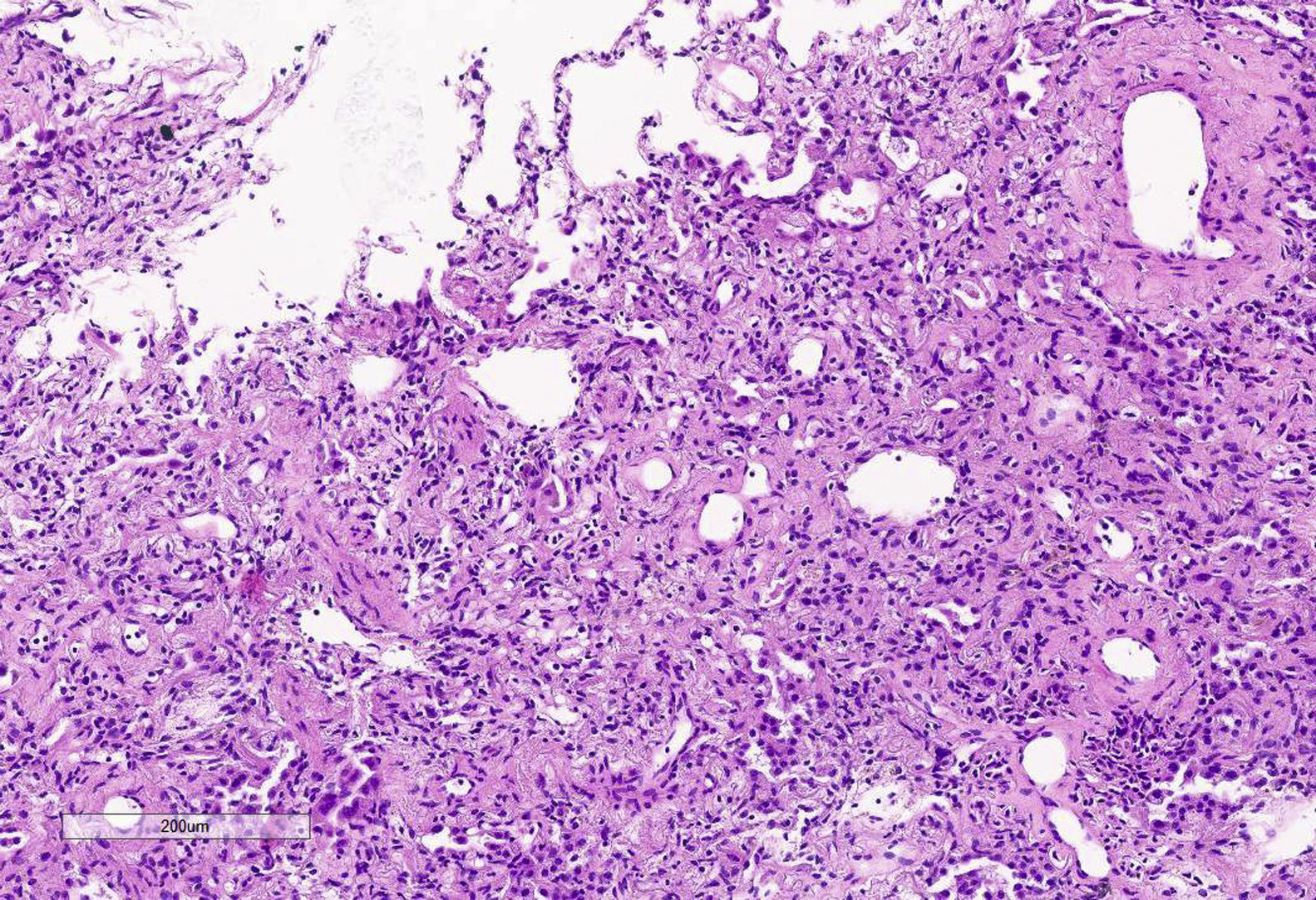
Tras la implementación del ECMO se alcanzaron niveles en rangos de normalizad de PaO2 y PaCO2. Así mismo, se intentó iniciar ventilación ultraprotectora con los siguientes parámetros: volumen tidal (Vt) de 3ml/kg (210ml), frecuencia respiratoria de 10rpm, PEEP 10cmH2O y FiO2 del 30%. Con ello, la presión meseta alcanzada era >30mbar con una compliance dinámica de 5ml/mbar, por lo que en el intento de conseguir una ventilación más protectora se disminuyó el Vt a 130ml Tras 20 días de persistencia de dicho patrón ventilatorio de mal pronóstico se planteó la obtención de imágenes por tomografía computarizada (TC) del tórax y la realización de una criobiopsia pulmonar. En la TC (fig. 1) se apreció extenso broncograma aéreo con pequeñas áreas anteriores de vidrio deslustrado, sin observarse claros signos de fibrosis pulmonar. Cabe destacar el hallazgo fortuito de una pequeña cámara de neumotórax anterior no visualizada en radiografías o ecografías previas que, una vez drenado, no se acompañó de cambios en la dinámica pulmonar. La biopsia pulmonar (fig. 2) mostró un patrón de daño alveolar difuso (DAD) en fase proliferativa y en evolución a fibrosis.
Tras los hallazgos encontrados y en situación de irreversibilidad respiratoria se procedió, previo a la información y conformidad de familiares, a la adecuación del esfuerzo terapéutico y retirada del soporte ECMO tras 28 días de terapia, produciéndose el éxitus de manera inmediata.
El síndrome del distrés respiratorio del adulto (SDRA) se caracteriza por la presencia de edema pulmonar no cardiogénico que condiciona la aparición de hipoxemia e infiltrados bilaterales en la radiografía de tórax. Son diversas las enfermedades que pueden evolucionar a dicho cuadro respiratorio, incluyendo las neumonías virales, como se ha podido observar recientemente en numerosos pacientes con infección por SARS-CoV-2 que han precisado VMI3.
Es conocida la posible evolución del distrés en fases avanzadas hacia una condición de fibrosis pulmonar irreversible4. La valoración con pruebas de imagen mediante TC es importante por tener utilidad pronóstica, al poder orientar sobre la presencia de fibrosis establecida5. Varios estudios han relacionado ciertos hallazgos en la imagen con estadios finales del SDRA y de fibrosis6: «bronquiectasias con áreas de tracción, patrón en vidrio deslustrado, afectación de >80% del parénquima pulmonar, patrón en panal de abeja o signos de presiones elevadas en ventrículo derecho (VD) (dilatación del VD y aumento del diámetro de la arteria pulmonar)». Por el contrario, la presencia de un patrón de consolidación en estadios precoces se asocia a una evolución más favorable7. También se ha descrito correlación entre baja compliance pulmonar y la presencia de reticulaciones y bronquiectasias en la imagen de la TC8.
En nuestra paciente, ante el incierto pronóstico y el patrón restrictivo observado en la consola del ventilador se decidió realizar una TC de tórax que apoyara la sospecha del pésimo pronóstico. Sin embargo, las imágenes radiológicas obtenidas fueron poco concordantes con una dinámica pulmonar restrictiva y fibrosis pulmonar irreversible. El hallazgo de un extenso patrón de consolidación podría ser una limitación para la valoración de fibrosis9, contrastando, por otro lado, con la evolución más favorable referida en revisiones previas7. Por otra parte, podríamos puntualizar que hallazgos de neumotórax en fases tardías del distrés se han asociado a mayor mortalidad10.
Es por ello que, ante este cuadro de evolución todavía desconocida se recurrió a la obtención de una muestra de tejido pulmonar. En la muestra de tejido destacaba una hiperplasia marcada de pneumocitos y prominente engrosamiento de septos alveolares a expensas de fibrosis hialina, con obliteración de luces alveolares. El componente inflamatorio era muy escaso y no se identificaron membranas hialinas ni trombos.
Nos encontramos ante una llamativa disociación histo-radiológica donde la observación al microscopio in vivo de una muestra tisular fue determinante a la hora de la toma de decisiones. Lo novedoso y singular de este caso radica en las imágenes histológicas obtenidas en una situación respiratoria de total incompatibilidad con la vida (compliance 5ml/mbar), siendo posible su obtención in vivo gracias a la asistencia con ECMO.
Con el caso de esta paciente y los datos recabados de su evolución, pretendemos añadir algo de evidencia sobre esta nueva entidad desconocida que ha irrumpido recientemente en nuestra especialidad.