Determinar la relación entre duración y dispersión del QRS con la aparición de arritmias ventriculares en las fases iniciales del infarto agudo de miocardio (IAM).
DiseñoEstudio descriptivo retrospectivo longitudinal.
ÁmbitoHospital General Universitario «Camilo Cienfuegos» de Sancti Spíritus, Cuba. Atención secundaria.
Pacientes o participantesDoscientos nueve pacientes con diagnóstico de IAM con elevación del segmento ST entre enero de 2012 y junio de 2014.
Variables principales de interésSe midieron la duración y dispersión del QT, QTc y QRS del primer electrocardiograma hospitalario y se determinó la presencia de taquicardia/fibrilación ventricular en el seguimiento (estancia hospitalaria).
ResultadosSe detectaron arritmias en 46 pacientes (22%), en 25 (15,9%) estas fueron ventriculares; más frecuentes en el IAM anterior extenso, que fue responsable del 81,8% de las fibrilaciones ventriculares y más de la mitad (57,1%) de las taquicardias ventriculares. La duración del QRS (77,3±13,3 vs. 71,5±6,4ms; p=0,029) y su dispersión (24,1±16,2 vs. 16,5±4,8ms; p=0,019) fue superior en las derivaciones afectadas por la isquemia. Los mayores valores de todas las mediciones se presentaron, con diferencia significativa, en el IAM anterior extenso: QRS 92,3±18,8ms, dQRS 37,9±23,9ms, QTc 518,5±72,2ms y dQTc 94,9±26,8ms. Los pacientes con mayores valores de dispersión del QRS tuvieron más probabilidad de presentar arritmias ventriculares, con puntos de corte de 23,5ms para la taquicardia y de 24,5ms para la fibrilación ventricular.
ConclusionesEl incremento de la duración y dispersión del QRS mostró mayor probabilidad de aparición de arritmias ventriculares en las fases iniciales del IAM que los incrementos del intervalo QTc y su dispersión.
To determine the relationship between QRS duration and dispersion and the occurrence of ventricular arrhythmias in early stages of acute myocardial infarction (AMI).
DesignA retrospective, longitudinal descriptive study was carried out.
SettingHospital General Universitario “Camilo Cienfuegos”, Sancti Spíritus, Cuba. Secondary health care.
Patients or participantsA total of 209 patients diagnosed with ST-segment elevation AMI from January 2012 to June 2014.
Main variables of interestThe duration and dispersion of the QT interval, corrected QT interval, and QRS complex were measured in the first electrocardiogram performed at the hospital. The presence of ventricular tachycardia/fibrillation was assessed during follow-up (length of hospital stay).
ResultsArrhythmias were found in 46 patients (22%); in 25 of them (15.9%), arrhythmias originated in ventricles, and were more common in those subjects with extensive anterior wall AMI, which was responsible for 81.8% of the ventricular fibrillations and more than half (57.1%) of the ventricular tachycardias. The widest QRS complexes (77.3±13.3 vs. 71.5±6.4ms; P=.029) and their greatest dispersion (24.1±16.2 vs. 16.5±4.8ms; P=.019) were found on those leads that explore the regions affected by ischemia. The highest values of all measurements were found in extensive anterior wall AMI, with significant differences: QRS 92.3±18.8ms, QRS dispersion 37.9±23.9ms, corrected QT 518.5±72.2ms, and corrected QT interval dispersion 94.9±26.8ms. Patients with higher QRS dispersion values were more likely to have ventricular arrhythmias, with cutoff points at 23.5ms and 24.5ms for tachycardia and ventricular fibrillation, respectively.
ConclusionsIncreased QRS duration and dispersion implied a greater likelihood of ventricular arrhythmias in early stages of AMI than increased duration and dispersion of the corrected QT interval.
Las arritmias ventriculares constituyen la principal causa de letalidad en las fases iniciales del infarto agudo de miocardio (IAM). Las guías más recientes de la Sociedad Europea de Cardiología, sobre el tratamiento de pacientes con arritmias ventriculares y prevención de la muerte súbita cardiaca, plantean que hasta un 6% de los pacientes con síndrome coronario agudo (SCA) sufren taquicardia o fibrilación ventricular (FV) en las primeras 48h tras la aparición de los síntomas, y que el infarto que se presenta como muerte súbita en esas horas es una de las principales causas de muerte por IAM1.
La fisiopatología de estas arritmias en ese contexto es compleja, por los cambios electrofisiológicos que ocurren en el área isquémica. En el corazón normal, las células M, localizadas en el miocardio medio, muestran una duración del potencial de acción significativamente más prolongada que en el epicardio y el endocardio, existiendo un acoplamiento electrotónico con las capas adyacentes, lo que coincide con el final de la onda T del electrocardiograma (ECG)2. Dicho acoplamiento se altera después de una lesión miocárdica isquémica y permite la expresión de las propiedades intrínsecas de estas células M, que se manifiestan en el ECG de superficie como prolongación del intervalo QT3.
Llois et al.4 encontraron una correlación positiva entre los niveles de troponina y el intervalo QT corregido (QTc), como predictor independiente de eventos clínicos mayores a los 30 días de seguimiento en pacientes con SCA; y otro estudio5 encontró arritmias ventriculares más graves durante la isquemia aguda, así como la presencia de un nuevo SCA, en el seguimiento de pacientes con mayor dispersión del QTc (dQTc). Por tanto, no hay dudas de que mientras mayor sea la heterogeneidad de la repolarización, expresada por la dQTc, existirán más probabilidades de arritmias ventriculares graves; sin embargo, poco se conoce sobre la dispersión del complejo QRS (dQRS).
Los cambios electrofisiológicos presentes en el SCA se manifiestan en el ECG como prolongación del intervalo QT, aumento de la dQTc y de la dispersión del Tpeak-Tend6. Estas alteraciones, a las que se suma la dQRS, hacen que el ECG continúe siendo una herramienta diagnóstica y pronóstica de gran utilidad para el cardiólogo clínico.
Varios estudios han relacionado la dQRS con la aparición de muerte súbita en pacientes con insuficiencia cardiaca7–9, pero ninguno ha evaluado este parámetro en el contexto del SCA. Por estas razones, el objetivo principal de este estudio fue determinar la relación entre la duración y la dispersión del QRS con la aparición de arritmias ventriculares en las fases iniciales del SCA, precisar su rendimiento diagnóstico y establecer los puntos de corte.
Pacientes y métodosSe realizó un estudio descriptivo retrospectivo longitudinal con 209 pacientes de los 241 que ingresaron con diagnóstico de SCA con elevación del segmento ST (SCACEST) en la Unidad de Cuidados Intensivos Coronarios del Hospital General Universitario «Camilo Cienfuegos» de Sancti Spíritus, Cuba, en el período comprendido del 1 de enero de 2012 al 30 de junio de 2014.
Para establecer el diagnóstico y la topografía del SCACEST se utilizaron los criterios de la tercera definición universal de infarto de miocardio10 y de otras investigaciones11,12.
Fueron excluidos 6 pacientes con bloqueo de rama izquierda del haz de His, uno con vía accesoria evidente en el ECG, 15 con datos clínicos y de laboratorio insuficientes, 2 con ECG en mal estado que impidió realizar las mediciones requeridas, 5 con diagnóstico de fibrilación auricular previa al SCACEST, y 3 con enfermedad valvular y miocardiopatía hipertrófica o dilatada. Ninguno de los pacientes incluidos utilizaba tratamiento previo con algún fármaco antiarrítmico que pudiera modificar el QTc.
Análisis del electrocardiogramaSe analizó el primer ECG de 12 derivaciones realizado tras la llegada del paciente al hospital, antes de habérsele realizado cualquier procedimiento de revascularización (trombólisis o intervencionismo coronario percutáneo). Los ECG se obtuvieron a una velocidad de barrido de 25mm/s y una ganancia estándar, con un electrocardiógrafo Cardiocid (ICID, Cuba) que integra un filtro pasa banda que limita el espectro de frecuencias entre 0,05 y 150Hz, y un filtro peine para zumbido eléctrico (hum) a 60Hz.
Dos observadores (autores), con la ayuda de una lente de aumento, midieron de forma manual12,13 e independiente los siguientes parámetros en todas las derivaciones del ECG de cada uno de los pacientes:
- -
QT: Es el QT medido, que corresponde al tiempo en milisegundos (ms) transcurrido desde el inicio del QRS hasta el final de la onda T, definido como el punto de regreso de la onda T a la línea isoeléctrica, o el nadir entre la onda T y la onda U cuando esta estuviera presente13. Se medió en todas las derivaciones y se halló el promedio.
- -
QTc: La medición, según la fórmula de Bazett14, se efectuó en todas las derivaciones y se halló el promedio. Se consideraron anormalmente prolongados los intervalos QTc≥440ms en el hombre y≥460ms en la mujer15.
- -
Dispersión del QT: Diferencia entre el QT máximo y el mínimo de las 12 derivaciones del ECG.
- -
dQTc: Diferencia entre el QTc máximo y el mínimo de las 12 derivaciones del ECG.
- -
Duración del QRS: Tiempo en ms transcurrido desde el inicio de la onda Q o R hasta el final de la R o S.
- -
dQRS: Diferencia entre el QRS máximo y el mínimo de las 12 derivaciones del ECG.
La variabilidad interobservador, mediante la determinación del coeficiente kappa de Cohen, fue escasa, como lo muestran sus valores de sustancial concordancia para cada uno de los parámetros medidos: QT: 0,82; QTc: 0,69; dispersión del QT: 0,74; dQTc: 0,67; duración del QRS: 0,79 y dQRS: 0,73.
Otras variablesAl ingreso de los pacientes en la Unidad de Cuidados Intensivos se obtuvieron sus datos demográficos, los factores de riesgo coronario y la existencia o no de signos de disfunción ventricular izquierda; además, se les realizó un ecocardiograma transtorácico, se obtuvo muestra de sangre para analítica y se continuó el tratamiento del IAM de acuerdo a las recomendaciones de las guías de práctica clínica en el manejo del SCACEST, vigentes en ese momento16–19.
SeguimientoTras 48h de estabilidad clínica y eléctrica los pacientes se trasladaron a la planta de Cardiología hasta el alta hospitalaria, que fue el tiempo de seguimiento posible, debido al diseño retrospectivo del estudio. En las primeras 24h de evolución en esa planta se utiliza telemetría, lo que permitió extender el tiempo de monitorización eléctrica hasta una media general de 78±11h. De las historias clínicas se obtuvieron para su análisis los trazos electrocardiográficos posteriores, en papel o a través del registro digital del evento arrítmico, pues este último, en ocasiones, no fue grabado en papel debido a su corta duración o a la prioridad de otras acciones médicas más decisivas.
Se determinó así la presencia de taquicardia ventricular (TV) o FV, por los criterios electrocardiográficos establecidos1,11,12, y no se consideraron otras arritmias que tuvieran escasa repercusión clínica como las contracciones prematuras de cualquier origen.
Análisis estadísticoSe utilizó una base de datos creada en el paquete estadístico SPSS v.17.0 para Windows. Se comprobó la distribución normal y homogénea de la muestra (p>0,05), lo que permitió realizar pruebas paramétricas.
Se realizó distribución de frecuencias de las variables numéricas en estudio y comparaciones de medias entre muestras relacionadas e independientes. Para comprobar la fortaleza de asociación entre variables cualitativas se empleó la prueba no paramétrica Ji Cuadrado de Pearson y ante situaciones en que más del 20% de las frecuencias esperadas presentaron valores menores de 5 se utilizó la prueba exacta de Fisher. Para comparar las medias de variables cuantitativas se empleó el estadígrafo t de Student para muestras independientes. La validación estadística de los resultados de la investigación adoptó un nivel de significación del 95% (p<0,05) para los grados de libertad previamente fijados en cada una de las circunstancias presentadas.
Para la relación entre las variables continuas asociadas y la ocurrencia de complicaciones, mortalidad, o ambas, así como mortalidad aislada, se calculó su capacidad de discriminación mediante la construcción de curvas ROC y el cálculo del área bajo la curva (índice «c»). Teniendo en cuenta los resultados se determinó un punto de corte para las variables continuas que se incluyó en el análisis univariado.
Como contribución relativa a la determinación de factores de riesgo se hizo un análisis multivariado con un modelo de regresión logística binaria resultando la variable dependiente (dicotómica) la aparición de complicaciones y mortalidad, o ambas, y la presencia de mortalidad aislada. En el análisis multivariado se identificaron como factores propensos a la predicción aquellos aspectos contenidos en las variables para los que el estadígrafo Wald mostró una probabilidad menor al 5% (p<0,05).
Una vez determinadas las variables con significación estadística se procedió a la construcción del score de riesgo asignándose un valor de 1 punto por cada variable con significación estadística. Este score fue aplicado a la población del estudio para, posteriormente, construir las curvas ROC y calcular del índice «c». La calibración del modelo, con el método de Hosmer-Lemeshow, refleja la capacidad para predecir la aparición de complicaciones y mortalidad.
Se determinó el área bajo la curva y el intervalo de confianza mediante curvas ROC, para precisar la variable más relacionada con la aparición de arritmias en la muestra estudiada.
ÉticaLa investigación fue aprobada por el Comité de Ética y el Consejo Científico del hospital (número de registro HCC2015/178) y no se publicaron datos identificativos de los pacientes, no obstante se respetó su confidencialidad durante su manejo.
ResultadosSe estudiaron un total de 209 pacientes, 87 mujeres (41,6%) y 122 hombres (58,4%), con edades medias de 69,9±11,5 y 69,7±10,8, respectivamente.
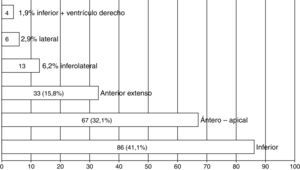
La figura 1 muestra el predominio de pacientes con SCACEST de topografía inferior (41,1%) y anteroapical (32,1%).
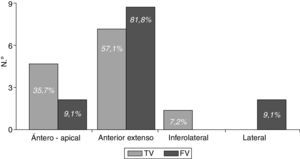
Se detectaron arritmias en 46 pacientes (22%), en 25 (15,9%) estas fueron ventriculares, más frecuentes en el IAM anterior extenso (68,0%); localización que fue responsable del 81,8% de las FV y más de la mitad (57,1%) de las TV (fig. 2). No se presentaron arritmias ventriculares en pacientes con IAM inferior aislado o con toma de ventrículo derecho.
Al comparar varias de las características de los pacientes que presentaron o no arritmias ventriculares (tabla 1) se puede observar que la mayor edad (p=0,013), la presencia de diabetes mellitus (p=0,003), el IAM anterior extenso (p<0,001), el fallo de bomba, clínico (Killip-Kimbal III-IV, p=0,008) o ecocardiográfico (fracción de eyección del ventrículo izquierdo<0,40; p=0,004), no emplear alguna estrategia de revascularización (p<0,001), y las mayores duración y dispersión del QRS y el QTc, se asociaron –con diferencias estadísticamente significativas– a la aparición de TV y FV; mientras que la ausencia de disfunción ventricular (Killip-Kimbal I-II [p=0,008] y fracción de eyección del ventrículo izquierdo>0,50 [p=0,030]) y la aplicación de trombólisis (p=0,001) se asociaron significativamente a una evolución más favorable durante la fase hospitalaria del IAM, con menor incidencia de TV o FV. Por otra parte, la aparición de estas arritmias se asoció a la mortalidad con una diferencia estadística altamente significativa (p<0,001).
Características demográficas, clínicas, electrocardiográficas y del ecocardiograma de los pacientes en estudio
| Variables | Total (n=209) | TV/FV | p | |
|---|---|---|---|---|
| Sí (n=25) | No (n=184) | |||
| Características demográficas | ||||
| Sexo masculino | 122 (58,4) | 13 (52,0) | 109 (59,2) | 0,64 |
| Edad (años) | 69,9±11,1 | 74,6±11,4 | 68,8±10,8 | 0,013* |
| Color blanco de piel | 137 (65,6) | 16 (64) | 121 (65,8) | 0,96 |
| Factores de riesgo | ||||
| Hipertensión arterial | 153 (73,2) | 17 (68) | 136 (73,9) | 0,70 |
| Diabetes mellitus | 67 (32,1) | 15 (60) | 52 (28,3) | 0,003* |
| Hiperlipidemia | 79 (37,8) | 8 (32) | 71 (38,6) | 0,68 |
| Obesidad | 43 (20,6) | 5 (20) | 38 (20,6) | 0,85 |
| Hábito de fumar | 114 (54,5) | 13 (52) | 101 (54,9) | 0,95 |
| Topografía del infarto | ||||
| Anteroapical | 67 (32,1) | 6 (24) | 61 (33,2) | 0,49 |
| Anterior extenso | 33 (15,8) | 17 (68) | 16 (8,7) | <0,001* |
| Inferolateral | 13 (6,2) | 1 (4) | 12 (6,5) | 0,96 |
| Lateral | 6(2,9) | 1 (4) | 5 (2,7) | 0,78 |
| Otros | 90 (43) | 0 (0) | 90 (48,9) | 0,001* |
| Clase de Killip-Kimbal | ||||
| I-II | 141 (67,5) | 9 (36) | 132 (71,7) | 0,008* |
| III-IV | 68 (32,5) | 16 (64) | 52 (28,3) | 0,008* |
| FEVI | ||||
| >0,50 | 88 (42,1) | 5 (20) | 83 (45,1) | 0,030* |
| 0,50-0,40 | 59 (28,2) | 6 (24) | 53 (28,8) | 0,79 |
| <0,40 | 62 (29,7) | 14 (56) | 48 (26,1) | 0,004* |
| Variables electrocardiográficas | ||||
| QRS | 76,6±12,8 | 95,2±17,9 | 72,3±5,6 | <0,001* |
| dQRS | 23,2±15,5 | 42,1±24,5 | 18,9±7,8 | 0,001* |
| QTc | 461,8±68 | 511,4±72,7 | 450,5±73,9 | 0,001* |
| dQTc | 68,0±32 | 91,9±23,3 | 62,5±31,3 | <0,001* |
| Estrategia de reperfusión coronaria | ||||
| Trombólisis | 135 (64,6) | 7 (28) | 128 (69,6) | 0,001* |
| Intervencionismo percutáneo | 43 (20,6) | 4 (16) | 39 (21,2) | 0,73 |
| No | 31 (14,8) | 14 (56) | 17 (9,2) | <0,001* |
| Fallecidos | 26 (12,4) | 18 (72) | 8 (4,3) | <0,001* |
dQRS: dispersión del QRS; dQTc: dispersión del QTc; FEVI: fracción de eyección del ventrículo izquierdo; FV: fibrilación ventricular; TV: taquicardia ventricular.
Los datos expresan n (%) o media±desviación estándar.
Otras variables clínicas y de laboratorio se muestran en la tabla 2 (ver material suplementario), donde se puede observar que los mayores valores de glucemia y creatinina, y los menores de presión arterial sistólica, fracción de eyección del ventrículo izquierdo y filtrado glomerular, tuvieron una asociación estadística altamente significativa (p<0,001) con la aparición de arritmias ventriculares y con la mortalidad.
La zona del IAM fue, desde el punto de vista electrocardiográfico, la que con más frecuencia (183/209; 87,6%) presentó una mayor duración del QRS en los pacientes estudiados (tabla 3), y las medias de duración del QRS (77,3±13,3 vs. 71,5±6,4ms; p=0,029) y de su dispersión (24,1±16,2 vs. 16,5±4,8ms; p=0,019) fueron superiores en las derivaciones afectadas por la isquemia, respecto al resto de las derivaciones (tabla 4).
Máxima medición del QRS en las regiones afectadas por la isquemia según la topografía del infarto
| Topografía | QRS máximo en región afectada | Total (n=209) | |
|---|---|---|---|
| Sí (n=183) | No (n=26) | ||
| Anteroapical | 65 (35,5) | 2 (7,7) | 67 (32,1) |
| Anterior extenso | 30 (16,4) | 3 (11,5) | 33 (15,8) |
| Inferior+VD | 3 (1,6) | 1 (3,8) | 4 (1,9) |
| Inferior | 71 (38,8) | 15 (57,7) | 86 (41,1) |
| Inferolateral | 10 (5,5) | 3 (11,5) | 13 (6,2) |
| Lateral | 4 (2,2) | 2 (7,7) | 6 (2,9) |
VD: ventrículo derecho.
χ2 de Pearson=12,148; p=0,033
Los valores expresan n (%).
Duración del QRS y su dispersión en las derivaciones del ECG con o sin isquemia
| Variable | Derivaciones del ECG | Diferencia de medias | IC 95% | p | ||
|---|---|---|---|---|---|---|
| Con isquemia | Sin isquemia | Inferior | Superior | |||
| QRS, ms (media±DE) | 77,3±13,3 | 71,5±6,4 | 5,8 | 0,5 | 11,0 | 0,029 |
| dQRS, ms (media±DE) | 24,1±16,2 | 16,5±4,8 | 7,6 | 1,2 | 13,9 | 0,019 |
DE: desviación estándar; dQRS: dispersión del QRS; ECG: electrocardiograma; IC: intervalo de confianza.
Los mayores valores de media de las variables electrocardiográficas estudiadas se presentaron, con diferencias altamente significativas, en el IAM anterior extenso (tabla 5 [ver material suplementario]): QRS 92,3±18,8ms, dQRS 37,9±23,9ms, QTc 518,5±72,2ms y dQTc 94,9±26,8ms. En el resto de las zonas topográficas afectadas por la isquemia los valores fueron más cercanos a la normalidad. No obstante, se debe mencionar que le siguió en orden de frecuencia el IAM anteroapical donde se encontró el segundo QRS más ancho (75,7±11,5ms), el segundo QTc más prolongado (476,9±69,6ms) y las terceras dQRS y dQTc.
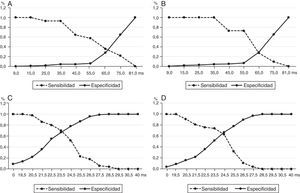
Al analizar el área bajo la curva (tabla 6 y fig. 3), la probabilidad de aparición de cualquier episodio arrítmico ventricular grave, en la población estudiada, fue similar para la dQRS y la dQTc (0,760 vs. 0,768), aunque ambos parámetros mostraron diferencias estadísticas significativas (p<0,001). Sin embargo, cuando se hizo el análisis de forma independiente, estas arritmias ventriculares tuvieron mayor probabilidad de presentarse en los pacientes con valores más elevados de dQRS con respecto a la dQTc: 0,942 vs. 0,660 para la TV y 0,966 vs. 0,852 para la FV.
Áreas bajo la curva e intervalos de confianza correspondientes al análisis de sensibilidad y especificidad
| Tipo de arritmia | Variable | Área bajo la curva | IC 95% | p | |
|---|---|---|---|---|---|
| Inferior | Superior | ||||
| Arritmias | dQRS | 0,760 | 0,652 | 0,869 | <0,001 |
| dQTc | 0,768 | 0,703 | 0,834 | <0,001 | |
| TV | dQRS | 0,942 | 0,868 | 1,000 | <0,001 |
| dQTc | 0,660 | 0,560 | 0,760 | 0,046 | |
| FV | dQRS | 0,966 | 0,942 | 0,990 | <0,001 |
| dQTc | 0,852 | 0,777 | 0,927 | <0,001 | |
dQRS: dispersión del QRS; dQTc: dispersión del QT corregido; FV: fibrilación ventricular; IC: intervalo de confianza; TV: taquicardia ventricular.
Curvas ROC para pronosticar la aparición de arritmias ventriculares con el análisis de la sensibilidad y la especificidad de las dispersiones del QRS y el QTc. A. Para cualquier arritmia ventricular grave. B. Taquicardia ventricular. C. Fibrilación ventricular. ABC: área bajo la curva; dQRS: dispersión del QRS; dQTc: dispersión del QT corregido; IC: intervalo de confianza.
Para establecer un valor de corte que permitiera identificar a los pacientes con mayor riesgo de TV y FV empleamos curvas ROC independientes para cada una de las variables analizadas y encontramos que una dQTc≥65ms era igualmente predictora de TV o FV (fig. 4, A y B); mientras que en la dQRS el punto de corte fue de 23,5ms para TV, con sensibilidad y especificidad del 69 y 67%, respectivamente (fig. 4C); y de 24,5ms para FV (fig. 4D), con similares sensibilidad y especificidad.
DiscusiónLos principales hallazgos de esta investigación han sido a) que hubo más arritmias en los pacientes con mayor área miocárdica isquémica, b) que la duración y la dispersión del QRS fueron significativamente mayores en las derivaciones correspondientes al IAM y c) que la dQRS fue la variable electrocardiográfica más relacionada con la aparición de TV y FV.
Varios autores han explicado la fisiopatología de las alteraciones electrofisiológicas en la isquemia aguda6,20, que son las responsables de los trastornos de la despolarización y la repolarización ventriculares que se detectan por las mediciones electrocardiográficas mencionadas y justifican la presencia de arritmias ventriculares durante el IAM21–26.
La prolongación del intervalo QTc y de su dispersión tiene un elevado valor pronóstico en los inicios del proceso isquémico agudo27 y los mayores retrasos de activación se han demostrado en las zonas discinéticas o acinéticas de los pacientes isquémicos28–30.
Estos retrasos de activación y conducción que se asocian a la presencia de QRS más anchos en el área de la isquemia aguda fueron evidentes en nuestros resultados. Tal es así, que se encontraron mayores duración (anchura) y dispersión de los QRS, con diferencia significativa, en las derivaciones del ECG donde existía supradesnivel del ST, en relación con el resto de las derivaciones que exploraron las regiones miocárdicas no isquémicas. De aquí se deriva que estos retrasos de la conducción en las regiones afectadas prolongan los QRS de forma proporcional a la extensión del territorio isquémico, lo que explica por qué se encontraron mayores valores de QRS en el área isquémica de los pacientes con IAM anterior extenso, seguido en orden de frecuencia por el anteroapical y el inferolateral.
Por otra parte, al existir una causa local suficiente para prolongar el QRS, mayor será la dQRS que afecta las propiedades electrofisiológicas del miocardio como un todo y facilita la aparición de arritmias ventriculares potencialmente letales. De ahí que hayamos encontrado una asociación altamente significativa más evidente entre la dQRS y las arritmias ventriculares (con valores de corte de 23,5ms para TV y 24,5ms para FV) al compararla con la dQTc. Esto no niega, bajo ningún concepto, la capacidad predictiva de riesgo de la dQTc (donde hemos encontrado un valor de corte de 65ms para ambos tipos de arritmia ventricular), pues el QRS forma parte de este intervalo y mientras mayor sea el QRS, mayor será el QT; sin embargo, nuestros resultados demuestran, al comparar ambas variables de forma independiente, que la dQRS fue más útil para predecir este tipo de arritmias. Este resultado puede responder a que el intervalo QT es la representación electrocardiográfica de todo el proceso de despolarización y repolarización ventricular y el QRS solo representa la despolarización31.
El hecho de que aparezcan más complicaciones eléctricas en pacientes con mayores áreas miocárdicas isquémicas y que el QTc prolongado o disperso sea un predictor de riesgo no es nada nuevo; eso está perfectamente demostrado en múltiples investigaciones5,6,12; sin embargo, nunca se había estudiado la dQRS en este contexto.
La dQRS fue estudiada por primera vez en el año 2000 por Anastasiou-Nana et al.7, quienes la relacionaron con la muerte súbita en pacientes con insuficiencia cardiaca congestiva avanzada. Yamada et al.8, en 2004 la consideraron como un potente marcador pronóstico de mortalidad en pacientes con insuficiencia cardiaca congestiva leve a moderada, y en el mismo año, Ma et al.21 la definen como el más potente predictor independiente de muerte súbita cardiaca en pacientes con displasia arritmogénica del ventrículo derecho. Además, Chávez González et al.32 utilizan por primera vez esta variable para evaluar la respuesta a la resincronización cardiaca.
Es importante señalar que no existe ningún otro estudio que relacione la duración y dispersión del QRS con la probabilidad de desarrollar arritmias ventriculares durante el IAM. Los únicos que estudiaron solamente su duración fueron Kirchhof et al.31 y sus resultados fueron contradictorios porque, paradójicamente, concluyeron que el aumento de la duración del QRS aumentaba la dispersión del QT, pero sin relacionarse con la presencia de eventos arrítmicos en los supervivientes de un IAM. Sin embargo, Sheng et al.33 demostraron que la presencia de fragmentación del QRS durante el IAM se asocia con un mayor riesgo de desarrollar arritmias ventriculares malignas a corto plazo; y por otra parte, Bayés de Luna y Elosua34 reconocen la anchura del QRS entre los signos electrocardiográficos relacionados con la muerte súbita durante el IAM, y Hetland et al.6 demostraron que los pacientes que presentaron arritmias ventriculares 40 días después del IAM tenían QRS más anchos que el grupo sin arritmias (114±26 vs. 104±20ms, p=0,05).
El presente estudio demuestra que la probabilidad de presentar arritmias ventriculares durante el IAM es mucho mayor cuando se incrementan la duración y la dispersión del QRS que cuando aumentan las del QTc; por lo cual se sugiere que estamos ante 2 nuevas variables que pueden predecir el riesgo de desarrollar estas arritmias durante las fases iniciales del IAM.
Limitaciones del estudioEl reducido tamaño de la muestra y el consecuente escaso número de pacientes con arritmias ventriculares constituyen la principal limitación del estudio.
ConclusionesLa duración y la dispersión del QRS fueron mayores en las derivaciones electrocardiográficas correspondientes a la isquemia aguda. El incremento de estas variables mostró mayor probabilidad de aparición de arritmias ventriculares en las fases iniciales del IAM que los incrementos del intervalo QTc y su dispersión. A partir de una dQRS de 23,5ms aumenta el riesgo de TV; y el de FV, después de 24,5ms.
Conflicto de interesesLos autores declaran que no existen conflictos de intereses.