INTRODUCCIÓN
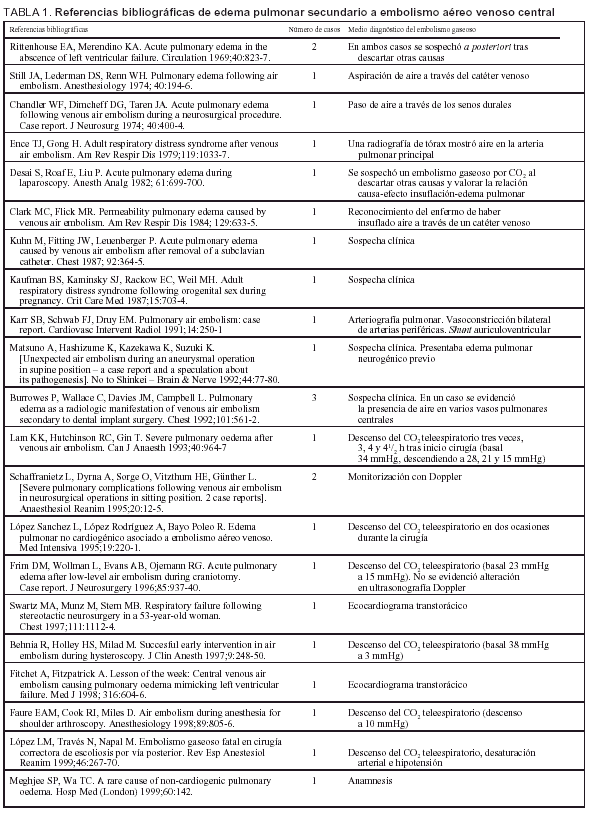
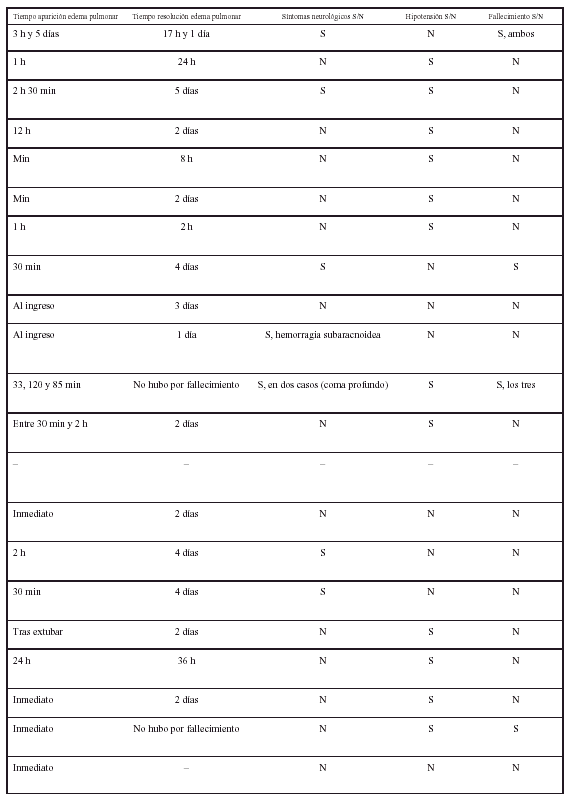
El embolismo gaseoso es una entidad relacionada con numerosas situaciones clínicas. Tanto a escala venosa como arterial el émbolo gaseoso puede precipitar situaciones de emergencia médica dramáticas aunque son raras las ocasiones en que la cuantía del volumen gaseoso es suficiente para generarlas. El embolismo aéreo venoso central (EAVC) es una entidad infradiagnosticada ya que la mayor parte de los émbolos son de escasa significación clínica1. La repercusión clínica es variable así como las complicaciones desarrolladas. Describimos un caso de embolismo gaseoso que en su evolución posterior desarrolló edema agudo de pulmón, revisando aspectos de la fisiopatología, tratamiento y prevención.
CASO CLÍNICO
Se trata de un varón de 32 años sin antecedentes clínicos. Presentaba tinnitus e hipoacusia izquierda de un año de evolución, sin otra sintomatología acompañante. Mediante un estudio de resonancia magnética nuclear se evidenció la existencia de una lesión de 1 ×1,5 cm a nivel del ángulo pontobulbocerebeloso sugestiva de neurinoma del acústico.
Fue intervenido quirúrgicamente, realizándose craniectomía retromastoidea en posición sedente, con exéresis microquirúrgica de la lesión. Se monitorizó el ritmo electrocardiográfico, la presión arterial mediante técnica invasiva, la presión venosa central, la saturación de oxígeno por pulsioximetría (SaO2), el valor de CO2 teleespiratorio (ETCO2), la diuresis y los parámetros respiratorios. El mantenimiento anestésico se realizó con O2/aire, sevoflurano y perfusiones de fentanilo y rocuronio.
Durante el transcurso de la intervención se evidenció una disminución brusca del ETCO2, desde 30 mmHg a 14, sin modificación de la SaO2 ni repercusión hemodinámica, coincidiendo con un pequeño desgarro a nivel del seno transverso. Ante la sospecha de EAVC se aumentó la FiO2 a 1, se colocó al paciente en posición de Trendelemburg y decúbito lateral izquierdo, irrigándose el campo quirúrgico. Se aspiró a través del acceso venoso central, extrayendo burbujas de aire. El ETCO2 volvió a los valores previos y la intervención quirúrgica prosiguió, sin más incidencias, siendo trasladado posteriormente a la unidad de cuidados intensivos (UCI), según protocolo habitual.
A su llegada a la UCI el paciente estaba sedorrelajado conectándose a ventilación mecánica, manteniendo una SaO2 del 100% con FiO2 de 0,4. La exploración física y las determinaciones analíticas convencionales no demostraron hallazgos patológicos.
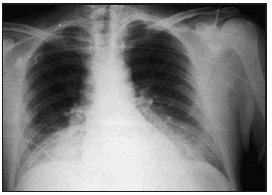
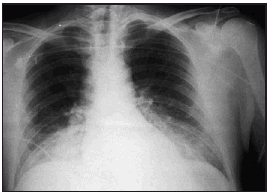
Pasadas 4 h el paciente presentó una disminución de la SaO2 al 91% con la misma FiO2. La auscultación pulmonar fue normal, con murmullo vesicular conservado bilateralmente. Se realizó una radiografía de tórax que demostró un infiltrado alveolointersticial bilateral no presente en la radiografía preoperatoria. Una gasometría arterial demostró: pH 7,28, PaCO2 40 mmHg, PaO2 73 mmHg, HCO3 18 mEd/l, SaO2 del 91%. Ante la sospecha de un edema agudo de pulmón secundario a EAVC se aumentó la concentración de oxígeno (FiO2 1) y se administró dosis de 250 mg de metilprednisolona.
Se realizó una ecocardiografía que demostró una contractilidad cardíaca normal. No se apreció la presencia de burbujas de aire en aurícula o ventrículo derechos y tracto de salida de este último. La presión venosa central fue normal. Las enzimas cardíacas (CPK y LDH) sufrieron una movilización ligera. No se observaron cambios electrocardiográficos.
El paciente evolucionó favorablemente, mejorando la SaO2, siendo posible disminuir la FiO2 a 0,4 y proceder a la extubación en las horas siguientes. Fue dado de alta a planta a las 24 h de su ingreso en UCI. En planta de neurocirugía se realizó una radiografía de tórax de control en la que el infiltrado había desaparecido.
DISCUSIÓN
La incidencia real del EAVC es difícil de establecer debido a que la mayoría de los casos se producen de manera subclínica, y a que la posibilidad de hacer un diagnóstico correcto está condicionada por el grado de monitorización empleado en el momento en que se produce el embolismo, el volumen de gas que pasa al torrente circulatorio y la magnitud clínica del cuadro. Puede producirse en relación con procesos quirúrgicos, traumatismos, procedimientos diagnósticos o procedimientos terapéuticos1,2. Un estudio retrospectivo sobre 432 pacientes en los que se realizó cirugía de resección de un neurinoma del acústico3 demostró 74 casos (17,1%) de EAVC. El diagnóstico se realizó mediante monitorización del ETCO2, Doppler precordial o ecocardiografía transesofágica. La incidencia de EAVC fue del 28,4% entre los 222 pacientes en los que la intervención se realizó en posición sedente, y del 5,2% entre los restantes 210 pacientes. Se produjo edema de pulmón secundario al EAVC en un solo paciente (1,3%). Se produjo hipotensión intraoperatoria en el 9,4% de los casos con EAVC.
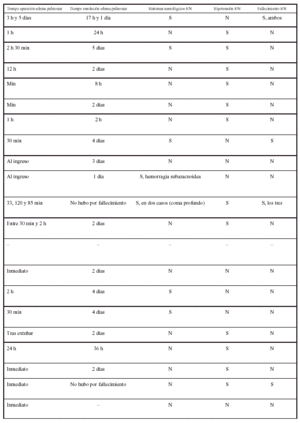
En nuestro caso, el EAVC se sospechó cuando la capnografía delató un descenso del ETCO2 sin alteraciones hemodinámicas, acorde con otros casos referidos en la bibliografía (tabla 1). Esta técnica es menos sensible que el Doppler precordial o la ecocardiografía transesofágica3, pero está más en relación con el volumen de gas embolizado, es decir, que estas últimas serán capaces de evidenciar la presencia de burbujas de gas que no tendrán trascendencia clínica, aunque su detección permitiría prevenir eventos mayores. No se conoce la cantidad de aire que puede desencadenar un episodio clínicamente grave, e incluso letal, de EAVC. Se considera que oscila entre 200-300 ml y se ha comunicado un caso de fallecimiento en relación a la inyección de 200 ml de aire4, aunque no es posible saber si esa es la cantidad mínima requerida y si también influye el estado cardiovascular previo. La ecocardiografía transesofágica es la técnica más sensible para detectar burbujas de gas circulantes1, pero los episodios que detecta y que no recoge el Doppler precordial no tienen trascendencia clínica. Como además la primera técnica es más dependiente del operador, la vigilancia conjunta mediante ETCO2 y Doppler precordial se describe como la monitorización más adecuada1.
En nuestro caso no se evidenció inestabilidad hemodinámica. En la serie presentada por Duke et al el 9,4% de los pacientes con EAVC presentaron hipotensión3.
Se ha descrito la presentación de edema pulmonar no cardiogénico como único síntoma de EAVC subclínico5. También se ha evidenciado la presencia de edema pulmonar en pacientes que han sobrevivido a una EAVC. Desde la publicación de los dos primeros casos de edema de pulmón en pacientes que habían padecido un embolismo aéreo (Rittenhouse et al), se han descrito en la bibliografía algo más de 30 casos, los últimos en series del año 1999. En la tabla 1 se expone la mayoría de casos publicados, con las principales características clínicas.
La aparición del edema alveolar parece estar en relación con la distribución de burbujas de aire en la circulación pulmonar que producen una respuesta inflamatoria aguda en su microvascularización. En esta respuesta intervienen leucocitos polimorfonucleares activados que liberan metabolitos tóxicos de oxígeno que inducen un daño en las uniones de las células endoteliales y la lámina basal, y muestran un aumento secundario de permeabilidad1,2,5, mientras que las propias células endoteliales, capilares y alveolares, parecen respetadas . Se han encontrado datos sugerentes de que los derivados de la ciclooxigenasa6, la concentración intracelular del adenosín monofosfato cíclico (AMPc) y Ca++ citosólico7 son algunos de los mecanismos que desempeñan un importante papel en la fisiopatología del edema pulmonar secundario.
Experimentalmente se ha demostrado que un EAVC produce hipertensión arterial pulmonar e incremento de la resistencia arterial pulmonar, sin afección de la presión de la aurícula izquierda, así como una forma reproducible de edema pulmonar no cardiogénico8. Cheney et al no encontraron relación entre el desarrollo de hipoxia alveolar regional y la formación del edema9.
En nuestro caso no sospechamos ningún otro factor que contribuya a la presentación de edema alveolar. No se evidenció sobrecarga hídrica, ni hubo evidencia de fracaso cardíaco, aunque no se puede descartar de manera absoluta que existiera aumento de presión hidrostática en el capilar pulmonar porque no se realizó cateterización de la arteria pulmonar y no se puede disponer de medidas de la presión de enclavamiento pulmonar. La rápida resolución del compromiso alveolocapilar concuerda con la mayoría de casos descritos.
El tratamiento más eficaz es la rápida instauración de medidas para resolver el EAVC. Evitar la nueva entrada de aire e intentar retirar el aire de las cavidades derechas si se dispone de un catéter venoso central. La posición en decúbito lateral izquierdo ha sido útil en algunos casos al desplazar la burbuja de aire del tracto de salida del ventrículo derecho. Puede precisarse soporte hemodinámico agresivo. Los émbolos que se han desplazado al territorio vascular pulmonar pueden disminuir de tamaño ventilando al paciente con oxígeno puro para facilitar la retirada de nitrógeno, gas inerte de escasa solubilidad. Si se ha usado anestesia general con óxido nitroso éste debe ser retirado porque aumenta el tamaño de las burbujas gaseosas. También se ha propuesto el uso de oxígeno hiperbárico. Dado que las lesiones que conducen a la formación de edema alveolar dependen de fenómenos inflamatorios causados por radicales de oxígeno se ha propuesto el uso de corticosteroides de manera precoz para su tratamiento10, aunque no hay datos concluyentes. No existiendo un tratamiento estándar basado en la evidencia y ante el súbito deterioro del enfermo, utilizamos estas medidas por no poder prever las consecuencias que este deterioro pudiera ocasionar, dada la baja incidencia de esta enfermedad.
Figura 1. Radiografía del paciente del caso clínico en la que se muestra un infiltrado alveointersticial bilateral, compatible con edema pulmonar.
Creemos que debería establecerse una monitorización sistemática en cualquier intervención donde exista la posibilidad de comunicación entre el exterior y el sistema circulatorio venoso central, donde la diferencia de presiones favoreciese la entrada de aire a éste. En algunas intervenciones neuroquirúrgicas sería útil la monitorización conjunta mediante ETCO2 y Doppler precordial.