La administración de filgrastim (r-metHuG-CSF) en pacientes con neumonía y sepsis grave no disminuye la mortalidad a los 29 días.
Artículo: Root RK, Lodato RF, Patrick W, Cade JF, Fotheringham N, Milwee S, et al, for the Pneumonia Sepsis Study Group. Multicenter, double-blind, placebo-controlled study of the use of filgrastim in patients hospitalized with pneumonia and severe sepsis. Crit Care Med 2003;31:367-73.
Antecedentes: el filgrastim (factor estimulante de las colonias formadoras de granulocitos) es una citocina cuya producción endógena aumenta rápida y precozmente en presencia de una infección. Se han descrito efectos locales y sistémicos. A escala local favorece la acumulación de leucocitos y la fagocitosis tendentes a la erradicación de los patógenos. A escala sistémica el principal efecto es antiinflamatorio e inmunosupresor.
Las observaciones procedentes de modelos animales de neumonía muestran que su administración aumenta la producción de los neutrófilos y mejora la supervivencia. Sin embargo, su eficacia y su seguridad no han sido evaluadas en enfermos con neumonía grave.
Objetivo: estimar el efecto sobre la mortalidad de la administración de filgrastim en pacientes con neumonía y sepsis.
Diseño: ensayo clínico con asignación aleatoria.
Lugar: estudio multicéntrico realizado en 96 hospitales de Estados Unidos, Canadá, Australia y Europa.
Período de estudio: abril 1996 a diciembre 1998.
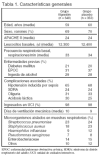
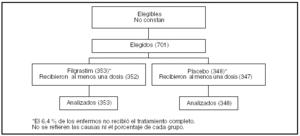
Pacientes (tabla 1 y fig. 1)
Figura 1.
Criterios de inclusión: 1. Edad > 18 años.
2. Infiltrados radiológicos compatibles con neumonía bacteriana (comunitaria o nosocomial).
3. Hemocultivo positivo o cultivo positivo de una muestra respiratoria obtenida mediante cepillado protegido o lavado broncoalveolar (en enfermos ventilados ≥ 3 días).
4. Fiebre ≥ 38 °C.
5. Taquipnea > 20 respiraciones/min o necesidad de ventilación mecánica.
6. Taquicardia > 90 lat/min.
7. Criterios de sepsis grave definida como disfunción de un órgano o más.
Criterios de exclusión: 1. Embarazo o lactancia.
2. Expectativa de vida menor de 72 h.
3. Shock cardiogénico como diagnóstico primario.
4. Hemorragia no controlada.
5. Quemaduras profundas o químicas > 20% de la superficie corporal.
6. Recuento de leucocitos > 40.000/μl.
7. Clase funcional IV de la NYHA.
8. Instrucciones de no resucitación.
9. Hipersensibilidad conocida a productos derivados de Escherichia coli.
El 80 % de los enfermos tenía neumonía comunitaria. Se refiere que el porcentaje fue similar en ambos grupos.
Intervenciones que se comparan:
Grupo filgrastim: administración precoz de 300 μg/día de filgrastim en 30 min durante 5 días o hasta que el recuento de leucocitos fuese > 75.000/μl, o hasta el día que se suspendiera el tratamiento antibiótico.
Grupo placebo: administración de placebo en un vial idéntico al filgrastim y con la misma duración.
La administración se realizó en las primeras 24 h en que los enfermos cumplieran los criterios de inclusión y en las primeras 4 h tras la asignación aleatoria.
Asignación aleatoria: sí. No consta si se mantuvo oculta.
Enmascaramiento: en el texto se refiere como doble ciego. Aunque el incremento en el recuento de leucocitos diferenciara a ambos grupos, y afectara al enmascaramiento, este hecho no debe modificar la estimación del efecto sobre la mortalidad.
Desenlaces principales: mortalidad a los 29 días.
Análisis por intención de tratar: sí.
Resultados principales (tabla 2):
Los autores refieren que los efectos adversos con una diferencia en la incidencia entre los 2 grupos > 2% fueron: insuficiencia renal, síndrome de distrés respiratorio del adulto (SDRA), hipotensión, parada cardíaca y acidosis, pero no comunican en qué grupo la incidencia fue superior.
Información sobre costes: no consta.
Financiación del estudio: financiado por Amgen.
Conclusiones de los autores: la administración de filgrastim a pacientes con neumonía y sepsis grave no es eficaz en la reducción de la mortalidad.
Conclusiones de los revisores: las conclusiones de los autores están basadas en los resultados obtenidos.
La eficacia de filgrastim se ha estimado adecuadamente en enfermos que reciben quimioterapia mielosupresora y en enfermos con neutropenia crónica. Los ensayos clínicos en estos grupos de pacientes1 han mostrado una reducción en el tiempo de duración de la neutropenia y en la incidencia de infecciones, pero no en la mortalidad. Por tanto, con independencia de otras indicaciones, no se ha documentado de forma apropiada que el uso de filgrastim reduzca la mortalidad en ninguna situación clínica.