Editado por: Federico Gordo - Medicina Intensiva del Hospital Universitario del Henares (Coslada-Madrid)
Última actualización: Octubre 2023
Más datosEl aumento global de infecciones causadas por bacilos gram-negativos multi-resistentes (BGN-MR), lo cual incluye a los carbapenemes, supone uno de los grandes retos actuales en materia de sanidad. Esto incluye Enterobacterales productores de β-lactamasas de espectro extendido, productoras de AmpC desreprimida o Enterobacterales productores de carbapenemasas, así como BGN-MR no fermentadores como Pseudomonas aeruginosa o Acinetobacter baumannii. En Pseudomonas aeruginosa predominan otros mecanismos de resistencias diferentes a las β-lactamasas tales como bombas de expulsión o pérdida de porinas. A. baumannii presenta con frecuencia varios de estos mecanismos de resistencia. La mortalidad es elevada especialmente si el tratamiento empírico es inadecuado. En este capítulo se revisan las estrategias de tratamiento haciendo hincapié en las herramientas para identificar los pacientes en los que estaría justificado tratamiento antibiótico empírico para cubrir BGN-MR, la importancia de la optimización de la administración de estos antibióticos, así como las estrategias de prevención para evitar su diseminación desde pacientes colonizados o infectados por un BGN-MR.
The rise of infections caused by multi-resistant gram-negative bacilli (MR-GNB), which includes carbapenems, represents one of the major current challenges worldwide. These MR-GNB include extended spectrum β-lactamase-producing Enterobacterales, derepressed AmpC-producing or carbapenemase-producing Enterobacterales as well as non-fermenting Gram-negative bacilli such as Pseudomonas aeruginosa or Acinetobacter baumannii. P. aeruginosa predominantly exhibits other resistance mechanisms different to β-lactamases such as expulsion pumps or loss of porins. A. baumannii frequently presents several of these resistance mechanisms. Mortality is high especially if empirical treatment is inadequate. In this review, treatment strategies are revised, describing the tools available to identify patients in whom empirical antibiotic treatment would be justified to cover MR-GNB, the importance of optimizing the administration of these antibiotics, as well as prevention strategies to avoid its spread from patients colonized or infected by a MR-GNB.
La resistencia a los antibióticos es uno de los principales problemas de salud a los que nos enfrentamos hoy en día, y así es considerado por la Organización Mundial de la Salud. Un informe reciente prevé que casi 300 millones de personas morirán en las próximas décadas como resultado directo de la resistencia a los antimicrobianos. Más en concreto, para el año 2050, se estima que fallecerán 3 millones de personas por infecciones causadas por E. coli muti-resistente y que las infecciones serán la primera causa de mortalidad, por encima del cáncer1. En Europa, un estudio epidemiológico realizado durante 2015 estimó una incidencia de 131 infecciones causadas por bacterias multi-resistentes (BMR) por 100.000 habitantes, ocasionando una mortalidad atribuible de 6,44 fallecidos por 100.000 habitantes (mortalidad atribuible superior a 33.000 personas) y causando la pérdida de 170 años de vida ajustados por discapacidad por 100.000 habitantes2.
Aunque dicho problema afecta a la mayoría de las bacterias y otros patógenos como los hongos es, sin lugar a dudas, el desarrollo de resistencias por parte de los bacilos gram-negativos (BGN) el que ha generado un mayor nivel de alarma entre la comunidad científica. Esto incluye Enterobacterales productores de β-lactamasas de espectro extendido (BLEE), productoras de AmpC desreprimida o Enterobacterales productores de carbapenemasas (EPC), así como BGN no fermentadores multi-resistentes como Pseudomonas aeruginosa y Acinetobacter baumannii3.
El aumento global de EPC es alarmante y representa una amenaza cada vez mayor para los cuidados sanitarios y la seguridad de los pacientes. En los últimos años, la situación epidemiológica de la EPC ha empeorado considerablemente, en particular por la rápida propagación de Enterobacterales productores de Klebsiella pneumoniae carbapenemasa (KPC), de oxacilinasa 48 (OXA-48) o productores de metalo-β-lactamasas. Así, en 2015, 13 de 38 países europeos notificaron una propagación interregional de la EPC o una situación endémica, mientras que en 2013 solo 6 de 38 países reportaron esta situación4.
Además, continúa siendo un problema Pseudomonas aeruginosa, un BGN no fermentador con elevada capacidad para desarrollar resistencias. A esto hay que añadir Acinetobacter baumannii, un patógeno que causa fundamentalmente infecciones nosocomiales y que se caracteriza por su gran persistencia en el medio ambiente que le permite propagarse rápidamente y por su extraordinaria capacidad de desarrollar resistencia a todos los antimicrobianos convencionales y a algunos biocidas5.
Epidemiología de la multi-resistencia en bacilos gram-negativos en las unidades de cuidados intensivosLa resistencia a los β-lactámicos incluyendo los carbapenemes en el caso de Enterobacterales resulta principalmente por la expresión de enzimas inactivadoras de antibióticos (β-lactamasas), aunque también pueden estar implicados mecanismos no enzimáticos (bombas de expulsión o pérdida de porinas). Estas β-lactamasas pueden surgir de mutaciones en genes cromosómicos, pero con mayor frecuencia se originan por la transferencia horizontal de elementos genéticos móviles a través de plásmidos o transposones6.
Por el contrario, en P. aeruginosa predominan otros mecanismos de resistencias diferentes a las β-lactamasas tales como bombas de expulsión o pérdida de porinas7. Un estudio reciente realizado en España y que analizó 1.445 muestras clínicas de P. aeruginosa, solo en el 3,1% de los aislados se detectó una β-lactamasa de espectro extendido o una carbapenemasa, siendo el tipo VIM la más frecuentemente identificada. Por el contrario, si fue más frecuente la presencia de AmpC des-reprimida que se observó en el 8,3% de los aislados8. En cuanto a A. baumannii, este posee mecanismos de resistencia innatos frente a múltiples antimicrobianos en su genoma central. Además, las cepas pueden fácilmente adquirir nuevos determinantes de resistencia a través de varios elementos genéticos móviles. Casi todos los mecanismos de resistencia a los antimicrobianos se han descrito incluyendo inactivación enzimática, alteración de las dianas bacterianas, barreras de permeabilidad para la absorción de antimicrobianos o bombas de expulsión activas. En cuanto a los mecanismos de resistencia a carbapenemes, los más frecuentes son la presencia de carbapenemasas, especialmente metalo-β-lactamasas de la clase VIM, así como de β-lactamasas de la clase D, principalmente OXA-23 y OXA-585,7.
En cualquier caso, la incidencia de BGN multi-resistentes (BGN-MR) es un problema generalizado y en aumento en los últimos años. En una encuesta realizada entre intensivistas europeos en el año 2017, el 12,4% de los participantes respondieron haber tratado en los últimos 6 meses al menos una infección causada por una bacteria resistente a casi totalmente resistente a todos los antibióticos9. Un estudio multicéntrico realizado en 116 unidades de cuidados intensivos (UCI) en los 5 continentes analizó los datos de 1.156 pacientes con bacteriemia nosocomial (aislándose un total de 1.317 patógenos) se encontró resistencia a carbapenemes en el 69% de Acinetobacter spp. (el 71,3% fue calificado como extremadamente resistente), el 38% de Klebsiella pneumoniae el 71,3% fue calificado como extremadamente resistente, el 37% de Pseudomonas spp., 5,7% de Enterobacter spp. y el 1% de Escherichia coli10.
En un ensayo clínico realizado en España, Italia y Grecia que aleatorizó pacientes con neumonía asociada a ventilación mecánica (NAVM) con alto riesgo de BGN-MR, se aislaron 212 bacterias, principalmente BGN (82%). Los patógenos más frecuentes fueron P. aeruginosa, A. baumannii y K. pneumoniae. De ellos, el 38,1% eran resistentes a carbapenemes y el 12,4% eran resistente a la colistina11. De los 65 aislamientos en muestra respiratoria de A. baumannii que hubo en este ensayo clínico, todos menos 2 (97%) fueron resistentes a carbapenemes, y estos siempre estuvieron asociados con una carbapenemasa adquirida, principalmente OXA-23 (80%). Es importante resaltar que la resistencia a la colistina en estos A. baumannii fue del 47,7%12.
Pronóstico de las infecciones causadas por bacilos gram-negativos multi-resistentesDiversos autores han demostrado que estas infecciones especialmente cuando afectan al enfermo crítico tienen una elevada morbimortalidad. En un estudio sobre la prevalencia y pronóstico de las infecciones de la UCI (62% debidas a BGN-MR), la mortalidad de los pacientes infectados fue más del doble que en los no infectados (25 vs. 11%). En este trabajo, tras ajustar por variables de confusión, infecciones causadas por Klebsiella spp. resistente a los β-lactámicos (incluyendo carbapenemes) y A. baumannii resistente a carbapenemes se identificaron como factores independientes de mortalidad hospitalaria13.
La mortalidad de la bacteriemia por un BGN resistente a carbapenemes en una cohorte de pacientes críticos fue el doble que en el grupo control que no presentó bacteriemia (49,3 vs. 25,6%) siendo un factor independiente de mortalidad tras ajuste por variables de confusión. También ocasiona un incremento de la estancia hospitalaria (mediana de 30 vs. 12 días) con el consiguiente aumento del costo por hospitalización14. Además, señalar que la mortalidad por bacteriemia causadas por EPC es, tras ajustes de las variables de confusión, 4 veces superior a la mortalidad asociada a episodios de bacteriemia causadas por EPC, pero con otros mecanismos de resistencia pues no producían carbapenemasa15.
En un estudio multicéntrico realizado en 137 UCI italianas se comparó el impacto en el pronóstico de infecciones por K. pneumoniae multisensible, K pneumoniae productoras de BLEE y K. pneumoniae resistentes a carbapenemes (el principal foco fue pulmonar seguido de intra-abdominal). Las infecciones por K. pneumoniae resistentes a carbapenemes presentaban un incremento de mortalidad del 20% respecto a la mortalidad predicha, lo cual era especialmente evidente en pacientes con alto riesgo de mortalidad (riesgo predicho superior al 32%) lo cual no se observó en el caso de aislamientos sensibles a carbapenemes, pero productores de BLEE16.
Factores de riesgoEstudios epidemiológicos han demostrado la relación directa entre el uso de antibióticos y el desarrollo de resistencia a los mismos por parte de los BGN. Esto ha sido demostrado en el caso de CPE17,18, Pseudomonas19–21, Acinetobacter spp19,22–24. Se sabe que por cada día de exposición adicional a antibióticos β-lactámicos antiseudomonales, el riesgo de aparición de una nueva resistencia aumenta desde un 2% para meropenem hasta un 8% para cefepima o piperacilina/tazobactam25. No obstante, los mecanismos de desarrollo de resistencia por parte los BGN son complejos y esta relación entre el uso de ciertos antibióticos y la aparición de resistencia no siempre ocurre26.
Por otro lado, el perfil de pacientes que desarrollan infección por BGN-MR incluye enfermos vulnerables, con largas estancias y uso previo de antibioterapia de amplio espectro. Los factores de riesgo más frecuentemente identificados se resumen en la tabla 1.
Factores de riesgo más frecuentemente identificados para infecciones por bacilos gram-negativos multi-resistentes
| - Edad avanzada |
| - Colonización previa (especialmente por A. baumannii y Enterobacterales productores de BLEE y carbapenemasas) |
| - Paciente institucionalizado |
| - Gravedad subyacente |
| - Inmunosupresión |
| - Ingreso urgente |
| - Ingreso por fallo respiratorio |
| - Antibioterapia previa (uso previo de carbapenemes para BGN resistente a los mismos) |
| - Múltiples procedimientos invasivos |
| - Larga estancia en la UCI |
BGN: bacilo gram-negativo; BLEE: β-lactamasa de espectro extendido; UCI: unidad de cuidados intensivos.
Dos aspectos claves en el éxito del tratamiento antibiótico de las infecciones graves son la precocidad del tratamiento adecuado y la correcta dosificación para lograr niveles terapéuticos especialmente en el sitio de la infección.
En un estudio multicéntrico que analizó 1.156 episodios de bacteriemias adquiridas en el hospital, la incidencia de BMR y extremadamente resistentes fue del 48 y del 21%, respectivamente. En el modelo multivariante, el aislamiento de BMR y el foco no controlado fueron predictores independientes de 28 días mortalidad, mientras que la precocidad del tratamiento se identificó como un protector de mortalidad10. El tiempo hasta la antibioterapia adecuada fue un factor independiente de mortalidad en pacientes con bacteriemia por K. pneumoniae productora de KPC. La mediana de tiempo de inicio de tratamiento adecuado desde la extracción del hemocultivo fue de 8,5h en los pacientes que sobrevivieron y de 48h en los que fallecieron en los 30 días siguientes27.
Identificación de pacientes subsidiarios de recibir tratamiento antibiótico empírico para cubrir bacilos gram-negativos multi-resistentesEn cuanto a la elección de los antibióticos a emplear en el tratamiento empírico para que este sea adecuado, la dificultad es identificar qué pacientes pueden sufrir una infección causada por un BGN-MR, y así utilizar antibióticos activos frente a dicho patógeno. Para ello, el clínico tiene 3 posibles herramientas: conocimiento de si el paciente está colonizado por alguna de estos BGN-MR, las técnicas microbiológicas de diagnóstico rápido y los algoritmos basados en la inteligencia artificial.
Está bien establecida la relación existente entre colonización del tracto digestivo por ciertos BGN-MR y el posterior desarrollo de infecciones invasivas por dicho patógeno, especialmente neumonías o bacteriemias. Esto ha sido demostrado para A. baumannii28–31 y para Enterobacterales productores de BLEE32–38, Enterobacterales productores de AmpC39,40 y Enterobacterales productores de diversos tipos de carbapenemasas41–44. La capacidad de producir infecciones diseminadas parece superior en los casos de colonización por cepas productoras de KPC que en aquellos casos de colonización por Enterobacterales productores de metalo-β-lactamasa o de otra β-lactamasa44,45.
La tabla 2 resume los principales hallazgos de los estudios que han analizado el valor predictivo de la colonización por Enterobacterales productores de BLEE para identificar el patógeno causante de una NAVM. El valor predictivo positivo (VPP) siempre es bajo, y en cualquier caso inferior al 50%, pero el valor predictivo negativo (VPN) si es muy elevado superando en todos los estudios el 90%. No está definido si estos pacientes colonizados por BGN-MR deben recibir tratamiento antibiótico empírico para cubrir dicho BGN en caso de desarrollar infección. Esto puede conllevar a un sobre uso de cierto grupo de antibióticos lo cual está demostrado en el caso de pacientes colonizados por Enterobacterales productores de BLEE que desarrollan una NAVM lo que conllevó a un sobreuso de carbapenemes en el tratamiento empírico a pesar de la baja incidencia de NAVM confirmadas por estos patógenos46. No hay por el momento estudios que hayan reportado el aumento de los antibióticos activos frente a EPC aunque es de prever que esto ocurra si se generaliza su uso empírico en pacientes colonizados por dichos patógenos que desarrollan una infección. En cualquier caso, la guía de la British Society for Antimicrobial Chemotherapy para el tratamiento de infecciones causadas por BGN-MR considera que solo los pacientes con factores de riesgos y colonizados por BGN-MR que desarrollen infección deben recibir antibióticos activos frente a dichos patógenos47.
Estudios que han evaluado el valor predictivo de la colonización por Enterobacterales productores de BLEE para identificar el patógeno causante de una NAVM
| Autor (ref)/diseño | Patógeno analizado/frecuencia | N°. de pacientes incluidos/N.° NAVM/N.° NAVM causadas por BGN analizado | VPP/VPN | Comentarios |
|---|---|---|---|---|
| Bruyère et al.32/retrospectivo | Enterobacterales productores de BLEE/Al ingreso y semanalmente | 3.439/587/20 | 41,5/ 99,4% | |
| Razazi et al.34/prospectivo | Enterobacterales productores de BLEE/Al ingreso y semanalmente | 6.303/843/157 | No reportado | Colonización con E. cloacae o K. pneumoniae fue factor de riesgo para NAVM en comparación con E. coli o E. aerogenes |
| Houard et al.35/retrospectivo | Enterobacterales productores de BLEE/Al ingreso y semanalmente | 1.570/469/43 | 43,6/97,3% | |
| Massart et al.38/retrospectivo | Enterobacterales productores de BLEE/Al ingreso y semanalmente | 3.250/205/15 (8 NAVM y 7 BP) | 31,6/95,2% | Analiza conjuntamente NAVM y BP |
| Manquat et al.40/retrospectivo | Enterobacterales productores de BLEE y Enterobacterales HPAC/Al ingreso y semanalmente | 3.228/468/39 BLEE y 36 HPAC | 14,8/98,8% para E-BLEE/20,3 y 98% para HPAC | El método empleado para el aislamiento en la muestra rectal es específico para E-BLEE, pero no para HPAC por lo que pudo infraestimarse su número |
BGN: bacilo gram-negativo; BLEE: β-lactamasa de espectro extendido; BP: bacteriemia primaria; HPAC: hiperproductor de AmpC; NAVM: neumonía asociada a ventilación mecánica; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Otras herramientas para ayudar a la elección del tratamiento inicial son los test microbiológicos rápidos. Las pruebas microbiológicas clásicas requieren al menos de 24 a 48h para la identificación de microorganismos y de 48 a 72h para la determinación del antibiograma. Para solucionar este problema, se han desarrollado técnicas de diagnóstico rápido (de 1,5 a 6h) basadas en la amplificación de ácidos nucleicos que proporcionan una identificación rápida de los microorganismos y también pueden detectar diversos genes de resistencia (p. ej., los que codifican BLEE o carbapenemasa). Por el contrario, si el mecanismo de resistencia a los β-lactámicos, incluyendo los carbapenemes, es otro distinto a una enzima inactivadora (sobreexpresión de bombas de expulsión, pérdida o mutación de porinas…) no se detectan por estos sistemas moleculares. Además, estas pruebas siguen siendo caras (>100€ por test) y debe realizarse junto con los cultivos convencionales a los que hoy en día no pueden reemplazar3.
Por último, algoritmos derivados de la inteligencia artificial pueden ser una herramienta para identificar qué paciente pudiera presentar una infección causada por una bacteria multi-resistente48. Así, un reciente estudio desarrolla un algoritmo que, con un VPP muy modesto (30%), pero con un muy elevado VPN (99%), identifica pacientes con una infección por BGN resistente a carbapenemes49.
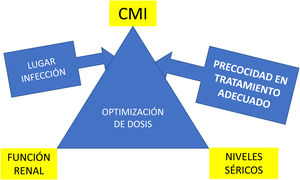
Optimización del tratamiento antibiótico para mejorar el pronósticoLos regímenes de dosificación estándar no son a menudo adecuados para los pacientes críticos. Existen 2 diferencias principales en los parámetros farmacocinéticos/farmacodinámicos (PK/PD) entre los enfermos críticos y el resto de pacientes: el incremento del volumen de distribución y el aumento del aclaramiento de antibióticos que se excretan por vía renal en aquellos pacientes hiperfiltradores o hiperaclaradores. Estas variables junto con la concentración mínima inhibitoria del patógenos implicado y la precocidad del tratamiento son claves para lograr la curación clínica (fig. 1). Un estudio realizado en 285 pacientes críticos (1.660 determinaciones del aclaramiento de creatinina) puso de manifiesto que el 65% de los pacientes presentaban un aumento de la función renal, definida por un aclaramiento de creatinina 130ml/min/1,73m2, durante la primera semana de hospitalización. Este hallazgo es particularmente preocupante porque la gran mayoría de los regímenes antimicrobianos en la UCI se basan en β-lactámicos que se eliminan predominantemente por vía renal, lo cual hace que en la mayoría de los pacientes hiperaclaradores no se logren concentraciones terapéuticas para tratar infecciones por BGN con la dosificación recomendada en ficha técnica50. Este hecho también afecta a nuevos β-lactámicos que se han introducido recientemente en la clínica y que son activos frente a BGN-MR como ceftolozano-tazobactam51 o cefiderocol52.
Es interesante resaltar que un estudio reciente realizado en 577 pacientes adultos con infecciones por K. pneumoniae productora de KPC (391 de ellos con bacteriemia) y tratados con ceftazidima-avibactam, el ajuste de dosis de este antibiótico según la función renal fue un factor independiente de mortalidad a los 30 días mientras que su empleo en perfusión extendida se identificó como un factor protector53.
Papel de los programas de optimización de antibióticosLos programas de optimización de antibióticos (PROA) se crearon con el objetivo principal de mejorar el uso de los antimicrobianos para aumentar su eficacia y reducir los efectos adversos, las infecciones por Clostridium difficile y la aparición de resistencias antibióticas, y como objetivos secundarios disminuir los costes sanitarios al evitar tratamientos innecesarios y complicaciones.
Los PROA han demostrado ser una estrategia eficaz para reducir las tasas de BMR en todos los ámbitos del sistema sanitario: a nivel comunitario, hospitalario y específicamente en las UCI. Un metaanálisis que incluyó 24 estudios (solo 3 eran ensayos clínicos aleatorizados) demostró una disminución de la utilización de antimicrobianos con el consiguiente menor coste y una reducción del tiempo de uso de antibióticos. Además, las intervenciones que tenían una duración superior a los 6 meses se asociaron con reducciones de las tasas de resistencias a los antimicrobianos54.
En España, 2 estudios publicados han reportado el impacto de un PROA de composición multidisciplinar realizado en las UCI, y liderado por médicos intensivistas. El primero demuestra que este programa logró una reducción significativa del uso de antimicrobianos en las UCI sin afectar a la mortalidad, aunque tampoco se redujo el aislamiento de bacterias multi-resistentes55. En otro estudio que comparó 2 periodos (2007 a 2010 vs. 2011 a 2015) se demostró que se logró una reducción significativa del número de pacientes que recibieron uno o más antibióticos, del uso de antibióticos (evaluado por dosis definida día y por días de tratamiento), así como un ahorro cercano al 1.000.000€ desde su implantación. Es importante señalar que la mortalidad global no se vio afectada y se redujo significativamente las infecciones ocasionadas por bacterias por multi-resistentes que pasaron de afectar al 15,8 y al 32,4% de los pacientes en 2007 y 2008 al 2,8 y al 3,3% de los pacientes en 2014 y 201556.
La implantación de un PROA en 2 UCI holandesas también confirmó que se lograba una reducción significativa del consumo de antibióticos que se acompañó de un descenso en la tasa de bacteriemia relacionada con catéter por BGN-MR57. Un estudio de intervención diseñado para reducir la duración del tratamiento antibiótico en las UCI, demostró que tras 10 meses de su implantación se logró una reducción significativa de A. baumannii y K. pneumoniae resistentes a imipenem58. Finalmente, reseñar un programa de revisión de la prescripción de los antibióticos de mayor impacto ecológico (quinolonas, carbapenemes y cefalosporinas) acompañado del feedback a los prescriptores se tradujo en una reducción de las tasas de resistencias en P. aeruginosa y en la proporción de Enterobacterales hiperproductores de AmpC59. Señalar que todos estos estudios confirman que la mortalidad no se modifica por la implantación de estos PROA los cuales se asocian con una reducción del consumo de antibióticos y en varios estudios con una disminución de las tasas de resistencias especialmente en BGN.
Una de las estrategias que se preconizan en estos PROA es el des-escalamiento terapéutico. Dicha estrategia consiste en modificaciones tempranas de la terapia antimicrobiana empírica de amplio espectro lo cual se realiza para prevenir la aparición de resistencia a los antimicrobianos al disminuir la exposición general a los antibióticos de amplio espectro. El des-escalamiento terapéutico se ha demostrado una práctica segura que lleva a cabo cambiando de terapia combinada a monoterapia o reduciendo el espectro antimicrobiano cuando solo se usó un antibiótico de amplio espectro de manera empírica60,61. La suspensión precoz del tratamiento empírico cuando se llega al diagnóstico de que el cuadro que motivó el empleo de antibióticos no es una infección es también una buena práctica clínica que hay que realizar siempre aunque no se considera conceptualmente como des-escalamiento terapéutico62. Además, al disminuir el número de antibióticos administrados, el des-escalamiento también se asocia a una reducción de los efectos secundarios y disminuye los costos.
Muchos clínicos todavía se muestran reacios a reducir el espectro de la antibioterapia empírica de amplio espectro incluso cuando el paciente evoluciona adecuadamente. Hasta la fecha, todos los estudios coinciden en que el des-escalamiento terapéutico es seguro. A pesar de estos datos, la tasa de des-escalamiento antibiótico sigue siendo muy baja. En un estudio observacional multinacional publicado recientemente y realizado entre octubre 2016 y mayo 2018 (estudio DIANA), la tasa de des-escalamiento de la terapia empírica fue solo del 16%63. En dicho estudio, se observó que la aparición de patógenos multi-resistentes entre los días 2 y 28 de seguimiento fue menor en el grupo en que se realizó des-escalamiento terapéutico que en aquellos pacientes en los que se mantuvo la terapia empírica con fuerte tendencia a la significación estadística (7,5 vs. 11,9%; p=0,052).
Por otro lado, se ha demostrado que una estrategia restrictiva consistente en el empleo de antibióticos solo tras identificación microbiológica (con la excepción de los casos de shock séptico, fallo respiratorio agudo o meningitis) junto con una intervención para acortar la duración de la terapia antibiótica redujo de forma significativa la adquisición en la UCI de Enterobacterales productores de BLEE, así como las infecciones causadas por estos patógenos64. Es importante resaltar que la mortalidad cruda no ajustada en la UCI fue significativamente menor con la estrategia restrictiva que en el grupo de manejo convencional (22,5 vs. 28,6%; p<0,01).
PrevenciónLas medidas de prevención y control de son eficaces para reducir la transmisión de los BGN-MR y se basan en poner barreras a los medios de transmisión mediante el uso de las medidas de control de infecciones65. Estas medidas deben aplicarse no solo a los pacientes con infección demostrada sino con igual intensidad a los pacientes colonizados por BGN-MR. Por ello, la identificación al ingreso en la UCI y durante su estancia en la unidad de los pacientes colonizados por BGN-MR a través de estrategias de detección activa es esencial para reducir la diseminación de los mismos como recomienda el proyecto Resistencia Zero de SEMICYUC66.
El contacto físico a través de las manos del personal (sanitario o familiares) o bien a través de los equipos médicos (fonendoscopio, ecógrafo…) o instrumentos para el cuidado (grúas, arnés, …) son las principales vías de transmisión de los BGN-MR. Estas medidas de aislamiento incluyen el uso sistemático de precauciones estándar (higiene de manos, guantes, batas, protección ocular) y precauciones basadas en el mecanismo de transmisión (contacto, gotas, aerotransportado).
El agua hospitalaria y los dispositivos médicos que emplean agua pueden servir como reservorio de patógenos asociados a la asistencia sanitaria. Varias especies de BGN-MR clínicamente importantes, incluidas Enterobacterales, A. baumannii y P. aeruginosa, están bien adaptadas para colonizar las biopelículas de los sistemas de conducción de agua, y su presencia en dichos sistemas se ha asociado con infecciones esporádicas y brotes en pacientes críticos67-70. Estrategias dirigidas a eliminar estos reservorios o el uso del agua para la higiene de pacientes han sido eficaces para eliminar brotes71.
Cuando ocurre un brote por BGN-MR se debe siempre realizar un estudio exhaustivo para conocer fuentes, reservorios, mecanismos de transmisión y así determinar las medidas de control más efectivas cuando ocurre un brote. El equipo de control debe definir las muestras biológicas y ambientales que deben llevarse a cabo para su investigación. Deben siempre realizarse técnicas de tipificación molecular las cuales van a permitir determinar la relación genética existente entre 2 o más aislamientos de la misma especie72. Los objetivos del estudio de un brote nosocomial se resumen en la tabla 3.
Objetivos del estudio de un brote nosocomial por BGN-MR
| - Conocer el alcance del brote: número de pacientes afectados, unidades implicadas, evolución de los pacientes |
| - Determinar la fuente de origen |
| - Identificar las formas y las vías de transmisión |
| - Identificar la presencia de enzimas inactivadoras de β-lactámicos |
| - Interrumpir su diseminación |
| - Evitar situaciones similares en un futuro |
BGN-MR: bacilos gram-negativos multi-resistentes.
Una encuesta reciente en el que participaron profesionales europeos directamente implicados en el control de infecciones, se identificaron 3 áreas críticas para lograr la implementación y cumplimiento: 1) el número de personal dedicado al control de infecciones, 2) la existencia de programas educacionales y 3) el número de personal clínico73.
Por último, resaltar que para combatir este problema de multi-resistencia en los BGN se requiere actuar en diversos ámbitos siendo mucho más efectivo que la actuación sobre uno solo de los factores implicados. Así, una estrategia combinada que consiste en la combinación de precauciones estándar (higiene de manos, precauciones de contacto), existencia de un programa de optimización de antibióticos, limpieza ambiental (limpieza de todas las superficies y equipamiento médicos) y control de foco (baño o limpieza diaria con clorhexidina) es lo que se ha demostrado eficaz en reducir de forma significativa la incidencia de BGN-MR74. No obstante, señalar que de forma aislada, un programa de limpieza diaria con clorhexidina al 2% no logró reducir la incidencia de infecciones por BGN-MR en pacientes críticos adultos75.
ConclusionesEl aumento de las infecciones por BGN-MR en todos los ámbitos del sistema sanitario, pero especialmente en las UCI, junto con su elevada morbimortalidad asociada obliga a una actuación rápida y coordinada de todos los organismos públicos, industria farmacéutica y los profesionales sanitarios para prevenir las infecciones causadas por estos patógenos multi-resistentes, así como para acelerar su diagnóstico y seguir desarrollando nuevas moléculas activas que demuestren su eficacia en ensayos clínicos bien diseñados. Igualmente es necesario optimizar la utilización de viejos y nuevos antibióticos para así aumentar su eficacia y reducir los efectos adversos. Todo ello además debe ser complementado con la formación de los médicos intensivistas que deben estar familiarizados con el manejo de estas infecciones de gran complejidad por afectar a pacientes críticos, y deben participar y liderar los estudios requeridos para resolver las preguntas clínicas que se nos plantean sobre el mejor tratamiento de estas infecciones que puede variar según la situación clínica del paciente, lugar de infección, patógeno responsable y mecanismo o mecanismos de resistencias implicados.
FinanciaciónNo existe financiación para el presente manuscrito.
Conflicto de interesesJosé Garnacho-Montero ha participado en actividades formativas patrocinadas por MSD, Shionogi y Pfizer. Rosario Amaya-Villar ha participado en actividades formativas patrocinadas por MSD y Pfizer.