INTRODUCCION
Los efectos de propofol (2,6 disopropil fenol disuelto en intralipid al 10%) han condicionado su amplio uso como anestésico y sedante de manera prolongada en pacientes de cuidados intensivos. Entre los pacientes suceptibles de su uso se encuentran los sometidos a ventilación mecánica por enfermedad pulmonar. Los efectos de propofol sobre el corazón y la circulación sistémica se han estudiado con cierta extensión. Sobre la circulación pulmonar, las acciones de propofol son menos conocidas y no totalmente concluyentes respecto a su acción sobre los vasos pulmonares ni sobre los mecanismos que expliquen estos efectos.
Claeys et al1 en uno de los primeros trabajos en que analizan los efectos de propofol en humanos sobre la circulación pulmonar afirman que tras una dosis de este fármaco para inducción anestésica, las resistencias pulmonares se incrementan en un 36%, retornando posteriormente a los valores previos a la inducción. Naeije et al2, en perros, encuentran que el propofol no modifica las resistencias vasculares pulmonares ni parece inhibir la vasoconstricción pulmonar hipóxica (VPH). En humanos se encuentran resultados similares3.
Trabajos posteriores de Park et al4 en vasos pulmonares aislados, Rouby et al5 en clínica y Rich et al6 en pulmones de rata encuentran un descenso de las resistencias vasculares pulmonares. Más recientemente, Uezono y Clarke7 afirman que el propofol en pulmones de conejos perfundidos no produce un efecto vasodilatador con presiones vasculares pulmonares normales, pero sí disminuye las resistencias pulmonares vasculares cuando se encuentran elevadas previamente. Erdemli et al8, en un modelo de pulmón de rata aislado y perfundido, describen también este descenso de resistencias vasculares pulmonares mediado por propofol cuando están previamente elevadas, mientras que en situaciones normales el propofol no produce ningún efecto. Más recientemente9 se han vuelto a confirmar estos mismos datos en circulación pulmonar de animal entero.
El mecanismo de la posible vasodilatación pulmonar por el propofol tampoco está suficientemente aclarado. Para Park et al4, la vasodilatación pulmonar inducida por este fármaco es endotelio independiente, lo que también es afirmado por Chang y David10 para aorta, y en el mecanismo de vasodilatación estarían implicados mecanismos de bloqueo de los canales de calcio. Erdemli et al8 demuestran en su trabajo que el propofol vasodilata las arterias pulmonares cuando el tono vascular está elevado activando canales de K sensibles a ATP. Por el contrario en su trabajo, Rich et al6 implican al endotelio pulmonar en esta respuesta vasodilatadora, lo que está en concordancia con los trabajos de Petros et al11, que demuestran un incremento en valores de GMPc en cultivos de células endoteliales de aorta tras el aporte de propofol. Para Kaye et al12 el propofol tiene un efecto vasodilatador y este efecto no estaría mediado o modulado por NO, apertura de canales de K, ATP o por liberación de productos vasodilatadores de la ciclogenasa.
Conviene analizar el solvente de la preparación, ya que los efectos de intralipid (10% de aceite de soja, 2,25% de glicerol y 1,2% de fosfolípidos purificados) sobre la circulación pulmonar y la función pulmonar han sido también estudiados. En algunos trabajos se describen alteraciones del intercambio gaseoso y producción de hipertensión pulmonar13,14. Existe controversia respecto a la diferenciación de estos efectos en el pulmón sano y el patológico, sus mecanismos de acción y la posibilidad de que inhiba la VPH15-18, lo que podría ser responsable de los efectos del propofol y limitar, por tanto, su uso en pacientes con enfermedad respiratoria.
En nuestro trabajo pretendemos fundamentalmente estudiar los efectos de propofol sobre la VPH, situación en la que se produce un incremento de las resistencias vasculares pulmonares. El trabajo estudia esta situación en la circulación pulmonar aislada de rata a dosis que se utilizan en clínica humana, tanto para la anestesia como para la sedación de pacientes en cuidados intensivos.
MATERIAL Y MÉTODOS
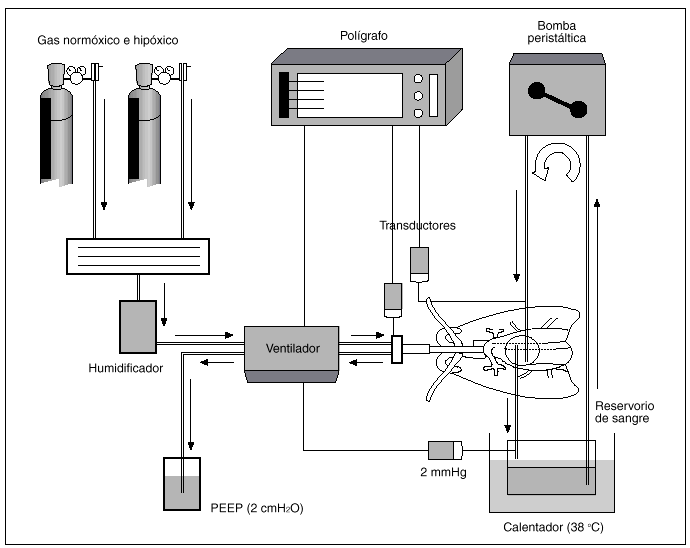
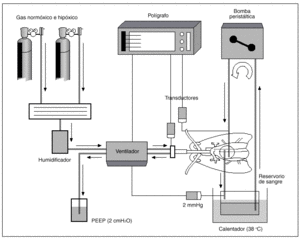
Hemos utilizado para nuestro trabajo una preparación de pulmón aislado y perfundido de rata, basada en la técnica inicialmente descrita por Hauge19, para la medida de la presión en la arteria pulmonar (fig. 1). Un total de 42 ratas hembras Wistar de 275 (15) g (DE), fueron anestesiadas con 50 mg intraperitoneales de cloruro de quetamina (Ketolar, Parke Davis). Tras efectuar una traqueotomía, los pulmones fueron ventilados con una bomba de ventilación para ratas (C.F. Palmer. London Tdt), con aire a una frecuencia respiratoria de 40 respiraciones/min y 23 cmH2O de presión positiva espiratoria final (PEEP). Se ajustó el volumen respiratorio para mantener una presión inspiratoria pico de 10 mmHg. Se inyectan 500 U de heparina sódica en la vena yugular. Tras esternotomía y pericardiotomía se expuso el sistema cardiopulmonar. Se introdujo una cánula de polietileno en la arteria pulmonar a través de una ventriculotomía derecha que se fijó con una ligadura alrededor de la raíz de dicha arteria. Otra cánula se insertó en la aurícula izquierda, a través del ventrículo izquierdo, fijándose mediante sutura de la incisión ventricular. Los pulmones se perfundieron con 20 ml de sangre total heparinizada, procedente de una rata donante y de la utilizada durante la experiencia, mediante bomba peristáltica (Cobe laboratories, INC) a un flujo de 0,03 ml/g de peso/min.
Fig. 1. Preparación de pulmón aislado y perfundido de rata.
La sangre se mantuvo en un depósito en contacto con una atmósfera similar a la del gas que se utiliza en cada momento para la ventilación, lo que se consiguió con tubuladuras que provenían de los tanques de gas que proveían al respirador. El reservorio de sangre se mantuvo a una temperatura de 38 °C y estaba provisto de un filtro de sangre de malla de nailon. Una vez realizada la técnica, se cubría la preparación con una campana de metacrilato y se humidificaba con un nebulizador ultrasónico termostatizado para mantener una niebla a 37 °C de temperatura. La perfusión pulmonar se efectuó mediante una cánula introducida en arteria pulmonar, midiendo su presión con una conexión en T en dicha cánula. Teniendo en cuenta que el flujo es constante, los cambios de presión en arteria pulmonar representan modificaciones de las resistencias vasculares. La sangre efluyente de la aurícula izquierda retorna al reservorio para su recirculación. Una vez iniciada la circulación pulmonar se ventilaron los pulmones con O2 al 20% y CO2 al 5%.
Durante toda la experiencia se tomaron muestras para análisis de pH y gases en sangre (AVL 900), manteniéndose el pH entre 7,35-7,45, añadiendo pequeños bolos de bicarbonato sódico al reservorio si era preciso. Las presiones de la arteria pulmonar, de la vía aérea y de la aurícula izquierda (2 mmHg) se recogieron mediante transductores calibrados a un polígrafo (Beckman Dynograph Recorder R 612). Al terminar cada experimento se pesaron los pulmones, se secaron en una estufa y se volvieron a pesar, para desechar las experiencias en las que la relación de pesos pulmonares normal frente a desecado indican producción de edema.
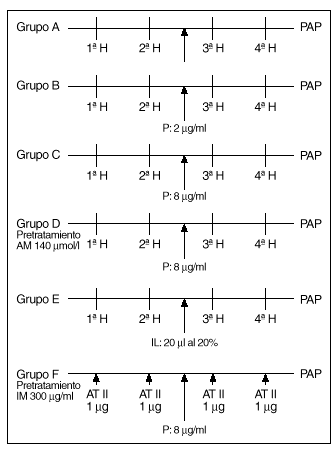
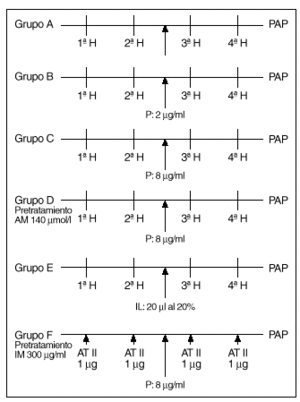
Protocolos experimentales (fig. 2)
Fig. 2. Esquema de los diferentes protocolos experimentales. H: hipoxia. P: propofol. AM: azul de metileno. IL: intralipid. IM: indometacina. AT II: angiotensina II.
Tras un período de 20-30 min en los que se estabiliza la preparación se procede según los distintos grupos de experimentos:
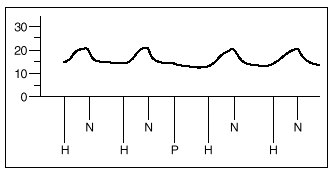
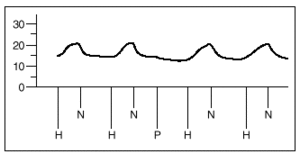
1. Un grupo A de 8 experimentos destinado a demostrar la similitud de las respuestas a la hipoxia. Tras estabilizarse la preparación, se inician ciclos de ventilación con gases hipóxicos (2% de O2, 5% de CO2 y 93% de N2) durante 8 min, seguido de un período de recuperación de 10 min. Se analizan 4 respuestas obtenidas a partir de obtener dos respuestas iguales a la hipoxia (que se diferencian en menos de 1 mmHg) (fig. 3).
Fig. 3. Registro de presiones de la arteria pulmonar en pulmones aislados y perfundidos de rata. H: hipoxia. N: normoxia. P: propofol.
2. Un grupo de 8 experimentos B, en los que se procede de forma similar a los del grupo anterior, añadiendo propofol al reservorio para conseguir una concentración de 2 mg/ml tras la segunda respuesta del grupo a analizar y obtenidas con el mismo criterio que las del grupo anterior.
3. Un grupo C, similar al anterior, excepto que la concentración de propofol es de 8 mg/ml.
4. Un grupo de 5 experiencias D, realizadas de forma similar a las anteriores, en preparaciones que fueron pretratadas con azul de metileno añadido al reservorio de sangre para obtener una concentración de 140 µmol/l. Tras la segunda respuesta a la hipoxia se añade propofol al reservorio a una concentración de 8 µg/ml.
5. Un grupo de 8 experiencias E, en el que se procede como en el grupo A; tras la segunda respuesta, se añade un bolo de 20 ml de intralipid al 20% en la cánula de infusión de la arteria pulmonar y se efectúan otros dos ciclos de estimulación hipóxica.
6. Un grupo de 5 experiencias F, en pulmones de ratas pretratadas con indometacina (300 mg/ml), que se someten a dosis de angitensina II en bolos de 1 µg inyectados en la cánula de perfusión pulmonar. Se analizan las respuestas antes y tras el aporte de propofol a concentraciones de 8 mg/ml.
En todos los grupos experimentales se compararon las medias de las primeras 2 respuestas con la media de la tercera y la cuarta. Las variables han sido definidas mediante la media y su desviación estándar (DE). Para el análisis estadístico se han utilizado pruebas no paramétricas de datos pareados (Wilcoxon T test).
RESULTADOS
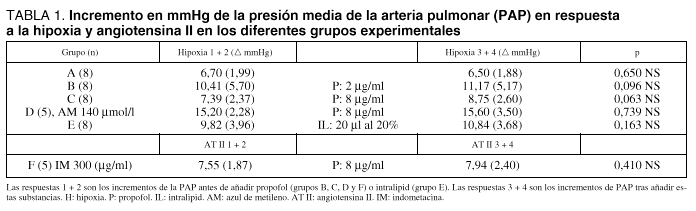
En la tabla 1 se muestran los resultados obtenidos en los diferentes grupos experimentales. En A (grupo control) se comparan las medias de las dos primeras respuestas a la hipoxia 6,70 (1,99) mmHg, respecto a las de la tercera y cuarta 6,50 (1,88) mmHg. No hay diferencias estadísticamente significativas ( p = 650). En B, se comparan las respuestas a la hipoxia 10,41 (5,70) mmHg con los efectos de concentraciones de 2 m/ml de propofol en las respuestas a la hipoxia 11,17 (5,17) mmHg, no hay diferencias significativas. En C, se comparan las medias a respuesta hipóxica 7,39 (2,37) con los efectos de concentraciones de 8 m/ml propofol en las respuesta de hipoxia 8,75 (2,60) mmHg; no se observan diferencias significativas, p = 0,063. En D, se muestran las preparaciones tratadas con azul de metileno, las respuestas a la hipoxia antes de propofol a concentraciones de 8 m/ml, de 15,20 (2,28) mmHg las cuales fueron similares a las de después de administrar propofol, 15,60 (3,50) mmHg (p = 0,7395). En E, se muestra que las respuestas a la hipoxia fueron de 9,82 (3,96) mmHg y tras añadir 20 ml de intralipid 20% fueron de 10,84 (3,68) mmHg, sin diferencias estadísticas significativas (p = 0,163). En F, se comparan las respuestas vasoconstrictoras de angiotensina II (1 mg) antes, 7,55 (1,87) mmHg y tras propofol a concentración de 8 mg/ml 7,94 (2,4) mmHg, sin diferencia significativa (p = 0,410).
DISCUSION
El primer grupo de experimentos (A) pone de manifiesto que una vez que se obtiene una respuesta estable, se suelen mantener constantes al menos las 4 respuestas siguientes, lo que permite comparar la 3 y 4 cuando se introduce una posible variable en la experiencia con la 1 y 2, que actúan como controles.
El comportamiento del propofol respecto a la VPH no revela en nuestros resultados ninguna atenuación de la misma. Estos efectos ya se habían supuesto en la circulación pulmonar de animales enteros2 y en la especie humana3. Cuando la preparación está tratada con azul de metileno, con efectos fundamentalmente inhibidores de guanilato ciclasa, encontramos un incremento en la respuesta a la VPH, como ya se había demostrado en rata, pero el aporte de propofol tampoco disminuye la resistencia a la hipoxia en esta situación. Los mecanismos por los que el propofol disminuiría las resistencias vasculares pulmonares no están suficientemente aclarados. Así, para algunos autores el endotelio desempeña un importante papel al obtener distintas respuestas trabajando con endotelio intacto o sin él o encontrando incrementos de GMPc por el endotelio de aorta cuando se aporta propofol7,11. Para otros autores, el papel del endotelio es irrelevante en los efectos del propofol, ya que en preparaciones tratadas con inhibidores del FRDE (factor relajante del endotelio) no se encuentran diferencias respecto a las variaciones del tono basal con las no tratadas con FRDE4,10,12. También se ha trasladado a la circulación pulmonar argumentos encontrados en la circulación sistémica que evidencian el efecto vasodilatador del propofol como un efecto dependiente del bloqueo directo de influjo de calcio al interior de las células musculares vasculares10.
Más recientemente, trabajando con pulmones aislados perfundidos se ha insistido en que los efectos vasodilatadores del propofol sobre la circulación pulmonar sólo se producen cuando las resistencias vasculares están previamente elevadas4,7,8. También se ha demostrado este efecto en animales íntegros9. Para Erdemli et al8 el efecto vasodilatador del propofol en la circulación pulmonar aislada con resistencias vasculares incrementadas por elevación de K en el líquido de perfusión se produce por activación de canales de K sensibles a ATP y, en menor medida, bloqueando canales de Ca. Cuando nosotros conseguimos elevar las resistencias vasculares pulmonares mediante hipoxia no encontramos que el propofol disminuyera esas resistencias. Parece que la VPH se produce por un mecanismo endotelio independiente20. Los trabajos de Post et al21 demuestran que la hipoxia inhibe las corrientes de K en células musculares lisas de arteria pulmonar, causando depolarización de la membrana y entrada de Ca al interior de la célula, lo que provocaría contracción muscular. Estos canales de K no serían ATP dependientes, ya que éstos producen pocos efectos en la VPH22. Por tanto, durante la hipoxia, el mecanismo de elevación de las resistencias vasculares no sería idéntico al que estudian los trabajos antes citados4,7-9. Si aceptásemos los mecanismos vasodilatadores del propofol sobre la circulación pulmonar que Chang y Davis10 proponen para la aorta, podría esperarse que, al bloquear canales de calcio similares, en alguna manera disminuiría la VPH. Con el mecanismo propuesto por Erdemli et al8, el propofol en la circulación pulmonar actuaría sobre distintos canales de K que la hipoxia y, por tanto, no se opondría a sus efectos. El efecto de la hipoxia mantendría abiertos los canales de Ca, ya que el propofol a estas dosis no los inhibiría23.
Durante la hipoxia y debido al incremento de la presión vascular pulmonar se activa la liberación de NO, lo que incrementa los valores de GPPc24. De esta manera, durante la hipoxia el sistema NO-GMPc actúa como freno fisiológico para prevenir respuestas vasoconstrictoras exageradas a la hipoxia o muy mantenidas en el tiempo25,26. Si el mecanismo de acción de propofol sobre los vasos pulmonares fuera por acción sobre el endotelio incrementando la liberación o los efectos del FRDE podría presuponerse que, en cierta medida, se inhibiera la respuesta vasoconstrictora hipóxica al incrementarse aún más los valores de GMPc. Actuando en sentido contrario, cuando aportamos a nuestra preparación azul de metileno y disminuimos los valores de GMPc tampoco encontramos variaciones en la respuesta a la hipoxia, lo que podría entenderse si los efectos vasodilatadores de propofol fueran debidos al incremento de las concentraciones de NO. Ahora bien, esto encajaría si en las preparaciones no tratadas con azul de metileno hubiera habido una disminución en la respuesta hipóxica por el propofol, lo que no ha ocurrido.
Por otra parte, cuando provocamos una vasoconstricción pulmonar con angiotensina II, que actúa por un mecanismo diferente a la hipoxia, tampoco podemos evidenciar modificaciones en la respuesta hipertensiva que provoca el uso de propofol a dosis que se utilizan en clínica. Por tanto, los efectos disminuidores de las resistencias vasculares que recientemente se han atribuido a propofol4,7-9 no se manifiestan en todas las situaciones responsables de elevación de las resistencias vasculares.
Se han efectuado diversos estudios de los efectos de un componente del propofol, el intralipid, sobre el intercambio gaseoso pulmonar y la respuesta de la circulación pulmonar a su aporte. La consignación de disfunción pulmonar por el uso de lípidos intravenosos es contradictoria. Para algunos13,14 se alteraría la función pulmonar por la infusión de lípidos solamente si existe distrés respiratorio, sobre todo asociado a sepsis. Baudomín et al17 en preparaciones de pulmones aislados informan de una reducción importante por intralipid de la VPH. Erdemli et al8 no encuentran modificaciones en la presión pulmonar de pulmones de rata aislados tratados con intralipid. Nosotros, con dosis moderadas de intralipid, no encontramos modificaciones de presiones en la arteria pulmonar ni en VPH.
Por tanto, en función de nuestros resultados podemos concluir que el propofol no modifica la respuesta vasoconstrictora hipóxica y que, por tanto, es un anestésico utilizable en pacientes con enfermedad pulmonar, sin riesgo de incrementar la hipoxemia. Los efectos de intralipid sobre la función pulmonar, si bien controvertidos, no parecen importantes.