El embarazo crítico en la alta altitud aumenta su morbimortalidad a partir de los 2.500 m sobre el nivel del mar (m s. n. m.). Además de la altitud, existen otros factores influyentes, como las desigualdades sociales, las barreras culturales, prehospitalarias y falta de desarrollo adecuado de las infraestructuras sanitarias. Las causas más frecuentes del embarazo crítico que motivan el ingreso en las Unidades de Medicina Intensiva son los trastornos hipertensivos del embarazo (las residentes nativas parecen estar más protegidas), las hemorragias y la infección/sepsis. En Latinoamérica hay 32 Unidades de Medicina Intensiva a partir de los 2.500 m s. n. m. La gasometría arterial en la altitud se ve afectada por los cambios de la presión barométrica. El análisis de sus valores proporciona una información muy útil para el manejo de las urgencias obstétricas a muy alta altitud, especialmente de las enfermedades respiratorias y metabólicas.
Critical pregnancy at high altitudes increases morbidity and mortality from 2,500 meters above sea level. In addition to altitude, there are other influential factors such as social inequalities, cultural, prehospital barriers, and lack the appropriate development of healthcare infrastructure. The most frequent causes of critical pregnancy leading to admission to Intensive Care Units are pregnancy hypertensive disorders (native residents seem to be more protected), hemorrhages and infection/sepsis. In Latin America, there are 32 Intensive Care Units above 2,500 meters above sea level. Arterial blood gases at altitude are affected by changes in barometric pressure. The analysis of their values provides very useful information for the management of obstetric emergencies at very high altitude, especially respiratory and metabolic pathologies.
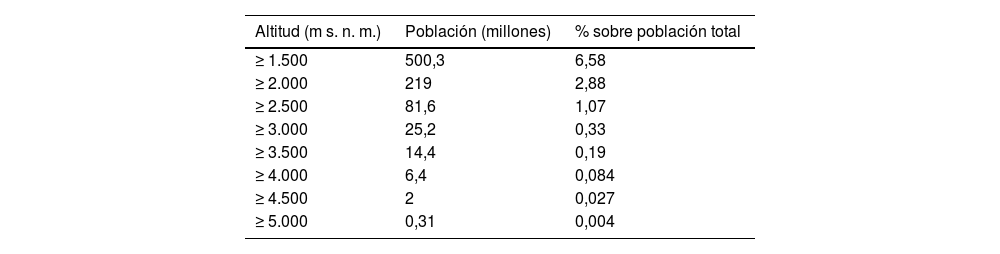
Consideramos altitud a los 1.500 m sobre el nivel del mar (m s. n. m.) porque se ha detectado que a partir de los 1.500 m s. n. m. se observan las primeras adaptaciones y efectos sobre el rendimiento físico derivadas del descenso progresivo de la presión barométrica (PB) consecutiva al ascenso a la altitud1. En la tabla 1 se exponen los millones de habitantes que viven en altitud2. Asia y América del Sur tienen poblaciones considerables que residen> 4.000 m s. n. m. y es en Asia donde se encuentra poblaciones que viven> 5.000 m s. n. m.3, aunque en Bolivia hay una población minera que desde hace más de 100 años vive a 5.000 m s. n. m.4. Estas cifras van en ascenso en la última década de acuerdo con las proyecciones estadísticas.
Población que vive en altitud
| Altitud (m s. n. m.) | Población (millones) | % sobre población total |
|---|---|---|
| ≥ 1.500 | 500,3 | 6,58 |
| ≥ 2.000 | 219 | 2,88 |
| ≥ 2.500 | 81,6 | 1,07 |
| ≥ 3.000 | 25,2 | 0,33 |
| ≥ 3.500 | 14,4 | 0,19 |
| ≥ 4.000 | 6,4 | 0,084 |
| ≥ 4.500 | 2 | 0,027 |
| ≥ 5.000 | 0,31 | 0,004 |
m s. n. m.: metros sobre nivel del mar; %: porcentaje
Fuente: Mallet et al.1.
El ciclo de la vida comienza con la embriogénesis en un entorno hipóxico durante las 10 primeras semanas de embarazo porque la tensión de oxígeno dentro de la placenta es mucho más baja (15-20mmHg)5, posteriormente aumenta a 40-80mmHg y permanece en este rango durante el segundo y tercer trimestre6.
Las presiones parciales normales de oxígeno arterial (PaO2) en individuos que viven a diferentes altitudes varían desde 75-100mmHg a nivel del mar, a 50mmHg a 4.000 m s. n. m. y a 19-30mmHg en altitudes de montaña mucho más altas. A pesar de que se han encontrado bebés de bajo peso al nacer, el tamaño placentario más pequeño y tasas más altas de preclampsia (PE) en las madres que viven a grandes altitudes, no hay evidencia directa de que sus fetos sean más hipóxicos que los de las madres que viven a nivel del mar7.
El embarazo en alta altitud (AA), especialmente a partir de los 2.500 m s. n. m.8, supone un desafío al transporte de oxígeno, que se magnifica porque la disminución de la PB y conlleva una disponibilidad del O2 limitada con caída de la saturación arterial de O2 (SaO2) y establecimiento de hipoxemia, causando estrés hipóxico. A la hipoxia consecutiva a la altitud se le conoce como hipoxia hipobárica (HH)9.
En el embarazo en AA se inicia una serie de respuestas fisiológicas dinámicas para compensar las demandas metabólicas. Uno de los mayores desafíos fisiológicos es mantener un adecuado suministro de sangre oxigenada en la circulación uteroplacentario para facilitar el desarrollo fetal. Aunque se necesitan más investigaciones para revelar los mecanismos involucrados en la disfunción vascular, estos mecanismos están relacionados con incremento de la hipertensión arterial (HTA) durante el embarazo, restricción del crecimiento intrauterino (RCIU), la PE, hemorragia posparto, etc.10. Sin olvidar que muchos riesgos van asociados al bajo y mediano ingreso económico en Latinoamérica, riesgos que pueden incrementar la morbimortalidad de la embarazada a gran altitud11.
El objetivo de este trabajo es revisar la problemática de las enfermedades maternas críticas a gran altitud (> 2.500 m s. n. m.), fundamentalmente centrada en los trastornos hipertensivos del embarazo en Latinoamérica.
Hipoxia hipobárica y embarazoEn la HH de la AA se producen cambios ambientales a la que está expuesta la embarazada, como el aumento de la radiación, la disminución de la temperatura, la falta de humedad, la sequedad del aire y la reducción de la PB12; este último se considera el factor más importante para el desarrollo del embarazo, ya que afecta a la presión ambiental del O2 y, por lo tanto, a la disponibilidad de O2 para la madre y el feto13. El estrés hipóxico durante el embarazo tiene repercusiones maternas, placentarias, fetales y perinatales12.
Relación hipoxia y trastornos hipertensivos del embarazoEl primer reconocimiento de que la hipoxia crónica era parte de la etiología de la PE se hizo a gran altitud. Datos recopilados retrospectivamente en Colorado revelaron que la hipertensión inducida por el embarazo era más común a 3.100 m s. n. m. (12%), que a 2.410 m s. n. m. (4%) o 1.600 m s. n. m. (3%). La proteinuria y el edema en las extremidades superiores también fueron más frecuentes a los 3.100 m s. n. m. que a los 1.600 m s. n. m.14. Sin embargo, en la mayoría de los casos, la HTA durante el embarazo a gran altitud está probablemente relacionada con la hipoxia crónica en lugar de la PE clásica10,15. De hecho, las mujeres embarazadas a gran altitud carecen de la caída fisiológica de la presión arterial al comienzo del segundo trimestre14,15. Una posible explicación es que la hipoxia crónica disminuye el efecto vasodilatador del óxido nítrico (NO), mientras que el sistema nervioso simpático (receptor∝1-/∝2-adrenérgico) se activa5. Además, los potentes vasoconstrictores como la endotelina-1 (ET-1) y el factor inducible por la hipoxia (HIF) se estimulan al principio del embarazo por la generación excesiva de especies reactivas de oxígeno16.
Se conoce que las mujeres embarazadas que viven en altitudes elevadas (> 2.500 m s. n. m.) son más susceptibles a las complicaciones vasculares del embarazo, como la PE y el RCIU10, pero los atributos genéticos de la ascendencia de las tierras altas confieren una protección relativa contra los trastornos vasculares del embarazo en altitudes elevadas17. La ascendencia andina, por ejemplo, protege contra el RCIU asociado a la altitud, tiene mejor flujo sanguíneo uteroplacentario y el suministro de oxígeno durante el embarazo18, protección que no se ha observado en las mujeres de ascendencia europea que nacieron y crecieron en grandes altitudes19. Julian et al.20 postularon la hipótesis, y posteriormente demostraron, que la expresión de canales iónicos con función conocida como vasodilatadores o promotores de la función placentaria estaba alterada en mujeres que vivían en grandes altitudes con PE en comparación con los controles normotensos y que la expresión positiva de estos canales está asociada con la ascendencia amerindia (bolivianos y peruanos) de gran altitud, siendo negativa en la ascendencia europea.
Hipoxia, insuficiencia placentaria y peso al nacerLa exposición a gran altitud desarrolla una insuficiencia placentaria que repercute sobre el peso natural al nacer, superando a otros factores de riesgo, como el bajo peso materno, tabaquismo, primiparidad, antecedentes preeclámpticos, etc.21. Un aumento de 1.000 m s. n. m. en la altitud da como resultado una disminución media natural del peso al nacer de 100 g5. La exposición a gran altitud, que parece estar asociada con un mayor riesgo de PE, puede contribuir aún más a un bajo peso al nacer en las poblaciones de gran altitud10. Estudios con ultrasonido Doppler a 3.600 m de altitud en Bolivia encontraron diferencias en el flujo de la arteria uterina desde las 20 semanas de gestación18. Al aplicar la misma metodología se ha podido determinar que la diferencia en el tamaño fetal, entre Cerro de Pasco (4.320 m s. n. m.) y Lima (150 m s. n. m.), se observa a partir de las 25-29 semanas de gestación22.
Hipoxia y efectos maternosLa respuesta cardiovascular a AA ha sido propuesta como la principal causa de las complicaciones del embarazo en la altitud, como la hipertensión sistémica, sangrado, oligoamnios, insuficiencia placentaria, trabajo pretérmino y RCIU10.
La presencia de presión arterial materna es alta, se incrementa en embarazadas a término llegando a duplicar la hipertensión gestacional y las embarazadas a AA tienen hasta un 30% más de trastornos hipertensivos cuando se comparan con poblaciones similares8. Sin embargo, se han observado discrepancias en su prevalencia, y estas pueden deberse con diferencias étnicas en la población estudiada, como nativas andinas adaptadas a la AA y población no andina12. Se ha comprobado que las mujeres andinas embarazadas en los Andes, en comparación con las no andinas, en la semana 36 del embarazo tenían niveles más altos de progesterona, cortisol, estrona, 17β-estradiol, como resultado de una mayor actividad de la aromatasa, y niveles más bajos de cortisol y una mayor capacidad antioxidante. Un cortisol más bajo, un estriol más alto, tendencias a niveles más altos de progesterona y 17β-estradiol y mayor capacidad antioxidante se asociaron con mayores diámetros de la arteria uterina y mayor flujo sanguíneo en la AA, posibles factores de protección contra los trastornos hipertensivos del embarazo23,24. Con base a esta información, parece ser que los desórdenes hipertensivos durante el embarazo son más comunes en alta altitud, pero los residentes multigeneracionales aparentan estar más protegidos de forma relativa que los recién llegados12. La mortalidad materna también incrementa con el aumento de la altitud, el rango de mortalidad en mujeres con PE severa e hipertensión gestacional en AA fue del 34,1% comparado con 11,8% en baja altitud9.
Hipoxia y efectos fetalesEl hallazgo fetal más frecuente en los embarazos en AA es el RCIU, con marcadas disminuciones en el tamaño y el peso fetal en relación con las gestaciones de tierras bajas. Sin embargo, también existen diferencias entre los nativos y los residentes europeos en la AA12. Varios estudios muestran que la ascendencia andina favorece mayor peso al nacer12,21,25, porque el mayor flujo sanguíneo en la arteria uterina que facilita la oxigenación y el intercambio de nutrientes entre el lado materno y fetal de la placenta20,26.
En referencia a la mortalidad fetal tardía en la AA, considerada como la muerte después de 28 semanas o más de gestación, este riesgo es 4,82 veces mayor que a nivel del mar27.
Aclimatación y adaptación materna a la gran altitudClasificación de la altitud en el manejo del paciente críticoEl Comité de Expertos de Medicina Crítica en la Altitud de la Federación Panamericana e Ibérica de Medicina Crítica y Terapia Intensiva (CEMCA-FEPIMCTI) ha trabajado en el consenso de estas definiciones y ha considerado que, como los procesos adaptativos se inician a partir de los 1.500 m s. n. m. y que las Unidades de Cuidados Intensivos que se encuentran a mayor altitud en el mundo son las ubicadas en Cerro de Pasco-Perú, a 4.380 m s. n. m. y El Alto-Bolivia, a 4.150 m s. n. m., desde un punto de vista práctico y adecuando la escala de Barry y Pollard28 ha propuesto clasificar a la altitud relacionada con la atención al paciente crítico en 3niveles29:
- –
Media altitud: de 1.500 a 2.500 m s. n. m.
- –
Elevada altitud: de 2.500 a 3.500 m s. n. m.
- –
Gran altitud: de 3.500 a 5.800 m s. n. m.
Posiblemente fueron los habitantes de las tierras altas de Etiopía quienes primeros vivieron en la gran altitud (> 3.500 m s. n. m.). Las poblaciones indígenas tibetanas llevan viviendo en la gran altitud un máximo de 25.000 años y las andinas 11.000 años30,31.
El término aclimatación se refiere al proceso normal mediante el cual seres humanos de nivel del mar o baja altitud responden al estrés hipóxico consecutivo a la HH, cuando se exponen a una altitud mayor (> 1.500 m s. n. m.) respecto a su hábitat natural. En términos generales en la aclimatación a gran altitud hay cambios fisiológicos que comienzan a los pocos segundos, otros tardarán minutos, horas, semanas o meses32. La aclimatación no es permanente y se pierde cuando se retorna al hábitat habitual, por lo que en cada nueva ascensión el organismo tiene que volver a iniciar el proceso de aclimatación.
La adaptación es una respuesta evolutiva a largo plazo. Es una herramienta biológica para conseguir vivir en la altitud de forma permanente, armónica y con un éxito reproductivo asociado a la trasmisión de los rasgos genéticos. A diferencia de la aclimatación, implica miles de años y muchas generaciones, como muestran los estudios realizados en la población andina33. En la figura 1 se expone la evolución en el tiempo del proceso de aclimatación y adaptación34-37.
Las principales respuestas a un ascenso a gran altura involucran el cerebro, los pulmones, el corazón, los riñones y la sangre. En escala logarítmica se muestran los cambios cualitativos a lo largo del tiempo. En la aclimatación, estos cambios fisiológicos van desde minutos hasta semanas de estancia en la gran altitud. La adaptación es una respuesta evolutiva que implica miles de años y muchas generaciones.
Fuente: basada en la original de Peacock34 y en sus posteriores y sucesivas modificaciones y adaptaciones de Imray et al.35, Luks et al.36 y Quispe-Cornejo et al.37.
En la altitud existe una gran diversidad de tipos de poblaciones. El CEMCA-FEPIMCTI ha propuesto clasificarlas en según su origen y según su tiempo de permanencia. Según su origen se clasifican en: a) nativo: persona nacida y gestada en la altitud, que ha desarrollado una aclimatación natural (adaptación fisiológica) a la HH, que le permite vivir y funcionar eficientemente, y b) no nativo o inmigrante: persona no nacida en la altitud y que asciende. Según su tiempo de residencia se clasifican en: a) residente: persona que vive en una altitud≥ 1.500 m s. n. m. de forma permanente durante un año como mínimo, o de forma transitoria por periodos variables e intermitentes (mínimo 2semanas al mes durante un año continuo) que, si bien al principio puede experimentar algunos efectos de la altitud, tienden a aclimatarse con el tiempo, y b) no residente o visitante: individuos que no viven en la altitud y se desplazan por un tiempo muy limitado a áreas de elevada altitud, con riesgo de presentar, por falta de aclimatación, enfermedades relacionadas con el mal agudo de montaña29.
Adaptación a la altitud y factor inducible por la hipoxiaEl HIF y concretamente el HIF 1α (HIF-1α) es el principal factor en la adaptación vascular materna en grupos de residentes multigeneracionales de la AA9. En los últimos 20 años se ha incrementado de forma exponencial los estudios genéticos de la adaptación a la AA, concluyendo que la vía del HIF es la llave del mecanismo por el cual la hipoxia activa numeroso genes relacionados con la formación de vasos sanguíneos (VEGF, PDGF, FLT), producción de células rojas, factor de necrosis tumoral, inflamación (IL-6), vasodilación o vasoconstricción (EDN, NOS, PRKAA1), metabolismo de la glucosa (IGFBP, PRKAA1) y otros que afectan el transporte de oxígeno38,39. También hay genes como EGLN1 y EPAS1 que desempeñan un papel importante en la determinación de la variabilidad de respuesta a la HH y se han relacionado con la policitemia y anomalías asociadas40. Por ejemplo, el aumento de la frecuencia de una variante causal del gen EGLN1, en la etnia quechua peruana, aumenta el consumo de O2 y el rendimiento en la altitud41.
Importancia de los principales cambios fisiológicos del embarazo derivados de la adaptación a la altitudLa oxigenación arterial materna es un determinante muy importante en el peso del recién nacido a gran altitud y depende de numerosos factores, por ejemplo: disponibilidad de oxígeno ambiental, sensibilidad ventilatoria, función respiratoria, capacidad en su difusión, capacidad de transporte de oxígeno13.
La población andina adaptada a la AA se caracteriza por tener volúmenes pulmonares superiores, gradientes entre la presión alveolar de O2 y la PaO2 disminuidos, menor respuesta vasoconstrictora a la hipoxia, mayor flujo en la arteria uterina durante el embarazo, aumento del peso al nacer, aumento de la circunferencia craneal y un mayor consumo de O2, cuando se comparan estos parámetros con los habitantes de tierras más bajas no adaptados a la AA42-44.
En el embarazo a AA aumenta la sensibilidad ventilatoria secundaria a la hipoxia hasta 3veces, la ventilación en reposo (VR), la PaO2 y la SatO2. Esta hiperventilación incrementa el contenido arterial de oxígeno (CaO2). La ascendencia andina, identificada mediante 81 marcadores genéticos, se correlaciona con un aumento de la frecuencia respiratoria y volumen corriente bajo. Además, hay un aumento del volumen plasmático en un 40% y al no cambiar la masa de glóbulos rojos, la hemoglobina disminuye. Esta disminución de la hemoglobina se compensa con un incremento de la VR y SaO2, con resultado de un incremento del CaO2 a niveles similares a los anteriores al embarazo, modificaciones protectoras tanto para la madre como para el feto que va a nacer45.
Estudios muestran que varios genes tienen un papel clave y específico para regular el HIF y son responsables de la adaptación a la gran altitud en los andinos y tibetanos, y que varias regiones cromosómicas diferentes están implicadas en la supuesta respuesta a la selección46. Los andinos tienen niveles bajos de ET-1, un potente vasoconstrictor inducido por HIF-1, durante embarazos a baja o gran altitud. Sin embargo, las madres europeas aumentaron notablemente los niveles plasmáticos de ET-1 en AA. Se han identificado asociaciones significativas de polimorfismos de nucleótido único, variante genómica en la posición de una base única en el ADN, con el peso al nacer y la protección vascular. Estas adaptaciones, probablemente se han ido produciendo en los últimos 10.000 a 15.000 años en las poblaciones humanas que viven en el altiplano andino47.
En definitiva, las respuestas maternas para lograr un embarazo exitoso en AA dependerán, por lo tanto, de las características de ascendencia altitudinal y de la capacidad de adaptación individual.
Emergencias obstétricas y Unidades de Cuidados Intensivos: una mirada a LatinoaméricaEpidemiologíaEl ingreso en una Unidad de Medicina Intensiva (UMI) durante el durante el embarazo es poco común. Sin embargo, conlleva una morbimortalidad materna y fetal muy elevadas. La incidencia de ingreso en UMI es muy variada y oscila entre 0,7 a 13,5 por 1.000 partos48,49. Aunque no hay grandes diferencias en el perfil de ingreso en la UMI en los países en desarrollo en comparación con los desarrollados, sí la hay en cuanto a tasas de mortalidad, que oscila entre el 0 y el 14% en los desarrollados frente a 2-43% en los no desarrollados50,51.
Los datos referentes a Latinoamérica son muy dispersos y poco concluyentes. En un estudio realizado en La Paz (Bolivia) el índice de mortalidad es del 3,6%, índice que consideran relativamente bajo52, en otro realizado en Argentina la cifra es del 11,2%53, aunque en otro la cifra es 2,6%54. Sin embargo, los datos referentes a los motivos de ingreso en la UMI tienen unos resultados mucho más homogéneos siendo los trastornos hipertensivos del embarazo, más predominantes en países latinoamericanos y poco desarrollados50,52,53, la hemorragia obstétrica, más frecuente en países desarrollados o en hospitales privados de países pocos desarrollados48,51,54, y la sepsis/infección48-57. Un estudio realizado en Bolivia en La Paz sobre 401 casos de urgencias obstétricas mostró que el 47% de los casos tenía asociada una hemorragia severa y el 46% trastornos hipertensivos52. Indudablemente, aunque este estudio, que representa el 75% de los partos hospitalarios y recoge la mayoría de los embarazos y partos complicados en la zona, tiene el sesgo de estar en una gran ciudad donde las barreras prehospitalarias son menores por su facilidad de accesibilidad a la asistencia. Aun así otro estudio realizado en este entorno con salud maternal gratuita y accesible mostró que el 75% de las mujeres se encontraban en condiciones críticas al llegar58. Las principales barreras prehospitalarias que encontraron estuvieron relacionadas con las desigualdades sociales, geográficas y culturales, falta de recursos y desconfianza en el sistema. Otro ejemplo de barrera es el importante déficit de especialistas y camas de terapia intensiva que hay en algunos países como Bolivia. Antes de la pandemia de COVID-19, las Unidades de Terapia Intensiva ubicadas a partir de 2.500 m s. n. m. tenían un total de 255 camas y actualmente están en 291. En El Alto (4.150 m s. n. m.), que tiene un poco más del millón de habitantes, el número total de camas es 60. Se calcula que Bolivia solo tiene un 40% de las camas que necesita, el 60% están en el sector privado y el total de intensivistas apenas superan los 20059.
Unidades de Medicina Intensiva en la altitudEn la tabla 2 se exponen las unidades polivalentes de aquellos países latinoamericanos que tienen unidades situadas a partir de los 2.500 m s. n. m., haciendo referencia a su ubicación y a la altitud donde se encuentran. Estos datos han sido reportados por el CEMCA-FEPIMCTI. El número de EO oscila entre un 5 y 15% y entre el 5 y 20% precisaron ventilación mecánica. Esta cifra de EO es llamativa porque se trata de unidades polivalentes con una media de 10 camas. En un estudio realizado en una unidad de un centro de atención terciaria obstétrica con 76 camas, de ellas 4 de UCI, el número de urgencias hipertensivas, hemorragia y sepsis/infección fue el 21,08% de todos los ingresos de la UCI49.
Ubicación y altitud de las Unidades de Medicina Intensiva de América Latina que se encuentran a partir de los 2.500 m s. n. m
| Bolivia |
| El Alto: 4.150 m s. n. m. |
| Potosí: 4.090 m s. n. m. |
| Oruro: 3.706 m s. n. m. |
| La Paz 1: 3.640 m s. n. m. |
| La Paz 2: 3.200 m s. n. m. |
| Sucre: 2.690 m s. n. m. |
| Cochabamba: 2 570 m s. n. m. |
| Colombia |
| Ipiales: 2.898 m s. n. m. |
| Tunja: 2.782 m s. n. m. |
| Bogotá: 2.625 m s. n. m. |
| Chía: 2.562 m s. n. m. |
| Chiquinquirá: 2.556 m s. n. m. |
| San Juan de Pasto: 2.527 m s. n. m. |
| Ecuador |
| Tulcán: 2.980 m s. n. m. |
| Latacunga: 2.860 m s. n. m. |
| Quito: 2.850 m s. n. m. |
| Riobamba: 2. 764 m s. n. m. |
| Cuenca: 2.560 m s. n. m. |
| Ambato: 2.500 m s. n. m. |
| México |
| Toluca: 2.663 m s. n. m. |
| Metepec: 2.610 m s. n. m. |
| Ciudad Serdán: 2.526 m s. n. m. |
| Perú |
| Cajamarca: 2.720 m s. n. m. |
| Ayacucho: 2.781 m s. n. m. |
| Andahuaylas: 2.926 m s. n. m. |
| Huaraz: 3.052 m s. n. m. |
| Huancayo: 3.250 m s. n. m. |
| Cusco: 3.399 m s. n. m. |
| Huancavelica: 3.676 m s. n. m. |
| Juliaca: 3.824 m s. n. m. |
| Puno: 3.827 m s. n. m. |
| Cerro de Pasco: 4.380 m s. n. m. |
m s. n. m.: metros sobre nivel del mar.
La aplicación de principios de cuidados intensivos durante el embarazo en la altitud se basa en la comprensión de los cambios fisiológicos relacionados con el embarazo y la altitud y en las enfermedades exclusivas de las pacientes obstétricas. Un punto esencial en los cuidados intensivos en la altitud, que le imprimen un carácter diferencial, es la presencia de hipertensión pulmonar y mal crónico de montaña. Los cambios cardiovasculares fisiológicos del embarazo pueden exacerbar potencialmente las afecciones cardiacas y pulmonares60. En los Andes, la hipertensión pulmonar y el mal crónico de montaña o enfermedad de Monje la desarrollan entre el 5 y el 18% de sus habitantes61. La enfermedad de Monje, predominante en los andinos bolivianos de origen genético mixto o completamente europeo, se caracteriza por una eritrocitosis excesiva e hipoxemia, y con frecuencia se asocia a hipertensión pulmonar moderada o severa que puede evolucionar hacia un cor pulmonale, terminar en una insuficiencia cardiaca congestiva62 y complicar las urgencias obstétricas en la AA.
Otro punto importante está relacionado con la alteración de los gases arteriales. Los valores normales gasométricos en la altitud no son similares a los del nivel mar porque están condicionados por los cambios de la PB con la altitud y su influencia en el descenso progresivo de la presión de oxígeno ambiental, de la presión inspiratoria de oxígeno, de la presión alveolar de oxígeno y de la presión arterial de oxígeno. El residente de la altitud incrementa su volumen minuto respiratorio, eso genera mayor eliminación de CO2 y provoca una alcalosis respiratoria que se compensa con una disminución concomitante del bicarbonato. Este proceso de adaptación hace que los valores normales del análisis de gases arteriales del residente de la altitud correspondientes a la PaO2, PaCO2, SaO2 y CO3HNa sean inferiores con respecto al nivel del mar y que el pH se mantenga. A pesar de la caída de la PaO2, la cascada de oxígeno, que continúa funcionando eficazmente en la población residente en la altitud, garantiza la llegada de oxígeno a la célula y el funcionamiento mitocondrial, con independencia de la PO2 inspirada63.
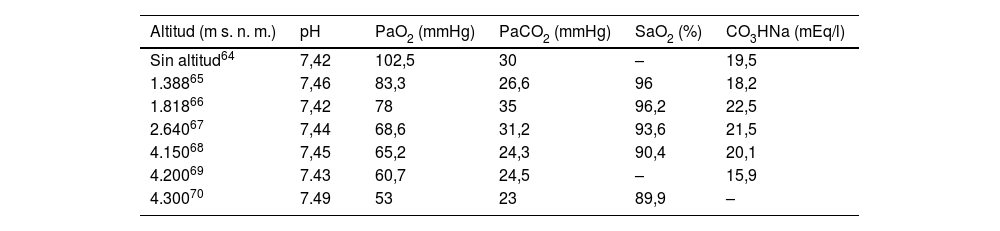
Las mujeres embarazadas tienen un mayor riesgo de desarrollar síndrome de distrés respiratorio del adulto en comparación con las mujeres no embarazadas56 y puede ser causado por procesos similares a los de la paciente no embarazada64. El análisis de los valores alterados de gases arteriales en sangre proporciona información muy útil sobre la enfermedad respiratoria y metabólica de la embarazada. En la tabla 364-70, se puede comprobar la variación de los valores medios de la gasometría arterial, reportados en el tercer trimestre del embarazo, en relación con la altitud. Se ha comprobado que la PCO2 de la mujer embarazada a AA es más baja que en mujeres no embarazadas66,67. La gasometría arterial, tomada con precaución, proporciona una valiosa información para el manejo de las urgencias obstétricas a muy alta altitud68. Las enseñanzas adquiridas en las UMI ubicadas en la altitud, durante la pandemia por COVID-19, ha ayudado mucho en la compresión y el manejo de los trastornos respiratorios71.
Evolución de los valores medios de la gasometría arterial, reportados durante el tercer trimestre del embarazo, desde el nivel del mar hasta los 4.300 m s. n. m
| Altitud (m s. n. m.) | pH | PaO2 (mmHg) | PaCO2 (mmHg) | SaO2 (%) | CO3HNa (mEq/l) |
|---|---|---|---|---|---|
| Sin altitud64 | 7,42 | 102,5 | 30 | – | 19,5 |
| 1.38865 | 7,46 | 83,3 | 26,6 | 96 | 18,2 |
| 1.81866 | 7,42 | 78 | 35 | 96,2 | 22,5 |
| 2.64067 | 7,44 | 68,6 | 31,2 | 93,6 | 21,5 |
| 4.15068 | 7,45 | 65,2 | 24,3 | 90,4 | 20,1 |
| 4.20069 | 7.43 | 60,7 | 24,5 | – | 15,9 |
| 4.30070 | 7.49 | 53 | 23 | 89,9 | – |
CO3HNa: bicarbonato de sodio; mEq/l: miniequivalentes/litro; mmHg:mm de mercurio; m s. n. m.: metros sobre el nivel del mar; PaCO2: presión parcial de dióxido de carbono; PaO2:presión parcial de oxígeno; SaO2: saturación arterial de oxígeno; %: porcentaje.
La ventilación mecánica debe ser congruente con los cambios anatómicos y cardiopulmonares y con las demandas metabólicas de la unidad fetoplacentaria del embarazo. El objetivo a nivel del mar es mantener la PaO2 materna en niveles entre 65-70mmHg, o superiores, para garantizar un suministro adecuado de oxígeno al feto60. En la altitud hay que evitar la hiperoxia, ya que las pacientes adaptadas viven en hipoxia crónica debida a su permanencia en la altitud. La gasometría puede servir de guía para conseguir valores similares a las diferentes altitudes donde residen (tabla 3). La hipercapnia permisiva no es una opción segura durante el embarazo ni desde el punto de vista fetal ni del materno72. La ventilación mecánica, además de asegurar el adecuado intercambio de gases, deberá minimizar el riesgo de lesión pulmonar, intentando que sea protectora, con volúmenes corrientes entre 6-8ml/kg, evitando una excesiva presión de distensión alveolar (< 14 cmH2O), con una presión meseta (< 30 cmH2O), y ajustando la CO2 a los valores considerados normales en la altitud geográfica en que se encuentre60,72.
ConclusionesLos embarazos críticos en la altitud aumentan su morbimortalidad a partir de los 2.500 m s. n. m.. Las residentes nativas parecen estar más protegidas contra los trastornos hipertensivos. Hay también otros factores que influyen como las desigualdades sociales, las barreras prehospitalarias y el desarrollo de las infraestructuras asistenciales. La gasometría arterial en la altitud se ve afectada por los cambios de la PB. El análisis de sus valores proporciona una información muy útil para el manejo de las urgencias obstétricas a muy alta altitud, especialmente de las enfermedades respiratorias y metabólicas.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Contribución de los autoresA. Avila-Hilari, M. L. Avellanas-Chavala realizaron la revisión bibliográfica, recogieron datos de las UMI a partir de 2.500 m s. n. m. y escribieron el manuscrito. Todos los autores leyeron, revisaron y aprobaron el manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.