El empleo de sistemas de oxigenación con membrana extracorpórea se ha incrementado significativamente en los últimos años; ante esta realidad, la Sociedad Española de Medicina Intensiva Crítica y Unidades Coronarias (SEMICYUC) ha decidido elaborar una serie de recomendaciones que sirvan de marco para el empleo de esta técnica en las Unidades de Cuidados intensivos. Los tres ámbitos de empleo de oxigenación con membrana extracorpórea más frecuentes en nuestro medio son: como soporte cardiocirculatorio, como soporte respiratorio y para el mantenimiento de los órganos abdominales en donantes. La SEMICYUC nombró una serie de expertos pertenecientes a los tres grupos de trabajo implicados (Cuidados Intensivos Cardiológicos y RCP, Insuficiencia Respiratoria Aguda y Grupo de trabajo de Trasplantes de SEMICYUC) que tras la revisión de la literatura existente hasta marzo de 2018, elaboraron una serie de recomendaciones. Estas recomendaciones fueron expuestas en la web de la SEMICYUC para recibir las sugerencias de los intensivistas y finalmente fueron aprobadas por el Comité Científico de la Sociedad. Las recomendaciones, en base al conocimiento actual, versan sobre qué pacientes pueden ser candidatos a la técnica, cuándo iniciarla y las condiciones de infraestructura necesarias de los centros hospitalarios o en su caso, las condiciones para el traslado a centros con experiencia.
Aunque desde un punto de vista fisiopatólogico, existen claros argumentos para el empleo de oxigenación con membrana extracorpórea, la evidencia científica actual es débil por lo que es necesario estudios que definen con más precisión qué pacientes se benefician más de la técnica y en qué momento deben iniciarse.
The use of extracorporeal membrane oxygenation systems has increased significantly in recent years; given this reality, the Spanish Society of Critical Intensive Care Medicine and Coronary Units (SEMICYUC) has decided to draw up a series of recommendations that serve as a framework for the use of this technique in intensive care units. The three most frequent areas of extracorporeal membrane oxygenation systems use in our setting are: as a cardiocirculatory support, as a respiratory support and for the maintenance of the abdominal organs in donors. The SEMICYUC appointed a series of experts belonging to the three working groups involved (Cardiological Intensive Care and CPR, Acute Respiratory Failure and Transplant work group) that, after reviewing the existing literature until March 2018, developed a series of recommendations. These recommendations were posted on the SEMICYUC website to receive suggestions from the intensivists and finally approved by the Scientific Committee of the Society. The recommendations, based on current knowledge, are about which patients may be candidates for the technique, when to start it and the necessary infrastructure conditions of the hospital centers or, the conditions for transfer to centers with experience.
Although from a physiopathological point of view, there are clear arguments for the use of extracorporeal membrane oxygenation systems, the current scientific evidence is weak, so studies are needed that define more precisely which patients benefit most from the technique and when they should start.
El empleo de los sistemas de oxigenación de membrana extracorpórea (ECMO) en adultos se ha incrementado sustancialmente en la última década y con resultados esperanzadores. Los avances tecnológicos tanto en el diseño de la bomba con equipos más simples y compactos y sobre todo con el uso de membranas mucho más biocompatibles y eficientes en el intercambio gaseoso, han permitido el uso prolongado y más seguro de la técnica, lo que sin duda ha contribuido a la difusión de la misma.
Diversos grupos de trabajo han comunicado resultados favorables en pacientes seleccionados aunque cuando se analizan en su conjunto con criterios estrictos, se pone de relieve la dificultad para extraer conclusiones con un alto grado de certeza. Con frecuencia, los estudios no disponen de un grupo control adecuado o presentan un alto grado de heterogeneidad entre ellos debido a diferencias en los criterios de inicio de ECMO o en los protocolos de manejo de los pacientes, lo que pone de manifiesto la débil evidencia científica con que nos movemos en este campo1,2.
A pesar de que se trata de una técnica invasiva que se utiliza en pacientes extremadamente graves y con una elevada tasa de complicaciones, el impacto de las mismas en la mortalidad es limitado3 por lo que, ante la realidad de su uso y aunque existe controversia en muchos aspectos relacionados tanto con la utilidad del empleo de ECMO como con su aplicación práctica, la Sociedad Española de Medicina Intensiva Crítica y Unidades Coronarias (SEMICYUC) se ha planteado elaborar una serie de recomendaciones a modo de líneas generales que sirvan de marco para el empleo de ECMO en las Unidades de Cuidados intensivos (UCI) de nuestro país. Clásicamente, el empleo de ECMO se ha enfocado como un medio de soporte cardiocirculatorio o como soporte respiratorio, sin embargo, en los últimos años va ganando terreno una nueva indicación orientada al mantenimiento normotérmico de órganos abdominales previo a su extracción en donantes de órganos. Los tres ámbitos de aplicación mantienen una estrecha relación con la Medicina Intensiva por lo que hemos creído conveniente incluir los tres bloques de recomendaciones: ECMO como soporte cardiocirculatorio, ECMO como soporte respiratorio y ECMO en el mantenimiento de órganos abdominales en donantes.
El empleo de ECMO requiere una serie de condiciones que van más allá de lo que este manuscrito pretende abordar. En la página web de la Extracorporeal Lung Support Organization (ELSO) (https://www.elso.org/), el lector interesado puede encontrar información sobre otros aspectos como riesgos de la técnica, necesidades de formación tanto de médicos como de enfermería en este campo y otros aspectos importantes para el empleo racional de esta técnica. En esta web se registra también la actividad y los resultados de los hospitales que ofrecen asistencia con ECMO, lo que proporciona una valiosa información. Desde aquí hacemos un llamamiento a los centros que realizan esta técnica para que colaboren en este registro.
MetodologíaLa decisión de elaborar las recomendaciones sobre el empleo de ECMO en UCI parte de la Junta Directiva de la SEMICYUC que tras reconocer la trascendencia del asunto, decidió nombrar un coordinador (EFM) para la elaboración de un documento sobre recomendaciones de uso de ECMO en UCI. Para ello, se contactó con los coordinadores de los tres grupos de trabajo implicados con el encargo de que nombrasen expertos por cada grupo para conformar el equipo de redacción del documento. Este equipo de redacción tenía la tarea de analizar la bibliografía, plantear las recomendaciones y servir de enlace con el resto de componentes de cada grupo de trabajo a los que se les trasladaron los diferentes borradores con el fin de recoger las modificaciones o sugerencias al documento. En octubre de 2016 se conformó el equipo de redacción que quedó compuesto por ML, OP y TG por el grupo de trabajo de Insuficiencia Respiratoria Aguda, MPF, JLPV y MSB por el grupo de trabajo de Cuidados Intensivos Cardiológicos y RCP y JJR y JMPV por el grupo de trabajo de Trasplantes de SEMICYUC. Los miembros del equipo de redacción solicitaron la colaboración de otros expertos cuando lo consideraban necesario (Anexo).
En noviembre de 2016 se realizó la primera teleconferencia para establecer el ámbito y el formato de las recomendaciones de cada grupo y acordar la metodología de trabajo. Cada grupo, utilizando los operadores boleanos habituales, realizó una búsqueda bibliográfica estructurada hasta marzo de 2018 en Medline/PubMed con las siguientes palabras clave: Circulatory Assistance, Cardiogenic shock, Cardiac transplantation, Transportation in ECMO, Venoarterial extracorporeal membrana oxygenation, acute respiratory distress syndrome, refractory hypoxemia, protective ventilation, ultraprotective ventilation, extracorporeal membrane oxygenation, extracorporeal CO2removal, ECMO referral, Outcome, Non heart beating donation, Normothermic abdominal perfusion. Esta búsqueda se ha suplementado con una lista de bibliografía relevante conocida.
Los acuerdos para la elaboración de las recomendaciones se realizaron por consenso, inicialmente entre los miembros del equipo de redacción mediante cuatro teleconferencias. Cuando no había unanimidad en algún punto durante la teleconferencia, se continuaba la discusión por vía electrónica hasta que la redacción final era aceptada por todo el grupo. Posteriormente se envió un borrador de las mismas a los diferentes grupos de trabajo para que realizasen aportaciones o sugerencias.
Las recomendaciones iniciales fueron presentadas en el LII Congreso Nacional de SEMICYUC donde todos los socios y asistentes pudieron comentar y realizar aportaciones.
Tras la redacción inicial, el documento fue revisado por el Comité Científico de la SEMICYUC y puesto a disposición de los socios durante 15 días en la web de SEMICYUC para recibir aportaciones. Pasado este periodo de tiempo se realizó la redacción final que fue la que se envió para publicación.
ResultadosRecomendaciones ECMO como asistencia circulatoriaRecomendación 1ECMO como soporte circulatorio está indicada en situaciones de shock cardiogénico refractario con una escala Interagency Registry for Mechanically Assisted Circulatory Support (INTERMACS 1),siempre como puente a un objetivo: recuperación, trasplante cardiaco, a la toma de decisiones terapéuticas o cambio a otro tipo de asistencia de larga duración.
El uso de ECMO como soporte circulatorio debe realizarse como parte de una estrategia terapéutica y con una finalidad definida. Como puente a recuperación en patologías potencialmente reversibles, puente al trasplante cardiaco, a otro tipo de asistencia de mayor duración o definitiva, o a la decisión si tenemos que realizar más pruebas antes de considerar al paciente candidato a trasplante cardiaco4–6.
La refractariedad del estado de shock se define como la persistencia de hipotensión y/o hipoperfusión tisular asociado a bajo gasto cardiaco (<2,2 L/min/m2), a pesar de tener una volemia óptima, el uso de fármacos inotrópicos y/o vasoactivos a altas dosis. Una elevada dosis de estos fármacos se asocia con elevada mortalidad y tras el inicio de ECMO se pueden reducir o retirar. Se consideran dosis elevadas de fármacos inotrópicos o vasoactivos según estudios: dopamina > 10μg/kg/min, noradrenalina > 0,5μg/kg/min, adrenalina > 0,1μg/kg/min, dobutamina > 10μg/kg/min, milrinona > 0,5μg/kg/min7.
La hipoperfusión se define como oliguria (< 30ml/h o<0,5ml/kg/h), extremidades frías, alteración mental y/o lactato sérico elevado (> 2,0 mmol/l).
El gasto cardiaco debería ser valorado por métodos calibrados y fiables (catéter en arteria pulmonar o termodilución transpulmonar) y/o por ecocardiografía8.
Recomendación 2Las indicaciones de ECMO circulatoria deben estar bien definidas para evitar implantes en situaciones premortem, en casos fútiles o en enfermos con contraindicaciones para la técnica.
La ECMO no es una técnica para ser utilizada como último recurso terapéutico ante situaciones premortem o en pacientes terminales, ya que en estos casos la mortalidad es del 100%. Para no realizar un uso inadecuado de la técnica hay que conocer correctamente las indicaciones y contraindicaciones de la misma2,9 (tablas 1 y 2).
Indicaciones de ECMO venoarterial
| • Shock cardiogénico secundario a infarto de miocardio que no responde al tratamiento y se ha realizado revascularización mediante intervencionismo coronario |
| • Pacientes en lista de espera para trasplante cardiaco que sufran deterioro hemodinámico |
| • Miocarditis fulminante o aguda |
| • Descompensación clínica de un cuadro de insuficiencia cardiaca aguda o crónica reagudizada que no responden al tratamiento y sobre los que se plantea una actuación resolutiva de su etiología |
| • Intoxicación aguda por fármacos cardiodepresores |
| • Pacientes con tormenta eléctrica que no responden a tratamiento antiarrítmico y/o ablación por radiofrecuencia |
| • Tromboembolismo pulmonar con disfunción grave del ventrículo derecho y shock |
| • Disfunción miocárdica asociada a la sepsis en casos muy determinados |
| • Pacientes que tras cirugía cardiaca no pueden ser desconectados de la circulación extracorpórea a pesar de una adecuada corrección quirúrgica |
| • Shock cardiogénico poscardiotomía refractario en los que existe una posibilidad razonable de recuperación o bien de reintervención quirúrgica |
| • Pacientes con fallo primario del injerto tras trasplante cardiaco |
| • Como soporte circulatorio durante la realización de ciertos procedimientos en pacientes de alto riesgo (intervencionismo coronario percutáneo, colocación de endoprótesis aórtica vía percutánea) |
| • Parada cardiaca en casos muy concretos* |
| • Pacientes con insuficiencia respiratoria aguda grave que precisarían de ECMO venovenoso pero que presentan una disfunción uni- o biventricular asociada |
* Es una indicación con muchas controversias en la actualidad. Es importante conocer el momento de parada y la realización de maniobras de resucitación por testigos. Posiblemente se benefician más pacientes con parada secundaria a ritmos desfibrilables y en paradas intrahospitalarias con disponibilidad inmediata de la técnica. Si no hay recuperación de ritmo efectivo hay que considerar la ECMO como sistema de mantenimiento de la perfusión de órganos para la posible donación de los mismos10.
Contraindicaciones de ECMO venoarterial
| Absolutas | Relativas |
|---|---|
| • Enfermedad crónica terminal | • Edad* |
| • Neoplasia no controlada | • Contraindicaciones absolutas de anticoagulación |
| • Daño neurológico irreversible diagnosticado | • Obesidad mórbida (IMC > 40 kg/m2) |
| • Insuficiencia aórtica grave | |
| • Disección aórtica no corregida | |
| • Sepsis con fracaso multiorgánico (definido como ≥ 2 órganos con al menos ≥ 2 puntos en la escala SOFA sin contar el cardiovascular) | |
| • Corazón no recuperable y no candidato para trasplante ni para colocación de otro tipo de asistencia ventricular |
IMC: índice de masa corporal; SOFA: Sequential Organ Failure Assessment Score.
La ECMO no debe ser la primera medida terapéutica en el shock cardiogénico, pero se ha demostrado que la precocidad de su colocación permite obtener mejores resultados.
Antes de colocar este tipo de asistencia se ha de optimizar el tratamiento médico y/o quirúrgico ya que la ECMO es una técnica no exenta de complicaciones11–13.
Es difícil determinar el momento idóneo del implante de ECMO pero debe realizarse antes de que exista un fracaso multiorgánico establecido, por lo que hay que realizar una monitorización y seguimiento estricto de ciertas variables clínicas y analíticas para elegir de forma precoz su colocación14.
La escala SAVE (www.save-score.com) recomendada por la ELSO, que asigna puntuaciones a varios de estos parámetros para predecir la mortalidad tras la entrada en ECMO, puede servir de ayuda para la toma de decisiones15.
Los parámetros pre-ECMO asociados a mal pronóstico son:
- •
Peso (< 65 kg o > 90 kg).
- •
Edad (> 53 años, sobre todo mayores de 63).
- •
Hemodinámicos: presión de pulso (≤ 20mmHg), PA diastólica (>40mmHg), parada cardiaca.
- •
Respiratorios: presión inspiratoria pico (>20mmHg), ventilación mecánica (menor supervivencia cuantas más h).
- •
Renales: fracaso renal agudo, fracaso renal crónico, HCO3 (<15mmol/l).
- •
Otros fallos orgánicos: disfunción del sistema nervioso central, fallo hepático.
ECMO como soporte circulatorio debe colocarse en centros especializados para garantizar los mejores resultados. Estos hospitales deben disponer de amplia experiencia en la técnica así como de otras especialidades médico-quirúrgicas y de laboratorio para poder realizar un manejo adecuado de las posibles complicaciones derivadas de la asistencia circulatoria o del shock cardiogénico.
La ECMO consiste en una circulación mecánica extracorpórea no exenta de complicaciones por lo que se requiere tener experiencia por parte de todo el personal que interviene en el tratamiento de los pacientes sometidos a esta técnica16. Se precisa de formación y experiencia en todo el proceso: sentar la indicación y el momento de su inicio, la elección de la canulación óptima17, el manejo diario, la prevención y detección precoz de complicaciones y su resolución de forma adecuada. Se necesita un equipo multidisciplinar de diferentes especialidades liderado por médicos especialistas en el paciente crítico, un equipo de enfermería con adecuada formación y una serie de técnicas y servicios auxiliares disponibles en los centros durante 24 h todos los días del año. Este equipo debe además encargarse de la formación continua del personal, la elaboración de protocolos, checklist y de un registro de casos con su revisión y análisis posterior.
Una vez implantada la técnica, debe plantearse una estrategia terapéutica individualizada y multidisciplinar con cada paciente: cómo y cuándo iniciar el proceso de desconexión de la ECMO cuando exista recuperación de la función miocárdica, indicar la inclusión en lista de espera de trasplante cardiaco o contraindicar el mismo de forma temporal o definitiva, indicar la colocación de una asistencia de mayor duración (tanto como puente a la recuperación como puente al trasplante) o de una asistencia definitiva ante la contraindicación de trasplante. Elegir la mejor opción para cada paciente requiere una adecuada formación y experiencia de todo el equipo, la cual se deriva de una casuística elevada del uso de ECMO.
La ELSO recomienda que los centros de ECMO deben ser hospitales terciarios y con una cantidad mínima de casos anuales para que la técnica sea considerada coste-efectiva16. El número de ECMO/centro/ año no está exactamente determinado, pero según las últimas recomendaciones de expertos este debe ser superior a 30 procedimientos (incluyendo ECMO venovenosos, pero con una proporción importante de venoarteriales)18,19.
Recomendación 5Los traslados desde centros sin programa ECMO a centros de referencia para esta técnica se realizarán previa valoración de la estabilidad clínica para decidir implantar o no el dispositivo antes del traslado. Los traslados desde centros con disponibilidad de ECMO a centros con programa de trasplante cardiaco se realizarán cuando sean candidatos al mismo y previa estabilización clínica con la asistencia circulatoria.
Los programas de transporte interhospitalario son necesarios para garantizar la accesibilidad a la técnica de todos los ciudadanos y proporcionar un tratamiento óptimo independientemente del hospital donde sean asistidos. La posibilidad de acceso a ECMO debe considerarse como una garantía del principio de igualdad, no obstante, dadas las características de la técnica, esta requiere ser realizada en centros especializados y con una serie de requisitos y servicios para mejorar el pronóstico los pacientes20.
Si un paciente en shock cardiogénico es candidato a ECMO, ante la ausencia de contraindicaciones, debe ser trasladado de forma precoz a su centro de referencia para dicha técnica21. Ante esta situación se evaluará el estado clínico y hemodinámico del paciente para decidir si puede ser trasladado sin asistencia. Una vez en el centro de destino se reevaluará para implantar o no la ECMO finalmente.
Si existe inestabilidad clínica se debe colocar previamente la asistencia para realizar un transporte con garantía, por lo que el equipo ECMO se trasladará con el material y personal necesario al hospital donde se encuentre el paciente. Iniciada la ECMO y tras estabilización del paciente se procederá a su traslado al hospital de referencia para proseguir con la terapia y demás cuidados del paciente crítico. En la elección del modo de transporte con el paciente con ECMO (terrestre o aéreo es lo más frecuente o marítimo si fuera preciso) hay que tener en cuenta la disponibilidad de los medios de emergencias extrahospitalarias, la distancia, la climatología, la existencia de helipuerto en el hospital de procedencia y ciertas características del paciente (como altura, peso y situación clínica). Una vez en el centro de destino se reevaluará de nuevo la indicación y si se decide, se colocará a pie de cama.
Se ha comprobado que el transporte con ECMO con un equipo con experiencia, es seguro y factible con mínimas complicaciones durante el mismo, y la supervivencia es equiparable al grupo de pacientes que se coloca en hospital de referencia22.
En los centros con ECMO que no dispongan de programa de trasplante cardiaco y el paciente lo precise, se deberá acordar con el centro trasplantador el momento adecuado para realizar su traslado e inclusión en lista de espera.
Es necesario crear un programa dentro de cada región o comunidad autónoma que establezca el flujo de pacientes subsidiarios de asistencia circulatoria a los centros con ECMO y/o centros trasplantadores. También se debería realizar un consenso de manejo de estos pacientes (pre- y post-ECMO) entre los diferentes centros implicados en el proceso (locales, centros ECMO y centros ECMO-trasplantador).
Sería necesario contar con el apoyo institucional sanitario para tener en España diferentes programas de equipo ECMO móvil para dar asistencia igualitaria a todos los ciudadanos23.
Recomendaciones de uso de ECMO en insuficiencia respiratoriaRecomendación 6ECMO venovenosa es una técnica compleja de alto flujo que debe considerarse con precocidad en pacientes graves con insuficiencia respiratoria refractaria a otras medidas.
La ECMO venovenosa es un sistema extracorpóreo que permite oxigenar, depurar CO2 y facilitar la ventilación mecánica (VM) protectora o ultraprotectora mediante dos cánulas venosas gruesas22–30 que permitan el flujo de sangre necesario. Pueden utilizarse cánulas de doble luz, cuyo uso en insuficiencia respiratoria hipoxémica está limitado por el flujo. Dichos flujos oscilan entre 3-5 l/min y menores para depurar CO2 y realizar una ventilación protectora o ultraprotectora, y hasta 5-7 l/min en los casos de hipoxemia refractaria a otras medidas24. Puede asociar múltiples complicaciones, siendo las más frecuentes las hemorrágicas, descritas hasta en un 60% de los pacientes (menos frecuentes y graves con el uso de los nuevos sistemas) seguidas de las infecciosas1,3.
Hoy está considerada como «terapia de rescate» en insuficiencia respiratoria refractaria tras fracaso de otras medidas que deben incluir siempre el uso de VM protectora: Vt 4-8ml/kg de peso ideal; presión meseta (Pm) ≤ 30 cmH2O) y plantear al menos un cambio a decúbito prono (DP) salvo contraindicación25 y el uso de bloqueantes neuromusculares al menos 48 h26. Debe existir una recuperación predecible de la enfermedad que motiva la insuficiencia respiratoria o establecerse como puente al trasplante de pulmón.
El momento óptimo para instaurar una ECMO es controvertido y no está establecido, pero la precocidad en su inicio antes de que se inicie el fracaso multiorgánico mejora el pronóstico27.
Los resultados del estudio EOLIA28, recientemente publicados, muestran que el uso de ECMO precoz en el síndrome de distrés respiratorio agudo (SDRA) muy grave reduce la mortalidad a los 60 días pero no de manera significativa respecto a un abordaje convencional que incluye la ECMO como terapia de rescate (35% versus 46%; p=0,09). Ambos grupos eran homogéneos en cuanto a gravedad (SOFA 10,8±3,9 en el grupo ECMO; 10,6±3,5 en el grupo control), ramdomizados después de 34 h de media de VM y con un cociente PaO2/FiO2 de 73±30 y 72±24 respectivamente). No obstante, un 28% de los pacientes del grupo control finalmente recibieron ECMO por hipoxemia refractaria, falleciendo el 57%. Este subgrupo de pacientes más graves presentaban un cociente PaO2/FiO2 más bajo, lactato más elevado, mayor afectación cardiaca y parada cardiorrespiratoria pre-ECMO en 9 casos.
La ELSO sugiere indicar ECMO en insuficiencia respiratoria hipoxémica con una PaO2/FiO2<100 con FiO2 > 0,9 y/o escala Murray ≥ 3, índice de oxigenación >80 a pesar de tratamiento óptimo durante 6 h o menos29. Otros grupos establecen una PaO2/FiO2<50 con FiO2 1 a pesar del uso de VM protectora y al menos un cambio a DP durante 3 h25. En el caso de la insuficiencia respiratoria hipercápnica, una PaCO2 > 80mmHg o una imposibilidad para ventilar manteniendo una Pm<30 cmH2O o una retención de CO2 a pesar de Pm > 30 cmH2O25 constituirían otras indicaciones de la técnica.
Una vez iniciado el soporte ECMO se recomienda el mantenimiento de una ventilación protectora o ultraprotectora (Vt 3-4ml/kg; Pm<25 cmH2O)30.
Las indicaciones y contraindicaciones de la ECMO como soporte respiratorio figuran en la tabla 3, siendo la mayoría de ellas contraindicaciones relativas.
Indicaciones y contraindicaciones de la ECMO VV
| Indicaciones de ECMO VV |
|---|
| SDRA: neumonía de cualquier etiología, síndromes de aspiración, proteinosis alveolar, patología obstétrica, síndromes de inhalación |
| Obstrucción de la vía aérea, contusión pulmonar, fístula broncopleural |
| TP: puente, soporte intraoperatorio respiratorio, DPI (< 7 días) |
| Estatus asmático |
| Hemorragia pulmonar o hemoptisis masiva |
| Hipercapnia (pH < 7,20) y/o PaCO2 > 80 mmHg Imposibilidad para mantener Pm < 30 cmH2O |
| Vasculitis pulmonar |
| Contraindicaciones de ECMO VV |
|---|
| Enfermedad pulmonar sin recuperación predecible de la función pulmonar si no está indicado un TP |
| Contraindicaciones para la anticoagulación |
| Edad > 65 años (evidencia más limitada en este grupo de edad). Es contraindicación relativa |
| FMO con SOFA > 15 puntos |
| VM > 7días (especial consideración con Pm>30 cmH2O, imposibilidad para PEEP>10 cmH2O, FiO2 > 0,9). Es contraindicación relativa |
| Inmunosupresión grave farmacológica (neutrófilos < 400/mm3) |
| Coma tras parada cardiaca |
| Comorbilidades: enfermedad maligna activa, enfermedad cardiaca crónica, enfermedad pulmonar no reversible y/o no trasplantable, cirrosis con ascitis, enfermedad neurológica irreversible |
| Lesiones hemorrágicas o potencialmente hemorrágicas del SNC |
| Canulación imposible |
DPI: disfunción primaria del injerto; FMO: fracaso multiorgánico; SDRA: síndrome de distrés respiratorio agudo; SNC: sistema nervioso central; SOFA: Sequential Organ Failure Assessment Score; TP: trasplante de pulmón; VM: ventilación mecánica.
Se recomienda que la ECMO venovenosa forme parte de un algoritmo de manejo global que debe incluir de manera obligatoria el uso de VM protectora y al menos un cambio a decúbito prono.
La utilización de ECMO venovenosa en el tratamiento del síndrome de distrés respiratorio del adulto debe de considerarse una terapéutica de rescate que debe indicarse caso a caso. Las mejorías tecnológicas han hecho que esta técnica sea más segura y fácil de usar permitiendo una utilización más liberal de la misma. Sin embargo, la aplicación de la misma debe de hacerse de forma metódica y organizada tal como recomiendan diversas organizaciones y, a la vista de los datos existentes, es preciso evaluar anticipadamente su uso por el riesgo inherente a la misma o unas indicaciones inadecuadas31,32.
Todos los estudios publicados o en marcha incluyen pacientes con SDRA grave con unas características clínicas determinadas, tal como se muestra en la tabla 4.
Criterios gasométricos y ventilarorios utilizados en los diferentes estudios
| Consenso francés25 | ELSO29 | CESAR33 | EOLIA28 | |
|---|---|---|---|---|
| Criterios gasométricos | PaO2/FiO2<50 con FiO2=1 durante > 3 h | PaO2/FiO2 < 150 con FiO2 > 0,9 y/o un score de Murray 2-3 | SaO2< 90% con FiO2 >0,9 durante 12 o más h | PaO2/FiO2 < 50 con FiO2 > 0,8 durante más de 3 h |
| PaO2/FiO2<80 con FiO2=1 durante > 6 h | PaO2/FiO2 < 80 con FiO2 > 0,9 y/o un score de Murray 3-4 | pH < 7,20 de causa respiratoria o metabólica | PaO2/FiO2 < 80 con FiO2 > 0,8 durante más de 6 h | |
| pH < 7,20 durante > 6 h | PaCO2 > 80mmHg con Pplat < 30cm H2O | pH< 7,25 durante > 6 h con FR > 35 rpm | ||
| Criterios ventilatorios | Vt: 4-8 ml/kg | ------ | Vt: 4-8 ml/kg | Vt: 6 ml/kg |
| PEEP (elevada) | ------ | ------ | PEEP ≥ 10cm H2O | |
| Presión meseta ≤ 30cm H2O | ------ | Presión meseta | Presión meseta ≤ 32cm H2O | |
| Maniobras de reclutamiento: sí, decúbito prono | ------ | ≤ 30cm H2O | Maniobras de reclutamiento: sí, decúbito prono |
A ello hay que añadir que los pacientes han recibido una ventilación protectora adecuada y se han realizado maniobras de reclutamiento, preferiblemente el prono, antes de la utilización de ECMO venovenosa34.
Recomendación 8Las indicaciones potenciales de ECMO venovenosa como terapia de rescate son aquellas que causan insuficiencia respiratoria aguda grave hipoxémica y/o hipercápnica con recuperación predecible de la función pulmonar.
La ECMO venovenosa se puede utilizar en pacientes con insuficiencia respiratoria aguda grave en los que la ventilación mecánica no puede mantener una oxigenación o un lavado de CO2 aceptable y de forma mantenida (tabla 3). Esta situación clínica puede aparecer en el SDRA o en el estatus asmático35–37. Además, la ECMO venovenosa puede utilizarse en aquellos pacientes en los que el esfuerzo por mantener una adecuada oxigenación tiene un riesgo elevado de inducir una lesión pulmonar asociada al ventilador. En este caso, el empleo de ECMO venovenosa permite dejar «el pulmón en reposo» disminuyendo las presiones de la vía aérea y el volumen corriente38. Debido a las complicaciones asociadas a la técnica y a la falta de suficientes estudios que ratifiquen su eficacia, la selección de pacientes debe de ser cuidadosa.
Las contraindicaciones absolutas son: pacientes moribundos con fracaso multiorgánico establecido, pacientes con mal pronóstico a corto plazo o con comorbilidades graves, o enfermedad neurológica avanzada. Las contraindicaciones relativas son: ventilación mecánica de más de 7 días con presiones de vía aérea elevadas, pacientes añosos, dificultad para disponer de accesos vasculares y contraindicaciones para anticoagulación39. Existen escalas que permiten evaluar el riesgo y predecir el riesgo de mortalidad en estos pacientes40,41.
Recomendación 9Se recomienda el traslado de estos pacientes a centros con experiencia o de referencia donde la ECMO venovenosa forme parte del manejo global del paciente con insuficiencia respiratoria.
El manejo de pacientes con ECMO en centros especializados se asocia a una menor mortalidad33,42–44, por lo que se debe considerar el traslado de los pacientes candidatos a ECMO a centros de referencia o con experiencia en la técnica. El transporte a estos centros debe realizarse con las máximas condiciones de seguridad, valorando la posibilidad de deterioro clínico si el transporte se realiza con respirador convencional por lo que en tal caso, se planteará el traslado con ECMO45.
El traslado en ECMO es seguro siempre que se realice por un equipo experto46–48. El porcentaje de complicaciones y la mortalidad es comparable entre los pacientes trasladados en ECMO y aquellos en que el dispositivo es implantado en el centro ECMO49.
Los criterios de consulta inmediata para traslado a centro de referencia en insuficiencia respiratoria incluirían: la hipoxemia grave con PaO2/FiO2<60mmHg o una PaO2/FiO2<100mmHg y/o PaCO2 > 100mmHg durante más de una hora tras tratamiento optimizado y fracaso de otras terapias50. Se han establecido también un pH<7,2, puntuación en la escala de Murray > 2,5, una FiO2 no mayor de 0,8 durante 8 días y una presión meseta no mayor de 30 cmH2O durante 7 días como criterios de traslado a un centro ECMO51.
Recomendación 10Los sistemas ECCO2R (sistemas depuradores de CO2) son dispositivos de bajo flujo que permiten depurar CO2de manera eficaz. Tendrían indicaciones posibles muy precisas, como la facilitación de la ventilación protectora, pero aún no hay evidencia para plantear sus indicaciones.
Los sistemas ECCO2R (sistemas depuradores de CO2) constituyen una técnica de soporte vital extracorpóreo con dispositivos de bajo flujo que permiten depurar PaCO2 de manera eficaz. Tendrían indicaciones posibles muy precisas, como la facilitación de la ventilación protectora, pero aún no hay evidencia para plantear sus indicaciones. Los sistemas ECCO2R son dispositivos más sencillos que la ECMO y están considerados como técnicas de soporte respiratorio parcial. Respecto a la ECMO, estos sistemas requieren flujos de sangre menores, oscilando entre 250ml/min y 1,5-2 l/min, poseen una superficie de membrana menor, e igualmente requieren anticoagulación sistémica52,53. Pueden ser sistemas arteriovenosos sin bomba o venovenosos, aunque la tendencia actual serían los sistemas venovenosos con canulación única de doble luz ya que poseen menor número de complicaciones vasculares54,55. Permiten una depuración de CO2 eficaz sin contribuir de manera directa a la oxigenación56. En el paciente con enfermedad pulmonar obstructiva crónica estos dispositivos podrían ser considerados en el manejo de la insuficiencia respiratoria hipercápnica para evitar la ventilación mecánica invasiva, para facilitar su retirada, en no respondedores a ventilación no invasiva y para facilitar la misma56,57, aunque no están exentos de complicaciones58. En el SDRA la evidencia es más limitada, y su uso va más dirigido al control de la hipercapnia durante el uso de VM protectora o ultraprotectora (Vt 3-4ml/kg; Pm<25cmH2O) en el SDRA moderado57 y moderado-grave, donde estamos pendientes de los resultados de estudios clínicos experimentales59,60.
En definitiva, los sistemas ECCO2R pueden considerarse una estrategia terapéutica adyuvante prometedora para el tratamiento de pacientes con exacerbaciones graves de la enfermedad pulmonar obstructiva crónica, así como para la aplicación de ventilación protectora o ultraprotectora en pacientes con SDRA sin hipoxemia potencialmente mortal. Sin embargo, dada la metodología observacional de la mayoría de los estudios disponibles y las diferencias en las características técnicas y el rendimiento de los dispositivos actuales, el balance de riesgos y beneficios a favor o en contra de ECCO2R en dichas poblaciones de pacientes sigue sin estar claro.
Recomendaciones de uso de ECMO en donacion de órganosRecomendación 11La perfusión abdominal normotérmica con ECMO (PAN-ECMO) debe ser considerada como técnica de preservación in situ en el donante de órganos abdominales en asistolia controlada.
El uso de la perfusión abdominal normotérmica con ECMO como método de preservación de órganos abdominales en el donante en asistolia controlada, está adquiriendo cada vez más importancia en nuestro país61 a partir de los buenos resultados publicados en experiencias tanto internacionales62,63 como nacionales64. Su uso es compatible con la donación pulmonar en la que prima la cirugía superrápida con perfusión fría65 y se extiende, en experiencias recientes, a la preservación y extracción cardiaca66. Esta técnica permite recuperar los órganos abdominales del daño isquémico, especialmente el hígado67. Además reduce la urgencia del procedimiento quirúrgico y con ello la iatrogenia que a veces ocasiona la cirugía superrápida68. Se facilita la logística de todo el proceso, permitiendo valorar de forma tranquila órganos dudosos o marginales, ya que posibilita la intervención activa sobre el ambiente de preservación de los órganos y añade la capacidad de realizar determinaciones de marcadores de viabilidad y calidad durante el tiempo de mantenimiento. Además, nos permite realizar biopsias y analizar hallazgos intraoperatorios (nódulos, esteatosis etc.).
Recomendación 12Si no se dispone de esa tecnología, deben establecerse acuerdos de colaboración con hospitales que cuenten con ella y que puedan desplazarse.
La utilización en el ámbito de los cuidados intensivos del oxigenador de membrana extracorpóreo ha experimentado un importante incremento en los últimos años en relación con la mejoría en los circuitos de ECMO y la experiencia acumulada en circunstancias especiales como las pandemias de influenza A serotipo H1N133,69. Aún así se trata de un procedimiento complejo que se debe concentrar en centros con experiencia suficiente, según recomendaciones de la Extracorporeal Life Support Organization16.
Por otra parte, según datos de la Organización Nacional de Trasplantes, hay actualmente 91 hospitales en nuestro país con programa de donación en asistolia controlada70. Evidentemente muy pocos de estos hospitales disponen de ECMO para su uso en Cuidados Intensivos y, por tanto, tampoco para la perfusión abdominal normotérmica en el donante en asistolia controlada.
La experiencia con el desplazamiento interhospitalario de un equipo móvil de apoyo para la preservación de órganos abdominales en Andalucía71 o la creación de un equipo móvil dependiente de la Consejería de Sanidad como se ha organizado en la Comunidad de Madrid72 pone de manifiesto el beneficio de contar con intensivistas coordinadores de trasplantes experimentados tanto en el manejo del ECMO como en la donación en asistolia controlada y la utilidad de fomentar alianzas entre hospitales para incrementar el potencial de donación de nuestras Unidades de Cuidados Intensivos.
Recomendación 13Antes de iniciar el uso de ECMO tras el fallecimiento del donante y durante el desarrollo del procedimiento, debe asegurarse la perfecta oclusión de la aorta torácica.
La posibilidad de recuperación de pulso del donante tras la declaración de fallecimiento, cuando se usa la perfusión abdominal normotérmica con ECMO, puede generar inquietud desde el punto de vista ético73. Esta situación solo puede producirse cuando no se garantiza la oclusión de la aorta torácica.
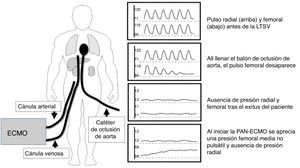
Es fundamental asegurar el adecuado inflado del balón y la correcta colocación del catéter de oclusión aórtico no solo para evitar una hipotética recuperación de pulso sino también para garantizar la adecuada perfusión de los órganos y restringir la preservación al territorio abdominal (fig. 1)74,75.
Para ello deben seguirse los siguientes pasos76.
- •
Antes de la limitación del tratamiento de soporte vital se canalizará una arteria radial izquierda junto a las cánulas arterial y venosa y el catéter de oclusión de aorta.
- •
Llenar el balón del catéter de oclusión, manteniéndolo tan solo durante unos segundos, al mismo tiempo que se monitoriza las presiones radial y femoral. La onda de pulso femoral debe desaparecer mientras se mantiene la de pulso radial. Se anotará el volumen de llenado como el volumen mínimo de oclusión de aorta a utilizar durante la perfusión abdominal normotérmica.
- •
Comprobar después, mediante control radiológico, la posición correcta del catéter de oclusión a nivel de la aorta torácica, fijarlo adecuadamente.
- •
Después de la declaración de éxitus, llenar el balón de oclusión e iniciar el ECMO.
- •
Durante la perfusión abdominal normotérmica se debe mantener la monitorización de ambas presiones radial y femoral. La línea femoral debe medir la presión no pulsátil conseguida con el flujo del ECMO, mientras la línea radial se mantiene en los valores basales posparada cardiaca.
- •
Si la presión en la arteria radial sube paralelamente al incremento en la presión femoral o aparece actividad eléctrica, se debe parar inmediatamente el ECMO, comprobar la correcta posición del catéter de oclusión y reanudar la perfusión abdominal normotérmica después de un nuevo periodo de observación de cinco min.
Debe corregirse la hipovolemia, anemia, acidosis o cualquier otro tipo de alteración del medio interno, manteniendo al donante como se haría con cualquier enfermo crítico.
Se recomienda asegurar los siguientes parámetros de preservación:
- 1.
Temperatura del circuito: 37°C.
- 2.
pH: 7,35-7,45.
- 3.
PaO2: 100-150mmHg.
- 4.
Hematocrito > 20%.
- 5.
Sodio, potasio, glucosa, lactato dentro del rango de normalidad de laboratorio77.
Es conveniente la utilización de gráficas de registro de todas estas variables, testadas de modo periódico cada 20 o 30 min, y realizar las correcciones adecuadas en cuanto a reposición de volumen, sangre, bicarbonato y para el mantenimiento de la normalidad de otros parámetros (sodio, potasio, glucosa, lactato), con el fin de disponer de la información más completa posible sobre la calidad de la preservación74.
Recomendación 15La PAN-ECMO debe mantenerse durante el tiempo necesario para permitir la recuperación hepática tras el estrés isquémico y una adecuada valoración de viabilidad previa al trasplante.
La duración del tiempo de preservación en recirculación normotérmica es un punto trascendente aún no dilucidado. No existe un tiempo mínimo útil establecido para alcanzar la recuperación celular deseada y la duración del mantenimiento de estos donantes se ha decidido por los diferentes grupos de modo empírico. Un tiempo demasiado corto conduciría a una recuperación celular incompleta después del estrés isquémico y a una posible evaluación insuficiente del injerto. Por el contrario, tiempos demasiado prolongados llevarían a una inestabilización del sistema y a la recirculación prolongada de elementos nocivos74.
El tiempo medio recogido en las experiencias nacionales e internacionales se encuentra próximo a los 90-120 min77.
DiscusiónLas presentes recomendaciones sobre el empleo de ECMO en Medicina Intensiva pretenden reflejar el horizonte de la práctica actual o potencial del empleo de esta técnica en adultos. La falta de estudios aleatorizados en muchas áreas se traduce en que algunas recomendaciones están basadas en opinión de expertos y en la experiencia consolidada de algunos centros, por lo que no se puede descartar que en próximas ediciones y en base a nuevas evidencias científicas, algunas recomendaciones sufran cambios sustanciales.
En el presente manuscrito se realizan recomendaciones para tres situaciones diferentes: como soporte circulatorio (ECMO venoarterial), como soporte respiratorio ECMO venovenoso) y en el mantenimiento de órganos en donantes (ECMO regional). Dentro de las recomendaciones de ECMO como soporte respiratorio se ha incluido una recomendación de empleo de ECCO2R. Esta inclusión puede resultar controvertida ya que evidentemente, la ECCO2R no es una técnica de oxigenación sino de depuración de CO2. No obstante, se trata de un sistema de soporte respiratorio con circulación extracorpórea y comparte aspectos prácticos con los sistemas de ECMO por lo que se ha considerado pertinente su inclusión en el texto.
Aunque el manuscrito se ha estructurado separando las indicaciones tanto de soporte circulatorio como de soporte respiratorio, en ocasiones pueden concurrir ambas condiciones. En estas circunstancias la experiencia del equipo es crucial para decidir la técnica y la estrategia de ECMO a emplear. Por otro lado, el grado de consolidación de la técnica es diferente en cada uno de los tres escenarios. El empleo de ECMO como soporte circulatorio ha sido relativamente frecuente en centros especializados y tradicionalmente se ha aceptado como un recurso útil como puente al trasplante cardiaco, miocarditis fulminante y otras situaciones de fallo de bomba. En el fracaso respiratorio por el contrario, el empleo de ECMO sufrió dos reveses importantes con la publicación de dos ensayos clínicos negativos78,79, desde entonces, su empleo permaneció muy restringido durante casi cuatro décadas a unos pocos centros que han acumulado experiencia en este campo80. Tras la epidemia de influenza A (H1N1) en 2009 y los resultados esperanzadores con el uso de ECMO durante la misma31,65 se aprecia un resurgimiento con fuerza de esta técnica, lo cual plantea no solo retos científicos sino también éticos por diferentes aspectos (ausencia de evidencia científica de calidad, accesibilidad a la técnica en circunstancias de recursos limitados, incierta relación beneficio/futilidad terapéutica, riesgo de complicaciones). De hecho, en unas recientes guías de tratamiento de pacientes con SDRA, el empleo de ECMO se considera sin recomendación definitiva debido a la ausencia de evidencia81. Con la publicación del estudio EOLIA28, las dudas sobre su eficacia están lejos de disiparse.
El estudio EOLIA se trata de un ensayo de asignación aleatoria y multicéntrico que incluyó unidades de cuidados intensivos de Francia, de Estados Unidos y de Canadá. En total, se reclutaron 124 pacientes con SDRA grave tratados con ECMO venovenoso asociado a ventilación mecánica convencional y 125 pacientes con SDRA tratados solo con ventilación mecánica convencional (ventilación mecánica de protección pulmonar con volumenes tidal 6mL/kg peso predicho, uso de relajantes neuromusculares, ventilación en decúbito prono durante periodos prolongados y maniobras de reclutamiento) y se permitió el cruzamiento de los pacientes asignados en el grupo control al grupo ECMO, si persistía la hipoxemia refractaria a pesar de las medidas utilizadas o a criterio del médico responsable. El desenlace primario fue la mortalidad a día 60 mediante un análisis por intención de tratar.
Los autores encontraron una mortalidad cruda a los 60 días del 35% (44/124 pacientes) en el grupo ECMO y 46% (57/125) en el grupo control, mostrando una reducción absoluta del riesgo (RAR) del 10% (intervalo de confianza [IC]-2% al 22%) pero el ensayo se detuvo después de la inclusión del 75% de los 331 pacientes planificados. La conclusión de los autores ha sido que «la ECMO no disminuye la mortalidad significativamente frente a una estrategia de ventilación mecánica convencional en la que se incluye el empleo de ECMO como terapia de rescate». No obstante hay que considerar que se produjo un 28% de cruzamiento de pacientes en el grupo control que recibió ECMO por hipoxemia refractaria a una media de 6,5±9,7 días después de la aleatorización (mediana, 4 días, rango intercuartil, 1 a 7). Estos pacientes tuvieron valores significativamente más altos que los pacientes en el grupo de control con respecto a la presión meseta inicial media (31,7±5,5 versus 28,5±4,1cm de agua), lo que indica que se trataban de pacientes con SDRA más grave en el momento del cruzamiento comparado con los pacientes que recibieron ECMO. La mortalidad a los 60 días de los pacientes que tuvieron cruzamiento al grupo intervención con ECMO fue del 57% (20/35 pacientes) entre los pacientes en el grupo control que cruzaron a ECMO versus el 41% (37/90 pacientes) entre los otros pacientes en el grupo control (riesgo relativo [RR] 1,39; IC del 95%; 0,95 a 2,03). La frecuencia de complicaciones no difirió significativamente entre los grupos, excepto más eventos hemorrágicos que requirieron la transfusión en el grupo ECMO comparado con el grupo control (en 46% frente a 28% de los pacientes, RAR, 18%; IC 95%, 6 a 30), así como más casos de trombocitopenia grave (en el 27% frente al 16%, respectivamente; RAR, 11%, IC del 95%, 0 a 21).
Por todo ello, a pesar de los resultados decepcionantes de este ensayo clínico multicéntrico (riesgo relativo 0,76; IC 95%, 0,55 a 1,04; p=0,09) y teniendo en cuenta la densidad de reclutamiento del estudio (0,058 pacientes/mes/centro en 100 unidades participantes), el alto porcentaje de cruzamiento de pacientes para recibir ECMO y la finalización anticipada del estudio, probablemente el poder estadístico puede haber sido infraestimado pues se requerirían más de 8 años de periodo de reclutamiento de pacientes con SDRA grave necesario para detectar un 11% de diferencia absoluta del riesgo estadísticamente significativo. Por lo tanto, puede considerarse el uso de ECMO como terapia de rescate en pacientes seleccionados con SDRA grave en centros de referencia.
Con la publicación de las actuales recomendaciones no pretendemos un uso liberal o desproporcionado del ECMO, ni mucho menos, la banalización de la técnica, sino procurar un uso racional basado en el conocimiento actual. En este sentido se han levantado voces que critican la enorme expansión de una técnica invasiva y que implica un elevado consumo de recursos pero que por otra parte, no dispone de un soporte científico indiscutible82. En este sentido, queremos hacer una llamada de atención para que la valoración de sus indicaciones se realice siempre por personal experimentado que evalúe escrupulosamente en cada caso el balance riesgo/beneficio ya que puntualmente, la técnica puede implicar complicaciones graves. Además, dada la incertidumbre de algunas indicaciones, son necesarias unas normas de uso basadas en el conocimiento actualizado de la bibliografía así como un registro de casos que permita la evaluación de los resultados.
En conclusión, la ECMO es una técnica que puede tener indicación en el tratamiento de pacientes en fracaso cardiaco o respiratorio, y para la preservación de órganos en el donante. Aunque desde un punto de vista fisiopatológico, existen argumentos para su empleo, se necesitan estudios que definan con más precisión qué pacientes y en qué momento debe iniciarse. Dadas las características de la técnica, para su implementación se requiere un claro compromiso institucional así como un personal multidisciplinar bien entrenado para todos los potenciales escenarios. Es deseable un registro nacional de los casos incluidos que permita conocer los resultados y detectar posibles desviaciones.
Conflicto de interesesMPFC ha organizado cursos de ECMO financiados parcialmente por Maquet, Thoratec y Cardiolink. MLS ha organizado cursos de ECMO financiados parcialmente por MAQUET y JLPV ha organizado cursos de ECMO financiados parcialmente por Maquet y Fresenius. El resto de los autores declaran no tener ningún conflicto de intereses.
- -
Victoria Boado Varela. Servicio de Medicina Intensiva. Hospital Universitario de Cruces. Bilbao.
- -
Ricardo Gimeno Costa. Servicio de Medicina Intensiva. Hospital Universitari i Politècnic La Fe. Valencia.
- -
Rocío Gómez López. Servicio de Medicina Intensiva. Hospital Quirónsalud. Pontevedra.
- -
Miguel Domínguez. Servicio de Medicina Intensiva. Hospital Quirónsalud. Pontevedra.
- -
Rubén Jara Rubio. Servicio de Medicina Intensiva. Hospital Universitario Virgen de la Arrixaca. Murcia.
- -
Luis Martín Villén. Servicio de Medicina Intensiva. Hospital Virgen del Rocío. Sevilla.
- -
M. Ángeles Rodríguez Esteban. Servicio de Medicina Intensiva. Hospital Universitario Central de Asturias. Oviedo.
- -
M. Isabel Rubio López. Servicio de Medicina Intensiva. Hospital Universitario Marqués de Valdecilla, Santander.
- -
Jordi Riera. Servicio de Medicina Intensiva. Hospital Universitario Valle Hebrón, Barcelona.
- -
Eduardo Miñambres García. Servicio de Medicina Intensiva. Hospital Universitario Marqués de Valdecilla, Santander.
- -
Francisco del Río Gallegos. Servicio de Medicina Intensiva, Hospital Clínico San Carlos. Madrid.
En el anexo figuran los expertos que han participado en el estudio.