INTRODUCCIÓN
El fracaso renal agudo (FRA) es una complicación frecuente en los pacientes hospitalizados, en especial en aquellos ingresados en las Unidades de Cuidados Intensivos (UCI)1.
La etiología en los pacientes de UCI suele ser múltiple y casi siempre encuadrada dentro de una situación de fallo multiorgánico (FMO). En cuanto a la supervivencia en este grupo, es menor que en el resto de la población, y los recursos empleados en su tratamiento elevados2.
La epidemiología y los factores de riesgo asociados a su desarrollo, así como el tipo de tratamiento a que les sometemos en la actualidad sigue siendo objeto de interés, dado el impacto que tiene en cuanto a morbi-mortalidad.
Nosotros nos planteamos como objetivo conocer el estado actual del FRA en los pacientes ingresados en nuestras UCI, para lo que se diseñó un estudio multicéntrico, cuyos objetivos principales fueron establecer la incidencia de FRA y la repercusión sobre la función renal al alta hospitalaria, determinar la mortalidad de los pacientes y evaluar la eficacia de los índices pronósticos habituales en esta población. Como objetivo secundario se planteó conocer el empleo de las técnicas de reemplazo renal.
MATERIAL Y MÉTODOS
Estudio epidemiológico, prospectivo y multicéntrico auspiciado por el grupo de trabajo de Cuidados Intensivos Nefrológicos de la SEMICYUC (Sociedad Española de Medicina Intensiva y Crítica y Unidades Coronarias) y llevado a cabo entre el 1 de marzo y el 31 de octubre de 1999.
Criterios de inclusión
Se incluyen todos los pacientes ingresados en las unidades participantes durante el período de estudio.
Definición de fracaso renal agudo
Creatinina sérica ≥ 2 mg/dl o diuresis < 400 ml en 24 horas. En pacientes con fracaso renal crónico (FRC), se consideró FRA sobre crónico si se producía un aumento del 100% sobre las cifras basales de creatinina, siendo la cifra basal inferior a 4 mg/dl.
Criterios de exclusión
Edad inferior a 12 años y creatinina basal superior a 3,9 mg/dl.
Tras una reunión entre los investigadores para consensuar las definiciones de las variables a estudio, se elaboró una hoja de recogida de datos que fue distribuida entre todas las unidades participantes.
Variables recogidas y analizadas
1. Variables dependientes: a) FRA (según definición previa); b) FRA oligúrico (diuresis < 400 ml/día o 0,25 ml/kg/hora durante un día); c) depuración extra-renal, recogiéndose las modalidades intermitentes (HDI) y continuas (TCRR); d) fallo renal residual (creatinina al alta de UCI y hospitalaria); e) mortalidad en UCI de los pacientes con FRA, distinguiendo los que se recuperaron del episodio de aquellos que fallecieron en situación de FRA.
2. Variables independientes: a) de severidad: APACHE II3 al ingreso en UCI, índice de severidad individual (ISI)4 y SOFA5 al inicio del episodio de FRA; b) grupo fisiopatológico (prerrenal, patología de grandes vasos, necrosis tubular aguda (NTA), lesión glomerular, nefritis, ateroembolia, postrenal o síndrome hepatorrenal); c) desarrollo de proceso infeccioso durante el FRA; d) presencia de SIRS según criterios de la Conferencia de Consenso de 19926; e) fallos orgánicos asociados según definición de Knaus7; f) severidad del fallo orgánico múltiple, valorado diariamente mediante la escala SOFA; g) cifras de albúmina sérica; h) datos de filiación que incluían edad, sexo, peso en kilogramos, antecedentes personales y motivo de ingreso (médico, coronario, trauma, quirúrgico, cirugía cardíaca y trasplante no renal); i) creatinina sérica basal (en pacientes con creatinina basal desconocida y sin historia de FRC, se asumió 1,3 mg/dl), al inicio del FRA y creatinina máxima y j) manejo terapéutico: aminas, diuréticos y técnicas de depuración extra-renal.
Cada hospital participante aportó asimismo aquellos datos necesarios para el análisis estadístico posterior, como fueron el número total de ingresos de cada unidad participante y su distribución por grupos (igual a la distribución utilizada para los pacientes objeto del estudio), mortalidad media de los ingresos de cada unidad durante el período de estudio, edad y sexo del total de ingresos e índices de gravedad medios del total de ingresos, medido por APACHE II.
Análisis estadístico
La base de datos fue revisada inicialmente para detectar variables perdidas o datos inconsistentes y se solicitó en un segundo tiempo a los investigadores responsables de cada centro la reevaluación de los mismos. Para el análisis se usó el paquete estadístico SPSS para Windowsâ. Las variables cuantitativas se expresan como media (intervalo de confianza para la media) menos las relacionadas con el tiempo que se expresan como mediana (percentil 25-75). Las variables cuantitativas se expresan como número (%). Para el análisis univariante se usó la «t» de Student para las variables cuantitativas y la ji cuadrado para las cualitativas, con un nivel de significación del 95%.
Para valorar de forma independiente la relación de diferentes variables con la mortalidad se realizó un análisis de regresión logística mediante el método paso atrás, incluyendo en el modelo todas aquellas variables que en el análisis univariante mostraron un valor p < 0,15, manteniendo en el mismo aquellas con una significación del 95%. Los resultados se muestran como odds ratio (OR) (intervalo de confianza para OR).
Se construyó una curva ROC para cada uno de los índices pronóstico analizados, calculando el área bajo la curva para cada una de estas variables (AuC).
RESULTADOS
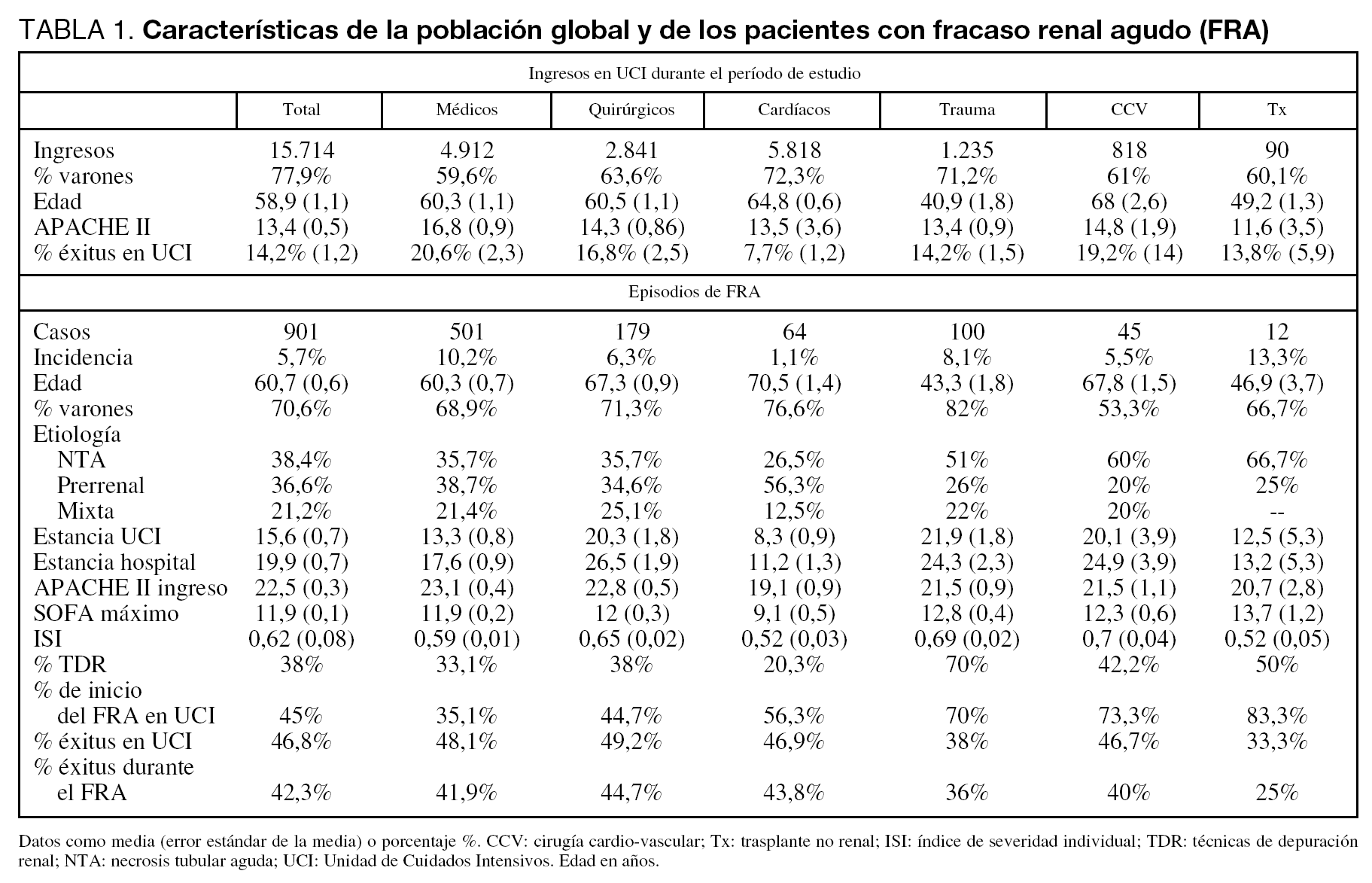
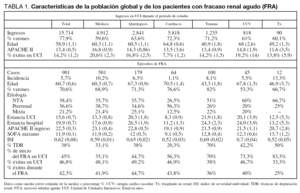
Participaron en el estudio 43 hospitales de diferentes Comunidades Autónomas. Se registraron 15.714 ingresos en UCI durante el período de estudio, correspondiendo a 12.325 varones (77,9%), con una edad media de 58,9 (57,8-60) años. El tipo de ingreso fue médico en 4.912 (31,3%), postquirúrgico en 2.841 (18,1%), traumatizados 1.235 (7,9%), cardíacos 5.818 (37%), tras cirugía cardíaca 818 (5,2%) y trasplante 90 (0,5%) pacientes (tabla 1).
Desarrollaron FRA 901 pacientes, cifrándose por tanto la incidencia de FRA en el 5,7%. De estos, 635 fueron varones (70,6%) con una edad media de 60,7 años (60,1-61,2). La mediana de la estancia en UCI fue de 8 (4-19) días y la hospitalaria de 12 (5-25) días. De ellos, 496 (55%) presentaban FRA en el momento del ingreso en UCI. El tipo de ingreso más frecuente fue el de causa médica (501 casos, 55,6%), seguido del de causa quirúrgica (179 casos, 19,9%), traumatismo (100 casos, 11,1%), cardíacos (64 casos, 7,1%), cirugía cardíaca (45 casos, 5%) y trasplante no renal (12 casos, 1,3%) (tabla 1).
La incidencia de FRA fue más elevada en pacientes cuyo motivo de ingreso fue el trasplante no renal (incidencia 13,3%), seguido de los de tipo médico (10,2%), traumatizados (8,1%), postquirúrgicos (6,3%), cirugía cardíaca (5,5%) y pacientes cardíacos (1,1%).
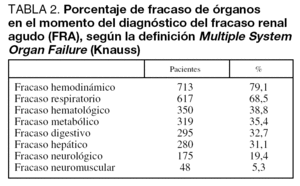
El APACHE II al ingreso fue de 22,5 (22,2-22,8), los índices de gravedad al inicio del cuadro de FRA fueron ISI 0,62 (0,61-0,63) y SOFA 9,8 (9,7-9,9), siendo el SOFA máximo alcanzado de 11,9 (11,8-12,0) (tabla 1). El número medio de órganos fracasados en el momento del diagnóstico (exceptuando el renal) fue 3,10 (3,04-3,16). Tan sólo 67 (7,4%) pacientes no presentaban ningún órgano en fracaso, 120 (13,3%) fracaso de un órgano, 166 (18,4%) dos órganos afectados, 173 (19,2%) tres órganos y el resto presentaban fracaso de cuatro o más órganos. La frecuencia de alteración de cada órgano se presenta en la tabla 2.
La causa desencadenante del FRA fue NTA en 346 (38,4%) pacientes, prerrenal en 330 (36,6%), de etiología mixta en 191 (21,2%) y una miscelánea en los restantes 34 (3,8%) (tabla 1).
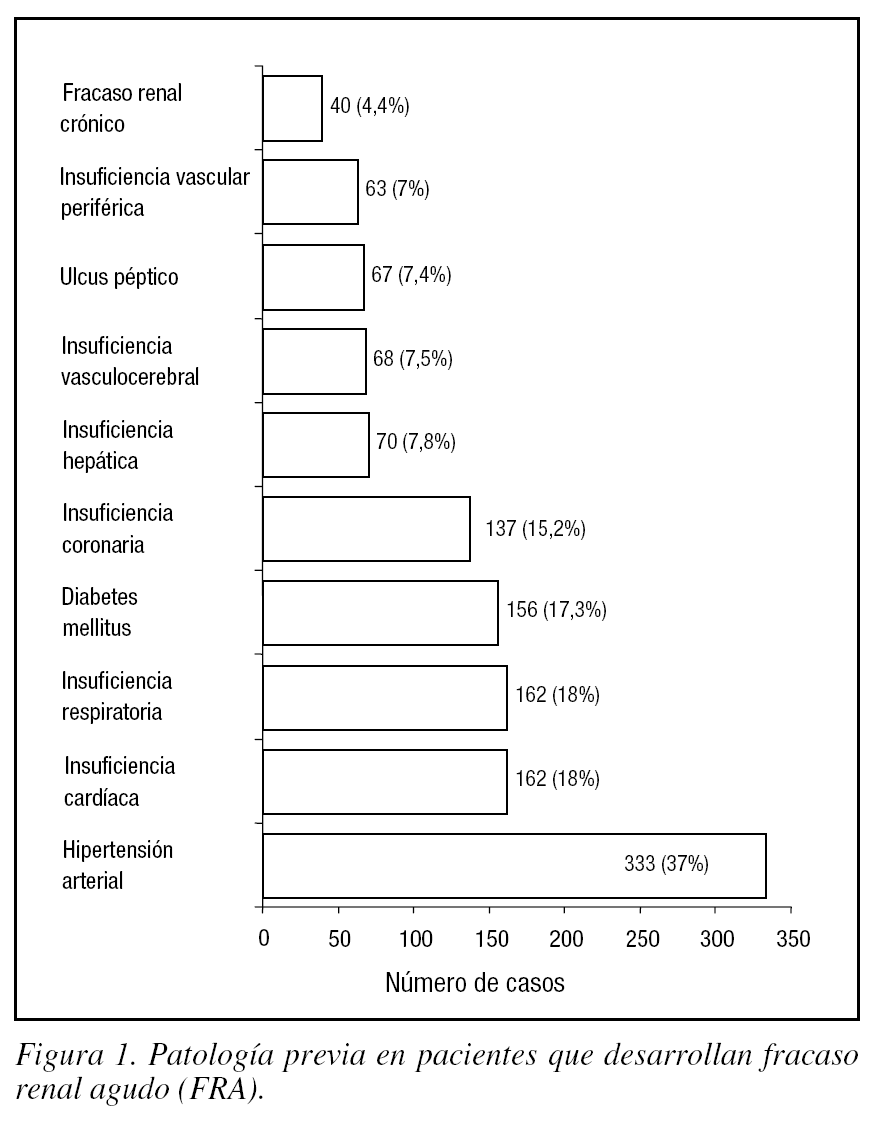
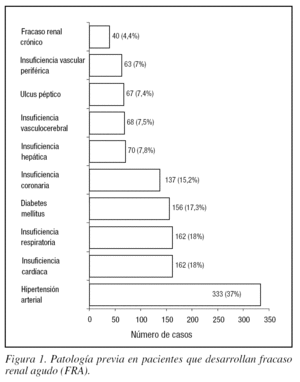
Sólo 253 (28,1%) pacientes con FRA no presentaban antecedentes patológicos, mientras que 648 (71,9%) presentaban al menos un antecedente (fig. 1).
Figura 1. Patología previa en pacientes que desarrollan fracaso renal agudo (FRA).
En el momento de inicio del FRA, 650 (72,1%) pacientes presentaban síndrome de respuesta inflamatoria sistémica (SIRS), 553 (61,4%) hipoalbuminemia y 398 (44,2%) infección previa.
Presentaron FRA oligúrico 352 (41,3%) pacientes y en el momento del diagnóstico del FRA la creatinina fue de 2,85 (2,4-3,3) mg/dl y el aclaramiento de creatinina (ClCr) calculado mediante fórmula de C-G de 29,5 (29,0-30,0) ml/min. El ClCr medido sólo se realizó en 609 pacientes (no se consideraba obligatorio según el protocolo), siendo de 28,6 (27,7-29,5) ml/min. Durante la evolución clínica, la creatinina máxima alcanzada se cifró en 3,92 (3,86-3,98) mg/dl.
En 711 (78,9%) pacientes fue necesario el uso de agentes vasoactivos (dopamina en 630 [88,6%], noradrenalina en 417 [58,6%] y dobutamina en 232 [32,6%]). Se usó algún tipo de diurético en 709 (78,7%) casos, siendo el más prescrito la furosemida en 630 (69,9%) (en 400 casos fue administrada en forma de perfusión continua) seguido de la dopamina en dosis diuréticas en 351 (49,5%) pacientes. Precisaron técnicas de depuración renal (DER) 342 (38%) pacientes, de las cuales 54 (15,8%) fueron HDI, 255 (74,6%) TCRR y aplicándose ambas técnicas de manera sucesiva en 33 (9,6%).
La mortalidad global en UCI fue del 14,2% para toda la población y para el grupo de estudio (901 episodios de FRA) del 46,8% (422 pacientes).
El tipo de ingreso no influyó en la mortalidad, pero sí la presencia de FRA en el momento de ingreso en la UCI (mortalidad 34,1% frente a 50,9% en los que no lo presentaban en el ingreso y lo desarrollan posteriormente, p < 0,001). La etiología del fracaso renal también se relaciona con la mortalidad, siendo del 80% (8 de 10 pacientes) para el síndrome hepatorrenal, 51,6% (246 de 477) para la NTA, 29,9% (112 de 375) para la prerrenal, 0% (0 de 14) para la postrrenal y del 36% para el resto (p < 0,001).
De los 520 pacientes que no fallecieron en la UCI durante el episodio de FRA, la recuperación de la función renal se produjo en 445 pacientes (85,6%) y este grupo presentó una mortalidad del 9,2%. Los restantes 75 pacientes (14,4%) presentaban aún fracaso renal a su alta de la unidad y de estos, 5 (1,1%) aún se mantenían con necesidad de DER.
Para los pacientes que no recuperaron la función renal pero no necesitaban sustitución renal al alta, la creatinina al alta fue de 2,4 (2,05-2,75) mg/dl.
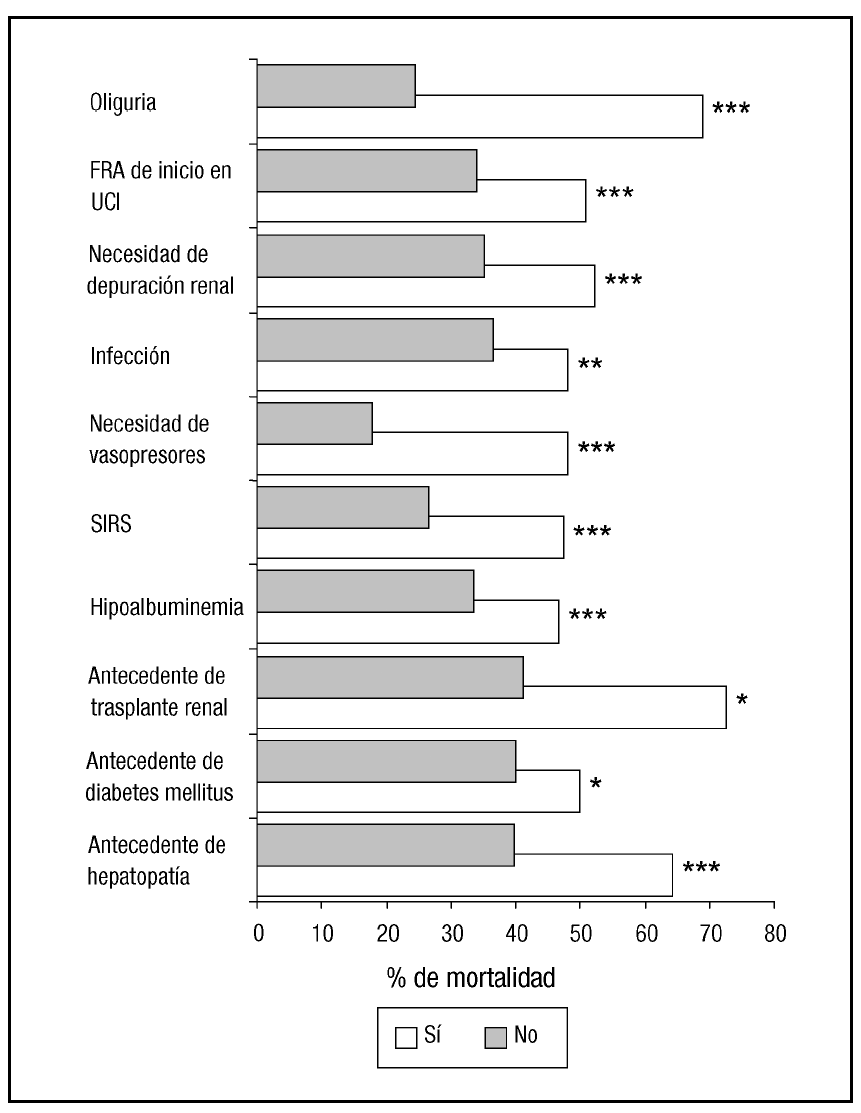
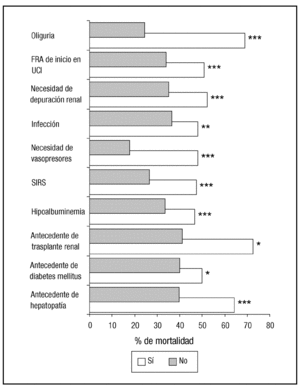
En el análisis univariante, hemos detectado que los pacientes de más edad, con hepatopatía, diabetes mellitus o trasplante renal previo presentan mayor mortalidad, así como los que presentan mayor gravedad medida por APACHE II al ingreso, ISI, FMO y SOFA en el momento del diagnóstico, hipoalbuminemia, SIRS, necesidad de soporte vasoactivo o infección. También se relaciona con la mortalidad el desarrollo del FRA en UCI, la oliguria y la necesidad de depuración extrarrenal (tabla 3 y fig. 2).
Figura 2. Variables cualitativas relacionadas con la mortalidad.*p < 0,05, **p < 0,01, ***p < 0,001.
En el análisis multivariante se demuestra una relación independiente con la mortalidad para la edad (OR 1,03; IC 1,01-1,04), antecedente de diabetes mellitus (OR 2,06; IC 1,28-3,31), el desarrollo de FRA en la UCI (OR 2,51; IC 1,72-3,65), la presencia de oliguria (OR 5,76; IC 3,76-8,84) y la necesidad de DER (OR 2,32; IC 1,45-3,68). Los índices pronóstico se relacionan asimismo de forma independiente con la mortalidad: APACHE II al ingreso (OR 1,05; IC 1,02-1,07), ISI (OR 1,90; IC 1,01-4,3) y SOFA máximo (OR 1,31; IC 1,21-1,41) y número de fallo de órganos en el momento del diagnóstico (OR 1,47; IC 1,26-1,72).
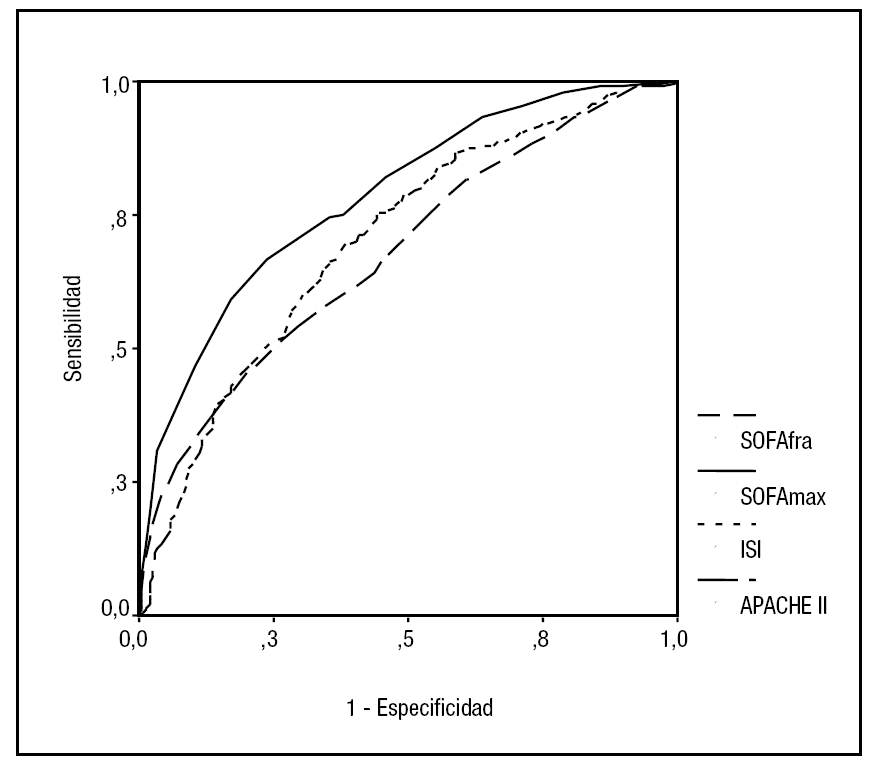
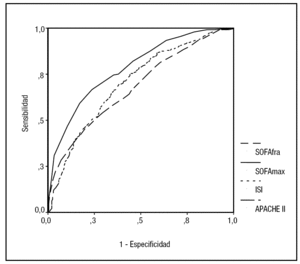
Para valorar el comportamiento de los diferentes índices de gravedad en relación con la mortalidad se ha dibujado la curva ROC para el APACHE II al ingreso (AuC 0,62; IC 0,59-0,66), SOFA al inicio del FRA (AuC 0,68; IC 0,65-0,71), SOFA máximo (AuC 0,79; IC 0,76-0,82) y el ISI (AuC 0,7; IC 0,67-0,74). Los resultados se muestran la figura 3.
Figura 3. Curva ROC mostrando la relación entre SOFA al inicio del fracaso renal agudo (FRA) (SOFAfra), SOFA máximo (SOFAmax), índice de Liaño (ISI) en el momento del diagnóstico y APACHE II al ingreso con la mortalidad en FRA.
DISCUSIÓN
El principal punto de conflicto para el diseño de cualquier estudio epidemiológico relacionado con el FRA se refiere al propio diagnóstico.
En los últimos años se ha hecho un esfuerzo en lo que debería ser una aproximación diagnóstica, plasmada en diferentes artículos de opinión8,9, no siendo hasta el año 2004 cuando aparece publicado por el grupo ADQI (Acute Dialysis Quality Initiative) lo que parece va a ser el referente en cuanto a diagnóstico de FRA10. Cuando este estudio fue diseñado, y por tanto sin esta referencia previa, consideramos adecuado definir FRA de acuerdo a una cifra de creatinina sérica, que en nuestro caso fue de 2 mg/dl (considerando también la definición de fallo agudo sobre crónico), así como por la existencia de oliguria, clasificando cada caso con la denominación de oligúrico o no oligúrico (lo que se atiene al Consenso del ADQI previamente mencionado). Dado que en el momento del diseño del estudio no eran conocidas las directivas marcadas posteriormente en el ADQI, decidimos considerar en aquellos pacientes sin creatinina basal conocida una cifra arbitraria de 1,3 mg/d sin establecer una aproximación individualizada como la recomendada por el MDRD (modification of diet of renal disease). Sin duda, si el estudio se hubiera diseñado con posterioridad al año 2004, el protocolo se hubiera adecuado a la Conferencia de Consenso.
El FRA según se desprende de nuestros datos, se muestra como una complicación poco frecuente en los pacientes ingresados en nuestras unidades, en especial en aquellos pacientes cuyo motivo de ingreso es coronario. Los ingresos coronarios es sabido que corresponden a un gran porcentaje de los que ocupan nuestras camas y la incidencia de FRA en este grupo es escasa, la más baja con amplia diferencia con respecto al resto de tipos de ingresos según nuestros datos. De hecho, si excluimos los pacientes ingresados por patología coronaria la incidencia observada asciende al 8%.
El perfil del paciente que desarrolla FRA en nuestro medio es un varón en la sexta década de la vida, que ha ingresado por una causa médica, y que ya en el momento de ser ingresado en la UCI era considerado un paciente grave, observado de acuerdo a diversos índices de gravedad que son de uso habitual como estratificación de riesgo en nuestras unidades.
El hecho de que el sexo masculino sea el más prevalente para esta complicación obedece al hecho de que el perfil está reflejando el de la totalidad de ingresos de nuestras unidades, donde la relación 2:1 para hombre-mujer se sigue manteniendo de manera global.
Posiblemente otros factores diferentes de los puramente epidemiológicos y los del estado de gravedad al ingreso tengan que ver con la predisposición a desarrollar esta complicación, lo que viene apoyado por el hecho de que más del 70 % de los pacientes que desarrollaron FRA tenían al menos un antecedente patológico de los considerados relevantes.
En cuanto a la etiología y al igual que lo referido por otros autores11,12, la NTA fue la causa más frecuente, si bien en un 21% de los casos coexistió más de un factor etiológico en el origen del fracaso renal.
Entre los factores que se asociaron al desarrollo del FRA en nuestra serie destacan el SIRS, la infección previa y la hipoalbuminemia, que al igual que en otras series se muestran asociados y en el caso de los dos últimos predisponentes para el posterior desarrollo de FRA13-15. La infección o bien la sepsis son de hecho para muchos autores el principal factor predisponerte del FRA en UCI, y aunque se describen otros múltiples factores como la depresión del nivel de conciencia, la insuficiencia respiratoria o la insuficiencia hepática, es el estado séptico el más asociado con su aparición16-18.
Resaltamos el hecho de la asociación del fallo de otros órganos distintos al riñón cuando se establece el diagnóstico de FRA en los pacientes de UCI, situándose en nuestros pacientes en 3 el número de fallo de órganos en ese momento, lo que sabemos que tiene implicaciones en el pronóstico, como nos muestran amplias series como la del grupo PICARD19 y se refleja en nuestros resultados.
En cuanto al tratamiento que aplicamos a estos pacientes, destaca como diurético la furosemida, si bien llama la atención el hecho de que la utilización de dopamina en dosis «dopaminérgicas» era una práctica habitual, posiblemente debido a que las recomendaciones al respecto que desaconsejan su uso fueron publicadas con posterioridad20.
En lo que se refiere a las técnicas de reemplazo renal, son las técnicas continuas las más ampliamente utilizadas, reservándose las intermitentes para el destete de la máquina en la mayoría de las ocasiones, lo cual refleja la tendencia actual, habida cuenta de la buena tolerancia hemodinámica y la baja incidencia de complicaciones referidas a la técnica cuando se cuenta con experiencia en su utilización21,22.
A pesar del hecho de que el FRA no es la complicación más frecuente de las desarrolladas por los pacientes de UCI, en nuestra serie el 5,7%, sí que observamos, al igual que lo referido por otros autores, un gran impacto en la morbimortalidad23,24.
Tanto la estancia en UCI como la hospitalaria fueron elevadas en aquellos pacientes que presentaron FRA, lo que concuerda con los resultados de otras series25, implica en sí mismo un mayor consumo de recursos de estos pacientes con respecto al resto y es objeto de reflexión ante la necesidad de optimizar el tratamiento que les ofrecemos26.
En cuanto a la predicción de mortalidad, coincidimos con la hipótesis de Lins27 en que los índices pronósticos habituales no son muy exactos en lo que se refiere al FRA, por lo que la búsqueda del índice pronóstico ideal en este contexto sigue siendo una necesidad. Según nuestros datos, el APACHE II, como índice general, no ha sido válido, ni tampoco el SOFA al inicio del FRA, siendo el ISI (como prototipo de índice en FRA) y sobre todo el SOFA máximo los que se han mostrado más adecuados entre los analizados.
La mortalidad de nuestros pacientes con FRA, cercana al 50% y dentro del rango de lo referido en la literatura para el FRA definido por cifras similares a las nuestras (creatinina sérica > 2 mg/dl)28, sitúa al FRA como una complicación grave.
Ya hace una década que Levy nos mostró que el desarrollo de FRA, con independencia de las condiciones basales de los pacientes y en un estudio ya clásico sobre FRA inducido por radiocontraste, predispone en sí mismo a una elevada mortalidad29 y centrándonos en pacientes de UCI, cada vez hay más evidencia de que el FRA representa un factor de riesgo independiente de peor pronóstico30. Por esto estamos asistiendo a un cambio de concepto basado en que los pacientes no sólo fallecen con FRA, dentro de un cuadro de disfunción multiorgánica, sino del propio FRA.
En este sentido, y como limitación al presente estudio, no hemos analizado la mortalidad de los pacientes sin FRA y por tanto no nos es posible determinar el impacto real en cuanto a «mortalidad atribuida» al propio FRA.
Destacamos que tal como se desprende de nuestros datos y de lo comunicado por otros autores11, la mortalidad es más elevada cuando el FRA se desarrolla en la propia UCI, con respecto a la de los pacientes que ingresan ya con fracaso renal, si bien nosotros observamos en los supervivientes un buen pronóstico funcional.
Por otra parte, de entre los pacientes que desarrollaron FRA, aquellos que presentaron oliguria tuvieron una mayor mortalidad, hecho a resaltar en cuanto a la conveniencia de categorizar a los pacientes con fallo renal oligúrico frente a no oligúrico, como indican los nuevos estándares basados en el ADQI.
Otro factor destacado con relación a la mortalidad fue la necesidad de uso de técnicas de DER, hecho ya conocido y referido por Metnitz30. En este sentido, además, un reciente trabajo confirma de nuevo este punto31 a la vez que muestra la validez del sistema RIFLE10 en los pacientes sometidos a TCRR, observando una mayor mortalidad en los pacientes categorizados como RIFLE-F con respecto a los RIFLE-I y R.
Hasta el momento y como resaltan estos autores, no se ha aplicado de manera clínica en un conjunto de pacientes con FRA, independientemente de la necesidad o no de TCRR, lo cual hubiera sido interesante en un estudio de las características del que ahora presentamos, pero dado que nuestro protocolo sólo preveía la recogida de creatinina sérica al ingreso y el día de diagnóstico del FRA (según la definición ya comentada) ha sido imposible estratificar los pacientes mediante la clasificación RIFLE.
Incidiendo en la necesidad de clasificar a los pacientes con FRA y tomando como punto de partida la clasificación propuesta por Bellomo8, Ostermann comunica un aumento progresivo en las cifras de mortalidad de sus pacientes atendiendo a los niveles ARI (acute renal injury), ARFS (acute renal failure syndrome) y SARFS (severe acute renal failure syndrome)32.
Conociendo el impacto del FRA y sus implicaciones pronósticas, nuestros esfuerzos deberían centrarse en realizar una estratificación de riesgo adecuada que permitiera detectar a aquellos pacientes con riesgo de desarrollar FRA con vistas a instaurar aquellas medidas que pudieran prevenir su desarrollo.
ANEXO
Coordinadores: J. Maynar Moliner (Hospital Santiago Apóstol, Vitoria-Gasteiz) y J.A. Sánchez-Izquierdo Riera (Hospital Doce de Octubre, Madrid).
Participantes: Hospital General de Albacete: V. Córcoles, M. Valiente. Hospital del Poniente, Almería: L.J. Fierro, J.A. Ramos. Hospital de la Cruz Roja, Barcelona: N. Rico. Hospital Sagrado Corazón, Barcelona: J.J. Brasó, E. Campañá. Hospital Santa Creu i San Pau, Barcelona: A. Roglán. Hospital General de Granollers, Barcelona: J. Xirgu, P. Garro. Hospital de Cruces, Bilbao: C. Pérez, K. Esnaola. Hospital General Yagüe, Burgos: M.J. López, L. Martín, A. Zabalegui. Hospital de Jerez de la Frontera, Cádiz: J. Carrizosa, A. Herrero. Hospital Puerta del Mar, Cádiz: A. Sánchez, M.J. Domínguez. Hospital Virgen de Luz, Cuenca: J.M. Añón, M.P. Escuela. Hospital Virgen de las Nieves, Granada: I. Navarrete. Hospital Juan Ramón Jiménez, Huelva: M. Rodríguez, J.M. Fernández. Hospital Insular, Las Palmas: L. Santana, I. García. Hospital del Bierzo, León: Z. Ferreras, C. Martínez. Hospital San Pedro y San Millán, Logroño: F. Goñi, M.C. Pavia. Hospital Xeral de Lugo: M.A. Garijo, M.C. Martín. Hospital Arnau Vilanova, LLeida: A. Barcenilla, L. Servia, J. Trujillano. Clínica la Concepción, Madrid: C. Pérez. Clínica Moncloa. Madrid: V. Gómez, R.M. de la Casa. Hospital de Móstoles. Madrid: E. Herrero, T. Honrubia, P. Galdós. Hospital Doce de Octubre, Madrid: J.A. Sánchez-Izquierdo, P. Arribas, D. Toral. Hospital Ramón y Cajal, Madrid: F. Liaño. Hospital Severo Ochoa, Madrid: J. López, R. Díaz. Hospital Carlos Haya, Málaga: M.E. Herrera, G. Seller, M.J. Chaparro, J.M. Moreno. Hospital de la Serranía de Ronda, Málaga: J.I. Mateo. Hospital Virgen de la Victoria, Málaga: D. Daga, A. Soler. Policlínica Miramar, Mallorca: P. Morrondo. Hospital General, Mallorca: L. Socias, G. Rialp, A. García. Hospital de Melilla: P. Bernard, F. León. Hospital Morales Meseguer, Murcia: M.D. del Baño, J.L. Espinosa. Hospital de Covadonga, Oviedo: J. Otero, E. Fernández, G. Muñiz. Hospital del Río Carrión, Palencia: A.P. Álvarez, V. Sagredo. Hospital Provincial de Navarra, Pamplona: J. Tirapu, I. Osés. Clínica San Miguel, Pamplona: J. Urtasun. Hospital Marqués de Valdecillas, Unidad Polivalente, Santander: J. Díaz-Regañón, E. Ibáñez, L. Iglesias, C. González. Hospital Marques de Valdecillas, Unidad de Politraumatizados, Santander: P. Ugarte. Hospital Vigil de Quiñones, Sevilla: D. Herrera, M. Pérez, J.I. Sánchez. Hospital Virgen del Rocío, Sevilla: J.M. Domínguez. Hospital Santiago Apóstol, Vitoria: J. Maynar, E. Corral. Hospital Txagorritxu, Vitoria: O. Saornil, J.M. Ruiz, M. Hernández. Hospital de Galdakao, Vizcaya: A. de la Serna.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses
El grupo «Estado actual del fracaso renal agudo y de las técnicas
de reemplazo renal en UCI. Estudio FRAMI» es una iniciativa
del grupo de trabajo de Nefrointensivismo de la SEMICYUC.
Correspondencia: Dr. M.E. Herrera Gutiérrez.
Unidad de Cuidados Intensivos.
Hospital Carlos Haya.
Avda. Carlos Haya, s/n.
29010 Málaga. España.
Correo electrónico: mehguci@wanadoo.es
Manuscrito aceptado el 23-I-2006.