INTRODUCCION
De los múltiples estados de inconsciencia, merece especial atención el llamado estado vegetativo (EV) por sus implicaciones médicas, sociales y legales. Este término fue propuesto por Jennett y Plum1 en 1972 para definir a los pacientes con lesión cerebral grave e inmersos en una situación clínica de total ignorancia de sí mismos y del entorno, con ciclos de sueño-vigilia y con preservación parcial o total de las funciones autónomas hipotalámicas y del tronco cerebral. La prolongación del EV más allá de unas semanas es referida como estado vegetativo persistente (EVP)2.
El EVP es, por tanto, una situación clínicamente bien definida que plantea un reto permanente por sus implicaciones clínicas, éticas y legales, por ser secundaria a múltiples procesos patológicos que, directa o indirectamente, afectan estructural o funcionalmente al parénquima cerebral y por la falta de claros factores predictivos de reversibilidad. Como en la gran mayoría de los procesos patológicos actuales, el EVP requiere una actuación y dedicación multidisciplinaria con la finalidad de:
1. Mostrar, analizar y comprender todos los factores de agresión cerebral causantes del EV.
2. Valorar con fiabilidad las probabilidades de que pacientes con determinadas lesiones alcancen una situación de EVP.
3. Las probabilidades fiables de recuperación o de permanecer en un EV permanente.
El EVP no representa el resultado de una etiología precisa y concreta sino más bien el del fracaso de un tratamiento en pacientes con alteraciones estructurales y funcionales de diversa etiología.
La Neurorradiología y la Medicina Nuclear forman parte de este equipo multidisciplinario implicado en el tratamiento de los pacientes en EV, merced a los continuos y avanzados progresos tecnológicos que aportan un análisis estructural y funcional del parénquima cerebral, una mejora progresiva en la caracterización de las lesiones del parénquima cerebral, que pueden desempeñar un papel importante en dilucidar los puntos cruciales mencionados para determinar la causa y quizá poder llegar a predecir la reversibilidad o no de esta situación clínica. No hay que olvidar que la plasticidad y las normales variaciones funcionales cerebrales nos obligan a ser muy prudentes a la hora de establecer criterios estrictos de predicción, tanto de la relación causa-efecto como de las posibilidades de recuperación.
ESTADO VEGETATIVO: CAUSAS
Los procesos patológicos que cursan con alteraciones estructurales o funcionales primarias y secundarias causantes en mayor o menor grado de una situación clínica de EV transitorio o permanente son numerosos (tabla 1). Destacan por su frecuencia y trascendencia social los traumatismos craneoencefálicos (TCE) graves y la hipoxia prolongada por parada cardiorrespiratoria (PCR).
Junto al mejor conocimiento de las lesiones estructurales y los cambios fisiopatológicos presentes en los pacientes con EVP, son cada vez más numerosos los medios in vivo para su análisis, valoración y cuantificación que desgraciadamente alcanzan conclusiones generalmente con más valor estadístico que práctico.
En todo TCE grave, PCR o cualquier otro proceso patológico responsable de una situación clínica de EV se presentan alteraciones estructurales y funcionales que no podemos considerar estáticas sino dinámicas y cambiantes desde las primeras fases iniciales de agresión del parénquima cerebral hasta las fases de estabilidad final:
Fase lesional primaria progresiva.
Fase lesional secundaria progresiva.
Fase de estabilidad lesional.
Fase lesional regresiva.
Fase residual.
En cada fase de agresión del parénquima cerebral se producen lesiones propias que pueden evolucionar, ceder o complicarse. En el balance de la situación clínica del paciente en EV, estos hallazgos permitirán tomar las decisiones terapéuticas clínicas o quirúrgicas y realizar su control, pero no hay que olvidar que son datos complementarios que deben valorarse siempre en su conjunto para una mejor comprensión de la situación clínica del paciente.
ESTADO VEGETATIVO PERSISTENTE: TOMOGRAFIA COMPUTARIZADA Y RESONANCIA MAGNÉTICA
En la década de los setenta, con la aplicación de la informática y la electrónica en radiología mediante la tomografía computarizada (TC), se inicia un cambio radical en el estudio del sistema nervioso central al pasar de un análisis indirecto a una visión directa del parénquima cerebral y de muchas de las patologías y cambios estructurales que en él se producen. En estos últimos 30 años, la TC no ha hecho más que progresar en rapidez de adquisición, resolución y sensibilidad, y sigue, por tanto, aportando un elevado nivel de información.
Un paso importante se produce en la década de los ochenta con la aplicación de la resonancia magnética (RM) en neurorradiología, al mejorar no sólo la resolución espacial y la sensibilidad frente a determinados cambios estructurales del parénquima cerebral, sino que debido a la progresiva introducción de programas y secuencias de adquisición de información, en un constante work-in-progress de la llamada RM avanzada, es posible obtener información in vivo sobre la circulación cerebral mediante la angiografía por RM; las secuencias de difusión y de perfusión cerebral permiten valorar en la isquemia cerebral los cambios acuosos iniciales en las células y el estado de perfusión vascular en el parénquima circundante. La espectrometría del parénquima nos ofrece la presencia y valoración de algunos metabolitos cerebrales y sus modificaciones en determinadas situaciones patológicas; la RM funcional alcanza a precisar la integridad y localización de determinadas funciones del parénquima cerebral y cada día se publican nuevas aplicaciones, algunas de gran interés como las alteraciones de la difusión en las zonas de desgarro axonal difuso3,4.
Muchos son los medios para valorar el daño cerebral, pero ninguna de las informaciones aportadas por los diferentes exámenes que nos permiten valorar la disfunción cerebral (TC, RM, potenciales evocados, electroencefalograma, tomografía computarizada por emisión de fotones simples, tomografía por emisión de positrones) tienen por sí mismas y de forma exclusiva el valor de predecir la recuperación de un paciente en EV. Mucho más importante es la valoración del conjunto de información aportada por los diferentes estudios realizados durante las primeras semanas posteriores a la agresión cerebral, ya que muchos de los hallazgos patológicos presentes en las primeras fases tras la agresión o lesión del parénquima cerebral desaparecen con el tiempo o dejan un rastro difícil de valorar en estudios posteriores, tengan o no éstos un mayor poder de resolución.
ESTADO VEGETATIVO Y TRAUMATISMO CRANEOENCEFALICO GRAVE
En los pacientes traumatizados inconscientes, en coma o en EV secundario a una lesión cerebral grave, es importante, por razones tanto médicas como legales, llegar a predecir lo antes posible, o en el curso de su proceso, si existen posibilidades de recuperación, teniendo muy presente que los errores en el diagnóstico de EVP son frecuentes5,6 y casi la mitad de los pacientes en EV postraumático se recuperan dentro del primer año después del traumatismo7.
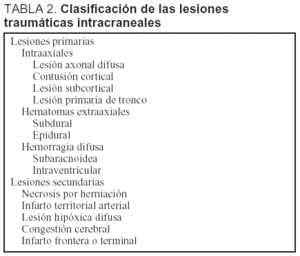
Las lesiones primarias o secundarias presentes en el traumatismo craneal fueron extensamente descritas y analizadas en la literatura (tabla 2) tanto con TC como con RM.
En relación con los pacientes con TCE grave y en EV, cualquiera de las lesiones cerebrales primarias descritas, en función de su naturaleza, localización, número y volumen, determinará la situación clínica inmediata del paciente, su evolución y pronóstico.
La elevada disponibilidad territorial de la TC, su rapidez en la adquisición de información, la facilidad de estudio en cualquier paciente en estado grave e importante soporte asistencial, y el constante incremento de su capacidad de resolución y análisis hacen que la TC sea el primer estudio neurorradiológico que se practica a cualquier paciente con sintomatología referida a una disfunción cerebral de cualquier índole.
La información que aporta la TC en los pacientes con TCE grave inconscientes y en coma es de suma importancia en el tratamiento y el control evolutivo.
Las lesiones primarias o secundarias, que pueden producirse o generarse en los TCE graves son bien conocidas8 (tabla 2) y son clásicos los trabajos basados en los hallazgos de la TC para clasificar a los pacientes con TCE grave (tabla 3) en la fase inicial. El conocimiento de estas lesiones iniciales por TC y su posterior control evolutivo, por TC o por RM, son de extraordinaria importancia para el tratamiento terapéutico y su pronóstico, ya que no podemos olvidar que muchas de estas lesiones iniciales se resuelven sin dejar rastro y, en contra de lo establecido en algunos trabajos, pueden ser difíciles de detectar en controles posteriores mediante RM.
La mayor sensibilidad de la RM en la detección de lesiones vasculares y postraumáticas9,10 ha despertado un gran interés en la valoración de estos pacientes mediante este examen por su potencial para predecir la recuperación de pacientes en EV11.
Lesiones traumáticas primarias
Las lesiones extracerebrales tienen una gravedad y un pronóstico distintos si se presentan de forma aislada o bien en el contexto de un traumatismo craneal grave. La gravedad y mortalidad del hematoma epidural presente en un 1-4% de los traumatismos está más en relación con una demora en la transferencia y el diagnóstico de los pacientes, o con complicaciones quirúrgicas, que con la gravedad intrínseca de la colección hemática. El hematoma subdural agudo presente en un 30% de los traumatismos graves es la lesión de mayor gravedad y elevada mortalidad con presencia de importantes lesiones parenquimatosas subyacentes. Su diagnóstico no presenta problemas ya que las imágenes son típicas y fácilmente detectadas, tanto por TC como por RM.
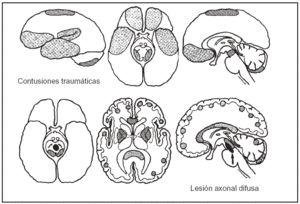
Las lesiones intraparenquimatosas representan contusiones corticales de las que la lesión axonal difusa (LAD) (fig. 1) es el componente lesional de mayor morbilidad en los pacientes traumatizados12 y su localización, extensión y multiplicidad lesional son los máximos responsables del pronóstico y estado clínico del paciente.
Figura 1. Localización y extensión de las lesiones intraparenquimatosas cerebrales.
La patofisiología de la LAD fue descrita en 1943 por Holbourn13 quien utilizó modelos de gelatina y demostró cómo las lesiones axonales difusas no son inducidas por fuerzas lineales, sino por la presencia de fuerzas rotacionales que se producen en los impactos bruscos con aceleración-desaceleración. Se conoce la localización de estas lesiones en áreas de diferente densidad y, por tanto, la mayoría de las lesiones se presentan en la interfase sustancia gris/sustancia blanca.
Patológicamente14 en la LAD se produce un desgarro axonal con edema y derrame axoplásmico, seguido de balonamiento axonal terminal, degeneración walleriana distal y pérdida de su función. La LAD es, por lo general, más amplia de lo que los medios de diagnóstico por imagen (TC y RM) nos permiten detectar. En los ganglios basales los efectos de la LAD conducen a una atrofia parenquimatosa por reducción del tamaño de los astrocitos, sobre todo en los núcleos lateral y anterior.
La LAD raramente es causante de la muerte del paciente, pero un gran porcentaje de estos pacientes quedan en EV. Clásicamente la LAD ha sido considerada como una lesión primaria producida en el momento del accidente15; sin embargo, se ha visto que los cambios y las alteraciones axonales pueden progresar y presentarse de forma tardía16.
En el traumatismo craneal grave, la topografía de las lesiones axonales difusas es generalmente imprecisa, bilateral y con afección preferente de: a) la sustancia blanca, con predominio en los lóbulos frontal y temporal; b) el cuerpo calloso, en especial su tercio posterior y el esplenio; c) la interfase sustancia gris/sutancia blanca; d) los márgenes posterolaterales de la protuberancia, y e) más raramente a distancia, con lesiones en el núcleo caudado, el tálamo, el tegmento y la cápsula interna.
En relación con la localización de las lesiones, Adams et al17 describen diferentes grados de afección:
Estadio I: afección de las áreas parasagitales de los lóbulos frontales, periventriculares de los lóbulos temporales y en menor grado de los lóbulos parietales, occipitales, la cápsula interna y el cerebelo.
Estadio II: a las lesiones del estadio I se asocia afección del cuerpo calloso, frecuentemente la parte posterior del cuerpo y el esplenio. La menor o mayor afección del cuerpo calloso se asocia a un peor pronóstico.
Estadio III: a las áreas afectadas del estadio II se añade la implicación del tronco cerebral, con predilección de los pedúnculos cerebelosos superiores, lemnisco medio y haces corticoespinales.
Sin profundizar en los detalles, sabemos que clínicamente la LAD condiciona una pérdida de con-ciencia; en los estudios por TC se presentan lesiones múltiples y casi el 80% de los pacientes permanecen en EV con preservación de las funciones del tronco cerebral18,19. El examen por TC en las fases iniciales de los pacientes con LAD muestra múltiples lesiones en un 50-80% de los casos, y en el 20-40% en que no se aprecia LAD, siempre que exista una discordancia clinicorradiológica, nos debe sugerir la presencia de una lesión axonal difusa que podrá valorarse mediante TC de control o RM.
En relación con el tamaño de las lesiones analizadas, si bien per se representan un factor de gravedad importante, no se encuentran diferencias significativas entre los dos grupos.
El pronóstico de los pacientes en EV no sólo se relaciona con el tipo lesional, sino que empeora a medida que el número de lesiones aumenta. Kinney y Samuels20, en un trabajo sobre pacientes en EV, sugieren que la situación clínica del paciente no es el resultado de un solo foco lesional, sino que, al contrario, la multiplicidad lesional y sus diferentes localizaciones explican las múltiples disfunciones cerebrales sensoriales, piramidales, extrapiramidales o cerebelosas presentes en los pacientes en EV.
No hay duda de que hoy la RM en sus múltiples facetas es el medio de examen preferido a pesar de la mayor disponibilidad de la TC y de su elevado grado de información para el tratamiento del TCE grave.
Imagen mediante tomografía computarizada
En las fases agudas, entre un 50-70% de los pacientes con lesión axonal difusa muestran una TC prácticamente normal; en ella se ven únicamente los desgarros axonales que presentan un cierto grado de sufusión hemorrágica en alguna de las áreas descritas. Sin embargo, en los controles realizados dentro de las 24-48 h del traumatismo, la TC puede ser de más utilidad al demostrar los cambios edematosos focales secundarios al desgarro axonal. Wang et al21 describen algunos criterios específicos de la lesión axonal difusa con el examen mediante TC:
Hemorragias intraparenquimatosas únicas o múltiples de menos de 2 cm de diámetro en los hemisferios cerebrales.
Hemorragia intraventricular.
Foco hemorrágico en el cuerpo calloso.
Pequeños focos hemorrágicos (< 2 cm) adyacentes al ventrículo III.
Hemorragia en el tronco cerebral.
Presencia de pequeños focos de baja densidad en las zonas de desgarro axonal.
En resumen, el grado de confidencia de la TC en los pacientes con LAD es moderado, por la frecuencia de falsos negativos (en la fase aguda del TCE grave), para tomar las decisiones terapéuticas adecuadas.
Imagen mediante RM
La RM es mucho más sensible a las alteraciones fisiopatológicas y los cambios estructurales que se producen en los traumatismos craneales graves; mediante las distintas secuencias clásicas se obtiene un grado de sensibilidad y fiabilidad muy alto del estado del parénquima cerebral.
Las secuencias potenciadas en T1 aportan una elevada información anatómica, donde las lesiones hemorrágicas suelen tener un claro aumento de señal. Hay que recordar que las lesiones no hemorrágicas pueden presentar una señal similar al parénquima circundante en las secuencias de T1; pero son claramente hiperintensas en secuencias potenciadas en T2. Con secuencias de difusión es posible observar zonas de hiperintensidad en las áreas de desgarro axonal.
Las secuencias de eco de gradiente muestran su utilidad al poner de manifiesto el efecto paramagnético de los componentes férricos en las hemorragias petequiales, incluso en lesiones que tienen una apariencia normal en las secuencias estándar de T1 y T2. Es una secuencia casi obligada en pacientes con sospecha de desgarro axonal. El efecto paramagnético de la hemosiderina puede persistir durante años, pero, en contra de lo que se ha dicho siempre, también puede llegar a desaparecer con el tiempo. Por ello, en la valoración de los pacientes en EV es importante considerar las lesiones que se presentan en cualquiera de las fases evolutivas, y en el balance global podremos determinar las que cicatrizan, se colapsan, se reabsorben o desaparecen con el tiempo.
Los hallazgos más típicos con RM son las áreas multifocales de hiperintensidad de señal en secuencias de T2 en la unión corticomedular de los lóbulos frontales, temporales o en el esplenio del cuerpo calloso.
Otras áreas de frecuente anormalidad son las localizadas en la porción dorsolateral de la protuberancia y en la corona radiata.
Las secuencias de transferencia de magnetización22, que permiten identificar lesiones no visibles con los pulsos de la secuencia estándar, constituyen nuevos campos de investigación.
Las probabilidades de que los pacientes permanezcan en EVP son mayores cuando las lesiones se producen en la sustancia blanca supratentorial, el cuerpo calloso y la corona radiata. Kampfl et al11 en un importante grupo de pacientes con TCE grave (escala de coma de Glasgow < 8), valorados periódicamente con RM hasta los 12 meses del traumatismo inicial, analizan el número, el tamaño y la localización de las lesiones cerebrales y ponen de manifiesto algunos datos estadísticamente significativos entre los pacientes que permanecen en EVP y los que no (NEVP), que pueden llegar a tener un cierto valor pronóstico. Las lesiones axonales difusas localizadas en el cuerpo calloso son estadísticamente significativas como signos de mala recuperación, en especial las lesiones localizadas en el tercio posterior del cuerpo calloso y en el esplenio (98% en EVP frente a 24% en NEVP).
En la fosa posterior las lesiones mesencéfalo-protuberanciales, en particular las localizadas en los márgenes posteriores de la calota protuberancial, muestran datos estadísticamente significativos de mal pronóstico y ausencia de recuperación clínica (74% en EVP frente a 26% en NEVP). Otras lesiones presentes en la fosa posterior no muestran diferencias significativas entre uno y otro grupo.
En los hemisferios cerebrales, los hallazgos anatomopatológicos también confirman que las lesiones axonales difusas, en especial en la corona radiata (57% en EVP frente a 26% en NEVP) muestran valores estadísticamente significativos, mientras que lesiones en la sustancia blanca lobular o en la cápsula interna no presentaban diferencias significativas entre ambos grupos y fueron observadas en más de la mitad de los pacientes. Contusiones corticales (50%), en los ganglios basales (40%) y en el hipocampo (20%) tampoco muestran diferencias significativas.
La RM es actualmente no sólo el mejor medio para detectar y localizar las lesiones cerebrales en la fase aguda y subaguda del TCE grave, sino que la presencia de signos de lesión axonal difusa y su localización en áreas cerebrales concretas pueden llegar a ser factores altamente predictivos de evolución favorable o desfavorable.
Encefalopatía anóxico-isquémica
La encefalopatía anóxica se presenta fundamentalmente en los pacientes con arritmia cardíaca o PCR, pero otras condiciones clínicas como el infarto de miocardio, la intoxicación por monóxido de carbono, sobredosis por drogas o alteraciones respiratorias graves pueden asimismo conducir a una anoxia cerebral grave.
La vulnerabilidad de los diferentes elementos estructurales del parénquima cerebral frente a la anoxia no es uniforme sino que, en función de su metabolismo y su vascularización, unas estructuras son más sensibles que otras frente a una anoxia cerebral difusa.
En sentido amplio, la sustancia gris es considerada más vulnerable que la sustancia blanca a la isquemia cerebral difusa; las capas celulares corticales, las células del hipocampo, del córtex cerebeloso y de los ganglios basales son las más sensibles en caso de anoxia cerebral23.
Los estudios neurorradiológicos en pacientes que han sufrido una anoxia cerebral grave ponen de manifiesto la pérdida total de diferenciación entre sustancia gris y sustancia blanca, mala definición de los núcleos basales, infartos en zonas frontera y unión corticomedular, y zonas de necrosis laminar24.
Los signos de isquemia se observan, en primer lugar, en las zonas frontera entre las arterias cerebrales y cerebelosas. La región más frecuente y severamente afectada es la parietoccipital, en la confluencia de los territorios de la arteria cerebral media, cerebral anterior y cerebral posterior25. Los ganglios basales son otro de los puntos frecuentemente afectados. En el caso de niños prematuros o recién nacidos, los territorios frontera se hallan en la profundidad de la sustancia blanca periventricular y se manifestará por una leucomalacia periventricular26; la isquemia en los casos graves se puede apreciar el llamado "signo inverso" en donde el cerebelo aparece con un aspecto de mayor densidad comparado con el resto de los hemisferios cerebrales.
Los hallazgos más significativos con TC son la presencia de bandas de baja densidad en la confluencia de grandes territorios vasculares y en los ganglios basales. Con RM y en secuencias potenciadas en T2 se observan con mayor sensibilidad estas áreas de hiperintensidad que frecuentemente muestran un área de captación giriforme, sobre todo durante la primera semana que sigue a la anoxia cerebral. Como sea que la necrosis laminar es con frecuencia hemorrágica, en las fases subagudas, la RM en secuencias potenciadas en T1 muestra áreas corticales de alta señal.
Actualmente, y en condiciones normales, es bien conocido el movimiento desorganizado y al azar de las moléculas de agua en el espacio extracelular (movimiento browniano) que condiciona una pérdida del desplazamiento de fase y una baja intensidad de señal en las secuencias de difusión. En las primeras fases de la encefalopatía anóxica, el edema citotóxico inicial condiciona una restricción de este movimiento browniano y provoca un aumento de la señal en secuencias de difusión. La extensión de las lesiones cerebrales estará determinada por la duración de la anoxia, el flujo cerebral, la temperatura y los valores de glucosa sérica27.
Ya hemos mencionado el principio de vulnerabilidad selectiva de las estructuras del parénquima cerebral frente a la anoxia, que explica las diferencias regionales de afectación cerebral. Cuando hay un predominio de afectación de sustancia gris hablamos de necrosis neuronal selectiva y cuando además se afectan las células gliales y los vasos sanguíneos, hablamos de necrosis panencefálica28.
Los pacientes con PCR prolongada, estudiados con RM y secuencias de difusión, muestran:
Fase aguda (antes de 24 h después del traumatismo): aumento de la señal cortical, en particular en el ámbito rolándico y occipital, en los ganglios basales y en el cerebelo. Las secuencias de RM convencionales no muestran cambios significativos en la fase aguda.
Fase subaguda (24 h-15 días): persiste la misma hiperintensidad de señal del córtex y los ganglios basales por mecanismos similares a los de la fase aguda. Durante este tiempo hay una reperfusión en las regiones isquémicas que por lo general es insuficiente para restablecer el flujo sanguíneo cerebral y produce un aumento del edema citotóxico que, junto a la presencia de edema vasogénico, conduce a un aumento de la señal de la corteza, tanto en secuencias convencionales como de difusión, además de lesiones necróticas en estas regiones.
Fase subaguda tardía (14-20 días): la disminución del pH, por aumento de la producción de ácido láctico, causa la alteración de células gliales y conduce a una hiperintensidad de señal en la sustancia blanca29.
Fase crónica (> 20-25 días): en estos momentos las imágenes de difusión suelen volver a la normalidad. Son las secuencias convencionales que ponen de manifiesto las secuelas de la anoxia cerebral.