INTRODUCCIÓN
Desde la antigüedad el ser humano ha planteado la posibilidad del trasplante de órganos; así lo demuestran las múltiples referencias que aparecen en la mitología y literatura antiguas hindú, egipcia, grecolatina y cristiana1. No es hasta principios de este siglo cuando se inicia la etapa experimental con animales2. En 1954 se realiza en Boston el primer trasplante con éxito a largo plazo, entre gemelos univitelinos, aunque la escasez de gemelos donantes impedía su generalización3. Posteriormente se inició una importante carrera en el conocimiento de los mecanismos de histocompatibilidad, realizándose los primeros intentos con las terapias inmunodepresoras. No es hasta los años setenta en los que, de forma fortuita, se descubre la ciclosporina A, fármaco que revolucionará y hará factible la universalización de esta técnica4. Resueltos los problemas quirúrgicos y con una terapéutica eficaz contra el rechazo, la única limitación actual es la escasez de órganos. A pesar del buen resultado del programa de donantes en muerte encefálica en nuestra comunidad, los equipos de coordinación deben tratar de optimizar el proceso y buscar nuevas alternativas. Un complemento a la extracción de órganos en muerte encefálica, puede ser la obtención de órganos de fallecidos en asistolia; así, en países como Holanda, España, los EE.UU. y Japón, donde no está reconocida la muerte encefálica se han adoptado programas de extracción de órganos en asistolia2,5. Koostra definió 4 tipos diferentes de donantes en asistolia: a) ingresos de cadáveres remitidos expresamente al hospital como donantes y que no han recibido maniobras de resucitación cardiopulmonar (RCP), la mayoría víctimas de accidentes; b) sujetos que sufren parada cardíaca fuera o dentro del hospital en los que las maniobras de RCP son infructuosas; c) pacientes con lesiones neurológicas que no evolucionan a muerte encefálica y a los que se retiran las medidas de soporte vital, con lo que se produce parada cardíaca, iniciándose entonces las medidas de preservación. Este gupo sólo se acepta en Pittsburgh y ha dado origen a importantes controversias éticas, y d) enfermos que sufren parada cardíaca durante el diagnóstico de muerte encefálica. Sánchez-Frucuoso et al han añadido un quinto grupo, las paradas cardíacas inesperadas en UCI2,5,6. Para preservar la viabilidad de los órganos obtenidos es imprescindible el inicio temprano de maniobras de RCP, que deben mantenerse hasta la llegada al centro hospitalario de referencia, donde se iniciaría la perfusión renal. Las técnicas de perfusión renal más utilizadas son cuatro: a) extraer los riñones lo más rápidamente posible, sin ningún método de preservación; b) masaje cardíaco con cardiocompresor, hasta que se realice la extracción; c) realizar bypass cardiopulmonar total o parcial con hipotermia profunda, y d) perfusión in situ con un catéter. Estas dos últimas son las más utilizadas, con resultados similares, aunque el bypass permite un mayor tiempo de mantenimiento y la preservación hepática. La perfusión in situ es una técnica más sencilla, que permite solamente la extracción renal2. En cuanto a la supervivencia de los injertos renales, los resultados a largo plazo son similares a los obtenidos en donantes en muerte encefálica, o incluso mejores cuando los riñones se obtienen de sujetos jóvenes que sufren parada cardíaca tras politraumatismo5,7. En este trabajo hemos querido conocer el número de donantes potenciales de órganos en asistolia, fallecidos tras politraumatismo, en la provincia de Gipuzkoa.
MATERIAL Y MÉTODOS
Se trata de un estudio observacional prospectivo, realizado dentro del proyecto POLIGUITANIA (Evaluación de la Calidad Asistencial al Traumatizado Grave en la Provincia de Gipuzkoa y Aquitania)8-12. Se analizan de forma consecutiva todos los politraumatizados fallecidos en Gipuzkoa en el período comprendido entre el 1 de enero de 1995 y el 31 de diciembre de 1998. La provincia de Gipuzkoa tiene una población aproximada de 700.000 habitantes y dispone de un hospital terciario. Toda la información necesaria para la realización de este estudio se obtuvo del Centro Coordinador de Emergencias Osakidetza, del informe médico de los servicios de ambulancia, de la historia clínica hospitalaria y del informe autópsico realizado por los forenses del Instituto Anatómico Forense de Gipuzkoa que realizaron las autopsias de todos los fallecidos tras traumatismo. Se analizaron las siguientes variables: edad, sexo, lugar donde ocurre el politraumatismo, mecanismo del accidente (tráfico, laboral, precipitación, caída causal, explosión, arma de fuego, otros), intencionalidad (suicida, agresión y accidental), presencia de lesión penetrante, causa de muerte según el informe forense (neurológica, no neurológica y mixta), lugar del fallecimiento (in situ, en el traslado, llegada a urgencias y posteriormente tras el ingreso hospitalario), localidad donde se produce, tiempo de desplazamiento de la unidad de soporte vital avanzado (SVA) recogido para cada caso por el Centro Coordinador de Emergencias y proximidad al hospital terciario de referencia como para iniciar los métodos de perfusión antes de 120 min. Este tiempo fue estimado por el centro coordinador de emergencias de Osakidetza, que asigna un tiempo medio anual de desplazamiento de las unidades de SVA para cada zona geográfica con respecto al hospital terciario, ya que no se procedió al traslado de los fallecidos en el medio prehospitalario al hospital terciario. La gravedad de las lesiones anatómicas, descritas en el informe del forense de las autopsias, fue medida individualizadamente mediante la aplicación del índice de gravedad Injury Severity Score (ISS) autópsico. A pesar de que éste inicialmente fue creado para su aplicabilidad en la práctica clínica hospitalaria13, posteriormente ha sido utilizado por la medicina forénsica14-16 y por nosotros mismos en el estudio de las autopsias17.
Los criterios de inclusión para la valoración prehospitalaria de los donantes potenciales a corazón parado fueron los siguientes:18,19
Cercanía a una unidad territorial de emergencias medicalizada prehospitalaria que permitiera el inicio de las maniobras de resucitación cardiopulmonar en menos de 15 min.
Proximidad al hospital terciario que permitiera el inicio de los métodos de perfusión antes de 120 min tras la parada cardíaca.
Hora de fallecimiento conocida.
Causa de la muerte conocida, descartando las no accidentales (suicidas u homicidas).
Edad superior a 16 años y menor de 50.
Ausencia de lesiones penetrantes sangrantes torácicas o abdominales.
Las variables cuantitativas se expresan como media y desviación estándar y las cualitativas como valor absoluto y proporciones.
RESULTADOS
Durante el período de estudio fallecieron en Gipuzkoa 687 personas tras politraumatismo. La edad media de la muestra fue de 44,3 años (DE = 20,9) y el 55,5% tenían entre 16 y 50 años. Un 78,4% fueron varones. El 54,4% fallecieron en el lugar del accidente, el 12,5% durante el traslado, un 4,8% a su llegada a urgencias y el 28,2% restante tras el ingreso en una planta hospitalaria. El 50,2% de las muertes se produjeron tras un accidente de tráfico, el 13,7% por precipitación, el 5% por caídas fortuitas y el resto se debieron a otras causas. La intencionalidad accidental se describió en el 72,2%, suicida en el 22,1% y homicida en 5,7%. El estudio necrópsico desveló una causa neurológica de muerte en el 42,7% de los casos, una causa extraneurológica (lesión cardiovascular, respiratoria, etc.) en el 44,5% y mixta en el 12,8%. Un 7,8% presentaron lesiones penetrantes. La media de ISS autópsico era de 58,6 (DE = 21,3), muy elevado como era de esperar debido a que las lesiones fueron de la suficiente entidad como para causar la muerte. En el 54,4% de los casos, el evento mortal ocurrió a una distancia de una unidad de soporte vital avanzado (SVA) suficiente como para que pudieran iniciarse maniobras de RCP en menos de 15 min. El tiempo medio entre la parada cardíaca y la llegada de la unidad de SVA fue de 12,7 min (DE = 9.6) (tabla 1).
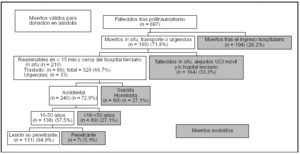
Como se puede observar en la figura 1, de los 687 fallecimientos traumáticos analizados, 194 (28,2%) llegaron a ingresar en un hospital, falleciendo por diferentes causas (sepsis, muerte encefálica, SIRS, fallo multiorgánico, secuelas graves, etc.) que los excluirían como potenciales donantes a corazón parado. De los 493 restantes, 374 (75,9%) murieron in situ, 86 (17,4%) durante el traslado y 33 (6,7%) a su llegada a urgencias. Entre los fallecidos in situ, 210 tenían posibilidades de inicio de las maniobras de RCP y traslado al hopital terciario de acuerdo con los criterios del programa de donación a corazón parado, en tanto que los restantes 164 fallecidos en el lugar del accidente estaban a una distancia de la base de la ambulancia de SVA y/o del hospital terciario que hacía imposible la inclusión dentro del programa. En resumen, la logística actual de las unidades de emergencias, asociada a la orografía de nuestra provincia, permitiría iniciar maniobras de RCP a 329 fallecidos de los 493 pacientes que sufrieron parada cardíaca extrahospitalaria o a la llegada a urgencias (fig. 1). De estos 329, descartaríamos 84 (25,5%) que fueron suicidios, así como 5 (1,5%) homicidios. De los 240 fallecidos accidentalmente y que no presentarían problemas teóricos para obtener el permiso judicial, 138 (57,5%) entrarían en el grupo de edad compatible como potencial donante y 102 (42,5%) presentarían una edad superior a 50 años o inferior a 16 años. En 7 pacientes no se iniciarían maniobras de RCP ante la presencia de lesiones penetrantes causantes de hipovolemia, quedando finalmente 131 casos en los que se podrían iniciar maniobras de RCP y traslado al hospital terciario, lo que supondría una media de 32 casos teóricos al año (fig. 1). Todos estos fallecidos podrían ser donantes potenciales de tejidos.
Figura 1. Criterios de inclusión y exclusión. En los recuadros de color blanco se describe el número de fallecidos válidos para la donación en asistolia. En fondo gris los muertos excluidos para donación.
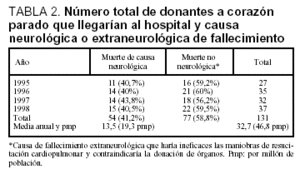
Tras analizar los informes autópsicos de estos pacientes, en 77 (58,8%) se encontraron lesiones internas cardiovasculares o respiratorias que hubieran hecho ineficaces las maniobras de RCP, y los 54 restantes (41,2%) presentaban únicamente lesiones neurológicas como causa de fallecimiento, lo que permitiría que las maniobras de RCP fueran eficaces para la correcta perfusión de los órganos. Esto supondría una media de 13,5 donantes de órganos a corazón parado teóricos al año (tabla 2).
DISCUSION
Nuestro país se ha convertido en estos últimos años en el primero del mundo en donantes de órganos y número de trasplantes. El número de donantes en España entre los años 1995 y 2000 ha oscilado entre 1.037 y 1.345 (26,8-33,9 pmp). En el año 2000 hubo 33,9 donantes pmp frente a 22,3 en los EE.UU., 17 en Francia, 15,4 en Italia o 12,5 en Alemania20,21. A pesar del incremento en el número de órganos implantados, las listas de espera no desaparecen e incluso se incrementan debido a la ampliación de las indicaciones22. Como es sabido, la única limitación actual al trasplante es la escasez de órganos y, por tanto, los equipos de coordinación tienen la obligación de tratar de optimizar todo el proceso y buscar nuevas alternativas. Hasta que la ciencia pueda generar órganos transgénicos aptos, la única fuente son los órganos de los fallecidos. Aunque la mejora de los programas de donación y extracción de órganos procedentes de pacientes en muerte encefálica puede incrementar su número, la donación a corazón parado se presenta como un complemento interesante23-25. El mejor conocimiento de las técnicas de preservación de órganos ha hecho que, actualmente, sea una alternativa o, mejor un complemento válido, con buenos resultado a largo plazo que lo avalan5,26,27. Cho et al describen una mayor supervivencia de los riñones procedentes de donantes en asistolia jóvenes fallecidos por traumatismo que los procedentes de donantes en muerte encefálica de etiología no traumática7. Autores españoles no encuentran diferencias significativas en la supervivencia del injerto renal al año y a los 5 años entre los obtenidos en asistolia y los de muerte encefálica (85 y 83% frente a 87 y 84%)6. Desde la mitad de los años ochenta, diferentes centros hospitalarios de distintos países han desarrollado programas de este tipo28. El Real Decreto 2070/1999 de 30 de diciembre pone las bases jurídicas para el desarrollo de un programa de donación a corazón parado. En nuestro país, varios hospitales han puesto en marcha un programa similar, obteniéndose 32 donantes en el año 2000 (42 riñones y 3 hígados) con este sistema, lo que supuso un 3,5% del total de donantes. En centros como el Hospital Clínico San Carlos de Madrid, donde tienen implantado un programa de este tipo, entre el 30 y el 40% de los riñones trasplantados proceden de donantes a corazón parado29,30. Desde el año 1995 llevamos a cabo el Proyecto Poliguitania, pionero en el Estado español en la evaluación de la calidad asistencial y en el estudio epidemiológico de todos los politraumatismos graves, utilizando como método una auditoría clínico-autópsica8-12. Un comité compuesto por 5 especialistas en medicina intensiva, con amplia experiencia, analizaron y procesaron mensualmente los datos obtenidos del Centro Coordinador de Emergencias de Osakidetza, informe médico de la ambulancia, la historia clínica médica y de enfermería de los que llegaron a urgencias y el informe autópsico realizado por el médico forense del Instituto Anatómico Forense de Gipuzkoa. El importante número de fallecidos, 171 por año, lo que supone 245 muertos por millón de habitantes y año, nos hizo considerar la existencia de un gran potencial para obtener órganos y tejidos con donantes a corazón parado. Algo más de la mitad de los fallecimientos ocurrieron en el mismo lugar del accidente. Debido a las características orográficas de Gipuzkoa y la dispersión de parte de la población, descartamos aquellos en los que las unidades de SVA tardaron más de 15 min en llegar al lugar el accidente y tan alejados del hospital terciario que no permitirían el inicio de métodos de perfusión en los plazos estipulados. Por otra parte, y tras reunirnos con los médicos forenses, hemos excluido a los fallecidos en los cuales podía concurrir algún problema judicial, muertos no accidentales, con intencionalidad presuntamente homicida o suicida. También retiraríamos los pacientes mayores de 50 años, aunque algunos grupos aumentan este límite hasta los 55 o 60 años6,26. Por otro lado, descartaríamos los pacientes pediátricos menores de 16 años y los que presentan lesiones externas penetrantes que contraindicarían o harían ineficaces las maniobras de RCP. Así, de los 171 fallecidos/año, 244 pmp, perderíamos el 80,9% por distintas contraindicaciones, logísticas, judiciales, edad, etc. y podrían llegar al hospital unos 32,7 pacientes año (46,8 pmp). De éstos, aproximadamente la mitad, según los informes autópsicos, serían portadores de alguna lesión interna que haría ineficaces las maniobras de mantenimiento, por lo que reduciríamos el número a 13,5 donantes teóricos de órganos al año (19,3 pmp), aunque todos podrían ser donantes de tejidos (tabla 2). En este trabajo, únicamente hemos analizado los fallecidos tras politraumatismo, sin tener en cuenta otros potenciales donantes, como las paradas cardiorrespiratorias que llegan al hospital y no consiguen ser reanimadas, por lo que probablemente el número de potenciales donantes estaría infraestimado. Por el contrario, el estudio no tiene en cuenta las pérdidas posteriores por negativa familiar, antecedentes de riesgo, contraindicaciones, mala perfusión de los órganos, etc. Queremos destacar que, del total de fallecidos tras politraumatismo, solamente un 7,9% podría ser donante potencial de órganos a corazón parado.
Probablemente, estos resultados sean extrapolables a otras áreas geográficas que presentan ciertas similitudes con nuestra población y pueden servir de guía antes de iniciar un programa de similares características. Parece razonable que, antes de iniciar cualquier programa, se realice un estudio de campo para detectar, cuantificar y analizar los posibles donantes, así como los problemas para la obtención óptima de órganos, para lo cual creemos que la metodología utilizada en el estudio, coordinando los datos de las unidades de emergencia, unidades clínicas y datos autópsicos puede ser válida en estudios previos a la implantación de un programa de donación a corazón parado.
Grupo de trabajo POLIGUITANIA
Servicio de Medicina Intensiva. Hospital de Donostia. San Sebastián: A. González-Sañudo, E. Laviñeta, A. Murgialdai, G. Lara, S. Trabanco y F. Zubia.
Unidad de Emergencias Osakidezta. Gipuzkoa: J.M. Olano, A. Fernández, J. Unanue y M. Merino.
Instituto Anatómico Forense. Gipuzkoa: R. Aranzabal, M.C. Baigorri, M.A. Carnicero, L. Goenaga, I. Lauda, J. Lezaún, P.X. Pinedo, I. Pradini, L. Querejeta, A. Ramírez y V. Verano.
Servicio SAMU 64 y Urgencias del Centro Hospitalario de la Côte Basque. Bayona: J. Darpeix, J.M. Campagne, T. Monki, N. Bonnemaison, E. Lalane, P. Brillaxis, P. Mathieu, M. Mariescu, J. Goulard, P. N'Guyen y P. Michandel.