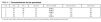INTRODUCCION
Los bloqueadores neuromusculares (BNM) son fármacos que en ocasiones resultan necesarios para conseguir la adaptación de los pacientes críticos a la ventilación mecánica1. Las modalidades de ventilación en el síndrome del distrés respiratorio agudo (SDRA), esto es, hipercapnia permisiva, relación invertida y decúbito prono, exigen una completa adaptación del paciente al respirador, que difícilmente se consigue sólo con el uso de sedantes y analgésicos2. Además, es frecuente su empleo en pacientes ventilados con presión intracraneal elevada, estatus asmático refractario a fármacos broncodilatadores y en aquellos en los que es útil disminuir una excesiva actividad neuromuscular (p. ej., tétanos, hipotermia y estatus convulsivo).
Paralelamente al aumento del empleo de estos fármacos, han surgido numerosas publicaciones sobre las complicaciones que presentan los pacientes críticos cuando se les administra BNM de forma repetida o continua. Así, se han descrito parálisis prolongadas, algunas producidas por la acumulación del BNM, y otras por su probable relación con la aparición de polineuropatías y miopatías3. Uno de los factores más importantes que contribuyen a la aparición de estas complicaciones es un exceso de la profundidad del bloqueo neuromuscular, y probablemente está influido por la ausencia de monitorización de la función neuromuscular4. El mantenimiento del bloqueo neuromuscular al mínimo nivel de profundidad indispensable puede disminuir de forma importante la incidencia de estas complicaciones5.
El rocuronio es el último BNM aminoesteroide comercializado. Es un fármaco químicamente relacionado con el vecuronio, encuadrándose conjuntamente con éste, con el atracurio y con el cisatracurio en BNM de duración intermedia6. Presenta dos diferencias relevantes con respecto al vecuronio. Por un lado, al poseer menor potencia farmacológica, tiene un efecto más rápido, lo que permite su uso en la secuencia rápida de inducción-intubación, con una efectividad muy similar a la succinilcolina7. Por otro lado, al metabolizarse el rocuronio no se producen metabolitos activos. El metabolito farmacológicamente activo del vecuronio, 3-OH-vecuronio, es el responsable de sus efectos acumulativos cuando se usa de forma continua en pacientes críticos con alteraciones de la función renal8. Estas dos diferencias le conceden teóricas ventajas para su empleo en los pacientes críticos.
A finales del año 2000 se aprobó en nuestro país el uso de rocuronio en perfusión continua en pacientes críticos. La experiencia publicada en esta indicación es muy escasa, por lo que el objetivo de nuestro estudio fue analizar la dosis necesaria para conseguir una completa adaptación a la ventilación mecánica con el mínimo nivel de profundidad de bloqueo neuromuscular.
MÉTODO
Estudio prospectivo en pacientes en ventilación mecánica, sedados en grados 5-6 de la escala de Ramsay, en los que se decidió administrar BNM en perfusión continua con una duración prevista de al menos 24 h. Se recogieron los siguientes datos: edad, peso, sexo, motivo de ingreso en la unidad de cuidados intensivos (UCI), APACHE II, motivo de ventilación mecánica y de uso de BNM, y patología concurrente.
Previamente a la administración del fármaco, los pacientes fueron monitorizados con el neuroestimulador TOF-GUARD®, Biometer, en el nervio cubital recogiendo la respuesta en el aductor del pulgar. Tras una dosis inicial de 50 mg de rocuronio, se inició la perfusión, 10 min más tarde, a una dosis de 0,6 mg/kg/h. Cada 10 min se valoró la respuesta al tren de cuatro (TOF) y se modificó la infusión hasta alcanzar la mínima dosis con la que se conseguía la presencia de 4 respuestas con agotamiento al TOF y/o la adaptación completa a la ventilación mecánica con abolición del reflejo tusígeno a la estimulación endotraqueal. Una vez alcanzada la mínima dosis de infusión, la monitorización se realizó cada 6 h y siempre que hubiera un episodio de desadaptación a la ventilación mecánica. Las modifica ciones de la perfusión se efectuaron con subidas o bajadas de 0,1 mg/kg/h. En los pacientes que fue necesario incrementar la dosificación, previamen te a la subida se administró una dosis aislada de entre 5 y 15 mg de rocuronio, dependiendo del nivel de profundidad del bloqueo existente. Tras la suspensión de la perfusión, se valoró el tiempo necesario para la desaparición del efecto bloqueador, mediante la estimulación doble ráfaga (DBS) cada 10 min hasta la obtención de las dos respuestas iguales.
Se recogieron datos sobre tiempo de infusión, dosis horaria necesaria para conseguir el mínimo grado de profundidad del bloqueo neuromuscular necesario, número de ajustes de la dosificación y tiempo necesario para la recuperación del bloqueo una vez suspendida la infusión. En los supervivientes se hizo un seguimiento para detectar posibles alteraciones neuromusculares clínicamente relevantes.
Todos los datos son expresados como media y desviación estándar (DE).
RESULTADOS
Se incluyó a 5 pacientes (tres mujeres), con edades de 49 (DE, 11) años y peso aproximado de 65 ± 10 kg. Los pacientes fueron ingresados en la UCI en 2 casos por insuficiencia respiratoria aguda, y en un caso por intoxicación farmacológica (por antidepresivos, antipsicóticos y benzodiacepinas), shock séptico y tras parada cardiorrespiratoria reanimada. El APACHE II al ingreso fue de 22 (DE, 6). Los pacientes necesitaron ventilación mecánica y sedación profunda, con midazolam (rango de 16 a 34 mg/h) y fentanilo, por SDRA (4 casos) y estatus mioclónico (un caso). Los 4 pacientes con SDRA fueron ventilados con VC < 6 ml/kg, PEEP 12-20 cmH2O e hipercapnia permisiva. Dos de ellos necesitaron relación invertida. Un paciente presentaba criterios de fallo multiorgánico (FMO). Se decidió bloqueo neuromuscular con rocuronio en perfusión continua para conseguir la adaptación a la ventilación mecánica en 4 casos, y para la abolición de las mioclonías en un caso (tabla 1). El tiempo total de infusión del rocuronio fue de 123 (DE, 70) h, lo que supuso el 45 (DE, 23)% de la duración total de la ventilación mecánica. En todos los casos se consiguió la adaptación a la ventilación mecánica con la presencia de las 4 respuestas a la estimulación TOF con una relación T4/T1 < 30%. La dosis necesaria para conseguir este nivel de bloqueo neuromuscular fue de 28 (DE, 20) mg/h, con un rango de 10-80 mg/h. Hubo 7 (DE, 3) cambios de dosificación por paciente. El paciente que presentaba criterios de FMO (con afección de la función hepática y renal) fue el que necesitó menos dosificación del fármaco. No se precisó aumentar la dosis durante el tiempo de infusión. Tres pacientes fallecieron. En los dos supervivientes, la recuperación del bloqueo (DBS 1) fue de 55 (DE, 5) min, y en su seguimiento no se observaron complicaciones neuromusculares relevantes.
DISCUSION
Hemos evaluado de forma prospectiva la dosis necesaria de rocuronio en perfusión continua para conseguir la adaptación a la ventilación mecánica, en 5 pacientes críticos, con el menor grado de profundidad de bloqueo neuromuscular necesario. Aunque con las limitaciones debidas al número de pacientes incluidos, varios aspectos del estudio merecen un comentario.
En primer lugar, hemos observado una amplia variabilidad en la dosis necesaria, de entre 10 y 80 mg/h, para conseguir el objetivo. Este hallazgo es común en la mayoría de los estudios con el uso de otros BNM en pacientes críticos y queda justificado tanto por la diversidad de problemas médicos que presentan estos pacientes como por las diferentes medicaciones que se usan conjuntamente y que pueden provocar alteraciones farmacocinéticas y farmacodinámicas de los BNM9-11.
En segundo lugar, hemos observado que un mínimo nivel de profundidad del bloqueo neuromuscular (presencia de 4 respuestas con relación T4/T1 < 30%) fue suficiente para conseguir el objetivo, es decir, la adaptación completa a la ventilación mecánica. Estos mismos hallazgos se han obtenido en otros estudios con vecuronio en perfusión continua12,13. Sin embargo, esta conclusión puede no ser aplicable en circunstancias diferentes de las de nuestro estudio, como, por ejemplo, cuando se emplee el rocuronio en pacientes sedados con dosis menores de midazolam o sedados con otro tipo de sedante, o uso de BNM para otras indicaciones, como el tratamiento de los pacientes con hipertensión intracraneal, en cuyo caso podría ser necesaria una mayor profundidad del bloqueo neuromuscular.
En tercer lugar, la estrecha monitorización de estos pacientes ha impedido la acumulación del fármaco y, por tanto, ha evitado el retraso en la desapa rición del efecto bloqueador. El rocuronio es un fármaco de eliminación hepatobiliar y en un 30%, de eliminación renal14. La administración del fármaco en estos casos, sin control de la profundidad del bloqueo neuromuscular, puede provocar su acumulación e inducir parálisis prolongadas15,16. En nuestro estudio, el único paciente con FMO tuvo una rápi da recuperación del bloqueo una vez suspendido el fármaco.
Estos tres aspectos recalcan la importancia de la monitorización del efecto del BNM en los pacientes críticos. Además, esta monitorización puede dis minuir la incidencia de miopatías17. Aunque en ninguno de los casos se realizó un estudio electromiográfico posterior, los dos únicos supervivientes de nuestro estudio no presentaron alteraciones neuromusculares clínicamente relevantes.
Existe muy poca experiencia publicada con el uso de rocuronio en pacientes críticos. En el momento de realizar el estudio, sólo existíann dos trabajos publicados en forma definitiva (uno de ellos en población infantil), y uno más en forma de resumen. Sparr et al publicaron la primera experiencia18. Los autores estudiaron a 32 pacientes críticos, de los cuales sólo 5 recibieron el fármaco en perfusión. El fármaco fue ajustado a un nivel de profundidad de bloqueo para tener una respuesta al estímulo TOF, es decir, más intenso que en nuestro estudio, y como es de esperar la dosis necesaria fue mayor, 44 mg/h (rango, 31-50) frente a 28 mg/h (rango, 10-80 mg/h). La menor variabilidad de la dosis probablemente se explique por los criterios de exclusión del estudio de Sparr et al, en el que se excluyó a los pacientes con fallo renal y/o hepático. El estudio publicado sólo en forma de resumen19 refiere la necesidad de dosis menores en los pacientes con criterios de FMO. Tobías20, en su trabajo sobre una población infantil (20 pacientes), también encuentra una amplia variabilidad (de hasta 8 veces) de la dosis necesaria para mantener una respuesta al estímulo TOF. Este autor refiere la presencia de tolerancia al fármaco cuando se administra más de 5 días. En nuestro estudio no hemos encontrado tolerancia, pero sólo un paciente recibió el fármaco más de 5 días.
En resumen, nuestro estudio, limitado por el pequeño número de pacientes estudiados, indica cuál es la dosis de rocuronio necesaria para adaptar a los pacientes a la ventilación mecánica, cuando se administra de forma intravenosa continua y ajustada para conseguir el mínimo grado de profundidad del bloqueo neuromuscular.