INTRODUCCIÓN
Los pacientes pediátricos que requieren asistencia ventilatoria mecánica (AVM), a menudo, son los más graves de aquellos ingresados a la Unidad de Cuidados Intensivos, y consecuentemente, también son los más expuestos a padecer complicaciones que ponen en riesgo sus vidas1. Por lo tanto, la identificación de los factores de riesgo asociados con una menor supervivencia deberían proveer información esencial para la toma de decisiones en la práctica clínica, e información a los familiares sobre el pronóstico de aquéllos que precisan de este soporte vital2.
La supervivencia de la población adulta ventilada mecánicamente oscila entre 56 y 70%, y los distintos factores que se asocian a una mayor mortalidad han sido claramente identificados3-7. En cohortes similares de niños la tasa de supervivencia es mayor, desde el 83% hasta el 98%8-12; sin embargo, son pocos los estudios que han evaluado de manera prospectiva si la gravedad al ingreso en la Unidad de Cuidados Intensivos Pediátricos (UCIP), así como las distintas causas de insuficiencia respiratoria aguda que ocasionan la necesidad de AVM o las complicaciones que se presentan durante la misma, están asociadas con la supervivencia de los niños ventilados. Por lo tanto, es de capital importancia identificar los factores antes mencionados, y con este objetivo hemos realizado un análisis secundario de la base de datos de un estudio multicéntrico llevado a cabo en pacientes pediátricos ventilados mecánicamente por un lapso de tiempo superior a las 12 horas12.
PACIENTES Y MÉTODOS
En 36 UCIP se llevó a cabo un estudio de cohortes de todos los pacientes ingresados en las Unidades participantes, a los que se les proporcionó ventilación mecánica por un lapso de tiempo superior a las 12 horas entre el 1 de abril y el 31 de mayo de 1999. El investigador designado en cada Unidad era el único que conocía la realización del estudio, con el fin de evitar cualquier influencia en el manejo habitual de los pacientes, y a cada uno de ellos se les proveyó de un manual que describía los datos a recoger y las definiciones.
Para el propósito de este estudio la variables obtenidas se dividieron en tres grupos, así como previamente fue descrito por Frutos et al7:
1. Variables previas al inicio de la ventilación mecánica. Datos demográficos: género, edad, peso, fecha de ingreso en la UCIP, puntuación del Pediatric Risk of Mortality (PRISM) score13 en el momento del ingreso, fecha de inicio de la ventilación mecánica y causa que motivó el inicio de la misma: enfermedad pulmonar, incluyendo a los enfermos con reagudización de la enfermedad pulmonar crónica debido a infección, broncoespasmo, o cualquier otra causa de exacerbación; asma; coma, incluyendo a los pacientes que requirieron ventilación mecánica por una disminución del nivel de conciencia secundaria a causas tumorales, hemorrágicas, infecciosas o metabólicas; enfermedad neuromuscular; insuficiencia respiratoria aguda, donde se incluyó a los pacientes que, no teniendo una enfermedad pulmonar crónica, precisaron ventilación mecánica debido a una de las siguientes causas: a) síndrome de distrés respiratorio agudo (SDRA) definido según la Conferencia de Consenso Americana-Europea14; b) postoperatorio, incluidos los pacientes que precisaron una prolongación de la ventilación mecánica tras una intervención quirúrgica debido a la enfermedad de base, o cirugía de alto riesgo; c) insuficiencia cardíaca/edema agudo de pulmón, pacientes con disnea, infiltrado alveolar bilateral, hipoxemia y evidencia de enfermedad cardíaca (arritmias, miocardiopatía y cardiopatía congénita) o pacientes con shock cardiogénico; d) aspiración, definida como visualización de contenido gástrico en la vía aérea o en el aspirado traqueal; e) neumonía, definida por la aparición de infiltrado alveolar persistente acompañado de fiebre/hipotermia y leucocitosis/leucopenia; f) bronquiolitis, definida por la presencia de taquipnea, tos, retracción torácica, espiración prolongada, sibilancias e hiperinsuflación torácica en la radiografía de tórax; g) sepsis y shock séptico, definida según los criterios de la Conferencia de Consenso de la ACCP/SCCM, con la adaptación de tales criterios para pacientes pediátricos como fuera descrita por Proulx et al15; h) traumatismos: pacientes que requerían ventilación mecánica debido a lesiones de tórax, abdomen y/ o cabeza producidas por un traumatismo; i) obstrucción de la vía aérea superior: debido a infección (epiglotitis y laringotraqueítis); j) misceláneas: cualquier otra etiología de fallo respiratorio agudo no mencionada antes.
En el caso que un paciente tuviese más de una causa, el investigador registró la causa dominante.
2. Variables relacionadas con el tratamiento durante la ventilación mecánica. En este grupo se han valorado las siguientes variables: parámetros ventilatorios (volumen corriente, frecuencia respiratoria, presión positiva espiratoria final [PEEP], fracción inspirada de oxígeno, presión inspiratoria pico), la gasometría más cercana al registro de los parámetros ventilatorios, la utilización de relajantes musculares, sedantes (opiáceos, benzodiacepinas y propofol) y fármacos vasoactivos.
3. Variables relacionadas con las complicaciones aparecidas durante la ventilación mecánica. En este grupo se han incluido las siguientes complicaciones: SDRA, barotrauma, neumonía asociada a ventilación mecánica, sepsis, shock, fracaso renal agudo, fallo hepático, coagulopatía, acidosis metabólica y acidosis respiratoria (para considerar presente alguno de estos acontecimientos se requería que se mantuviese durante al menos 24 horas). Dado que el SDRA, la sepsis y la neumonía podían ser motivo para el inicio de la ventilación mecánica, se consideraron complicaciones cuando aparecían con posterioridad a las primeras 48 horas desde el inicio de la ventilación. Las definiciones de las complicaciones mencionadas se exponen en el apéndice.
El seguimiento de los pacientes se realizó hasta el alta del hospital, registrándose los días de ventilación mecánica, de weaning, los días de estancia en la UCIP y la situación vital en el momento del alta.
Análisis estadístico
Los resultados se expresan como media y desviación estándar (DE), medianas con percentiles 25 y 75 o proporciones con intervalo de confianza (IC) del 95%, según fuese más apropiado. El objetivo primario fue la mortalidad en la UCIP. Para valorar la influencia de cada variable en la mortalidad al alta de la UCIP se realizó un análisis de particiones recursivas16 utilizando en el modelo las variables que presentaron significación estadística en el análisis univariante. Con el análisis de particiones recursivas se construyó, inicialmente, un árbol de clasificación introduciendo las variables previamente mencionadas. Este método identifica el punto de corte o valor umbral, para cada variable, que proporciona la mejor discriminación entre los enfermos que sobreviven y los que fallecen. Para las variables continuas, el potencial valor umbral es cualquiera de los representados en los datos, mientras que en las variables dicotómicas, el punto de corte se establece entre la ausencia o la presencia de una categoría.
Para las variables con varias categorías, el programa agrupa en las dos subcategorías que mejor clasifiquen a los pacientes. Las particiones empiezan tras evaluar la capacidad de cada variable para discriminar a los fallecidos de los supervivientes; así, la variable que da lugar a la mejor división se convierte en la primera rama del árbol. Este procedimiento se repite para cada uno de los dos subgrupos que han resultado de la primera división, hasta que no sea posible obtener más particiones por no haber diferencias significativas entre fallecidos y supervivientes o haya menos de 25 pacientes en uno de los grupos resultantes. Este método, además de dibujar un árbol de clasificación, nos permite obtener subgrupos de enfermos con diferentes combinaciones de variables asociadas que conllevan distinto riesgo de mortalidad. Una vez identificados los subgrupos de riesgo, se realiza un modelo de regresión logística para estimar la odds ratio (OR) de cada subgrupo. Los subgrupos obtenidos se introducen en el modelo como una variable dummy, que compara cada subgrupo con el que tiene una menor mortalidad.
RESULTADOS
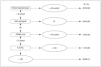
Durante el período de estudio 659 niños ingresados en las UCIP participantes requirieron ventilación mecánica durante más de 12 horas. Fueron excluidos del análisis 15 pacientes por desconocer su estado vital en el momento del alta de la UCIP. En la tabla 1 se exponen las características de los pacientes con relación a su estado vital al alta de la Unidad. La mortalidad observada fue del 15%, mientras que la mortalidad predicha por PRISM score fue del 17%.
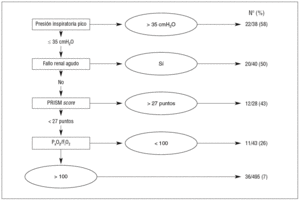
En el análisis de particiones recursivas que se observa en la figura 1 se identifican las variables asociadas a la mortalidad al alta de la UCIP: presión inspiratoria pico (PIP) * 35 cmH2O, desarrollo de fracaso renal agudo, hipoxemia grave (definida como un valor medio de relación PaO2/FiO2 < 100) durante la ventilación mecánica y gravedad de la enfermedad estimada por la puntuación del PRISM score. La combinación de estas variables identificó diferentes grupos de riesgo de la población estudiada. En la tabla 2 se expone el resultado del análisis multivariante con los subgrupos de riesgo obtenidos. Los 5 subgrupos se pueden agrupar en dos categorías basadas en su probabilidad de muerte; así, obtenemos una primera categoría con una alta probabilidad de muerte (entre 26% y 58%), constituida por los enfermos en los que se asocian factores de riesgo desarrollados durante la ventilación mecánica: PIP * 35 cmH2O, fracaso renal agudo, hipoxemia grave o que presentan, en el momento de su ingreso en la UCIP, una alta gravedad estimada por una puntuación PRISM score > 27. Por último, existe una categoría con una probabilidad de muerte inferior o igual al 7%, que comprende los pacientes con ausencia de los factores de riesgo antes mencionados.
Figura 1. Árbol de decisión en relación a la mortalidad en la Unidad de Cuidados Intensivos Pediátricos (UCIP).
DISCUSIÓN
En este estudio hemos identificado los factores que influyen sobre el pronóstico de los pacientes pediátricos ventilados mecánicamente. Este trabajo es el de mayor tamaño muestral que conocemos sobre el particular, y cuya recogida de datos fue realizada de manera prospectiva e involucrando a 36 UCIP distribuidas por distintos países. Nuestra tasa de mortalidad fue alrededor del 15%, que es muy similar a la reportada por otros autores en poblaciones heterogéneas de niños ventilados8-10,12.
Los estudios multicéntricos reportan tasas de mortalidad entre 13% y 17%8-10,12, sin embargo, un estudio reciente llevado a cabo en 9 UCIP de EE. UU. encontró que sólo 3 de 189 (2%) pacientes pediátricos fallecieron al alta del hospital11. Esta tasa de mortalidad es llamativamente menor a la reportada en el global de los ingresos de pacientes en las UCIP, que oscila entre 5 y 10%1,9,10,15. Es probable que estas discrepancias estén relacionadas con la exclusión de pacientes. Por ejemplo, en el estudio de Randolph et al11, de los 1.096 pacientes ventilados y potencialmente elegibles se excluyó a 796 (72%) y la mayoría de estas exclusiones fueron motivadas por patologías preexistentes (trasplantados, cardiopatías congénitas, dependencia crónica al respirador, etc.) que están asociadas a mayor mortalidad17.
Examinando los factores que se asocian independientemente a menor supervivencia, hemos encontrado que aquellos pacientes con presión pico * 35 H2O, presentan un alto riesgo de mortalidad (58%). Los niveles de PIP reportados en niños fallecidos oscilan entre 25 ± 7,3 y 73 ± 18 cmH2O12,18-20. En adultos, Esteban et al5 encontraron una asociación independiente entre PIP * 50 cmH2O y mayor mortalidad (OR 2,67; IC 95 % 1,50-4,72; p < 0,01). En niños, un valor umbral de PIP asociado a menor supervivencia no ha sido rigurosamente establecido. Nuestro análisis por particiones recursivas muestra que el valor umbral de PIP que mejor discrimina entre vivos y fallecidos es 35 cmH2O, y que un valor por encima de este punto de corte está asociado con mayor mortalidad. Desde esta perspectiva, nuestro estudio ofrece un valor de referencia para evaluar la efectividad de las estrategias de ventilación con protección pulmonar en pacientes pediátricos. Por otra parte, es necesario destacar que la asociación entre PIP y mortalidad no demuestra necesariamente causalidad; es probable que para mantener el adecuado intercambio de gases en pulmones con distintos grados de lesión se requiera el uso de altos niveles de PIP, o alternativamente, las altas presiones inspiratorias pueden por sí mismas inducir lesión pulmonar, ya sea por daño capilar o barotrauma.
El desarrollo de disfunción multiorgánica durante la estancia en la UCIP y su asociación con alta mortalidad ya fue reportada por otros9,10,15,20. Leteurtre et al9 encontraron que el fallo renal agudo se acompaña de un 20% de mortalidad y el desarrollo de hipoxemia grave (PaO2/FiO2 < 75) conlleva una mortalidad del 50%. Nosotros hemos encontrado las mismas complicaciones asociadas a un alto riesgo de mortalidad.
Distintas escalas son utilizadas para estimar el pronóstico de acuerdo a la gravedad de la enfermedad al ingreso a la UCIP en las primeras 24 horas13,21-23. Sin embargo, el pronóstico de los pacientes ventilados no sólo depende de las variables obtenidas en esas horas, sino también de los tratamientos empleados durante el curso de la ventilación mecánica y los eventos aparecidos durante la misma. Por otra parte, unas tasas de mortalidad inferior al 10% para los pacientes generales ingresados en las UCIP1,9,10,15,22-24 y 18% para los niños ventilados8-10,12 pueden resultar insuficientes para evaluar la eficiencia o efectividad de las UCIP en los estudios controlados. Por lo tanto, es probable que combinando gravedad de enfermedad con aquellos eventos de presentación más frecuentes durante el curso de la AVM, permitan reducir el tamaño muestral para evaluar la eficiencia o la efectividad antes mencionada.
Nuestro estudio tiene algunas limitaciones. La primera es la participación de UCIP de diferentes países sin un protocolo específico para el manejo de la ventilación, no obstante, la gran cantidad de pacientes de diferentes centros de atención puede reflejar la práctica cotidiana en estas Unidades. En segundo lugar, el análisis por particiones recursivas que hemos utilizado para identificar subgrupos de riesgo puede limitar el número de variables asociadas independientemente a la mortalidad. Sin embargo, la identificación de estos subgrupos puede ayudar en la toma de decisiones en la práctica clínica e información a los padres. De cualquier manera, esta identificación no debe ser utilizada como justificación de retirada de un determinado tratamiento. Por otra parte, por tratarse de un estudio de desarrollo, nuestro árbol de decisión debe ser prospectivamente validado en una población independiente de niños ventilados. Por último, ciertos diagnósticos, tales como inmunodeficiencia, leucemia y trasplante de médula ósea, están asociados a mayor mortalidad25,26; sin embargo, no hemos calculado el tamaño muestral para detectar estos subgrupos de riesgo en nuestra población.
En conclusión, en una cohorte de pacientes pediátricos ventilados mecánicamente durante más de 12 horas hemos identificado los factores de riesgo que se asocian con la mortalidad, y aunque algunos pueden ser determinados en las primeras horas del inicio de la ventilación, la mayoría de ellos se desarrollan durante el curso de la AVM. Todos estos factores deben ser tenidos en cuenta para la toma de decisiones en la práctica clínica e información a los padres.
AGRADECIMIENTOS
Los autores agradecen a las instituciones participantes y a los siguientes investigadores su generoso aporte para la obtención de los datos: Argentina (n = 214): R. Poterala y H. Amaro. Hospital de Niños R Gutiérrez. Buenos Aires; M. Adeja y C. Meregalli. Hospital de Niños P. Elizalde. Buenos Aires; N. Demo y G. Pujales. Hospital Materno Infantil. San Luis; P. Minces y E. Schniltzer. Hospital Italiano. Buenos Aires; S. Sáenz, M. Centeno. Hospital de Niños de la Santísima Trinidad. Córdoba; M. E. Ratto y C Peltzer. Hospital de Niños Sor María Ludovica. La Plata. Buenos Aires; D Allende y O. Maliarchuk. Hospital Provincial Castro Rendón. Neuquén; M. Cabezas e I. Oviedo. Hospital de Niños J.J. Vilela. Rosario. Santa Fe; R. Jabornisky y F. Avellaneda. Hospital de Niños Juan Pablo II. Corrientes; F. Olazarri, y F. Ibelli. Clínica Bazterrica. Buenos Aires.
Costa Rica (n = 81): A. Baltodano Agüero. Hospital Nacional de Niños Dr. Carlos Sáenz H. Costa Rica.
Grecia (n = 37): D. Paraschou. Children's Hospital Pesenti; M. Tamiolaki. Children's Hospital Santa Sophia. Athens.
Panamá (n = 38): M. Johnson y A. Vargas. Hospital de Niños de Panamá.
España (n = 173): P. Azcón. Hospital Universitario Virgen de las Nieves. Granada; J. Balcells. Hospital Vall d´Hebrón. Barcelona; J.C. de Carlos. Hospital Son Dureta. Palma de Mallorca; J. Espinosa. Hospital Materno-Infantil. Badajoz; M. Frías. Hospital Universitario Reina Sofía. Córdoba; E. García-Sánchez. Hospital Universitario Gregorio Marañón. Madrid; A. Hernández. Hospital Puerta del Mar. Cádiz; A. Medina. Hospital Central de Asturias. Oviedo; I. Martos. Hospital Ramón y Cajal. Madrid; P. Oliva. Hospital La Paz. Madrid; J. Pilar. Hospital de Cruces. Baracaldo; M. Pons. Hospital Sant Joan de Deu. Esplugues. Barcelona; F. Rodríguez Amuedo. Hospital Materno-Infantil. Málaga; J.I. Sánchez Díaz. Hospital 12 de Octubre. Madrid; J.M. Sánchez López. Complejo Hospitalario Materno-Infantil. Las Palmas de Gran Canaria; J.P. Santidrián. Hospital Universitario Marqués de Valdecilla. Santander; A. Serrano. Hospital Universitario del Niño Jesús. Madrid; C. Valdovinos. Hospital Miguel Servet. Zaragoza.
Reino Unido (n = 56): J. Fraser. Bristol Royal Hospital for Sick Children. Bristol; M.A. Petros. Great Ormond Street Hospital for Children. Londres.
Estados Unidos (n = 45): G. Reyes. PICU Hope children's Hospital. Illinois; Nemours org (PICU Alfred I. duPont Hospital for Children - Wilmington, DE).
APÉNDICE
Acidosis metabólica: se definió como un pH menor de 7,30 con una PaCO2 menor de 45 mmHg.
Acidosis respiratoria: se definió como un pH menor de 7,35 con una PaCO2 mayor de 55 mmHg.
Barotrauma: presencia de al menos uno de los siguientes hallazgos: enfisema intersticial, neumotórax, neumomediastino, neumoperitoneo y enfisema subcutáneo.
Coagulopatía: disminución del recuento de plaquetas < 25.000, con un aumento en el tiempo de protrombina, al menos dos veces el valor control.
Fallo hepático: se definió como un aumento en la bilirrubina por encima de 3 mg/dl con incremento de las transaminasas y de la lacticodeshidrogenasa dos veces por encima del límite superior de la normalidad.
Fracaso renal agudo: se definió como un aumento agudo en la creatinina mayor de 2 mg/dl, o que se doblara el valor basal en un paciente con fracaso renal crónico y/o la necesidad de cualquier método de depuración renal.
Neumonía asociada a la ventilación mecánica: fue definida de acuerdo con los criterios modificados de los CDC (CDC. Definitions for nosocomial infections, 1988. Am Rev Respir Dis. 1989;39:1058-9).
Síndrome de distrés respiratorio agudo: fue definido de acuerdo con los criterios de la conferencia de consenso Americano-Europea14.
Sepsis y shock séptico: fueron definidos de acuerdo con los criterios de la conferencia de consenso ACCP-SCCM, con la adaptación de tales criterios para pacientes pediátricos como fuera descrita por Proulx F, et al15.