INTRODUCCIÓN
El síndrome coronario agudo (SCA) continúa siendo la primera causa de muerte de la población española a pesar de los esfuerzos realizados para su prevención y tratamiento. La mortalidad global a los 28 días del infarto agudo de miocardio (IAM) se sitúa en España en torno al 50% y las proyecciones para la próxima década son de un aumento en su prevalencia de alrededor del 10% considerando el envejecimiento de la población1.
El conocimiento detallado del comportamiento fisiopatológico de la placa inestable activa, así como los conceptos de lesión culpable y arteria abierta, han facilitado la clasificación de los SCA y la individualización de su tratamiento2. La administración temprana de agentes fibrinolíticos constituye, juntamente con la revascularización percutánea, la mejor opción terapéutica para la mayoría de los pacientes con SCA y elevación del segmento ST3,4. Sin embargo, los registros realizados recientemente muestran una utilización de estos recursos inferior a la deseable, debido a causas diversas, y se estima que cerca de la tercera parte de los pacientes candidatos no reciben tratamiento de reperfusión5-8.
El Proyecto de Registro de Infarto Agudo de Miocardio Hospitalario (PRIAMHO) permite evaluar periódicamente el manejo del paciente con IAM y, en particular, la utilización de estos procedimientos de reperfusión9,10.
Este trabajo describe la utilización de la repefusión en los pacientes registrados en el estudio PRIAMHO II, analiza los factores relacionados con su uso y los beneficios, en términos de mortalidad, que este tratamiento generó.
MATERIAL Y MÉTODO
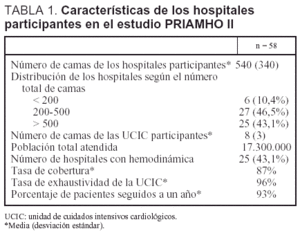
El registro PRIAMHO II es un estudio de cohorte con registro hospitalario de IAM y seguimiento a un año. Se recogieron, de manera prospectiva, los datos de los pacientes con IAM que ingresaron consecutivamente en las unidades de cuidados intensivos cardiológicos (UCIC) de 58 (71,6%) de los 81 hospitales españoles seleccionados. Esta selección fue hecha al azar entre los 165 hospitales que atienden pacientes con IAM, disponen de una UCIC y pertenecen a la red de asistencia pública o están concertados con ella. De los 81 seleccionados, 7 (8,6%) declinaron participar y fueron sustituidos por otros tantos de características similares. Únicamente 63 superaron la fase piloto, y 5 de ellos fueron finalmente eliminados del análisis por no cumplir los criterios de control de calidad, quedando 58 válidos. El reclutamiento tuvo lugar del 15 de mayo al 15 de diciembre de 2000. La selección aleatoria de hospitales se estratificó respetando la distribución por número de camas (< 200, 200 a 500 y > 500).
Los investigadores locales en cada UCIC recogieron de manera prospectiva los datos de cada paciente que cumpliera los criterios de inclusión en el estudio y, por otra parte, a partir de los listados de las altas hospitalarias, se confirmaron los diagnósticos de IAM de los pacientes que no habían sido registrados por los investigadores locales por no haber ingresado en la UCIC, y se identificaron los pacientes que habían sido ingresados en la UCIC pero no habían sido incluidos en el registro PRIAMHO. El número de pacientes diagnosticados correctamente de IAM que no habían pasado por la UCIC permitió determinar el porcentaje de cobertura de cada UCIC (número de IAM en UCIC × 100/número de IAM dados de alta en el hospital). La tasa de exhaustividad se calculó como número de IAM registrados × 100/número de IAM ingresados en la UCIC. Las condiciones que debieron cumplir los hospitales, al final del reclutamiento, para poder incluir sus datos en el registro fueron similares a las del PRIAMHO I11: a) tasa de cobertura: registro de al menos el 70% de los pacientes con IAM ingresados en el centro. Esta tasa se obtuvo de los listados de alta que correspondían a un promedio de 3 meses de registro por hospital tomados aleatoriamente; b) tasa de exhaustividad: registro de más del 75% de los pacientes con IAM ingresados en la UCIC, que se identificaron de una manera similar; c) tasa de concordancia: índice Kappa de concordancia promedio superior al 70% entre los datos registrados y los obtenidos por un auditor externo en una muestra aleatoria del 20% de los pacientes registrados por centro, y d) seguimiento al año: conocimiento del estado vital de más del 90% de los pacientes registrados residentes en el área de referencia del hospital. Las características de los hospitales que participaron en el estudio se muestran en la tabla 1.
De cada paciente con IAM ingresado en la UCIC se recogieron datos demográficos, de antecedentes y clínicos, así como los procedimientos diagnósticos y terapéuticos utilizados durante la estancia en la UCIC y en la planta de hospitalización, las complicaciones y los tratamientos al alta. Todas las variables se definieron previamente y su recogida y codificación se estandarizó12. La fibrinólisis o la angioplastia primaria, los bloqueadores beta, los antiagregantes plaquetarios, los inhibidores de la enzima de conversión de la angiotensina (IECA) y los hipolipemiantes se consideraron como indicadores índice del manejo óptimo del IAM.
La entrada de datos se realizó en cada centro mediante un programa informático propio del estudio, que permitía una monitorización automática de su coherencia interna y depuraba errores interactivamente. Un centro coordinador se encargó del seguimiento, control de calidad de los datos, análisis estadísticos y del apoyo logístico en los procesos de monitorización de los datos.
Los pacientes se siguieron desde el centro coordinador. El seguimiento mínimo de los supervivientes fue de un año. El acontecimiento de interés durante este período fue la muerte. Todos los fallecimientos ocurridos en los primeros 28 días después del IAM se consideraron relacionados con éste. Con posterioridad a ese período de 28 días, se incluyó la mortalidad por cualquier causa. No se realizó seguimiento de los pacientes que no ingresaron en las UCIC.
Diagnóstico de infarto de miocardio
El diagnóstico de IAM se fundamentó en la presencia de al menos 2 de los 3 criterios de la definición de la OMS13:
1. Presentación clínica: sintomatología compatible con isquemia coronaria de duración mayor de 20 min14.
2. Datos electrocardiográficos: IAM con onda Q: aparición de onda Q ≥ 30 mseg en 2 o más derivaciones contiguas)15,16. R/S ≥ 1 en V1-V2, para el IAM posterior.
3. Datos enzimáticos: se aplicaron 3 criterios: elevación de la creatincinasa (CK) total > 2 veces el límite de lo normal14; elevación de la CK-MB > 6% del total, o elevación de la CK-MB > 25 U/l o > 7 ng/ml según se determinara CK-MB actividad o masa17. Todo ello con determinaciones seriadas que mostraran curva evolutiva enzimática.
En relación con las derivaciones afectadas en el electrocardiograma (ECG), se consideraron infartos anteriores, inferiores y no localizados.
Indicación de reperfusión y complicaciones
Para los fines de este estudio, se estableció que los criterios para realizar reperfusión fueron: elevación del ST de al menos 1 mm en, por lo menos, 2 derivaciones de miembros o elevación de al menos 2 mm en 2 o más derivaciones precordiales contiguas, o bien bloqueo completo de la rama izquierda del haz de His (BCRIHH) y, en cualquier caso, menos de 12 h de evolución desde el comienzo de los síntomas. El descenso del ST en V1-V3 se consideró imagen en espejo de la cara posterior18.
Las complicaciones durante la fase hospitalaria se agruparon en: 1) isquémicas: angina post-IAM y reinfarto; 2) mecánicas: rotura mitral, cardíaca o del septo interventricular, y 3) alteraciones del ritmo: fibrilación ventricular primaria (FV), taquicardia ventricular sostenida (TV), flúter/fibrilación auricular (FA) y bloqueo auriculoventricular (BAV). El fracaso ventricular izquierdo se valoró según la clasificación de Killip, se agruparon los grados II y III y el shock cardiogénico se dejó como una categoría independiente. La fracción de eyección (FE) se recogió por cualquiera de las técnicas aceptadas y una vez estabilizado el paciente en el episodio agudo. Se han considerado contraindicaciones para la reperfusión (fibrinólisis) las que figuran en las guías de actuación al uso19.
Análisis estadístico
Los resultados de las variables continuas se muestran como media y desviación estándar, o como mediana y percentiles 25 y 75 si no seguían una distribución normal; las medias y las medianas se compararon con la t de Student o la U de Mann Whitney, respectivamente. Las variables categóricas aparecen como porcentajes y se compararon entre grupos con la prueba de la χ2. Se ha utilizado el método de Kaplan-Meier para elaborar las curvas de supervivencia a un año. Se compararon las curvas de supervivencia de los pacientes sometidos a reperfusión primaria con las de los que no la recibieron, mediante la prueba de Mantel Cox. Se utilizó un modelo exploratorio de regresión logística para conocer cuáles eran las características clínicas que se asociaban de manera independiente con el empleo de tratamiento de reperfusión. También se utilizó un modelo confirmatorio de regresión logística para evaluar el efecto de la reperfusión sobre la supervivencia a los 28 días. Para analizar los factores asociados a la mortalidad al año de los supervivientes a los 28 días, se usó un modelo de riesgos proporcionales de Cox. En ambos casos, se seleccionaron como posibles factores de confusión aquellas variables que se asociaron en el análisis bivariado con la mortalidad y con la reperfusión. Los cálculos se hicieron con el paquete estadístico SPSS.
RESULTADOS
Entre el 15 de mayo y el 15 de diciembre del año 2000 se incluyeron 6.221 casos de IAM. Para los motivos de este estudio se seleccionó a los 3.735 (60%) pacientes que cumplían los criterios para reperfusión. Éstos no tenían contraindicaciones absolutas para la fibrinólisis según las guías aceptadas19. Se practicó un procedimiento de reperfusión en 2.675 (71,6%) de los 3.735 pacientes: 1.641 (61%) en hospitales con laboratorio de hemodinámica y 1.034 (39%) en los que no disponían de él. El método de reperfusión primaria fue la fibrinólisis en 2.390 pacientes (89,3%) e intervención coronaria percutánea (ICP) en 285. Desde hospitales sin laboratorio de hemodinámica sólo se remitió a 31 pacientes para ICP. No se utilizó la cirugía de derivación aortocoronaria como procedimiento de reperfusión primaria. Dentro de la categoría de pacientes sin indicación para la reperfusión, 99 (4,3%) recibieron alguno de los 2 procedimientos. En el resto de los pacientes (2.387), la reperfusión ni estaba indicada ni se realizó. La tasa global de seguimiento al año en el registro fue del 93%. Los datos generales de este registro se han comunicado en otro escrito20.
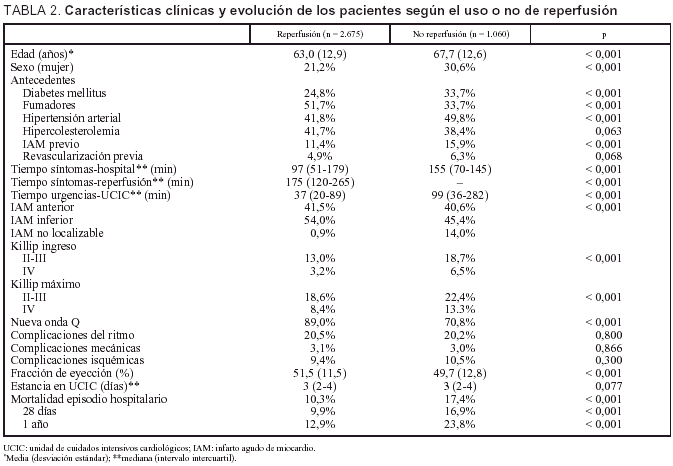
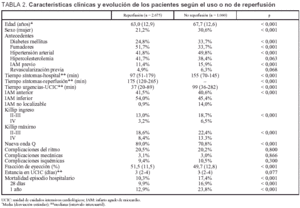
La comparación de las características demográficas, los antecedentes coronarios, los tiempos de presentación, la localización del IAM y la función ventricular izquierda, entre pacientes en los que se intentó la reperfusión o no, se muestran en la tabla 2. Los pacientes que no se sometieron a reperfusión eran mayores, con mayor frecuencia se trataba de mujeres, diabéticos, hipertensos, con infarto previo y con IAM agudo no localizable por el electrocardiograma. En cambio, había menos pacientes fumadores. Además, los pacientes a los que no se practicó ningún procedimiento de reperfusión se presentaron en el hospital con mayor retraso desde el inicio de los síntomas, y el intervalo urgencias-UCIC también fue más largo. De igual modo, los pacientes que no se reperfundieron presentaban una clase más alta en la clasificación de Killip al ingreso.
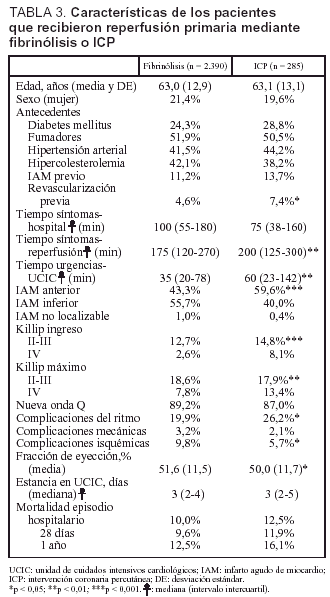
Se eligieron más pacientes con IAM anterior y peor clase de Killip para ICP y más con IAM inferior para fibrinólisis. El resto de las variables analizadas para comparar los 2 métodos de reperfusión primaria no tuvieron significación estadística (tabla 3).
La fibrinólisis se llevó a cabo mayoritariamente en la UCIC (72,6%), en la fase prehospitalaria se administró en 27 casos (1,1%), en hospital previo en el 12,2% y en la urgencia del hospital en el 10,5%. Los fibrinolíticos que se emplearon fueron: rTPA (58,7%), estreptocinasa (20,8%), rPA (13,5%), TNK (3,8%) y otros (3,2%).
Los pacientes sometidos a reperfusión desarrollaron más a menudo una nueva onda Q, tuvieron grados de Killip menores a lo largo de su evolución y la fracción de eyección del ventrículo izquierdo fue mejor (tabla 2).
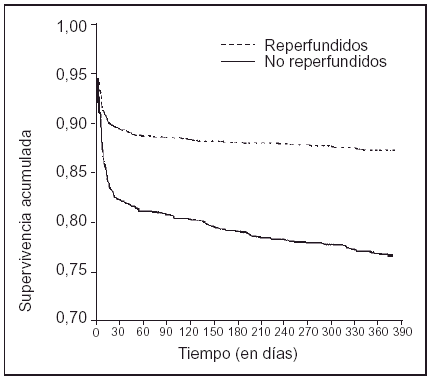
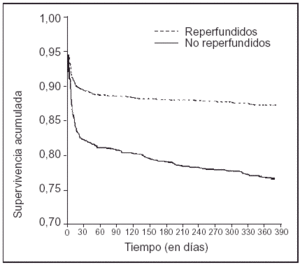
En 30 casos (1,2%) se produjo un accidente cerebrovascular posfibrinólisis. La mortalidad, tanto durante la hospitalización (17,4 frente a 10,3%) como a los 28 días (16,9 frente a 9,9%) y al año (23,8 frente a 12,9%), fue superior en los pacientes en los que no se intentó la reperfusión (fig. 1).
Figura 1. Supervivencia acumulada, al año, de pacientes reperfundidos y no reperfundidos.
Comparando los 2 métodos de reperfusión, los pacientes tratados con fibrinólisis tuvieron mayor incidencia de complicaciones isquémicas y los sometidos a ICP tuvieron más trastornos del ritmo y FE más baja, al tiempo que presentaban más antecedentes de revascularización coronaria y peores grados de Killip al ingreso. No hubo diferencias en la mortalidad a todos los plazos (tabla 3).
En 157 (6,4%) pacientes de los 2.459 que recibieron terapia fibrinolítica se realizó una reperfusión de rescate (ICP en el 72,6%, fibrinólisis en el 26,1% y cirugía coronaria en el 1,3% restante).
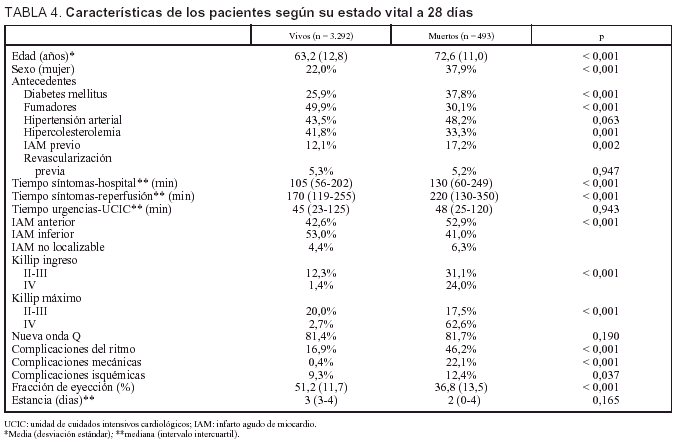
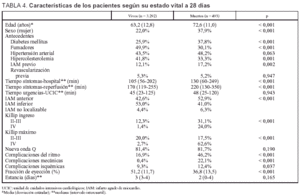
La edad, el sexo, los antecedentes de diabetes, el infarto previo, los retrasos síntomas-hospitalización, la localización anterior del IAM, las clases más altas de Killip al ingreso y la máxima alcanzada, las complicaciones del ritmo, mecánicas e isquémicas y la fracción de eyección inferior al 40% se asociaron con mayor mortalidad a los 28 días (tabla 4). Estos mismos factores se asociaron con la mortalidad al año en los que sobrevivieron 28 días (datos no mostrados).
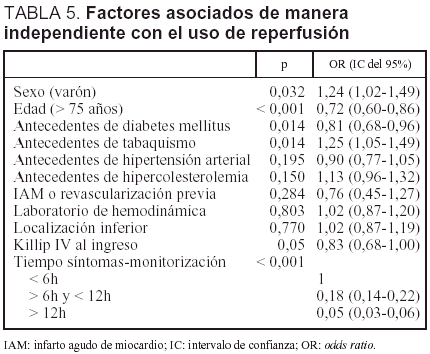
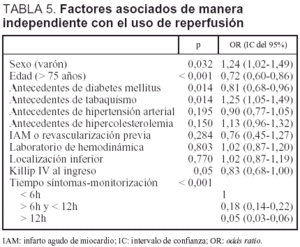
El modelo de regresión logística exploratorio mostró que la edad inferior a 75 años, el sexo masculino, el consumo de tabaco, la ausencia de antecedentes de diabetes, un tiempo de inicio de síntomas hasta la hospitalización menor de 6 h y un mayor grado Killip al ingreso, fueron predictores independientes de una mayor utilización de la reperfusión (tabla 5).
En un modelo de regresión logística confirmatorio ajustado por edad, sexo, antecedentes de diabetes, tabaquismo, IAM previo y localización del IAM, la odds ratio (OR) de la reperfusión fue 0,71 (intervalo de confianza [IC] del 95%, 0,57-0,88) para mortalidad a los 28 días. Al ajustar además por la clase de Killip, la OR dejó de ser estadísticamente significativa (OR, 0,84; IC del 95%, 0,66-1,08). La interacción entre la clase de Killip y la reperfusión no fue significativa. Las OR de la reperfusión para la mortalidad a un año de los supervivientes a los 28 días fueron 0,53 (IC del 95%, 0,38-0,74) y 0,57 (IC del 95%, 0,40-0,81), respectivamente.
DISCUSIÓN
A pesar de que los resultados de este estudio confirman el efecto beneficioso de la reperfusión primaria en los pacientes con IAM, también muestran que los pacientes excluidos de esta terapéutica suponen aproximadamente una tercera parte de los que podrían tratarse y que, además, presentan con frecuencia un perfil de gravedad superior al de aquellos que la reciben. Esta contradicción debería superarse a fin de obtener un mayor rendimiento de su uso en la práctica diaria.
Los registros de enfermedades presentan la ventaja, frente a los ensayos clínicos controlados, de que se acercan más a las condiciones reales de trabajo cuando se evalúa el efecto de las intervenciones terapéuticas21. Los registros deben recoger datos demográficos, de diagnóstico, evolución y tratamiento de los individuos que presentan una enfermedad bien definida, y debe hacerse de manera prospectiva para evitar los sesgos de información que se producen en los estudios retrospectivos22. La metodología del registro PRIAMHO II cumple estos criterios de diseño junto a los de selección aleatoria de los centros y el control de calidad, mediante auditoría externa, para poder ser considerado como un estudio de cohorte representativa de la asistencia al paciente con IAM en España.
Este estudio se realizó en el año 2000, se completó el seguimiento al año en el 2002 y el control de calidad en el 2003. De los 4.271 casos con elevación de ST/BCRIHH, 3.735 cumplían las indicaciones para ser reperfundidos y sólo se llevó a cabo en 2.675 (71,6%). El tiempo inicio del cuadro-monitorización para los que se intentó la reperfusión fue de 97 min, frente a 155 min en los que no se hizo aunque cumplían los criterios. Los tiempos puerta-aguja y puerta-balón tuvieron una mediana de 48 min (intercuartiles 30-77) y 80 (50-128), respectivamente. En el proyecto ARIAM, diseñado para ganar tiempo en la reperfusión, el tiempo desde el inicio del cuadro hasta la llegada al hospital estaba entre 80 y 115 min, y el puerta-aguja en 50 min (31-83)23. Son cifras similares pero están lejos aún de las recomendadas, 30 min para el intervalo urgencias-fibrinólisis según la Sociedad Española de Cardiología24 y 70 min desde el inicio hasta la reperfusión según el estudio MITI25. Del acortamiento de estos tiempos depende la salvación de miocardio en riesgo. Por esta razón, cobra significado el lugar donde se aplica la fibrinólisis, que en este estudio se revela como poco precoz26.
El importante porcentaje de pacientes que no se reperfundieron, aunque tenían indicación para ello (28,4%), representan una limitación del acceso a un procedimiento de eficacia probada que podría interpretarse como falta de equidad. Debemos hacer un uso mayor y más precoz de la reperfusión, así como intentar mejorar su porcentaje de éxitos con un aumento de la ICP y la búsqueda de sustancias de mayor eficacia en la fibrinólisis27.
Comparando los pacientes reperfundidos y los no reperfundidos de la tabla 2, se aprecia que las mujeres y las personas mayores reciben menos esta terapia, y que, paradójicamente, pacientes diabéticos, hipertensos y con antecedentes isquémicos también son discriminados negativamente. Es posible que la intensidad de los síntomas y de los cambios en el ECG puedan explicar en parte estos resultados. Se aprecia también mayor índice de reperfusión en la localización anterior del IAM y en los pacientes que acuden antes al hospital. En la evolución aparecen más ondas Q nuevas en los reperfundidos, pero el grado máximo de Killip y la mortalidad, tanto inmediata como al año, son menores.
Comparando los 2 métodos de reperfusión, fibrinólisis e ICP, los datos epidemiológicos fueron similares, con más antecedentes de revascularización coronaria en los que se realizó ICP. Fueron enviados al procedimiento invasivo mayor número de pacientes con IAM anterior y con mayor grado de la clasificación de Killip para insuficiencia ventricular izquierda, a la vez que los tiempos de actuación fueron más largos. La ICP fue más utilizada por hospitales que disponían de laboratorio de hemodinámica. La mortalidad no fue distinta, contrariamente a otros estudios publicados28, si bien el número de pacientes a quienes se practicó ICP es insuficiente para sacar conclusiones. El agente fibrinolítico más utilizado fue el rTPA y sus derivados, la estreptocinasa se empleó en el 21% de los casos, de modo similar a lo observado en otros registros. La incidencia de accidentes cerebrovasculares posfibrinólisis no difiere de la de otros estudios.
Las indicaciones para las reperfusión no fueron seguidas estrictamente. De los 2.486 casos que retrospectivamente no presentaban criterios para ello, se reperfundieron 99 (4,3%). La variabilidad individual en el manejo de los pacientes puede ser la causa de esos resultados29. A pesar de que la tasa de uso de reperfusión en los pacientes con IAM y elevación del ST es alta, existe aún un amplio margen de mejora.
Los resultados de este estudio sugieren que se excluye de la reperfusión a pacientes cuyas características determinan una mayor gravedad. Este hecho es especialmente preocupante, ya que los resultados también confirman que el uso de la reperfusión proporciona una reducción significativa de la mortalidad a los 28 días y al año, independientemente de los factores relacionados con la gravedad.
AGRADECIMIENTOS
Los autores agradecen a Helena Martí y Susana Tello su eficaz apoyo en el manejo de la base de datos.
ÝIn memoriam.
*Al final del artículo se relacionan los hospitales e investigadores que han participado en el estudio PRIAMHO II.
Este estudio se ha realizado con una ayuda para investigación de los Laboratorios Boehringer Ingelheim.
*ANEXO. Estructura organizativa del estudio PRIAMHO II
Comité científico: Fernando Arós (Presidente), José Cuñat, Elilberto TorradoÝ, Ángel Loma-Osorio, Pablo Ancillo, Xavier Bosch, Juan José Rodríguez, Lorenzo López Bescós, Pedro Pabón, Magda Heras y Jaume Marrugat.
Centro coordinador: Unitat de Lipids i Epidemiología Cardiovascular. Institut Municipal d'Investigació Médica (IMIM). Barcelona. Responsable: Jaume Marrugat.
Hospitales participantes e investigadores: Hospital General de Albacete, Albacete: J.Enero. Hospital Punta Europa, Algeciras (Cádiz): P.Cobo. Hospital Universitari Sant Joan d'Alacant, Alicante:V.Bertomeu, P.J. Moriles, A. Frutos, F. Coromina. Hospital General Uiversitario de Alicante, Alicante: F.Sogorb, J.Valencia, J.L. Antón. Hospital San Agustín, Avilés (Asturias): G.Rey. Hospital de Cruces, Baracaldo (Vizcaya): X.Mancisidor, S. Gómez, Y. Vitoria. C.S. Vall d'Hebrón, Barcelona: J.Figueras, C. Barbero, C. Carvajal, J. Cortadellas, R.M. Lidón, J. Barrabes. Hospital General de Granollers, Granollers (Barcelona): P.Velasco, S. Armengol, P. Garro. Hospital Clínic i Provincial de Barcelona, Barcelona: X. Bosch. Hospital General Yagüe, Burgos: A.Montón, J.M. Ayuela, M. Arroyo. Hospital La Plana, Castellón de la Plana: E. González, E. Belenguer, O. Castro. Hospital Marina Alta y C.E. Denia, Denia (Alicante): P. Marzal. C. H. Arquitecto Marcide, Ferrol (A Coruña): C.J. Fernández, J. González Tutor. Hospital de Cabueñes, Gijón (Asturias): J.A.Lapuerta. Hospital Universitari de Girona Josep Trueta, Girona: J. Sala, R. Masiá, I. Rohlfs, J. Balcells. Hospital Universitario Virgen de las Nieves, Granada: A. Reina, E. Aguayo de Hoyos, M. Colmenero, M. Jiménez. Ciutat Sanitaria de Bellvitge, Hospitalet de Llobregat (Barcelona): F. Worner, E. Romero. Hospital Can Misses, Ibiza: E. Escudero. Hospital Princesa de España, Jaén: A. Carrillo. Hospital Universitario de Canarias, La Laguna (Tenerife): M.García. Hospital de la Línea, La Línea de la Concepción (Cádiz): I. Ostobal, J. Traverso, L.M. Almagro. C. H. Materno-Insular, Las Palmas: V. Nieto, C. Culebras, G. O'Shanahan. Hospital Universitario Dr. Negrín, Las Palmas: A. Medina, E. Hernández. Hospital Severo Ochoa, Leganés (Madrid): Frutos del Nogal. Hospital de León, León: N. Alonso Orcajo, C. Pascual, R. Carbonell. C. H. Xeral-Calde, Lugo: O. Saornil. Hospital Provincial de Santa Maria, Lleida: J.Cabau. Hospital Universitari Arnau de Vilanova, Lleida: M. Piqué, B. Balsera, D. Campi, R. Alcega. C. H. Mostoles-Alcorcón, Móstoles (Madrid): P. Galdós, S. Bua. H. Hospital La Paz, Madrid: I. González Maqueda, E. Armada. C. H. Carlos Haya, Málaga: J.J. Rodríguez, B. Nacle, T. García, J.A. Ferriz, J.M. Álvarez. Hospital General Básico de Motril, Motril (Granada): J.M. Mercado. Hospital General J.M. Morales Meseguer, Murcia: A. Carrillo. C. H. Sta. Maria Nai-Cabaleiro Goas, Orense: E. Rodríguez. C. H. Ourensan Cristal-Piñor, Orense: A. Díaz, R. Rodríguez. Hospital Central de Asturias, Oviedo: I. Sánchez Posadas, M. Martín. Hospital Son Dureta, Palma de Mallorca: M. Fiol, J. Pérez, R. Amezaga, A. Carrillo, J. Velasco, M. Riera, M. Casares. Hospital de Navarra, Pamplona: M. Alcasena. Hospital Sant Joan de Reus, Reus (Tarragona): P. Garrido. Hosital General Básico Serranía, Ronda (Málaga):J.I. Mateo. Hospital de Sagunto, Sagunto (Valencia): V. Parra. Hospital Universitario de Salamanca, Salamanca: P. Pabón. Hospital Nuestra Sra. de Aránzazu, San Sebastian: P. Marco. Hospital General de Catalunya, Sant Cugat (Barcelona): M. Nolla. H. R. San Camilo, Sant Pere de Ribes (Barcelona): O. Martín. Hospital Universitario Marqués Valdecilla, Santander: J.M. San José, J. Gutierrez, P. Colvé. C.H.U. de Santiago, Santiago de Compostela: M.Jaquet, S. Fernández. Hospital General de Segovia, Segovia: P. Ancillo, J.J. Cortina, J.M. Campos, M.J. López, M.A. Taberna. Hospital Tortosa Verge de la Cinta, Tortosa (Tarragona): R. Claramonte. Hospital San Juan de la Cruz, Úbeda (Jaén): A. Bartolomés. Hospital Arnau de Vilanova, Valencia: M. Francés, M. García, A. Málaga, A. Hervas, L. Cortés, F. Fajarnés. Hospital Militar Vázquez Bernabeu de Valencia, Valencia. M. Rico. Hospital Doctor Peset, Valencia: F. Valls, V. Valentín, L. Miralles. Hospital General Universitario de Valencia, Valencia: I. Echanove. Hospital Universitario La Fe, Valencia: A. Cabadés. Hospital Universitario de Valladolid, Valladolid: J. Bermejo. Hospital General de Vic, Vic (Barcelona): C. Falces. Hospital do Meixoeiro, Vigo (Pontevedra): M.V. Platero. Policlínico Vigo, S.A. (POVISA), Vigo (Pontevedra): F. Noriega, R. Fernández. Hospital del SVS de Villajoyosa, Villajoyosa (Alicante): F. Criado. Hospital Comarcal de Vinarós, Vinarós (Castellón): J.C. Sanz. Hospital Txagorritxu, Vitoria: A. Loma-Osorio, J. Castañeda. Hospital Clínico Universitario Lozano Blesa, Zaragoza: M.A. Suárez, J.J. Araiz, B. Jiménez, A. Pilar.
Monitorización y control de calidad: M. Paz Fuset, José L. Antón, Carlos Culebras, María Martín, Emilio Sanz, Patricia Bastante, María José Rivas y Marcos García.