Editado por: Alberto García-Salido - Cuidados Intensivos Pediátricos, Hospital Infantil Universitario Niño Jesús, Madrid
Última actualización: Mayo 2024
Más datosIdentificar los factores asociados con la ventilación mecánica prolongada (pVMI) en pacientes pediátricos en la unidad de cuidados intensivos pediátricos (UCIP).
DiseñoAnálisis secundario de una cohorte prospectiva.
ÁmbitoUCIP en los centros que integran LARed Network entre abril del 2017 y enero del 2022.
ParticipantesPacientes pediátricos en ventilación mecánica (VMI) debido a causas respiratorias. Definimos pVMI como eventos con tiempo VMI mayor al percentil 75 global.
IntervencionesNinguna.
Variables de interés principalesDatos demográficos, diagnósticos, puntajes de gravedad, terapias, complicaciones, estancias y morbimortalidad.
ResultadosSe incluyó a 1.698 niños con VMI de 8 ± 7 días y se definió pVMI en 9 días. Los factores relacionados al ingreso fueron la edad menor de 6 meses (OR 1,61, IC del 95%, 1,17-2,22), la displasia broncopulmonar (OR 3,71, IC del 95%, 1,87-7,36) y las infecciones fúngicas (OR 6,66, IC del 95%, 1,87-23,74), mientras que los pacientes con asma tuvieron menor riesgo de pVMI (OR 0,30, IC del 95%, 0,12-0,78). En cuanto a la evolución y la estancia en UCIP, se relacionó a neumonía asociada a la ventilación mecánica (OR 4,27, IC del 95%, 1,79-10,20), necesidad de traqueostomía (OR 2,91, IC del 95%, 1,89-4,48), transfusiones (OR 2,94, IC del 95%, 2,18-3,96), bloqueo neuromuscular (OR 2,08, IC del 95%, 1,48-2,93) y ventilación de alta frecuencia (OR 2,91, IC del 95%, 1,89-4,48) y una mayor estadía en UCIP (OR 1,13, IC del 95%, 1,10-1,16). Además, la presión media aérea mayor a 13cmH2O se asoció a pVMI (OR 1,57, IC del 95%, 1,12-2,21).
ConclusionesSe identificaron factores relacionados con VMI de duración mayor a 9 días en pacientes pediátricos en UCIP en cuanto a ingreso, evolución y estancia.
To identify factors associated with prolonged mechanical ventilation (pMV) in pediatric patients in pediatric intensive care units (PICUs).
DesignSecondary analysis of a prospective cohort.
SettingPICUs in centers that are part of the LARed Network between April 2017 and January 2022.
ParticipantsPediatric patients on mechanical ventilation (IMV) due to respiratory causes. We defined IMV time greater than the 75th percentile of the global cohort.
InterventionsNone.
Main variables of interestDemographic data, diagnoses, severity scores, therapies, complications, length of stay, morbidity, and mortality.
ResultsOne thousand 6hundred and ninety 8children with MV of 8±7 days were included, and pIMV was defined as 9 days. Factors related to admission were age under 6 months (OR 1.61, 95% CI 1.17–2.22), bronchopulmonary dysplasia (OR 3.71, 95% CI 1.87–7.36), and fungal infections (OR 6.66, 95% CI 1.87–23.74), while patients with asthma had a lower risk of pIMV (OR 0.30, 95% CI 0.12–0.78). Regarding evolution and length of stay in the PICU, it was related to ventilation-associated pneumonia (OR 4.27, 95% CI 1.79–10.20), need for tracheostomy (OR 2.91, 95% CI 1.89–4.48), transfusions (OR 2.94, 95% CI 2.18–3.96), neuromuscular blockade (OR 2.08, 95% CI 1.48–2.93), high-frequency ventilation (OR 2.91, 95% CI 1.89–4.48), and longer PICU stay (OR 1.13, 95% CI 1.10–1.16). In addition, mean airway pressure greater than 13cmH2O was associated with pIMV (OR 1.57, 95% CI 1.12–2.21).
ConclusionsFactors related to IMV duration greater than 9 days in pediatric patients in PICUs were identified in terms of admission, evolution, and length of stay.
El fallo respiratorio agudo (FRA) es una causa frecuente de ingreso a la Unidad de Cuidado Intensivo Pediátrica (UCIP) y entre el 35 y el 64% de estos pacientes requieren ventilación mecánica invasiva (VMI)1,2. Estudios recientes han demostrado que entre el 25 y el 34% de los pacientes con FRA requieren una ventilación mecánica prolongada (pVMI)3-5. Esta proporción ha aumentado en la última década debido a los avances en la tecnología utilizada en el soporte ventilatorio y en el Cuidado Intensivo en general4.
Sin embargo, en la actualidad, la definición de pVMI en niños es confusa y no existe consenso entre los expertos. Estudios previos han utilizado puntos de corte arbitrarios, que van desde las 96 h hasta los 21 días6-13. Esta falta de uniformidad dificulta la comparación y generalización de los resultados entre los diferentes estudios. Por lo tanto, es crucial establecer una definición clara y consensuada de pVMI en la población pediátrica para facilitar la investigación y la toma de decisiones clínicas10.
Además, se ha observado que la ventilación prolongada se asocia con factores de riesgo específicos en la población pediátrica, como edad menor a 12 meses, peso menor a 10kg, y puntaje PRISM mayor a 20, entre otros6-8. Estos factores pueden ayudar a identificar a los pacientes en mayor riesgo de desarrollar pVMI y guiar estrategias de manejo adecuadas.
La pVMI también se ha relacionado con peores desenlaces clínicos, como una mayor estancia hospitalaria, morbimortalidad y costos en la atención de los pacientes4,14-17. Estas complicaciones ponen de manifiesto la importancia de identificar y predecir el riesgo de pVMI en la población pediátrica para implementar intervenciones preventivas y optimizar el manejo clínico.
En ese contexto, el objetivo de esta investigación es describir una cohorte de pacientes pediátricos ventilados por FRA del registro de la Red Colaborativa de Latinoamericana (LARed network)18 y, utilizando estos datos, crear una definición de pVMI basada en frecuencia estadística (percentil 75). Luego, se busca determinar si esta definición se asocia con factores de riesgo y eventos posteriores durante la evolución y estancia en la Unidad de Cuidados Intensivos Pediátricos, tal como se ha descrito en la literatura científica. Además, se llevará a cabo una comparación con los puntos de corte descritos por otros autores para evaluar la adecuación de nuestra observación.
Pacientes y métodosAnálisis retrospectivo de una cohorte con datos recolectados en forma prospectiva en el registro de FRA de LARed Network (que incluye cerca de 40 centros hospitalarios de Latinoamérica)18. Se analizaron todos los pacientes que recibieron VMI durante la estancia hospitalaria entre abril del 2017 y enero del 2022.
SujetosEl registro recoge pacientes pediátricos entre los 0 meses y 18 años admitidos a la UCIP cuya causa de FRA, definida por el médico tratante, fue primariamente del sistema respiratorio (bronquiolitis, neumonía, asma, por ejemplo). Se considera que estos pacientes presentan un fallo respiratorio cuando muestran síntomas como hipoxemia, hipercapnia y aumento del trabajo respiratorio, los cuales requieren intervención mediante oxigenoterapia y soporte respiratorio. Para este análisis, se incluyeron aquellos casos que requerían VMI durante su estancia en la UCIP. Para garantizar la homogeneidad de los datos, se excluyó a pacientes con soporte ventilatorio invasivo domiciliario previo a su ingreso y aquellos pacientes que, a la fecha de corte de análisis, no habían sido egresados de la UCIP o tenían datos incompletos.
DefinicionesConsiderando que existen varios puntos de corte reportados en la literatura que varían desde 96 h hasta 21 días6-13, decidimos utilizar una definición estadística basada en la distribución de la población, utilizando el día más cercano al percentil p75 como punto de corte para nuestro estudio. Aunque esta selección podría parecer arbitraria, nos permitió caracterizar un grupo de niños que se diferenciaba de la mayoría de los otros casos en nuestra población, lo que podría identificar un posible mejor objetivo para una estrategia de mejora de calidad.
Para identificar los factores de riesgo potenciales, se consideraron aquellos presentes en el momento de ingreso de los pacientes a la UCIP. Por otro lado, se evaluaron los factores asociados a la evolución y estancia, tales como las complicaciones, tratamientos recibidos, terapias de rescate, y tiempo de estancia o mortalidad, ya que ocurren después del inicio de la ventilación mecánica invasiva(tabla 1S anexo).
Recolección de datosLa base de datos de LARed cuenta con un registro prospectivo de datos de la estancia en la unidad desde su ingreso hasta su egreso de esta. Se recogen variables demográficas (edad, peso y género), comorbilidades (definidas como enfermedades que ocurren además del trastorno primario y no al episodio actual), probabilidad de muerte calculada por el puntajes de gravedad Pediatric Index of Mortalitiy versión 3 (PIM3), diagnósticos de ingreso, signos vitales (frecuencia cardiaca, frecuencia respiratoria y saturación), ayudas diagnósticas (radiografía), tratamientos recibidos (transfusión sanguínea, corticoides, antibióticos, antivirales), complicaciones durante la estancia (SDRA), sepsis, neumotórax, fallo en la extubación) y desenlaces (mortalidad, estancia hospitalaria y nueva morbilidad; esta última definida como una diferencia entre ingreso al alta mayor de 3 en la puntuación de la Functional Status Scale (FSS).
Análisis estadísticoSe calculó el percentil 75 de la duración de la ventilación mecánica, definiendo el punto de corte de pVMI en esta cohorte, para estratificar en 2grupos: pVMI y ventilación mecánica no prolongada (npVMI).
Las variables continuas se informaron como promedio con desviación estándar y mediana con rango intercuartil; mientras que las categóricas como frecuencias absolutas y porcentaje. Para evaluar la diferencia entre los pacientes con pVMI y npVMI se realizó el análisis bivariado dividiendo las variables en 2grupos: las presentes al ingreso (datos demográficos y características clínicas) y las sucedidas durante la estancia en unidad de cuidado intensivo (tratamiento, complicaciones y desenlaces). Las variables continúas definidas como normales, utilizando el estadístico Kolmogorov-Smirnov, fueron procesadas con la prueba t Student e informados como media ± desviación estándar (DE). Las que presentaron una distribución no normal se utilizó una prueba U de Mann-Whitney y se informaron como diferencia de medianas con el rango intercuartílico (RIC) del 25 y 75%. Las variables categóricas fueron procesadas con la prueba de chi al cuadrado, informadas con frecuencia absoluta y porcentajes. Para determinar los factores asociados a pVMI, se ajustó un modelo mixto de regresión logística multivariado usando países como efectos aleatorios, se incluyeron las variables que cumplían los siguientes criterios: variables obtenidas en el momento de ingreso de los pacientes, diferencia significativa en el análisis bivariado y relevancia clínica sin pertenecer a la misma cadena causal. Para cada variable se probó colinealidad e interacciones para obtener los modelos finales. El análisis estadístico se realizó con el paquete de software estadístico STATA 16.
Consideraciones éticasEste análisis secundario fue presentado y aprobado por el comité de ética en seres humanos de la Sociedad de Cirugía de Bogotá Hospital de San José. Para la participación en el registro de LARed, cada centro cuenta con la aprobación de su comité de ética. Para este análisis se aprobó la dispensa del consentimiento informado, ya que los datos de análisis se encuentran anonimizados.
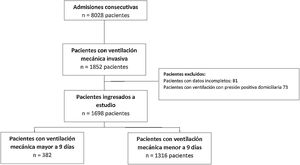
ResultadosEntre abril del 2017 y enero del 2022, se registraron en la base de datos de LARed 8.001 pacientes por FRA, de los cuales se incluyó a 1.698 pacientes para el análisis (fig. 1). La duración media de ventilación mecánica en toda la cohorte fue 7 ± 7 días, con un percentil 75 de 9 días. Esto clasificó a 382 (22,5%) como aquellos con pVMI. La distribución y la curva de supervivencia global está disponible en datos suplementarios (figuras 1s, 2s anexo).
Las características clínicas y datos de ingreso se presentan en la tabla 1. La procedencia de los pacientes incluidos fue principalmente de Colombia (602, 35,6%), Uruguay (397, 23,4%) y Chile (201, 11,8%).
Datos demográficos y características de ingreso de los pacientes incluidos en el estudio
| Características | n (%) o med (RIC) | OR | IC del 95% | ORa | IC del 95% | ||
|---|---|---|---|---|---|---|---|
| Todosn = 1.698 | pVMIn = 382 | npVMIn = 1.316 | |||||
| Sexo | |||||||
| Femenino | 689 (41) | 163 (23,7) | 526 (76,3) | (Ref.) | |||
| Masculino | 1010 (59) | 219 (21,7) | 791 (78,3) | 1,11 | 0,71-1,12 | 0,78 | 0,58-1,05 |
| Edad | |||||||
| Lactante menor a 6 meses | 846 (49,8) | 211 (24,9) | 635 (75,1) | 1,21 | 0,93-1,57 | 1,64 | 1,14-2,36 |
| Lactante 6 meses a 24 meses | 517 (30,4) | 111(21,5) | 406(78,5) | (Ref.) | |||
| Preescolar | 184 (10,8) | 28 (15,2) | 156(84,8) | 0,65 | 0,41-1,03 | 0,71 | 0,37-1,33 |
| Escolar | 50 (2,9) | 8 (16) | 42 (84) | 0,69 | 0,31-1,52 | 1,12 | 0,39-3,14 |
| Adolescente | 93 (5,4) | 22 (23,6) | 71 (76,4) | 1,13 | 0,67-1,91 | 1,59 | 0,77-3,25 |
| Zona de procedencia | |||||||
| Urbana | 1,484 (87,4) | 348(23,4) | 1136 (76,6) | (Ref.) | |||
| Suburbana o rural | 214 (12,5) | 35 (16,0) | 179 (83,9) | 0,62 | 0,42-0,92 | 0,70 | 0,42-1,17 |
| Previsión | |||||||
| Público | 748(43,8) | 111 (14,6) | 637 (85,4) | (Ref.) | |||
| Privado | 950(55,8) | 276 (28,7) | 674 (71,3) | 2,34 | 1,83-3,00 | 1,49 | 0,93-2,31 |
| Diagnóstico de ingreso | |||||||
| Bronquiolitis | 866 (51,1) | 233 (26,9) | 633 (73,1) | (Ref) | |||
| Neumonía | 557 (32,9) | 103 (18,5) | 454 (81,5) | 0,89 | 0,56-1,40 | ||
| Crisis asmática | 105 (6,2%) | 13 (12,4) | 92 (87,6) | 0,56 | 0,29-1,06 | 0,30 | 0,12-0,78 |
| Otro | 170 (10,1) | 33 (19,4) | 137 (80,6) | 1,06 | 0,69-1,65 | 0,74 | 0,37-1,48 |
| Sepsis | |||||||
| Presentar sepsis | 439 (26,1) | 83 (18,9) | 356 (81,1) | 0,74 | 0,56-0,97 | 0,98 | 0,61-1,57 |
| Sepsis sin criterios de severidad | 155 (9,1) | 25 (16,1) | 130 (83,8) | (Ref.) | |||
| Choque séptico | 216 (12,7) | 44 (20,4) | 172 (79,6) | 0,65 | 0,43-0,98 | 1,38 | 0,68-2,80 |
| Sepsis grave | 68 (4,0) | 13 (19,1) | 55 (80,9) | 0,48 | 0,20-1,14 | 0,63 | 0,19-2,02 |
| Falla multiorgánica | 67 (3,9) | 25 (37,3) | 42 (62,7) | 1,90 | 1,14-3,18 | 2,32 | 0.98- 5.46 |
| Infeccióna | |||||||
| Infección viral | 1353 (79,7) | 322 (23,8) | 1031 (73,2) | 1,48 | 1,09-2,01 | 0,73 | 0,40-1,34 |
| Infección bacteriana | 615 (36,2) | 108 (17,6) | 507 (82,4) | 0,62 | 0,49-0,80 | 0,79 | 0,49-1,28 |
| Infección fúngica | 19 (1,1) | 10 (52,6) | 9 (47,4) | 3,90 | 1,57-9,67 | 6,66 | 1,87-23,74 |
| Comorbilidadesb | |||||||
| Algunae | 660 (38,9) | 152 (23,0%) | 508 (77,0%) | 1,04 | 0,83-1,32 | 2,16 | 1.51-3,10 |
| Cardiopatía | 95 (5,6) | 23 (24,2) | 72 (75,8) | 1,10 | 0,65-1,82 | 1,04 | 0,51-2,11 |
| Prematurezc | 209 (12,3) | 50 (23,9) | 159 (76,1) | 1,09 | 0,76-1,55 | 0,76 | 0,43-1,34 |
| Desnutrición | 73 (4,3) | 21 (28,8) | 52 (71,2) | 1,41 | 0,79-2,43 | 2,22 | 0,57-5,06 |
| Genopatía | 54 (3,1) | 16 (29,6) | 38 (70,4) | 1,47 | 0,75-2,74 | 1,69 | 0,68-4,17 |
| Neurológicas | 79 (4,6) | 23 (29,1) | 56 (70,9) | 1,44 | 0,83-2,42 | 2,09 | 0,98-4,44 |
| Enfermedad oncológica | 14 (0,8) | 4 (28,6) | 10 (71,4) | 1,38 | 0,31-4,82 | 1,17 | 0,31-4,37 |
| Trasplante de médula ósea | 5 (0,3) | 2 (40) | 3 (60) | 2,30 | 0,19-20,2 | 4,63 | 0,61-35,27 |
| Comorbilidades respiratorias | 373 (22,0) | 89 (23,9) | 284 (76,1) | 1,10 | 0,83-144 | 1,43 | 1,00-2,04 |
| Displasia broncopulmonar | 91 (5,4) | 35 (38,5) | 56 (61,5) | 2,26 | 1,41-3,58 | 3,71 | 1,87-7,36 |
| Daño pulmonar crónico | 35(2,0) | 12 (34,3) | 23 (65,7) | 1,82 | 0,81-3,86 | 1,59 | 0,55-4,57 |
| Asma o sibilante | 207 (12,2) | 38 (18,4) | 169 (81,6) | 0,74 | 0,50-1,09 | 0,77 | 0,26-2,24 |
| Otras respiratorias | 84(4,5) | 16 (18,8) | 68 (81,0) | 1,19 | 0,83-1,72 | 0,93 | 0,33-1,99 |
| Parámetros respiratorios y oxigenación de ingreso | |||||||
| Fracción inspirada O2(FiO2) | 70 (50-100) | 80 (60-100) | 69 (50-100) | 1,01 | 1,0- 1,01 | 1,00 | 0,99-1,01 |
| Saturación O2(SpO2) | 96 (93-99) | 96 (93-99) | 96 (93-99) | 1,00 | 0,98-1,01 | 0,99 | 0,97-1,01 |
| Frecuencia respiratoria | 43 (30-59) | 40 (28-52) | 45 (30-60) | 0,98 | 0,97-0,99 | 0,99 | 0,98-1,00 |
| Frecuencia cardiaca | 152 (133-170) | 150 (130-165) | 152 (135-170) | 0,99 | 0,99-0,99 | 0,99 | 0,99-1,01 |
| SpO2/FiO2 | 137 (100-192) | 121 (99-160) | 147 (100-196) | 0,99 | 0,99-0,99 | 1,00 | 0,99-1,00 |
| Hallazgos radiológicosd | |||||||
| Normal | 49 (2,9) | 10 (20,4) | 39 (79,6) | 0,88 | 0,45-1,78 | 0,56 | 0,18-1,75 |
| Hiperinsuflación | 394 (23,2) | 55 (14) | 339 (86) | 0,48 | 0,35-0,66 | 0,88 | 0,55-1,41 |
| Condensación | 473 (27,8) | 76 (16,1) | 397 (83,9) | 0,57 | 0,43-0,75 | 0,69 | 0,43-1,11 |
| Infiltrado intersticial | 1135 (66,8) | 287 (25,3) | 848 (74,7) | 1,66 | 1,28-2,15 | 1,09 | 0,72-1,64 |
| Neumotóraxf | 20 (1,8) | 0 (0,0) | 20 (100,0) | ||||
| Derrame pleural | 55 (3,2) | 11 (16,9) | 54 (83,1) | 0,69 | 0,35-1,33 | 0,96 | 0,34-2,72 |
| Cardiomegalia | 51 (3) | 11 (21,5) | 40 (78,5) | 0,94 | 0,48-1,86 | 1,36 | 0,51-3,59 |
| Otro | 166 (9,7) | 34 (20,5) | 132 (79,5) | 0,87 | 0,59-1,30 | 1,09 | 0,63-1,86 |
| Puntajes ingreso | |||||||
| Probabilidad PIM3 | 0,57 (0,38-3,10) | 0,57 (0,39-1,40) | 0,59 (0,38-3,38) | 1,00 | 0,99-1,01 | 1,00 | 0,99-1,01 |
| FSS puntaje basal | 6 (6-7) | 6 (6-7) | 6 (6-7) | 1,00 | 0,96-1,04 | 1,01 | 0,95-1,06 |
Modelo de regresión logística mixto ajustado por país.
En negritas todos los valores estadísticamente significativos y subcategorías.
IC: intervalo de confianza; npVMI, ventilación mecánica no prolongada; OR: odds ratio cruda; ORa: odds ratio ajustada; PIM3: índice pediátrico de mortalidad; pVMI: ventilación mecánica prolongada; Ref: referencia; SpO2/FiO2: cociente SAFI.
El análisis multivariado mostró que la edad menor a 6 meses, la presencia de alguna comorbilidad, en especial la displasia broncopulmonar y aislamiento fúngico fueron factores independientes asociados a pVMI. Los pacientes con asma tuvieron menor probabilidad de relacionarse a pVMI (tabla 1).
Características de evolución y estancia en la unidadLas características de evolución y estancia en la unidad se presentan en la tabla 2. También está disponible la comparación bivariada para otros puntos de corte reportados en la literatura al igual que la medida de tendencia central y dispersión del tiempo de ventilación por factor en la tablas 3 y 4.
Factores relacionados con la evolución y la estancia en la UCIP asociados a ventilación mecánica prolongada después del análisis multivariado
| Características | n (%) o med (RIC) | OR | IC del 95% | ||
|---|---|---|---|---|---|
| Todosn = 1.698 | pVMIn = 382 | npVMIn = 1.316 | |||
| Parámetros ventilatoriosa | |||||
| Presión inspiratoria pico | 26 (21-29) | 28 (24-30) | 25 (20-29) | 1,05 | (1,0-1,10) |
| Presión media de vía aérea | 13 (11-15) | 14 (12-17) | 12 (11-14) | 1,07 | (1,0-1,15) |
| PEEP | 6 (7-8) | 6 (7-8) | 6 (7-8) | 1,40 | (1,16-1,70) |
| Frecuencia respiratoria | 26 (22-35) | 26 (22-35) | 25 (20-30) | 0,99 | (0,98-1,00) |
| FiO2 | 60 (50-80) | 70 (50-100) | 60 (50-80) | 1,01 | (1,01-1,02) |
| SDRA | |||||
| Presentar SDRA | 462 (27,5) | 121(26,9) | 341 (73,8) | 1,3 | (1,02-1,68) |
| Leve | 73 (15,8) | 7 (9,6) | 66 (90,4) | (Ref.) | |
| Moderado | 185(40,0) | 40 (21,62) | 145 (78,4) | 2,60 | (1,10-6,11) |
| Severo | 204(44,1) | 74 (36,3) | 130 (63,7) | 5,36 | (2,34-12,30) |
| Terapias recibidas | |||||
| Antibióticos | 1.515 (89,9) | 357 (23,6) | 1158 (76,4) | 1,95 | 1,24-3,08 |
| Antivirales | 136 (8,0) | 25 (18,4) | 111 (81,6) | 0,76 | 0,48-1,19 |
| Antifúngicos | 70 (4,2) | 41 (58,6) | 29 (41,4) | 5,32 | 3,25-8,68 |
| Corticoides | 542 (32,2) | 96 (17,7) | 446 (83,0) | 0,65 | 0,50-0,84 |
| Hemoderivados | 508 (30,2) | 211 (41,5) | 297 (58,5) | 4,28 | 3,36-5,44 |
| Bloqueo neuromuscular | 76 (13,4) | 229 (40,3) | 339 (59,7) | 4,31 | 3,39-5,47 |
| Decúbito prono | 202 (11,9) | 98 (48,5) | 104 (51,5) | 4,02 | 2,96-5,45 |
| Ventilación alta frecuencia | 202(11,90) | 129 (63,86) | 73 (36,14) | 8,68 | 6,32-11,92 |
| Óxido nítrico inhalado | 29(1,70) | 16 (55,17) | 13 (44,83) | 4,38 | 2,08-9,19 |
| Complicaciones asociadas a la ventilación | |||||
| Fallo de destete | 50 (2,9) | 19 (38,0) | 31 (62,0) | 2,16 | 1,21-3,88 |
| Traqueostomía | 15 (0,9) | 12 (80,0) | 3 (20,0) | 14,19 | 3,98-50,5 |
| Síndrome de abstinencia | 184 (10,0) | 48 (26,1) | 136 (73,9) | 1,24 | 0,87-1,77 |
| Atelectasia | 9 (0,5) | 2 (22,2) | 7 (77,8) | 0,98 | 0,20-4,75 |
| Neumotórax | 45 (2,6) | 14 (31,1) | 31 (68,9) | 1,57 | 0,83-2,99 |
| Estenosis subglótica | 16 (0,9) | 4 (25,0) | 12 (75,0) | 1,14 | 0,36-3,58 |
| Extubación accidental | 28 (1,6) | 8 (28,57) | 20 (71,4) | 1,38 | 0,60-3,17 |
| Infección asociada al cuidado de salud | |||||
| Alguna | 109 (6,5) | 50 (13,1) | 59 (4,4) | 3,21 | 2,16-4,77 |
| Asociada a dispositivo vascular | 42 (2,50) | 17 (40,5) | 25 (59,5) | 2,40 | 1,28-4,50 |
| Asociada a sonda ureteral | 26 (1,50) | 20 (76,9) | 6 (23,1) | 12,06 | 4,80-30,25 |
| Neumonía asociada ventilación mecánica | 54 (3,2) | 31 (57,4) | 23 (42,6) | 4,96 | 2,85-8,62 |
| Neumonía no asociada a VMI | 40 (2,4) | 14(35,0) | 26(65,0) | 0,07 | 0,97-3,65 |
| Infección de sitio quirúrgico | 5 (0,30) | 2(60,0) | 3(40,0) | 2,30 | 0,38-13,83 |
| Estado de egreso | |||||
| Puntaje FSS egresob | 7 (7-7) | 7 (7-9) | 7 (6-7) | 1,15 | 1,09-1,21 |
| Diferencia FSS ingreso y egresoc | 1(0-1) | 1 (0-1) | 1(0-1) | 1,11 | 1,05-1,17 |
| Días de estancia | 9 (5,9-12,9) | 15,1 (11,5-21,9) | 7,9 (5,2-10,4) | 1,19 | 1,16-1,22 |
| Fallecidos | 103 (6,1) | 29 (28,2) | 74 (71,8) | 0,72 | 0,46-1,13 |
Análisis bivariado.
En negrilla todos los valores estadísticamente significativos y subcategorías.
IC: intervalo de confianza; npVMI: ventilación mecánica no prolongada; OR: odds ratio crudo; ORa: odds ratio ajustada; pVMI: ventilación mecánica prolongada; Ref: referencia.
Análisis bivariado de la relación entre factores de ingreso y las diferentes definiciones de ventilación mecánica prolongada (pVMI) en la literatura médica
| Características | pVMI 96h | pVMI 7 días | pVMI 14 días | pVMI 21 días | Mediana (p50) |
|---|---|---|---|---|---|
| n=1048 (62%) | n=611 (36%) | n=146 (9%) | n=67 (4%) | RIQ (p25-p75) | |
| OR (IC95%) | OR (IC95%) | OR (IC95%) | OR (IC95%) | o [rho] | |
| Sexo | |||||
| Femenino | (Ref.) | (Ref.) | (Ref.) | (Ref.) | 5,2 (2,9-8,8) |
| Masculino | 1,06 (0,87-1,29) | 0,95 (0,77-1,16) | 0,76 (0,54-1,07) | 0,83 (0,51-1,36) | 5,2 (2,9-8,6) |
| Edad | |||||
| Lactantes menores de 6 meses | 1,15 (0,92-1,45) | 1,21 (0,96-1,52) | 0,58 (0,40-0,86) | 0,74 (0,42-1,32) | 5,8 (3,3-9,0) |
| Lactante de 6 a 24 meses | (Ref.) | (Ref.) | (Ref.) | (Ref.) | 5,2 (3,0-8,4) |
| Preescolar | 0,56 (0,40-0,78) | 0,59 (0,40-0,86) | 0,89 (0,51-1,56) | 0,76 (0,30-1,90) | 3,9 (2,3-6,8) |
| Escolar | 0,47 (0,26-0,84) | 0,51 (0,26-1,02) | 0,72 (0,25-2,06) | 1,44 (0,41-4,98) | 3,1 (2,0-6,8) |
| Adolescente | 0,69 (0,44-1,08) | 0,86 (0,54-1,38) | 1,10 (0,56-2,20) | 2,12 (0,91-4,91) | 4,3 (2,5-8,6) |
| Zona de procedencia | |||||
| Urbana | (Ref.) | (Ref.) | (Ref.) | (Ref.) | 5,4 (3,0-8,8) |
| Suburbana/rural | 0,72 (0,54-0,97) | 0,66 (0,48-0,90) | 0,49 (0,25-0,95) | 0,81 (0,37-1,80) | 4,7 (2,3-7,4) |
| Previsión | |||||
| Público | (Ref.) | (Ref.) | (Ref.) | (Ref.) | 4,0 (2,5-6,9) |
| Privado | 2,44 (1,99-2,98) | 2,62 (2,12-3,24) | 1,92 (1,33-2,77) | 1,33 (0,80-2,21) | 6,6 (3,6-9,8) |
| Diagnóstico de ingreso | |||||
| Bronquiolitis | (Ref.) | (Ref.) | (Ref.) | (Ref.) | 6,7 (3,7-9,6) |
| Neumonía | 0,47 (0,38-0,59) | 0,48 (0,38-0,60) | 1,13 (0,78-1,64) | 1,99 (1,15-3,44) | 4,5 (2,6-7,6) |
| Crisis asmática | 0,31 (0,21-0,47) | 0,26 (0,16-0,44) | 0,54 (0,21-1,38) | 1,02 (0,30-3,44) | 3,6 (2,1-5,8) |
| Otro | 0,34 (0,24-0,47) | 0,39 (0,26-0,56) | 1,15 (0,65-2,03) | 2,20 (1,03-4,68) | 3,4 (1,8-6,9) |
| Sepsis | |||||
| Presentar sepsis | 0,79 (0,63-0,98) | 0,73 (0,58-0,92) | 1,00 (0,68-1,48) | 1,65 (0,99-2,76) | 4,7 (2,8-7,9) |
| Sepsis sin criterios de severidad | 0,65 (0,47-0,91) | 0,59 (0,41-0,86) | 0,71 (0,37-1,39) | 1,37 (0,64-2,92) | 4,2 (2,7-7,4) |
| Choque séptico | 0,81 (0,61-1,09) | 0,92 (0,68-1,24) | 1,32 (0,82-2,11) | 1,37 (0,70-2,65) | 4,9 (3,0-7,9) |
| Sepsis grave | 1,51 (0,89-2,57) | 0,90 (0,54-1,51) | 0,84 (0,33-2,12) | 2,01 (0,78-5,16) | 5,2 (2,6-8,6) |
| Falla multiorgánica | 1,59 (0,93-2,73) | 1,88 (1,15-3,07) | 2,71 (1,44-5,09) | 4,84 (2,35-9,97) | 7,4 (3,4-11,5) |
| Infeccióna | |||||
| Infección viral | 2,26 (1,78-2,88) | 1,80 (1,38-2,35) | 1,13 (0,73-1,75) | 0,88 (0,49-1,58) | 5,7 (3,3-8,8) |
| Infección bacteriana | 0,57 (0,46-0,70) | 0,52 (0,42-0,64) | 0,85 (0,59-1,22) | 1,45 (0,89-2,37) | 4,4 (2,5-7,4) |
| Infección fúngica | 5,33 (1,23-23,16) | 5,07 (1,82-14,14) | 6,46 (2,50-16,67) | 9,31 (3,25-26,66) | 10,1 (5,1-21,3) |
| Comorbilidadesb | |||||
| Algunae | 0,73 (0,59-0,89) | 0,81 (0,66-0,99) | 1,25 (0,89-1,76) | 1,37 (0,84-2,24) | 4,8 (2,7-8,5) |
| Cardiopatía | 0,84 (0,55-1,28) | 1,04 (0,68-1,60) | 0,98 (0,46-2,05) | 0,78 (0,24-2,54) | 5,0 (2,6-8,6) |
| Prematurezc | 1,12 (0,83-1,52) | 1,09 (0,81-1,47) | 1,07 (0,65-1,78) | 0,69 (0,30-1,62) | 5,7 (3,0-8,8) |
| Desnutrición | 1,00 (0,61-1,61) | 1,25 (0,78-2,02) | 0,77 (0,31-1,95) | 0,68 (0,16-2,81) | 5,4 (2,9-9,9) |
| Genopatía | 0,61 (0,35-1,05) | 1,05 (0,60-1,84) | 2,20 (1,05-4,59) | 2,60 (1,00-6,76) | 4,3 (2,5-9,9) |
| Neurológicas | 0,69 (0,44-1,09) | 1,03 (0,65-1,65) | 2,66 (1,47-4,80) | 3,97 (1,94-8,10) | 4,7 (2,5-10,9) |
| Enfermedad oncológica | 0,82 (0,28-2,39) | 0,99 (0,33-2,96) | 1,78 (0,39-8,04) | 1,88 (0,24-14,62) | 4,5 (2,6-9,2) |
| Trasplante de medula ósea | 0,93 (0,15-5,57) | 1,19 (0,20-7,11) | 7,17 (1,19-43,24) | - | 4,8 (0,7-14,8) |
| Comorbilidades respiratorias | 0,69 (0,54-0,87) | 0,84 (0,66-1,07) | 1,43 (0,98-2,09) | 1,54 (0,90-2,63) | 4,7 (2,7-8,8) |
| Displasia broncopulmonar | 1,07 (1,00-1,14) | 1,97 (1,29-3,01) | 2,22 (1,24-3,98) | 1,45 (0,57-3,69) | 7,3 (3,6-11,2) |
| Daño pulmonar crónico | 0,93 (0,47-1,84) | 1,34 (0,68-2,64) | 3,27 (1,46-7,34) | 5,43 (2,17-13,56) | 6,3 (2,5-13,3) |
| Asma o sibilante | 0,58 (0,44-0,78) | 0,64 (0,47-0,89) | 1,01 (0,60-1,70) | 1,12 (0,55-2,30) | 4,0 (2,6-7,6) |
| Otras respiratorias | 0,47 (0,30-0,73) | 0,54 (0,32-0,90) | 1,13 (0,53-2,38) | 1,23 (0,44-3,46) | 3,7 (1,9-6,9) |
| Parámetros respiratorios y oxigenación de ingreso | |||||
| Fracción inspirada O2 (FiO2) | 1,020 (1,016-1,024) | 1,017 (1,013-1,021) | 1,009 (1,002-1,015) | 1,009 (1,000-1,018) | [0,24]e |
| Saturación O2 (SpO2) | 1,010 (0,996-1,024) | 0,996 (0,983-1,010) | 1,002 (0,978-1,026) | 0,984 (0,958-1,011) | [0,05]e |
| Frecuencia respiratoria | 0,984 (0,959-1,009) | 0,983 (0,955-1,011) | 0,969 (0,920-1,020) | 0,929 (0,856-1,009) | [-0,08]e |
| Frecuencia cardiaca | 0,999 (0,995-1,002) | 0,997 (0,993-1,000) | 0,992 (0,986-0,998) | 0,989 (0,980-0,997) | [-0,02]e |
| SpO2/FiO2 | 0,995 (0,994-0,996) | 0,995 (0,994-0,996) | 0,997 (0,995-0,999) | 0,997 (0,994-1,000) | [-0,22]e |
| Hallazgos radiológicosd | |||||
| Normal | 0,43 (0,24-0,77) | 0,65 (0,34-1,24) | 0,96 (0,34-2,72) | 2,29 (0,80-6,57) | 3,1 (2,0-7,2) |
| Hiperinsuflación | 0,58 (0,46-0,73) | 0,44 (0,34-0,57) | 0,70 (0,45-1,08) | 0,87 (0,48-1,58) | 4,1 (2,8-6,7) |
| Condensación | 0,55 (0,44-0,68) | 0,52 (0,41-0,66) | 0,83 (0,56-1,24) | 1,28 (0,76-2,15) | 4,2 (2,5-7,1) |
| Infiltrado intersticial | 2,16 (1,75-2,65) | 2,00 (1,60-2,50) | 1,30 (0,89-1,89) | 1,01 (0,60-1,70) | 6,0 (3,3-9,1) |
| Neumotórax | 0,33 (0,13-0,83) | 0,31 (0,09-1,06) | - | - | 3,0 (1,0-5,3) |
| Derrame pleural | 0,59 (0,36-0,97) | 0,48 (0,26-0,87) | 0,88 (0,35-2,23) | 0,77 (0,18-3,20) | 3,9 (1,0-5,4) |
| Cardiomegalia | 0,69 (0,39-1,20) | 0,73 (0,40-1,35) | 1,16 (0,45-2,97) | 1,54 (0,47-5,09) | 4,8 (1,4-7,9) |
| Otro | 0,69 (0,50-0,95) | 0,79 (0,56-1,12) | 0,66 (0,34-1,28) | 0,90 (0,38-2,12) | 4,6 (2,6-8,0) |
| Puntajes ingreso | |||||
| Probabilidad PIM3 | 0,99 (0,98-1,00) | 0,99 (0,98-1,00) | 1,009 (0,99-1,02) | 1,02 (1,01-1,03) | [-0,07]e |
| FSS puntaje basal | 0,97 (0,94-1,01) | 0,98 (0,94-1,01) | 1,041 (0,99-1,10) | 1,06 (1,01-1,13) | [0,16]e |
Análisis bivariado por modelo de regresión logística simple.
pVMI: ventilación mecánica prolongada; OR: odds ratio crudo; IC: intervalo de confianza; Spo2/Fio2: cociente saturación sobre fracción inspirada de oxígeno; PIM3: índice pediátrico de mortalidad versión 3; ref.: grupo de referencia.
Subrayados todos los valores estadísticamente significativos abajo de 1, en negrita, los significativos mayores de 1.
Análisis bivariado de la relación entre factores de evolución y estancia en UCIP y las diferentes definiciones de ventilación mecánica prolongada (pVMI) en la literatura médica
| Características | pVMI 96 h | pVMI 7 días | pVMI 14 días | pVMI 21 días | Mediana (p50) |
|---|---|---|---|---|---|
| n=1048 (62%) | n=611 (36%) | n=146 (9%) | n=67 (4%) | RIQ (p25-p75) | |
| OR (IC95%) | OR (IC95%) | OR (IC95%) | OR (IC95%) | o [rho] | |
| Parámetros ventilatorios máximos | |||||
| Presión inspiratoria pico | 1,04 (1.06-1,08) | 1,03 (1.01-1,04) | 1,00 (0,99-1,01) | 0,99 (0,98-1,00) | [0,29]c |
| Presión media de vía aérea | 1,13(1,10-1,17) | 1,07 (1,05-1,10) | 0,98 (0,96-1,00) | 0,96 (0,93-0,98) | [0,37]c |
| PEEP | 1,31 (1,23-1,40) | 1,18 (1,12-1,24) | 1,12 (1,06-1,18) | 1,09(1,03-1,15) | [0,25]c |
| Frecuencia respiratoria | 1,01 (0,99-1,01) | 1,06 (0,99-1,01) | 1,01 (1,01-1,02) | 1,02 (1,01-1,03) | [0,23]c |
| FiO2 | 1,01 (1,01-1,02) | 1,06 (1,00-1,01) | 0.99 (0,98-0,99) | 0,98 (0,98-0,99) | [-0,16]c |
| SDRA | |||||
| Presentar SDRA | 1,26 (1,01-1,59) | 1,08 (0,87-1,35) | 1,93 (1,36-2,74) | 2,28 (1,39-3,75) | 5,4 (3,2-9,4) |
| Leve | (Ref,) | (Ref,) | (Ref,) | (Ref,) | 4,5 (3,1-6,5) |
| Moderado | 1,08 (0,62-1,89) | 1,68 (0,88-3,21) | 2,21 (0,62-7,82) | - | 4,8 (3,3-7,9) |
| Severo | 1,62 (0,93-2,83) | 3,87 (2,06-7,26) | 5,69 (1,70-19,01) | - | 7,0 (3,3-11,8) |
| Terapias recibidas | |||||
| Antibióticos | 2,46 (1,78-3,40) | 2,08 (1,43-3,03) | 2,32 (1,07-5,04) | 2,40 (0,75-7,73) | 5,5 (3,1-8,8) |
| Antivirales | 0,87 (0,61-1,25) | 0,75 (0,51-1,10) | 0,94 (0,50-1,79) | 0,93 (0,37-2,35) | 4,8 (2,8-7,7) |
| Antifúngicos | 5,85 (2,66-12,85) | 3,83 (2,30-6,38) | 6,96 (4,12-11,75) | 8,34 (4,42-15,74) | 11,0 (6,4-17,8) |
| Corticoides | 0,62 (0,50-0,76) | 0,60 (0,48-0,74) | 0,99 (0,68-1,42) | 1,48 (0,90-2,45) | 4,5 (2,7-7,6) |
| Hemoderivados | 2,45 (1,94-3,09) | 2,93 (2,36-3,64) | 4,18 (2,94-5,96) | 2,91 (1,77-4,78) | 7,8 (4,1-11,9) |
| Bloqueo neuromuscular | 4,65 (3,63-5,95) | 4,44 (3,58-5,51) | 3,97 (2,79-5,66) | 2,72 (1,66-4,46) | 7,9 (5,0-11,7) |
| Decúbito prono | 5,07 (3,30-7,81) | 4,00 (2,94-5,45) | 5,56 (3,82-8,11) | 3,94 (2,31-6,71) | 8,9 (5,6-14,8) |
| Ventilación alta frecuencia | 12,93 (6,98-23,94) | 12,70 (8,56-18,82) | 5,99 (4,12-8,71) | 3,65 (2,13-6,26) | 10,6 (7,9-14,8) |
| Óxido nítrico inhalado | 5,48 (1,65-18,17) | 3,45 (1,60-7,48) | 6,94 (3,21-14,99) | 4,08 (1,38-12,06) | 11,0 (5,9-17,6) |
| Complicaciones asociadas a la ventilación | |||||
| Fallo de destete | 4,70 (1,99-11,08) | 3,00 (1,68-5,36) | 3,57 (1,82-6,99) | 4,31 (1,86-9,97) | 8,0 (5,7-13,9) |
| Traqueostomía | 2,49 (0,70-8,87) | 7,23 (2,03-25,73) | 22,74 (7,66-67,47) | 23,65 (8,31-67,37) | 17,8 (11,6-45,1) |
| Síndrome de abstinencia | 2,91 (1,98-4,26) | 1,46 (1,07-1,99) | 1,26 (0,76-2,09) | 1,29 (0,63-2,65) | 6,6 (4,5-9,8) |
| Atelectasia | 1,24 (0,31-4,97) | 1,42 (0,38-5,33) | 1,33 (0,17-10,71) | - | 6,1 (3,4-8,5) |
| Neumotórax | 1,38 (0,73-2,62) | 1,58 (0,87-2,85) | 1,34 (0,52-3,45) | 1,77 (0,54-5,87) | 6,8 (3,0-10,9) |
| Estenosis subglótica | 1,87 (0,60-5,82) | 1,79 (0,67-4,79) | 1,52 (0,34-6,78) | 1,63 (0,21-12,54) | 7,2 (4,0-9,2) |
| Extubación accidental | 0,82 (0,39-1,75) | 1,34 (0,63-2,85) | 2,36 (0,88-6,29) | 4,25 (1,43-12,61) | 5,6 (2,8-10,7) |
| Infección asociada al cuidado de salud | |||||
| Alguna | 2,73 (1,68-4,44) | 3,32 (2,22-4,97) | 3,65 (2,25-5,93) | 4,38 (2,34-8,20) | 8,6 (5,0-13,9) |
| Asociada a dispositivo vascular | 2,31 (1,10-4,86) | 2,68 (1,44-5,01) | 4,00 (1,96-8,13) | 4,36 (1,77-10,73) | 8,0 (4,5-15,1) |
| Asociada a sonda ureteral | 4,83 (1,44-16,16) | 10,10 (3,47-29,46) | 8,34 (3,76-18,53) | 9,89 (4,01-24,43) | 13,6 (9,5-21,3) |
| Neumonía asociada ventilación mecánica | 5,14 (2,19-12,09) | 8,35 (4,17-16,72) | 4,44 (2,38-8,27) | 5,47 (2,55-11,71) | 10,4 (7,6-15,8) |
| Neumonía no asociada a VMI | 2,98 (1,31-6,78) | 2,73 (1,44-5,19) | 0,86 (0,26-2,82) | 1,29 (0,30-5,46) | 7,9 (5,1-10,1) |
| Infección de sitio quirúrgico | 0,41 (0,07-2,47) | 1,19 (0,20-7,11) | - | - | 3,9 (2,9-10,7) |
| Estado de egreso | |||||
| Puntaje FSS egresoa | 1,04 (0,98-1,10) | 1,09 (1,03-1,14) | 1,15 (1,08-1,22) | 1,20 (1,13-1,29) | [0,21]c |
| Diferencia FSS ingreso y egresob | 1,06 (1,014-1,10) | 1,09 (1,046-1,15) | 1,07 (0,99-1,15) | 1,14 (1,03-1,24) | [0,17]c |
| Días de estancia | 1,31 (1,27-1,35) | 1,24 (1,207-1,27) | 1,11 (1,01-1,14) | 1,094 (1,07-1,11) | [0,69]c |
| Fallecidos | 0,64 (0,43-0,95) | 0,99 (0,66-1,51) | 1,90 (1,07-3,38) | 1,90 (0,84-4,27) | 4,3 (1,2-9,9) |
Análisis bivariado por modelo de regresión logística simple.
pVMI: ventilación mecánica prolongada; OR: odds ratio; IC: intervalo de confianza; ref.: referencia.
Subrayados todos los valores estadísticamente significativos abajo de 1, en negrita, los significativos mayores de 1.
El modelo multivariado mostró que el grupo de pacientes con pVMI requirió mayor uso de antifúngicos, hemoderivados, bloqueo neuromuscular y ventilación de alta frecuencia. Así mismo presentaron un mayor riesgo de presentar infecciones asociadas a cuidado de salud, en especial neumonía asociada a la ventilación mecánica invasiva y necesidad de traqueostomía. También se identificó que los pacientes que requerían durante la estancia hospitalaria utilizaron una presión media máxima de la vía aérea mayor a 13 (tabla 5) y presentaron una mayor estancia hospitalaria, sin presentar diferencias en mortalidad.
Factores relacionados con la evolución y la estancia en la UCIP asociados a ventilación mecánica prolongada después del análisis multivariado
| Factor | OR ajustada | IC del 95% |
|---|---|---|
| Presión media de vía aéreaa | ||
| Presión de vía aérea media menor a 13 | (ref.) | |
| Presión de vía aérea media mayor o igual a 13 | 1,57 | 1,12-2,21 |
| Terapias recibidas | ||
| Antifúngicos | 2,55 | 1,31-4,96 |
| Hemoderivados | 2,94 | 2,18-3,96 |
| Bloqueo neuromuscular | 2,08 | 1,48-2,93 |
| Ventilación alta frecuencia | 2,91 | 1,89-4,48 |
| Complicaciones | ||
| Traqueostomía | 2,91 | 1,89-4,48 |
| Infección asociada a cuidado de la salud | 2,53 | 1,39-4,60 |
| Neumonía asociada ventilación mecánica | 4,27 | 1,79-10,20 |
| Estancia hospitalaria | 1,13 | 1,10-1,16 |
Modelo de regresión logística mixto ajustado por país.
En negritas subcategorías.
No se incluye FSS egreso, diferencia de FSS ingreso y egreso por datos faltantes.
IC: intervalo de confianza; ORa: odds ratio ajustada; ref.: referencia.
El resultado principal del análisis de esta cohorte multicéntrica contemporánea de pacientes en VMI fue la identificación de los 9 días como punto de corte diferencial, que aporte a la definición de ventilación prolongada, basados en desenlaces de importancia en la práctica clínica diaria: mayor porcentaje de disfunción multiorgánica, presencia de SDRA, mayor cantidad de infecciones asociadas al cuidado y mayor uso de terapias auxiliares (como bloqueo neuromuscular, antibióticos, posición prono y VAFO), en aquellos con más de 9 días de VMI.
En pediatría no existe un consenso sobre pVMI y la evidencia para una definición apropiada es escasa. Esta brecha de conocimiento genera una gran variabilidad en la interpretación en los resultados de los diferentes estudios. Las definiciones más usadas en la literatura para pVMI son el requerimiento de ventilación mecánica invasiva por un tiempo mayor a 72 h19-21, 7 días8,22-26, 14 días27-29 y hasta 21 días6,30-31. En este estudio de la cohorte de LARed utilizamos una aproximación diferente. La PVMI se estableció como una duración mayor a 9 días, basado en el estadístico de dispersión percentil 75, incluyendo 22,5% de los casos en este grupo.
La frecuencia de pVMI de la cohorte analizada es difícil de comparar con otros reportes debido a la diferencia de definiciones y heterogeneidad de pacientes32. En nuestra cohorte 73,6% de pacientes tuvo una duración de VMI mayor a 72 h, 36% mayor a 7 días, 8,5% mayor a 14 días y 3,9% mayor a 21 días, datos similares a los obtenidos en el análisis de otras cohortes de pacientes con FRA22-24,27-31. Así mismo se obtuvo una mediana de 5,23 días de ventilación (2,92-8,62 días), similar al grupo de SDRA leve del estudio PARDIE con mediana de 5,9 días de ventilación (4,0-10,2 días)33.
No obstante, en esta cohorte homogénea de pacientes con falla respiratoria aguda, encontramos que la edad menor de 6 meses y la presencia de comorbilidades, específicamente displasia broncopulmonar, como factores de riesgo temprano para pVMI. Otros estudios en población general de UCI también han descrito que lactantes menores y prematuros o la presencia de comorbilidades se asocian a una pVMI6-8. Es interesante nuestro resultado de asociación negativa entre asma como diagnóstico principal de conexión a VMI y pVMI. El tiempo de duración con soporte ventilatorio fue menor de los pacientes con asma en comparación con bronquiolitis y neumonía, similar a lo reportado en otras cohortes34-37. Esto podría ser explicado por el mecanismo fisiopatológico, el cual tiende a ser revertido con frecuencia en un tiempo corto en la mayoría de los pacientes con una terapia adecuada37-39.
Se ha reportado que la coinfección bacteriana en pacientes con infección respiratoria por virus sincicial respiratorio tiene una duración mayor en los días de ventilación mecánica40. En nuestro estudio no se presentó una asociación con infección de etiología bacteriana o viral con pVMI, sin embargo, la decisión de iniciar terapia antibiótica sí fue un factor asociado a pVMI en el análisis univariado, lo que podría ser considerado como un marcador indirecto de sepsis o infección, incluso en ausencia de un cultivo positivo. El diagnóstico de infección fúngica sí tuvo una asociación fuerte con pVMI.
La relación entre un puntaje alto en estas escalas de severidad como predictor de ventilación prolongada es un tema controvertido. Payen et al. encontró una asociación entre el puntaje PRIMS y pVMI7. En nuestro estudio utilizamos la escala PIM3 y no encontramos una asociación con pVMI, es decir, no necesariamente el paciente más grave en el momento del ingreso está más tiempo en VMI.
La disfunción del sistema respiratorio se presentó con mayor frecuencia en pVMI; un mayor número de casos de SDRA y requerimiento de mayor soporte ventilatorio. Sin embargo, solo la presión media de vía aérea mayor 13 tuvo asociación significativa en el análisis multivariado. A diferencia de otras series, no encontramos una asociación de pVMI con el grado de hipoxemia, pero sí el uso de terapias como bloqueo neuromuscular y ventilación de alta frecuencia. El grupo de pVMI requirió más hemoderivados, similar a lo descrito en una cohorte de UCIP general por Monteverde et al.6.
En el análisis multivariado encontramos una asociación entre pVMI e infección asociada a cuidado de salud, especialmente de NAVM. Esto también ha sido reportado en población general de UCIP y en cardiooperados6. Otros estudios han demostrado una mayor mortalidad en pacientes con una ventilación mecánica por un tiempo más prolongado al de la media habitual. La mortalidad en pVMI fue 7%, pero no significativamente mayor a la cohorte. Sin embargo, pVMI estuvo asociado a una mayor estancia y requerimiento de traqueostomía. Los pacientes con pVMI tuvieron un peor puntaje en la escala FSS en el momento del egreso de la Unidad de Cuidado Intensivo Pediátrico. Las escalas de estado funcional no se han reportado en cohortes previas de pVMI, pero es un resultado clínico de gran importancia evaluando más allá de la mortalidad en la fase aguda, sino el efecto en la calidad de vida de los pacientes
Nuestro estudio presenta limitaciones. En primer lugar, debido a la falta de una definición de consenso de ventilación mecánica prolongada en pediatría, optamos utilizar una definición estadística basada en la distribución de nuestra población. Si bien reconocemos que esta selección puede considerarse arbitraria, nos permitió caracterizar de manera precisa un subgrupo significativo de niños en ventilación prolongada y obtener resultados clínicos relevantes. No obstante, es importante tener en cuenta que la aplicabilidad de estos resultados a otras series o cohortes puede ser limitada, por lo que debe requiere de la validación mediante la replicación de nuestros hallazgos en otras cohortes. En segundo lugar, una limitación clave del estudio es la falta de acceso a la temporalidad de los eventos posteriores a los 9 días de ventilación mecánica invasiva debido a la forma en que se construyó la base de datos. Como consecuencia, no pudimos establecer un orden causal con los datos disponibles. En tercer lugar, nuestro estudio es retrospectivo y se basa en el análisis secundario de una cohorte de pacientes con FRA, lo que limita el análisis a las variables presentes en la base de datos. Además, la duración de la ventilación mecánica y otros desenlaces pueden verse influidos por la variabilidad en la práctica médica entre las instituciones. Para mitigar esto, utilizamos un modelo de regresión logística mixto ajustado. Una cuarta limitación importante de nuestro estudio es la falta de información clínica al momento de la intubación de los pacientes. La inclusión de este dato habría permitido un análisis más preciso de la relación entre la ventilación prolongada y otros factores de riesgo y desenlaces clínicos. Sin embargo, debido a la forma en que se recopiló la información en la base de datos, solo pudimos acceder a los datos de ingreso a la Unidad de Cuidados Intensivos Pediátricos. Por último, es importante tener en cuenta que la asociación de factores no indica causalidad. Por lo tanto, nuestros resultados deben interpretarse con precaución y no deben utilizarse para establecer conclusiones definitivas sobre la relación entre la ventilación prolongada y los factores de riesgo de ingreso o eventos posteriores en pacientes con FRA.
ConclusionesEn nuestro estudio, observamos que ciertos factores al ingreso, durante la evolución y la estancia en UCIP están relacionados con una prolongación de la ventilación mecánica, definido como una duración mayor al percentil 75 de la población (9 días). Los resultados obtenidos en este estudio nos permitirían intervenir en factores de riesgo modificables y promover una liberación más temprana de la ventilación mecánica, con el objetivo de evitar complicaciones y desenlaces negativos. Nuestros datos pueden servir para proponer una forma de definir pVMP, así como utilizarse como métrica de estrategias de mejoría de calidad asistencial. Se requiere la realización de trabajos futuros para confirmar estas relaciones y, en especial, para establecer si también existe una relación entre la prolongación de la ventilación mecánica y la aparición de nuevas morbilidades.
AutoríaJuan Sebastián Barajas-Romero, Pablo Vásquez-Hoyos, Sebastian Gonzalez-Dambrauskas, Franco Díaz, Pietro Pietroboni participaron en la concepción y el diseño del estudio.
Pablo Vásquez-Hoyos, Rosalba Pardo, Juan Camilo Jaramillo-Bustamante, Regina Grigolli, Nicolas Monteverde-Fernández, Roberto Jabornisky, Pablo Cruces, Adriana Wegner, Pietro Pietroboni con la adquisición de datos.
Juan Sebastian Barajas-Romero, Pablo Vásquez-Hoyos, Sebastian Gonzalez-Dambrauskas, Franco Díaz con el análisis y la interpretación de los datos y el borrador del artículo.
Todos los autores colaboraron con la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta.
A todo el grupo de investigadores de LARed Network que hace posible este tipo de análisis.
Argentina
(AR) Hospital Juan Pablo II, Corrientes: Roberto Jabornisky, Fernando Español, Silvina Muzzio.
(AR) Hospital Regional Olga Stucky de Rizzi, Reconquista, Santa Fe: Alejandro Mansur, Evelin Cidral, Carlos Rodriguez, Roberto Jabornisky.
(AR) Hospital Durand, Bueno Aires: Analía Fernández, Diego Vinciguerra, Jorgelina Loyoco.
(AR) Hospital Pediátrico Alexander Fleming, Mendoza: Diego Aranda, Javier Figueroa, Patricia Correa.
Bolivia
(BO) Caja Nacional de Salud, La Paz: Antonio Bravo.
(BO) Hospital Materno Infantil Boliviano Japonés, Trinidad: Miguel Céspedes Lesczinsky, Zurama Velasco.
(BO) Hospital Regional San Juan de Dios, Tarija: Nils Casson Rodriguez, Estela Perales Ibañez.
(BO) Hospital del Niño Dr. Ovidio Aliaga Uría, La Paz: Vladimir Aguilera Avendaño, Alfredo Rodríguez Vargas, Miguel Quispe Huanca, Gregorio Mariscal Quenta.
Brasil
(BR) Hospital Infantil Sabará, San Pablo: Andrea Aparecida Freitas Souza, Thais Oliveira Franco, Nelson Kazunobu Horigoshi, Regina Grigolli Cesar.
Chile
(CL) Complejo Asistencial Dr. Víctor Ríos Ruíz Los Ángeles, Diego Aranguiz Quintanilla, Juan Sepúlveda Sepúlveda, Ivette Padilla Maldonado
(CL) Hospital Complejo Asistencial Dr. Sotero del Rio, Santiago: Adriana Wegner, Pamela Céspedes.
(CL) Hospital Clínico Metropolitano La Florida, Santiago: Alejandro Donoso, María José Núñez Sanchez.
(CL) Hospital El Carmen Dr. Luis Valentín Ferrada, Maipú: Pablo Cruces, Franco Díaz, Tamara Córdova.
(CL) Hospital Padre Hurtado, Santiago: Francisca Castro Zamorano, Javier Varela, Ricardo Carvajal Veas.
(CL) Hospital Luis Calvo Mackenna, Santiago: Carlos Acuña, Carolina Chandia, Jecar Neghme.
(CL) Hospital Regional de Antofagasta, Antofagasta: Pietro Pietroboni Fuster.
Colombia
(CO) Clínica Infantil de Colsubsidio, Bogotá: Alexandra Jimenez, Rosalba Pardo.
(CO) Hospital General de Medellín Luz Castro de Gutiérrez E.S.E. Medellín: Juan Camilo Jaramillo-Bustamante, Yúrika Paola López Alarcón.
(CO) Sociedad de Cirugía de Bogotá Hospital de San José, Bogotá: Pablo Vásquez-Hoyos.
(CO) Fundación Valle del Lili, Cali: Carlos Reina, Ruben Lasso, Sandra Concha.
(CO) Hospital Susana Lopez de Valencia, Popayán: Eliana Zemanate.
(CO) Hospital Universitario San Vicente Fundación, Medellín: Francisco Javier Montoya Ochoa, Andrea Betancur Franco.
(CO) Clínica UROS, Neiva: Boris Dussan, Ivan Ardila, Jennifer Silva.
Costa Rica
(CR) Hospital Nacional de Niños, San Jose: Ericka Ureña Chavarría, Jose Rosales Fernandez, Silvia Sanabria Fonseca.
Ecuador
(EC) Hospital Ingles, Quito: Maria Parada.
(EC) Hospital de Especialidades Carlos Andrade Marín, Quito: Andres Salazar, Jaime Fárez.
Surinam
(SR) Academic Pediatric Center Suriname Hospital Paramaribo, Paramaribo: Aartie Nannan-Toekoen, Juliana Amadu, Ragna Wolf.
Uruguay
(UY) Medica Uruguaya (MUCAM), Montevideo: Nicolas Monteverde-Fernandez.
(UY) COMEPA (Corporación Médica de Paysandú), Paysandú: Luis Martínez, Silvia Dubra.
(UY) Asociación Española: Alicia Fernández, Rodrigo Franchi.
(UY) Hospital Regional Salto, Salto: Luis Pedrozo, Alejandro Franco.
(UY) Círculo Católico de Obreros del Uruguay, Montevideo: Ema Benech, Mónica Carro.
(UY) Dirección Nacional de Sanidad Policial-Hospital Policial, Montevideo: Mercedes Ruibal, Andrea Iroa, Raúl Navatta, Magalí España.
(UY) Casa de Galicia, Montevideo: Alberto Serra, Fátima Varela, Bernardo Alonso.
(UY) Hospital Regional de Tacuarembó, Tacuarembó: Jorge Pastorini, Soledad Menta, Laura Madruga.
(UY) Hospital Central de las FFAA, Montevideo: Cristina Courtie, Javier Martínez, Krystel Cantirán.
(UY) CAMDEL (Cooperativa Asistencial Medica de Lavalleja): Luis Castro, Patricia Clavijo, Argelia Cantera.
(UY) COMECA (Cooperativa Medica de Canelones), Canelones: Bernardo Alonso, María Jose Caggiano, Carolina Talasimov.
(UY) Sanatorio SEMM-Mautone, Montevideo: Karina Etulain, Maria Parada, Nora Mouta, Maria José Corbo.
(UY) Hospital Evangélico del Uruguay, Montevideo: Eugenia Amaya, Verónica Etchevarren, Cecilia Mislej.