INTRODUCCIÓN
La sedación y la analgesia son parte integral en el manejo de los pacientes críticos en las Unidades de Cuidados Intensivos (UCI). Los objetivos de estas dos intervenciones son proporcionar a los pacientes un nivel óptimo de comodidad con seguridad, reduciendo la ansiedad y la desorientación, facilitando el sueño y controlando adecuadamente el dolor. De este modo también se facilita que no haya interferencia con los cuidados médicos y de enfermería1.
Los pacientes críticos en la UCI tienen riesgo de presentar ansiedad, agitación, combatividad, delirio y síndromes de abstinencia por privación (opiáceos, alcohol, nicotina, etc.). Es indispensable diagnosticar con la mayor exactitud estas manifestaciones clínicas, porque de ello depende su manejo adecuado2.
OBJETIVOS DE LA GUÍA
Proporcionar recomendaciones para el uso de la sedación y el manejo del dolor, en pacientes adultos que ingresan a las UCI, con o sin intubación traqueal (IT) y asistencia ventilatoria, y/o con algunas patologías o condiciones específicas.
Las recomendaciones se basaron en el consenso de los expertos en medicina crítica de diferentes países miembros de la Federación Panamericana e Ibérica de Sociedades de Medicina Crítica y Cuidados Intensivos (FEPIMCTI) (Apéndice 1). La guía es transparente en relación a la bibliografía que sustenta el nivel de evidencia, las recomendaciones y el método usado para el desarrollo de las guías, lo que permite que sea replicable y que se pueda aplicar en cualquier UCI.
Para la elección de las recomendaciones no se tuvieron en cuenta las consideraciones económicas (coste/ efectividad) encontradas en estudios globales, ya que las circunstancias de cada país pueden variar sustancialmente las condiciones de aplicabilidad. El informe técnico completo está disponible y puede ser solicitado por correo electrónico al coordinador de la guía en la siguiente dirección: famcelis1@cable.net.co
ALCANCE DE LA GUÍA
Las recomendaciones se han agrupado en diferentes secciones, de acuerdo con las condiciones específicas que caracterizan al grupo de enfermos a los que van dirigidas.
01. Paciente que precisa sedación consciente.
02. Paciente con delirio y síndromes de abstinencia.
03. Pacientes sin IT ni asistencia ventilatoria.
04. Pacientes con ventilación mecánica (VM).
05. Pacientes en proceso de retirada del tubo endotraqueal y de la VM.
06. Poblaciones especiales: pacientes traumatizados, ancianos y embarazadas.
07. Pacientes en el post-operatorio inmediato de cirugía cardiovascular.
08. Paciente neurológico y neuroquirúrgico.
09. Paciente con insuficiencia renal o hepática.
10. Paciente que requiere procedimientos especiales (traqueostomía, tubos o sondas torácicas, lavado peritoneal, curaciones y desbridamiento de heridas o quemaduras).
11. Estrategias no farmacológicas o terapias complementarias.
LIMITACIONES DE LA GUÍA
Esta guía no cubre la población infantil, ni la población adulta con condiciones diferentes a las mencionadas, tales como pacientes quemados, trasplantados, con muerte encefálica en proceso de donación de órganos, psiquiátricos, con síndromes de abstinencia al alcohol y psico-estimulantes.
USUARIOS
Esta guía ha sido elaborada para ser usada por médicos, enfermeras, fisioterapeutas (terapistas) que estén involucrados en el manejo de pacientes adultos en estado crítico. También puede ser utilizada para labores docentes de residentes y estudiantes. En el Apéndice 2 figura un glosario de las abreviaturas y términos usados en el texto.
METODOLOGÍA PARA EL DESARROLLO DE LA GUÍA
Conformación del grupo de consenso
Se invitó a participar en la elaboración de la guía a un total de 24 personas procedentes de 9 países, de las cuales aceptaron 21. Los invitados fueron escogidos por las sociedades de cuidado crítico de cada país participante, basándose en criterios como su experiencia en el tema y en la metodología para el desarrollo de guías.
En la elaboración de la guía participaron 19 especialistas en cuidados críticos, de los cuales 5 son expertos en epidemiología clínica. También formaron parte del grupo 4 expertos en metodología para la realización de guías basadas en evidencia. El papel de los metodólogos fue orientar y apoyar a los especialistas en la búsqueda de la literatura, así como en el desarrollo y la metodología para confeccionar la guía.
Desarrollo de la guía
Los 19 expertos definieron el alcance de la guía, los temas a evaluar y las preguntas relevantes a las que se debería dar respuesta. Se designaron dos expertos por tema.
El grupo de expertos decidió tomar como válidas y como punto de partida la guía para el uso de sedación y analgesia de la Society of Critical Care Medicine (SCCM)3.
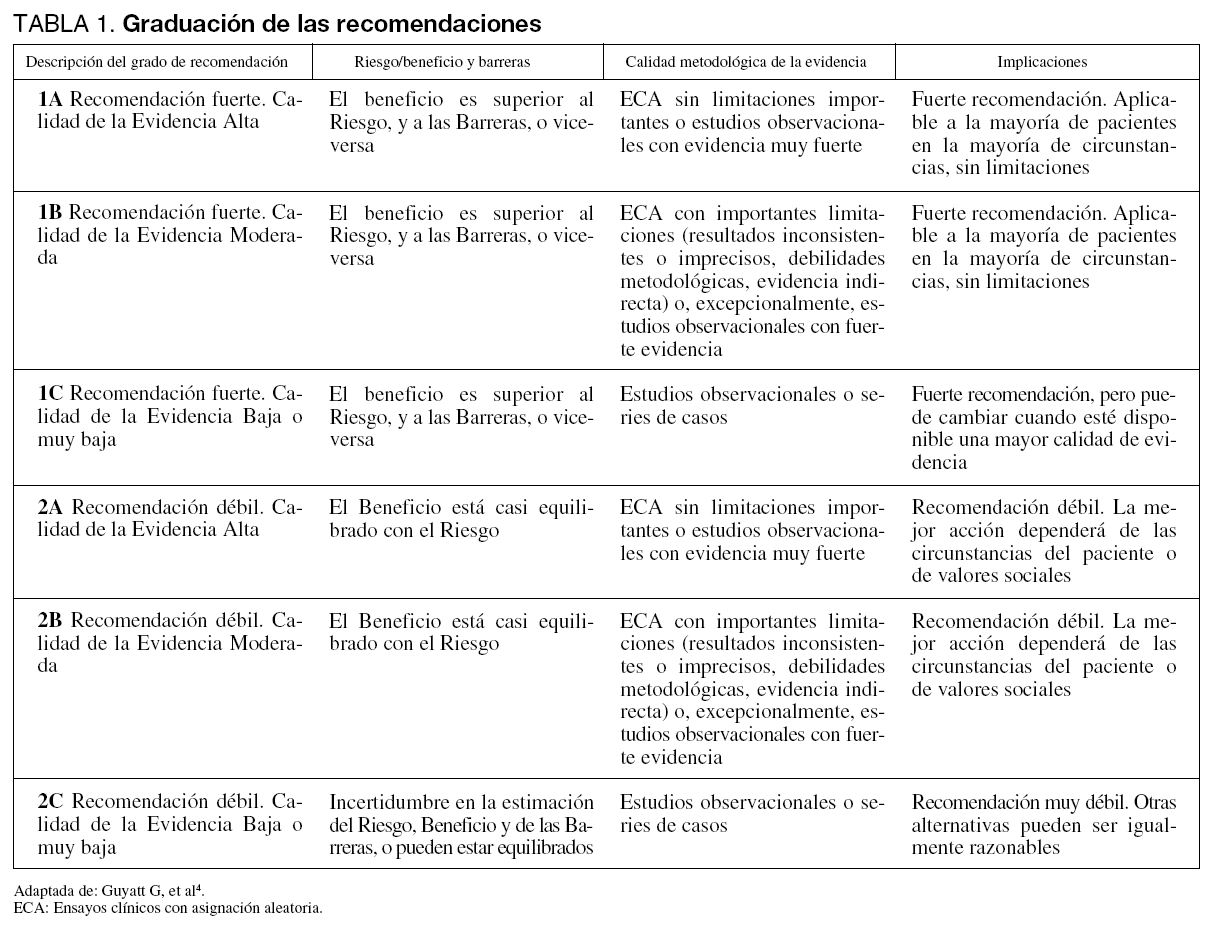
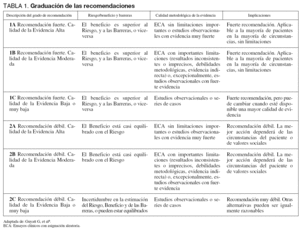
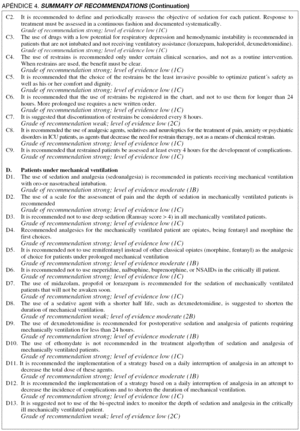
Se capacitó a los expertos en la metodología a seguir y se acogió la propuesta del Garding of Recommendations Assessment, Development and Evaluation (GRADE) Working Group4 para emitir el grado de recomendación y evaluar la calidad de la evidencia, de acuerdo con los criterios expresados en la tabla 1.
Búsqueda de la literatura biomédica
La estrategia de búsqueda fue diseñada por expertos en búsqueda de literatura e información biomédica y revisiones sistemáticas.
Los criterios de inclusión de los artículos fueron:
1. Tipos de estudio. Ensayos clínicos con asignación aleatoria, revisiones sistemáticas, estudios de cohortes, casos y controles, estudios descriptivos, series de casos.
2. Tipos de pacientes. Adultos, críticamente enfermos o ingresados en UCI, en alguna de las siguientes circunstancias: sin intubación endotraqueal; con intubación endotraqueal y VM; en proceso de retirada de la VM y del tubo endotraqueal; en postoperatorio inmediato de cirugía cardiovascular; con EPOC, con SDRA, ancianos, mujeres embarazadas o en lactancia; politraumatizados; neurocríticos; con insuficiencia renal; con insuficiencia hepática; con agitación y/o delirio y/o síndrome de abstinencia. Se excluyó el síndrome de abstinencia por alcohol o psicoestimulantes.
3. Tipo de intervenciones. Sedación y sedación consciente (se incluyeron loracepam, midazolam, propofol, diacepam, dexmedetomidina, tiopental sódico, haloperidol, clozapina, metadona, ketamina, estrategias no farmacológicas o terapias complementarias); analgesia (se incluyeron morfina, fentanilo, remifentanilo, sufentanilo, clonidina, AINE, hidromorfona, métodos de anestesia regional, PCA; procedimientos de inmovilización; procedimientos quirúrgicos frecuentes en la UCI (traqueostomía, tubos o sondas torácicas, lavado peritoneal, curas y desbridamiento de heridas o quemaduras).
La identificación de los estudios relevantes se llevó a cabo mediante una búsqueda electrónica de todos los estudios relacionados con los temas propuestos a partir del 1 de enero del año 2000.
Fueron consultados MEDLINE a través de PUBMED (1/01/2000 a 27/01/2007), las siguientes bases de datos de la biblioteca Cochrane: CDSR (Cochrane Database of Systematic Reviews), CENTRAL (Cochrane Central Register of Controlled Trials), DARE (Database of Abstracts of Reviews of Effects), NHS EED (National Health Service Economic Evaluation Database) a través de The Cochrane Library número cuatro, 2006, y la base de datos LILACS (Literatura Latinoamericana y del Caribe en Ciencias de la Salud) (enero 27, 2007). En el Apéndice 3 se detallan las diferentes estrategias de búsqueda en PUBMED.
La búsqueda bibliográfica identificó 13.489 referencias en las diferentes bases de datos mencionadas. El coordinador del proyecto y un metodólogo seleccionaron los estudios considerados relevantes para la elaboración de la guía, y descartaron los estudios que no cumplían los criterios de inclusión o correspondían a referencias ya identificadas en otra base de datos. Posteriormente un intensivista, con formación en epidemiología clínica, evaluó los textos completos de los restantes estudios, seleccionando finalmente 90 estudios para la guía. Adicionalmente, los expertos incluyeron 346 referencias secundarias identificadas en los estudios encontrados por las búsquedas electrónicas realizadas por ellos, incluyendo algunas de ellas en la bibliografía. Los estudios en los que se fundamentaron las recomendaciones fueron evaluados, según los estándares del GRADE Working Group4, por los expertos participantes apoyados por los cinco epidemiólogos intensivistas. Esta evaluación se realizó con instrumentos estandarizados.
Las propuestas para las recomendaciones fueron presentadas por un experto en una sesión plenaria, junto con la bibliografía que sustentaba la recomendación. Tras una discusión colectiva se establecieron las recomendaciones finales. Fueron incluidas como recomendaciones todas las propuestas que superaron el 80% del consenso, y retiradas aquellas recomendaciones que superaron el 80% de la votación para no ser tenidas en cuenta.
Recomendaciones finales de la guía
La distribución de las recomendaciones finales según el grado de recomendación figura en la tabla 2. En el Apéndice 4 figura la versión inglesa de todas las recomendaciones, su grado de recomendación y nivel de evidencia.
Actualización de la guía
Se propone que la guía sea actualizada a los dos años de la fecha de publicación.
Implementación y seguimiento
Se recomienda que cada sociedad federada FEPIMCTI implemente la guía según sus posibilidades y haga un seguimiento de los resultados. Estos resultados, con las fortalezas y debilidades encontradas, deberán servir de base para las actualizaciones futuras.
Exoneración
Es importante recordar que la guía es sólo una herramienta útil para mejorar las decisiones médicas, y que debe ser utilizada teniendo en cuenta el criterio médico, las necesidades y preferencias de los pacientes y la disponibilidad de los medios locales.
También conviene recordar que nuevos resultados de la investigación clínica pueden proporcionar nuevas evidencias que hagan necesario cambiar la práctica usual, aun antes de que esta guía sea actualizada.
RECOMENDACIONES, NIVEL DE EVIDENCIA Y JUSTIFICACIÓN
Esta guía se presenta como una lista de recomendaciones para cada pregunta del tema seleccionado.
RECOMENDACION GENERAL
Todos los pacientes críticos tienen derecho a un adecuado manejo del dolor cuando lo necesiten.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
A. Pacientes que precisan sedación consciente
¿Cuáles son las escalas y elementos más sensibles para la monitorización y diagnóstico de la agitación?
A1. Se recomienda la evaluación objetiva de la presencia y cuantificación de la agitación de todo paciente con riesgo de desarrollarla en una UCI, mediante una escala de medición validada (RASS o SAS). Debe hacerse de forma sistemática y por personal entrenado en su aplicación.
Grado de recomendación fuerte. Nivel de evidencia moderada (1B).
Justificación. Se define la agitación como la presencia de movimientos frecuentes de la cabeza, los brazos o las piernas y/o la desadaptación del ventilador, que persisten a pesar de los intentos de tranquilizar al paciente por parte del personal encargado de su cuidado5,6. Puede ocurrir por una toxicidad del SNC secundaria a los fármacos o por otras condiciones frecuentes en el paciente crítico7,8. La agitación sigue un círculo vicioso de retroalimentación en el que la respuesta defensiva del personal de atención sanitaria induce más agitación en el enfermo con la probabilidad de sufrir agresiones físicas, auto-retirada de sondas, catéteres y tubo endotraqueal9,10. El aumento de la demanda de oxígeno puede desencadenar una isquemia miocárdica u otros fallos orgánicos en el paciente grave, lo que justifica la necesidad de un tratamiento rápido y eficaz2,11,12.
La escala de sedación de Ramsay13 (tabla 3) fue validada hace más de 30 años específicamente para valorar el nivel de sedación. Incluye sólo una categoría de agitación en su graduación, lo que la hace muy poco útil para cuantificar el nivel de agitación.
En los últimos años se han desarrollado instrumentos (escalas) más eficaces para valorar la agitación. Entre los que han mostrado mayor validez y fiabilidad están: el MASS14, la SAS15,16 (tabla 4) y la RASS17 (tabla 5). Las escalas RASS y SAS son fáciles de usar y recordar, lo que favorece la aceptación por el personal de la UCI17-19.
¿Cuáles son los factores que contribuyen a la aparición de la agitación?
A2. Se recomienda que el personal que atiende al enfermo valore y cuantifique la presencia de factores de riesgo de agitación, con el fin de iniciar precozmente el tratamiento de esos factores.
Grado de recomendación fuerte. Nivel de evidencia moderada (1B).
Justificación. Los factores que contribuyen a la aparición de agitación se pueden clasificar según su origen en5,6,20:
1. De origen exógeno (externo) o tóxico-orgánico. Se produce por la acción de tóxicos o en el curso de enfermedades médicas. Son de aparición brusca. En los casos de drogas y fármacos se produce por exceso o sobredosificación, reacciones adversas o privación. Las drogas capaces de causar agitación incluyen: alcohol (delirium tremens y alucinosis), estimulantes, marihuana y alucinógenos. Entre los medicamentos están: atropina, corticosteroides, fenitoína, barbitúricos, fenotiacinas, antidepresivos tricíclicos y disulfiram. Entre las causas tóxico-orgánicas figuran: epilepsia, hematoma subdural, accidente cerebro-vascular, encefalopatía hipertensiva, hemorragia subaracnoidea, tumores intracraneales, sepsis, infección por el virus de la inmunodeficiencia humana con afectación del SNC, hipotiroidismo, psicosis puerperal, e hipoglucemia. También se asocian a agitación las encefalopatías asociadas a insuficiencia hepática e insuficiencia renal.
2. De origen psicógeno. Una situación de estrés en enfermos con personalidades susceptibles que se descompensan fácilmente.
3. De origen endógeno. Psicosis esquizofrénica, psicosis maniaco depresiva.
¿En qué situaciones está indicada la sedación consciente?
A3. Se recomienda la sedación consciente de los pacientes que necesiten una valoración periódica de su estado de conciencia, debido a una enfermedad crítica o a un procedimiento complejo que pueda complicarse gravemente con síntomas neurológicos.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. Se puede definir la sedación consciente como la depresión mínima del nivel de conciencia que permite al paciente mantener su vía aérea permeable. Desde un enfoque más operacional (al lado de la cama del enfermo), se considera «sedación consciente» aquella en la que el paciente preserva una respuesta apropiada a la estimulación verbal o táctil, con mantenimiento de los reflejos de la vía aérea y ventilación espontánea adecuada. Habitualmente la situación cardiovascular se mantiene estable21-23.
Se puede administrar durante diferentes procedimientos terapéuticos, diagnósticos o quirúrgicos, cuando se necesite una evaluación neurológica frecuente, durante el acoplamiento a la VM no invasiva, para la adaptación a las modalidades espontáneas de ventilación invasiva, o durante el proceso de retirada de IT.
A4. Se recomienda el uso de dexmedetomidina, fentanilo, propofol o midazolam, en dosis titulada según la respuesta (bolos o infusión), para la sedación consciente en situaciones terapéuticas, diagnósticas o quirúrgicas menores en la UCI.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. La dexmedetomidina, un agonista α2 de acción corta y alta especificidad, produce analgesia, ansiolisis y sedación, que ha sido descrita como consciente. Adicionalmente, la dexmedetomidina no produce depresión respiratoria clínicamente significativa, lo cual facilita el manejo de estos pacientes desde el punto de vista de la respiración y del mantenimiento de la permeabilidad de la vía aérea24-30.
El midazolam, el fentanilo y el propofol pueden proporcionar sedación consciente en dosis y tiempo variables, supeditada a las características farmacocinéticas de cada fármaco en particular31. Al usar infusiones continuas debe tenerse en cuenta la acumulación de metabolitos. Siempre es necesario recordar que el midazolam y el propofol no producen analgesia20-24,26-30,32-41.
A5. El uso de droperidol combinado con opiáceos para neuroleptoanalgesia debe ser cauteloso, valorando el riesgo-beneficio para cada paciente, por la aparición de síntomas extrapiramidales y el posible riesgo de «torsión de puntas».
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. El droperidol, una butirofenona de inicio rápido de acción y corta duración de efecto es útil para el tratamiento de estados de agitación psicomotriz y agresividad. Las dosis son muy variables (de 0,625 a 1,25 mg en bolo y de 5 a 25 mg en infusión en 24 horas). Hay que tener en cuenta sus efectos hemodinámicos adversos: vasodilatación, hipotensión y taquicardia. No tiene efecto analgésico significativo, por lo que generalmente se usa asociado a un opiáceo. Sin embargo, entre sus efectos adversos se han descrito síntomas extrapiramidales y posible alargamiento del QT con el consecuente riesgo de «torsión de puntas» (aunque este efecto no está claramente probado con dosis bajas)42-44.
El remifentanilo se ha utilizado en anestesia. Pese a su rápida terminación de efecto y su nula acumulación, el uso en la sedación consciente de los pacientes críticos necesita de una monitorización y un cuidado extremos, ya que pequeños incrementos de la dosis pueden hacer perder el control de la vía aérea. Hasta hoy, no existen experiencias clínicas publicadas para la sedación consciente.
B. Paciente con delirio y síndromes de abstinencia
Delirio
¿Cuáles son los factores que contribuyen a su aparición?
B1. Se recomienda definir y clasificar el tipo de delirio, al igual que los factores que lo desencadenan.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. El delirio se define como una alteración de la conciencia con inatención, acompañada de alteraciones cognitivas y/o de percepción que se desarrollan en un corto período de tiempo (horas o días) y fluctúan con el tiempo45. Los cambios cognitivos se manifiestan como alteraciones de la memoria, desorientación, agitación o habla confusa. Las alteraciones de la percepción se manifiestan como alucinaciones (usualmente visuales), ilusiones y/o delusiones. A menudo el delirio se confunde con la demencia, pero las alteraciones cognitivas que se presentan en ambas son diferentes. La demencia se define como una alteración de la memoria y la alteración cognitiva asociada a ella. Se desarrolla en meses o años y empeora progresivamente. El diagnóstico diferencial entre ambas es posible en la mayoría de los casos46,47.
El delirio de acuerdo con el nivel de alerta y de actividad psicomotora se clasifica en48-52:
1. Hiperactivo (30%): se caracteriza por agitación, agresividad, inquietud, labilidad emocional, tendencia a retirarse sondas, catéteres y tubos.
2. Hipoactivo (24%): se caracteriza por letargia, indiferencia afectiva, apatía y disminución en la respuesta a estímulos externos. Con el empleo de medicamentos psicoactivos es más prevalente que el hiperactivo. Se asocia a la prolongación de la estancia hospitalaria y a un incremento de la mortalidad.
3. Mixto (46%): presenta características de los dos anteriores.
Inouye et al53,54 desarrollaron un modelo predictivo de delirio y dividieron los factores de riesgo en dos categorías:
1. Predisponentes. Ingresan con estos factores en el hospital e indican la vulnerabilidad basal. En esta categoría figuran: edad superior a los 70 años, procedencia de una residencia/asilo, depresión o demencia, accidente cerebro-vascular previo, epilepsia, uso de medicamentos psicoactivos, alcoholismo o ingesta de drogas ilícitas, hipo o hipernatremia, hipo o hiperglicemia, hipo o hipertiroidismo, hipotermia o fiebre, insuficiencia hepática, renal o cardíaca, shock, desnutrición, procedimientos invasivos y enclaustramiento.
2. Precipitantes. Incluyen estímulos nociceptivos o lesiones, o factores relacionados con la hospitalización.
Ante un factor predisponerte, la presencia de uno precipitante favorece la aparición de delirio. Las benzodiacepinas, opioides y otros medicamentos psicoactivos incrementan entre 3 y 11 veces el riesgo de desarrollar delirio. Entre los opioides, el fentanilo es el que lo induce con más frecuencia55-57.
¿Cuáles son las escalas y elementos más usados para la monitorización y diagnóstico del delirio?
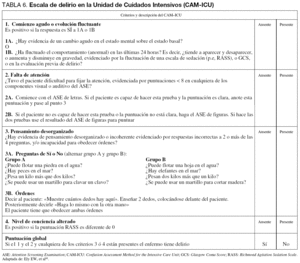
B2. Se recomienda utilizar la escala CAM-ICU para valorar el delirio en el enfermo grave.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
B3. Todo paciente que tenga una respuesta con la escala de RASS de -3 a +4 debe ser valorado con la escala CAM-ICU.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
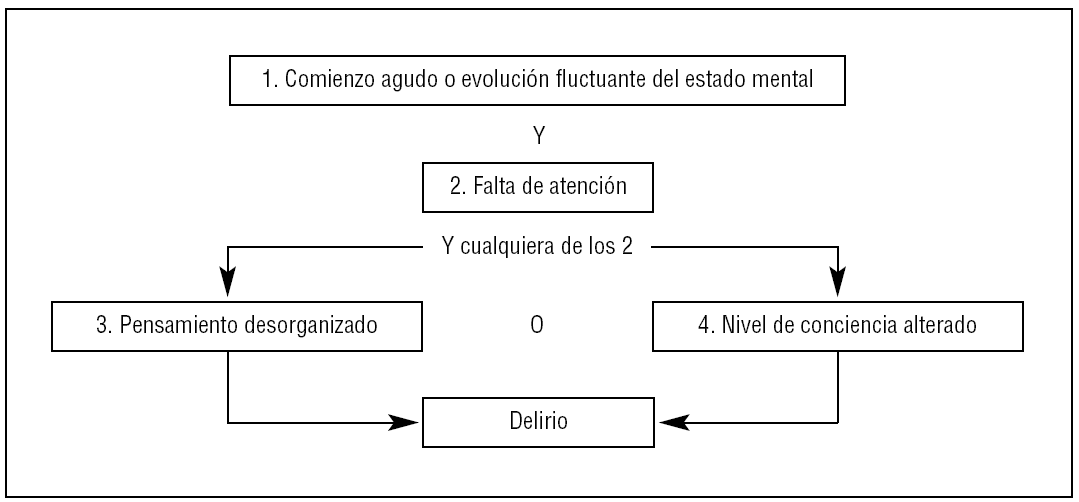
Justificación. La valoración del delirio en el paciente grave debe incluir, además de la exploración clínica, la escala CAM-ICU (tabla 6, fig. 1), que ha sido validada en pacientes graves que no verbalizan58-62. Este instrumento puede ser aplicado por médicos o enfermeras en diferentes grupos de pacientes graves, de una manera estandarizada, en la cabecera del enfermo. Para la aplicación y valoración adecuada de la escala CAM-ICU deberá capacitarse adecuadamente al personal que lo realizará63. Una vez aprendido el modo de utilizarla, su aplicación no lleva más de dos minutos.
Figura 1. Diagrama de flujo de la Confusion Assessment Method for the Intensive Care Unit (CAM-ICU). Adaptada de: Ely EW, et al61.
En la práctica clínica se inicia la valoración con la escala de sedación RASS, antes de la aplicación de la valoración CAM-ICU17.
¿Cuál o cuáles son las mejores opciones terapéuticas?
B4. Se recomienda el abordaje no farmacológico del delirio, previo a la terapia farmacológica.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. El primer paso en el manejo del delirio en el paciente grave es el diagnóstico temprano. Una vez detectado, deberán tratarse los factores de riesgo58,64,65. Las intervenciones generales recomendadas para ello son: a) adecuar la sedación; evitar sedación excesiva, monitorizarla, interrumpirla diariamente, evitar relajantes neuromusculares, adecuar la dosificación y el tiempo de aplicación de las combinaciones de sedantes; b) realizar traqueostomía temprana (cuando está indicada reduce la necesidad de sedación y mejora la capacidad de comunicación y la movilidad del paciente); c) optimizar el manejo del dolor y d) diagnóstico precoz, profilaxis y tratamiento de los síndromes de abstinencia.
Las estrategias no farmacológicas incluyen la reorientación, la estimulación cognitiva varias veces al día, adecuar la relación sueño-vigilia, la movilización temprana, la retirada precoz de catéteres, la estimulación visual y auditiva, el manejo adecuado del dolor y minimizar en lo posible el ruido y la luz artificial. Con estas intervenciones se reduce hasta en un 40% la incidencia del delirio. Deberá informarse a los familiares sobre estas alternativas de manejo y explicárselas para que no les cause ansiedad.
B5. El haloperidol es el medicamento recomendado para el manejo del delirio en el enfermo grave, comenzando con dosis de 2,5 a 5 mg intravenosos, con intervalos de 20 a 30 minutos, hasta el control de los síntomas.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. Las benzodiacepinas no están indicadas para el manejo del delirio, ya que predisponen a la sedación excesiva, depresión respiratoria y empeoramiento de la disfunción cognitiva. No obstante, las benzodiacepinas están indicadas en el delirium tremens y en otros estados de privación de drogas asociados a delirio hiperactivo. En ciertas poblaciones, como es la de pacientes mayores de 60 años y con demencia, las benzodiacepinas aumentan la confusión y la agitación.
A diferencia de los opioides, las benzodiacepinas y el propofol, la dexmedetomidina se asocia menos al delirio en el post-operatorio, por lo que podría ser una alternativa adecuada para el manejo de la ansiedad en estos casos.
En la actualidad, no hay medicamentos aprobados por la FDA para el tratamiento del delirio. Las guías de la SCCM3 recomiendan el haloperidol como el medicamento de elección. El haloperidol es una butirofenona con efecto antipsicótico que no suprime el reflejo respiratorio y actúa como antagonista dopaminérgico; además, tiene un efecto sedante. Ni el haloperidol ni otros agentes similares (droperidol, clorpromacina) han sido extensamente estudiados en los pacientes graves. Se recomienda iniciar el tratamiento con dosis bajas por vía intravenosa de haloperidol, 2,5 a 5 mg, en intervalos de 20-30 minutos, hasta lograr el control de los síntomas. En algunos pacientes se llega a requerir dosis muy elevadas, e incluso infusión continua de 5 y hasta 25 mg por hora. Deberá monitorizarse estrechamente el intervalo QT, pues su prolongación, por efecto del haloperidol, puede inducir arritmias ventriculares del tipo «torsión de puntas». Los efectos adversos del haloperidol incluyen hipotensión, distonías agudas, síntomas extrapiramidales, espasmos laríngeos, síndrome neuroléptico maligno, efectos anticolinérgicos, reducción del umbral de convulsiones y desregulación del metabolismo de la glucosa y de los lípidos. En enfermos con delirio hiperactivo grave se recomienda el uso simultáneo del haloperidol asociado a midazolam o propofol66-72.
B6. Se sugiere el uso de olanzapina como alternativa al haloperidol para el manejo del delirio.
Grado de recomendación débil. Nivel de evidencia moderado (2B).
Justificación. Los nuevos agentes antipsicóticos como la risperidona, cipracidona y olanzapina pueden emplearse para el manejo del delirio. Estos medicamentos podrían ser teóricamente superiores al haloperidol, especialmente en el delirio hipoactivo y mixto, porque no sólo actúan sobre los receptores dopaminérgicos, sino que también modifican la acción de neurotransmisores como la serotonina, la acetilcolina y la norepinefrina.
Los nuevos antipsicóticos pueden ser una alternativa eficaz y se recomiendan en los casos en los que el haloperidol esté contraindicado o presente efectos adversos. Su principal limitación es la no disponibilidad en presentación parenteral, lo que restringe su uso a los enfermos que toleren la administración enteral73.
Síndromes de abstinencia en la Unidad de Cuidados Intensivos
¿Cuáles son los factores que contribuyen para su aparición?
B7. Se recomienda evaluar el desarrollo de la tolerancia y el síndrome de abstinencia en todos los pacientes graves que se han manejado con sedantes y opioides, sobre todo cuando se utilizaron dosis elevadas, y en forma combinada por más de 48 horas.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. Una complicación frecuente de la sedación, cuando se utiliza durante más de una semana y en dosis elevadas es la tolerancia, que puede ser metabólica o funcional. La tolerancia cruzada aparece cuando el SNC tolera un medicamento y se adapta de una manera similar pero más rápidamente a un segundo.
Cuando la sedación o la analgesia prolongadas se suspenden abruptamente puede aparecer un síndrome de abstinencia. La incidencia del síndrome de abstinencia en las UCI pediátricas y de adultos puede llegar hasta el 62% y, a pesar de esto, esta complicación es subestimada, lo que se refleja en que sólo el 23,5% de los centros disminuyen de manera progresiva la dosis de los medicamentos empleados rutinariamente en la sedación74.
Los factores de riesgo asociados al desarrollo del síndrome de abstinencia son: a) dosis elevadas de benzodiacepinas, opioides y propofol; b) suspensión brusca; c) infusión durante un tiempo prolongado (más 3 días); d) combinación de medicamentos y e) administración de barbitúricos75,76.
Los opioides, las benzodiacepinas y el propofol pueden inducir tolerancia y síndrome de abstinencia77-80. El síndrome de abstinencia de las benzodiacepinas se manifiesta con agitación, delirio, convulsiones, alucinaciones, alteraciones cognitivas, insomnio, temblor, fiebre, náuseas, vómitos e hiperactividad simpática (taquicardia, hipertensión, taquipnea). La asociación con pentobarbital acentúa el síndrome. Un síndrome semejante se ha descrito con el uso de alprazolam y loracepam en pacientes críticos75,77,78,81-87. El síndrome de abstinencia por propofol se asocia a infusiones durante más de 24 horas y a dosis elevadas. En la mayoría de los casos, el propofol se utiliza junto con las benzodiacepinas y los opioides, por lo que el síndrome de abstinencia puede ser mixto. Se caracteriza por confusión, temblor, alucinaciones, convulsiones tónico-clónicas, taquicardia, taquipnea y fiebre. El desarrollo de tolerancia al propofol está sujeto a controversia38,88-98.
El fentanilo, sulfentanilo y remifentanilo, por su gran afinidad por los receptores opioides, tienen un mayor riesgo de inducir tolerancia y abstinencia que los opioides no sintéticos como la morfina. Por ello, deberá de pautarse cautelosamente su dosificación. El síndrome de abstinencia por opioides se caracteriza por: irritabilidad, temblor, clonus, delirio, hipertonicidad, movimientos coreo-atetósicos, alucinaciones, vómitos, estridor, diarrea, hipertensión arterial, taquicardia, diaforesis y fiebre. Los factores de riesgo para el desarrollo de movimientos coreo-atetósicos por abstinencia de opioides son: género femenino, administración simultánea de midazolam y aminofilina e hipoalbuminemia. Una dosis de fentanilo de más de 1,5 mg/kg o una duración de la infusión por más de 5 días se asocia a una incidencia de síndrome de abstinencia del 50%. Mientras que una dosis superior a 2,5 mg/kg por más de 9 días se asocia a una incidencia del 100%78,99-103.
¿Cuál o cuáles son las mejores opciones terapéuticas?
B8. Se recomienda el uso de protocolos de disminución progresiva de los sedantes y opioides para evitar síndromes de abstinencia.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
B9. Se recomienda el empleo de loracepam durante la retirada de infusiones con dosis altas y por tiempo prolongado de midazolam.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. Dentro de las estrategias para disminuir la incidencia de los síndromes de abstinencia a sedantes y opioides en el paciente grave se han descrito: a) el uso de escalas para ajustar las dosis a los objetivos terapéuticos de la sedación; b) evitar la sedación excesiva; c) limitar, en lo posible, los días de tratamiento; d) definir en cada caso y para cada sedante la forma de administración, en bolos o en infusión; e) reducir progresiva y gradualmente los sedantes y analgésicos; f) evitar, en lo posible, la combinación de medicamentos sedantes, sobre todo en dosis elevadas y g) valorar el empleo de la dexmedetomidina para facilitar la reducción de la dosis de opioides y sedantes.
Se han propuesto diferentes esquemas para la retirada de medicamentos:
1. Para una sedación inferior a 5 días, la reducción debe ser del 10 al 15% de la dosis cada 6 a 8 horas hasta su suspensión104.
2. Para una sedación de 7 días o más, sobre todo cuando se realiza con medicamentos de lenta eliminación, se recomienda la administración oral o subcutánea de dosis bajas del medicamento76.
3. Después de infusiones prolongadas de midazolam se recomienda el cambio a loracepam por vía oral, teniendo en cuenta que la relación potencia y vida media midazolam/loracepam es de 1:2 y 1:6 respectivamente. Después de la segunda dosis de loracepam por vía oral se iniciará la reducción a un 50% de la dosis del midazolam y otro 50% tras cada dosis por vía oral104,105.
4. Para la reducción de los opioides se recomienda disminuir inicialmente de un 20 a un 40% la dosis y posteriormente el 10% cada 12-24 horas105.
B10. Se recomienda la metadona por vía oral durante la retirada de los opioides administrados en dosis elevadas y durante un tiempo prolongado.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. La metadona es útil para facilitar la retirada de opioides intravenosos, sobre todo cuando se combinaron con benzodiacepinas. Se deberá tomar en cuenta que la relación fentanilo/metadona para la potencia analgésica es de 100:1, y para la vida media de 1:75/100. La biodisponibilidad oral de la metadona es del 75-80%. La dosis inicial de metadona será igual a la dosis total de fentanilo intravenoso. Después de la segunda dosis oral de metadona, la infusión de fentanilo se reducirá a un 50%, y así sucesivamente, hasta la cuarta dosis. Las manifestaciones de abstinencia se tratarán con dosis de rescate de morfina. La dosis total de morfina usada para los rescates deberá considerarse para calcular la dosis de metadona del siguiente día. Si se observa una sedación excesiva, la metadona puede ser reducida en un 10-20% hasta que la sedación se controle. La dosis de metadona será reducida progresivamente en un 20% cada semana. De esta manera los opioides podrán ser descontinuados en 5 a 6 semanas104.
B11. Se sugiere el uso de la dexmedetomidina o la clonidina para facilitar la retirada de las benzodiacepinas y el propofol y tratar sus síndromes de abstinencia.
Grado de recomendación débil. Nivel de evidencia moderada (2B).
Justificación. Se ha sugerido que la clonidina o la dexmedetomidina pueden ser útiles para el tratamiento del síndrome de abstinencia asociado a opioides. Hasta el momento no se han comunicado síndromes de abstinencia asociados a dexmedetomidina. A pesar de ello, se recomienda no suspenderla de manera brusca106-110.
C. Pacientes sin intubación traqueal ni asistencia ventilatoria
¿Cuáles son las recomendaciones para el manejo del paciente con ansiedad y combativo que ingresa a la Unidad de Cuidados Intensivos?
C1. Se recomienda el inicio de la sedación del paciente críticamente enfermo agitado sólo después de proporcionar una analgesia adecuada y tratar las causas potencialmente reversibles.
Grado de Recomendación fuerte. Nivel de Evidencia bajo (1C).
C2. Se recomienda establecer y redefinir periódicamente el objetivo de la sedación para cada paciente. La respuesta al tratamiento debe ser evaluada en forma continua y documentada sistemáticamente.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
C3. Se recomienda en los pacientes sin IT ni soporte ventilatorio usar fármacos con bajo riesgo de producir depresión respiratoria y efectos adversos hemodinámicos graves, tales como loracepam, haloperidol y dexmedetomidina.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. El tratamiento farmacológico en el paciente críticamente enfermo agitado sin vía aérea artificial puede llevar a una menor cooperación por parte del paciente. Además, los medicamentos por sí solos pueden ser la causa de la agitación o de la pérdida de la vía aérea, creando una emergencia aguda. Por tanto, la monitorización del nivel de sedación es más importante que la técnica seleccionada para sedar111.
En los enfermos sin IT se usan los mismos fármacos que en los pacientes intubados. La forma de administración en bolo es mejor al inicio, continuando con infusión que será pautada según la respuesta. Si el paciente está muy agitado puede ser inmovilizado mientras se le administran las medicaciones apropiadas por vía endovenosa111. Lo más importante para la sedación en el paciente crítico agitado sin VM es la presencia física de personal adecuadamente entrenado en el manejo de la vía aérea111.
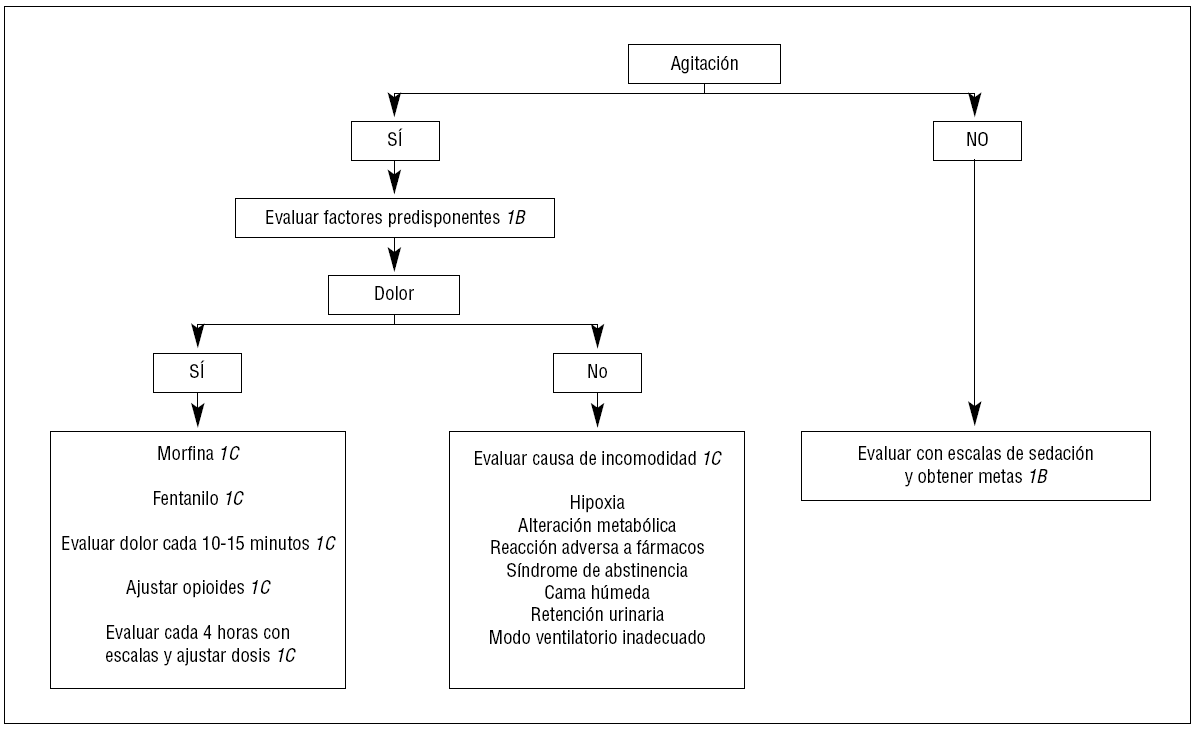
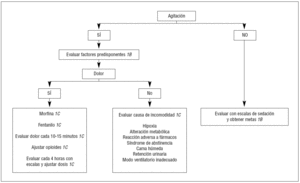
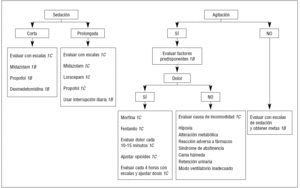
La elección apropiada de los medicamentos sedantes es a menudo difícil, y depende de las necesidades individuales. Si se requiere un rápido despertar, como en el paciente neurológico, el propofol es el fármaco recomendado. El loracepam es considerado el fármaco de elección para la sedación prolongada. El haloperidol es el fármaco preferido en el delirio. Las dosis de medicamentos requeridos para la adecuada sedación también varían en el paciente crítico dependiendo de la comorbilidad, de la interacción del sedante con otros fármacos y de la respuesta al tratamiento3 (fig. 2).
Figura 2. Algoritmo para la sedación y analgesia de los pacientes sin intubación traqueal.
¿Se deben utilizar elementos para la inmovilización de pacientes? ¿Cuándo?
C4. Se recomienda el uso de sujeción sólo en situaciones clínicas apropiadas, y no como un procedimiento de rutina. Cuando la sujeción sea usada, debe ser claro su beneficio.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
C5. Se recomienda que la elección de la terapia de sujeción sea la menos invasiva y capaz de optimizar la seguridad del paciente, su comodidad y su dignidad.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
C6. Se recomienda el registro en la historia clínica del uso racional de la sujeción. No debe utilizarse más de 24 horas. Su uso por más tiempo requiere nuevas órdenes escritas.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
C7. Se sugiere reevaluar la posibilidad de retirar la sujeción cada 8 horas.
Grado de recomendación débil. Nivel de evidencia bajo (2C).
C8. Se recomienda el uso de los medicamentos analgésicos, sedantes y neurolépticos para el tratamiento del dolor, la ansiedad o los trastornos psiquiátricos del paciente en la UCI, ya que pueden disminuir la necesidad de sujeción. Esos medicamentos no se deben administrar en dosis excesivas como «método de sujeción química».
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
C9. Se recomienda evaluar el desarrollo de complicaciones de la sujeción, al menos, cada 4 horas.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. Las sujeciones son usadas en la UCI para mantener los tratamientos que requieren técnicas invasivas cuando los pacientes no pueden entender su necesidad112.
El objetivo principal de la inmovilización de los pacientes es evitar la retirada, de forma deliberada o accidental, de los dispositivos médicos como tubos endotraqueales, sondas nasogástricas, catéteres venosos, catéteres arteriales, tubos de drenaje y sondas urinarias, así como impedir la lesión involuntaria al personal de salud debido a la alteración del estado cognoscitivo112,113. También puede ser necesaria para limitar los movimientos del paciente cuando éstos estén contraindicados; por ejemplo, en una fractura espinal, para facilitar la realización de procedimientos en los que el paciente no puede colaborar, y finalmente en pacientes psiquiátricos114. El método usado más frecuentemente es limitar el movimiento de los miembros superiores mediante la fijación a nivel de las muñecas (87%)113.
La inmovilización debe ser usada sólo cuando las medidas alternativas han sido infructuosas o no puedan ser empleadas sin poner en riesgo al paciente. Entre estas medidas alternativas no farmacológicas está la limitación del ruido, evitar despertar innecesariamente al paciente, y la colaboración familiar. Si lo anterior falla, la inmovilización será necesaria.
A la hora de prescribir la sujeción del paciente hay que considerar el potencial conflicto entre la percepción del equipo médico-enfermera y el mejor interés del paciente. Por un lado, hay que valorar la necesidad de proteger al enfermo de sus acciones involuntarias y tener en cuenta que la inmovilización puede agravar los síntomas de delirio y puede producir lesiones. Por otro lado, hay que proteger al equipo que atiende al enfermo de la agresión involuntaria por parte de un paciente agitado.
La sujeción se debe usar el menor tiempo posible y su indicación debe quedar escrita en la historia clínica. Según las normas de la JCAHO115, una vez que las alternativas a la sujeción han fracasado y se da la orden de sujetar al paciente, es necesario notificarlo al médico, explicando el motivo de la misma.
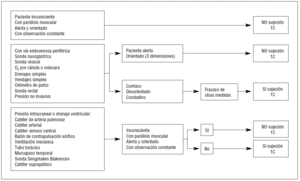
En la realidad, es el personal de enfermería el que toma la decisión de usar la inmovilización de los pacientes. Cada institución debe desarrollar internamente un programa para asegurar la calidad de la atención, en concordancia con los principios y políticas para un adecuado uso de las inmovilizaciones físicas113 (fig. 3).
Figura 3. Necesidades de sujeción relacionadas con el tipo de pacientes y el uso de dispositivos para monitorización y/o tratamiento.
D. Paciente con ventilación mecánica
¿Hay beneficios fisiológicos al utilizar sedación y analgesia durante la ventilación mecánica?
D1. Se recomienda el uso rutinario de los analgésicos y sedantes en forma combinada (sedo-analgesia), en los pacientes ventilados mecánicamente con IT.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. La lucha del paciente con el respirador genera numerosas complicaciones que pueden agravar la situación de los pacientes críticos y que, por tanto, deben ser evitadas. Entre ellas: acidosis respiratoria secundaria a hipoventilación y aumento de la producción de CO2; hipocapnia por hiperventilación; hipoxemia por asincronía entre el paciente y el ventilador; aumento de la presión intratorácica con disminución del retorno venoso, del volumen minuto cardíaco y de la presión arterial; aumento del consumo de O2 por el aumento de la actividad de los músculos esqueléticos y respiratorio3,116.
Es frecuente que el uso de la sedación y la analgesia esté indicado en pacientes muy graves, que requieren al mismo tiempo otras medicaciones o tratamientos considerados prioritarios. La indicación de sedación y analgesia se realiza de manera empírica, con una elección del fármaco y una dosificación frecuentemente inadecuada117.
No todos los pacientes ventilados requerirán de todos o algunos de estos medicamentos, como es el caso de los pacientes neuromusculares (por ejemplo: síndrome de Guillain-Barré), los cuales necesitarán una sedación diurna leve y una nocturna necesaria para asegurar el sueño. Un paciente con SDRA grave necesitará probablemente niveles máximos de analgesia, sedación y, a veces, relajación muscular118-120.
La analgesia implica ausencia de sensibilidad al dolor o a los estímulos agresivos, como, por ejemplo, la presencia de un tubo endotraqueal o las maniobras de aspiración de secreciones. Es muy frecuente que en la VM se utilicen fármacos sedantes, que "duermen" al paciente pero que no lo protegen del dolor ni de las reacciones sistémicas que éste provoca, como son la taquicardia, el aumento del consumo de oxígeno miocárdico, etc. Si tras la administración de analgésicos, los signos fisiológicos alterados desaparecen, se confirma la idea del dolor como causa de esas alteraciones3,121,122.
La sedación en el paciente crítico se indica como tratamiento básico de la ansiedad y la agitación. Estas dos sensaciones, ligadas a la VM, hacen que la indicación de sedación en dichos pacientes sea inevitable, al menos en los primeros períodos3,116. Existen diferencias en la modalidad del uso de los agentes sedantes, en situaciones agudas o de corta duración, y la sedación prolongada que acompaña a la VM. Estas diferencias radican no sólo en el agente a utilizar, sino en el modo de administración.
¿Cuáles son las recomendaciones para el manejo de la sedación y la analgesia en el paciente con ventilación mecánica?
D2. Se recomienda la utilización de una escala para la evaluación del dolor y la profundidad de la sedación en el paciente con VM.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. Es importante evaluar de forma reproducible si la analgesia buscada con el tratamiento se ha logrado satisfactoriamente. Como el dolor es predominantemente subjetivo, se tratará, si el estado del paciente lo permite, de obtener su opinión. Dado que estamos considerando a los pacientes ventilados y, por supuesto, con IT, se puede usar una escala gráfica del dolor (Escala Visual Analógica), fácilmente comprensible, que tenga, por ejemplo, una línea no dolor en uno de sus extremos y dolor máximo en el otro. En el caso de los pacientes sedados, en los que especialmente se tiende a infrautilizar la analgesia, es importante evaluar los equivalentes somáticos y fisiológicos del dolor. Entre los primeros, la expresión facial, los movimientos y la postura pueden ser claros indicadores de dolor. Entre los signos fisiológicos, la taquicardia, la hipertensión, la taquipnea, la desadaptación al ventilador, obligarán a considerar la administración de analgésicos, si no se estaban administrando, o a aumentar su dosis3,121,122.
Otro problema es la dificultad en la evaluación de la profundidad de la sedación. El uso de escalas para la evaluación de la profundidad de la sedación durante la VM está recomendado en la mayor parte de los consensos realizados sobre el tema. El uso de las escalas de sedación es parte fundamental de los protocolos de adaptación del paciente con VM121-123 (tabla 3).
D3. Se recomienda no usar sedación profunda (escala de Ramsay superior a 4) rutinariamente en los pacientes con VM.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. Los niveles de sedación serán diferentes para cada tipo de paciente. Los niveles de sedación adecuados para los pacientes ventilados estarían entre los niveles 2 y 4 de la escala de Ramsay13 (tabla 3). En los pacientes con VM por situaciones respiratorias complejas, por ejemplo: EPOC reagudizada, asma grave, SDRA, se recomiendan niveles 3 o 4, que además producirían amnesia del período de sedación. Debe recordarse que la sedación profunda de nivel 5 o 6 de la escala propuesta podría ser útil únicamente en la sedación que forma parte del tratamiento de la hipertensión endocraneal o en situaciones como el tétanos o la hipertermia maligna124,125.
D4. Se recomiendan los opioides como analgésicos de elección en el paciente ventilado, siendo de primera línea el fentanilo y la morfina.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. Los efectos secundarios más importantes de los opiáceos, que se consideran los agentes de elección para la analgesia en el paciente crítico, son depresión respiratoria, hipotensión arterial, retención gástrica e íleo. A pesar de esos efectos adversos, una correcta analgesia es un objetivo primario en el paciente crítico con VM3,121,122.
La morfina, ya sea como sulfato o clorhidrato, constituye el agente analgésico de elección para los pacientes ventilados. Sus ventajas son su potencia analgésica, el bajo coste y el efecto euforizante. La morfina debe administrarse por vía endovenosa, comenzando con una dosis de carga y luego con una infusión venosa continua. La dosis de carga recomendada es de 0,05 mg/kg administrada en 5 a 15 minutos. La mayoría de los adultos requieren una infusión continua que oscila desde 2-3 mg por hora, hasta 4 a 6 mg por hora en algunos pacientes. Es frecuente que, durante la infusión continua de morfina, se requieran uno o más bolos con las mismas dosis que la carga inicial para lograr un efecto analgésico adecuado. En el caso de optar por un esquema de administración en bolos, éste debería programarse en dosis repetidas, cada tres horas, tratando de graduar las dosis sobre la base de la respuesta terapéutica3.
El fentanilo es el agente analgésico de elección para los pacientes ventilados con inestabilidad hemodinámica o para los pacientes que manifiesten síntomas de liberación histamínica o alergia con el uso de la morfina. No causa liberación de histamina, hecho que puede explicar su menor efecto sobre la presión arterial y el músculo liso bronquial. Tiene una vida media relativamente corta (de 30 a 60 minutos) debido a una rápida distribución. Sin embargo, su administración prolongada lleva a su acumulación en los compartimentos periféricos y al aumento de su vida media (vida media contextual) hasta 16 horas. Debe administrarse en infusión continua de 1 a 2 µg/kg por hora, tras una o más dosis de carga de 1 a 2 µg/kg. El uso rutinario no es recomendable en todos los pacientes, debido a que su efecto analgésico es similar al de la morfina, tiende a acumularse por la prolongación de su vida media y su costo suele ser mayor3.
D5. Se recomienda no utilizar el remifentanilo como potencial analgésico de elección frente a los opioides clásicos (morfina, fentanilo) en la analgesia prolongada de la VM.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. El remifentanilo es un opioide sintético que, por ser metabolizado rápidamente por esterasas plasmáticas, prácticamente no se acumula. Tampoco lo hace en pacientes con insuficiencia renal o hepática. Estas propiedades hacen que la recuperación de su efecto se produzca en pocos minutos, aún después de infusiones prolongadas. Dependiendo de la dosis, produce efectos depresores centrales como otros opioides. Se precisan ensayos clínicos controlados para valorar su eficacia en la sedación prolongada. Puede utilizarse en el proceso de destete del ventilador126-128.
D6. Se recomienda no usar en el paciente crítico meperidina, nalbufina, buprenorfina y AINE.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. La meperidina tiene un metabolito activo, la normeperidina, que puede acumularse y producir excitación del SNC y convulsiones, especialmente en los pacientes con daño neurológico agudo3.
La nalbufina y la buprenorfina se prescriben habitualmente para calmar el dolor leve o moderado en el post-operatorio inmediato. Debe recordarse que pueden revertir el efecto de los otros opiáceos por interacción a nivel de los receptores. Pueden usarse como opción cuando estén contraindicados los opiáceos tradicionales3.
Los AINE no tienen ninguna ventaja en su efecto analgésico sobre los opiáceos y tienen efectos secundarios potenciales, como hemorragia gastrointestinal, inhibición plaquetaria y desarrollo de insuficiencia renal o hepática3.
D7. Se recomiendan midazolam, propofol o loracepam como sedantes de elección en pacientes con VM que no requieren un despertar inmediato.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
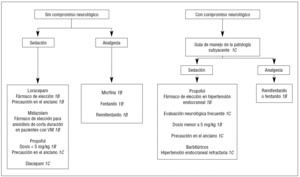
Justificación. Existen diferencias en la modalidad del uso de los agentes sedantes en situaciones agudas o de corta duración, y en la sedación prolongada que acompaña a la VM (fig. 4). Estas diferencias radican no sólo en el agente a utilizar, sino en el modo de administración.
Figura 4. Algoritmo para la sedación y analgesia en los pacientes con intubación traqueal.
Todas las benzodiacepinas parenterales causan amnesia anterógrada y debemos recordar que no tienen actividad analgésica. Aunque el prototipo del sedante intravenoso es el diacepam, ya no se recomienda porque: a) causa con frecuencia dolor y tromboflebitis cuando se administra por una vena periférica; b) la administración en forma de bolos puede llevar a una sedación excesiva; c) la administración en infusión intravenosa continua aumenta su vida media, llegando a ser hasta de siete días en algunos pacientes; d) requiere dilución en un volumen grande, lo que implicaría el riesgo de sobrecarga hídrica en el uso prolongado. Sin embargo, en algunos centros se utiliza por su bajo coste y por su rápido mecanismo de acción para maniobras cortas (cardioversión eléctrica, IT), indicándose un bolo único3. El midazolam y el propofol son los agentes de elección para la sedación de corta duración, como la que es necesaria para realizar maniobras de la IT en el comienzo de la VM.
La dosis habitual de midazolam para lograr una sedación efectiva durante las maniobras de la IT u otros procedimientos de corta duración es de 0,2 mg/kg, que puede repetirse en bolos de 0,07 mg/kg hasta lograr el nivel de sedación deseado3.
El propofol es un agente anestésico intravenoso que cuando se usa en dosis sub-anestésicas tiene propiedades sedantes, hipnóticas, y la capacidad de generar cierto grado de amnesia anterógrada. El propofol y el midazolam han demostrado poseer el mismo efecto sedante en estudios comparativos3,129.
El comienzo de la acción del propofol es rápido tras la administración de un bolo intravenoso (1 a 2 minutos) y su efecto es breve (10 a 15 minutos) dada su rápida entrada en el SNC. Cuando se usa en forma prolongada sólo debe administrarse por infusión continua con la precaución de usar una vena central y no periférica. También el propofol alarga significativamente su vida media con la administración por períodos prolongados, debido a la acumulación en los depósitos lipídicos, llegando a ser hasta de 300 a 700 minutos129,130.
Para lograr una sedación rápida, como en el caso de una IT, se utiliza la administración en bolo de 2 a 2,5 mg/kg. Si se quiere mantener al paciente sedado, en el caso de proseguir con VM, se deberá continuar con una infusión continua a un ritmo inicial de 0,5 mg/kg por hora, que se aumentará 0,5 mg/kg cada 5 a 10 minutos de acuerdo con la respuesta clínica. Una dosis habitual de mantenimiento oscila entre 0,5 y 3 mg/kg por hora. La administración en bolo de propofol causa habitualmente un descenso de la presión arterial, que puede ser de hasta el 30% de la presión basal131,132.
El loracepam es uno de los fármacos apropiados para la sedación prolongada en el paciente ventilado. Es una benzodiacepina de acción intermedia que, por ser menos lipofílica que otros agentes del grupo, tiene menor acumulación periférica. El loracepam, en comparación con el midazolam, tiene una vida media más larga y una capacidad equivalente de provocar amnesia anterógrada. Dada su vida media, el fármaco es apto para la administración en bolos intermitentes, aunque puede usarse por infusión continua. Debido a que el loracepam tiene un tiempo de latencia mayor que otras benzodiacepinas para el comienzo de su acción farmacológica, se aconseja comenzar con una dosis de diacepam o midazolam para inducir una rápida sedación. La dosis de loracepam aconsejada como bolo inicial o como dosis de «refuerzo» es de 0,05 mg/ kg, que deberá repetirse cada 2 a 4 horas según se precise. En la sedación prolongada algunos autores aconsejan la administración en infusión continua de loracepam en dosis de 0,025 a 0,05 mg/kg por hora. Estas dosis suelen ser insuficientes y llegar a duplicarse o triplicarse en algunos pacientes. Desafortunadamente, esta forma farmacéutica del loracepam no se encuentra disponible en todos los países3.
D8. Se sugiere utilizar un sedante de vida media más corta, como la dexmedetomidina, para disminuir el tiempo de VM.
Grado de recomendación débil. Nivel de evidencia moderado (2B).
D9. Se recomienda la dexmedetomidina como agente útil para la sedación y la analgesia postoperatoria de los pacientes que requieren VM por tiempos menores a 24 horas.
Grado de recomendación fuerte. Nivel de evidencia moderado (1C).
Justificación. La dexmedetomidina es un agonista α con una afinidad mayor por los receptores α2 que por los α1. Al inhibir los receptores postsinápticos produce, además de la reducción de la presión arterial y la frecuencia cardíaca, un claro efecto ansiolítico y sedante. Por su efecto a nivel de los receptores espinales, produce, además, un efecto analgésico. La administración inicial de carga en los pacientes ventilados es de 1 µg/kg en 10 minutos, seguida por una infusión de mantenimiento de 0,2 a 0,7 µg/kg por hora. La dosis de mantenimiento debe ser aumentada frecuentemente cuando se usa la dexmedetomidina en forma prolongada. El bolo de carga puede ocasionar bradicardia acompañada de hipotensión, en ocasiones sostenida, lo que suele ser más frecuente en pacientes hipovolémicos y ancianos.
Este medicamento no produce depresión respiratoria, ni alteración del intercambio gaseoso, y puede administrarse con seguridad en pacientes con insuficiencia renal. Tampoco produce alteraciones en la función adrenocortical, ni inflamatoria. Debido a las propiedades mencionadas algunos autores eligen este fármaco como el sedante más adecuado para el proceso de destete de la VM. Las dosis deben ser reducidas en pacientes con insuficiencia hepática13,25,29,133.
D10. Se recomienda no usar el etomidato en la sedo-analgesia del paciente con VM.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. El etomidato por su capacidad de provocar insuficiencia suprarrenal debería contraindicarse en el paciente crítico134.
D11. Se recomienda la interrupción diaria de la infusión de sedantes y analgésicos con el fin de disminuir la dosis total administrada.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
D12. Se recomienda la interrupción diaria de la sedo-analgesia con el fin de disminuir la aparición de complicaciones y el tiempo de VM.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. Kress et al135, en un ensayo clínico con 128 enfermos tratados con el mismo esquema de sedo-analgesia, midazolam o propofol, más morfina, para mantener unos valores de la escala de Ramsay de 3 o 4, compararon el efecto de interrumpir diariamente la sedo-analgesia a partir de las 48 horas de su inicio (grupo experimental) con la interrupción de la sedo-analgesia según juicio del médico (grupo control). La duración media de la VM en el grupo experimental fue de 4,9 días y en el grupo control de 7,3 días; la estancia en la UCI fue de 6,4 y 9,9 días, respectivamente. La incidencia de complicaciones; por ejemplo, la retirada accidental del tubo endotraqueal, fue del 4 y 7%, respectivamente. La disminución en la dosis total de sedantes y morfina sólo se observó en los enfermos tratados con midazolam (40% menos dosis en el grupo experimental) y no en los tratados con propofol.
Resultados similares se han repetido en un estudio retrospectivo, en el que también se observó una menor incidencia de neumonías, sinusitis, bacteriemia y trombosis venosa profunda en los pacientes manejados con la interrupción diaria de la sedo-analgesia135,136.
La suspensión diaria de la sedo-analgesia no debe hacerse de rutina en los pacientes con hipertensión intracraneal y con inestabilidad hemodinámica, situaciones que deben evaluarse individualmente135,136.
Si el paciente está desadaptado del ventilador, tiene ya una dosis máxima de morfina y un nivel 4 de la escala de Ramsay, se pueden usar relajantes neuromusculares. No se debe progresar a grados más altos de sedación para la adaptación al ventilador. En los pacientes que estén recibiendo una infusión de relajantes musculares, deberá esperarse a la desaparición de sus efectos antes de decidir la suspensión diaria de la sedo-analgesia. Si pasado el plazo que se considere suficiente para la pérdida del efecto paralizante, el paciente no presenta desadaptación del ventilador, se procederá a la suspensión del midazolam como en el resto de los pacientes135,136.
D13. Se sugiere no utilizar el índice «biespectral» para monitorizar la profundidad de la sedo-analgesia en el paciente crítico con VM.
Grado de recomendación débil. Nivel de evidencia bajo (2C).
Justificación. En los últimos años se ha desarrollado un tipo especial de registro encefalográfico del que se genera un índice llamado «biespectral», con el objetivo de monitorizar la profundidad de la sedación. Se ha utilizado en anestesia, pero su uso no está validado en la sedación prolongada de la VM. Algunos autores han comunicado una buena relación de los niveles de la sedación en la VM indicados por el índice «biespectral» con los obtenidos usando la escala de Ramsay137,138.
D14. Se recomienda valorar la disminución de la dosis de sedantes y analgésicos en los pacientes con VM tras practicarles traqueostomía.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. Cuando la VM se prolonga el paciente no debe continuar con el tubo endotraqueal. No es el propósito de este documento discutir cuál es el momento para realizar la traqueostomía, ni cuál es el mejor método para realizarla. La ausencia de tubo a través de la glotis disminuye sensiblemente el dolor del paciente. Asimismo el nivel de sedación puede disminuirse en estas circunstancias, porque el paciente está más estable tanto desde el punto de vista hemodinámico como neurológico y respiratorio. Nieszkowska et al139 encontraron en un estudio observacional retrospectivo de 72 enfermos ventilados mecánicamente que tras la traqueostomía disminuyeron las necesidades de sedantes y analgésicos.
D15. Se sugiere no aumentar rutinariamente las dosis de sedantes, cuando se acompañan de una infusión de morfina, en los pacientes tratados con hipercapnia permisiva.
Grado de recomendación débil. Nivel de evidencia bajo (2C).
Justificación. La hipercapnia permisiva es una técnica de VM que puede utilizarse en dos tipos de situaciones. La primera es la de los pacientes con obstrucción severa del flujo aéreo (asma, EPOC) que requiere una baja frecuencia respiratoria y bajos volúmenes corrientes para evitar las altas presiones en las vías aéreas y el atrapamiento aéreo. La segunda es la de los pacientes con SDRA grave que desarrollan hipercapnia al ser ventilados con una estrategia protectora140. Estas situaciones precisan frecuentemente el uso de relajantes musculares. Vianayak et al141 observaron en un estudio retrospectivo de 124 enfermos ventilados mecánicamente, que durante los 3 primeros días los pacientes con hipercapnia permisiva tratados con midazolam (n = 13) no precisaron más dosis que los que no tuvieron hipercapnia permisiva (n = 51). Sin embargo, los pacientes con hipercapnia permisiva tratados con propofol (n = 10) sí precisaron una mayor dosis que los que no tuvieron hipercapnia (n = 50).
Otros estudios han mostrado resultados similares142,143.
D16. En los pacientes con trauma cráneo-encefálico o post neurocirugía, se sugiere la sedación basada en analgesia con remifentanilo para disminuir el tiempo de ventilación mecánica y la dosis concomitante de sedantes.
Grado de recomendación débil. Nivel de evidencia moderado (2B).
Justificación. La estrategia de sedación basada en la analgesia con remifentanilo, que es un opioide de vida media ultracorta que se metaboliza íntegramente en el plasma, ha sido propuesta por varios autores, asociada a dosis bajas de midazolam o propofol. Según Breen et al acorta significativamente el tiempo de la VM. Esto se justificaría por la rapidez del despertar al suspender la infusión de remifentanilo y por la baja dosis de sedantes adyuvantes utilizados127.
¿Cuáles son las recomendaciones para pacientes con condiciones especiales como paciente con EPOC, SDRA, asma, inestabilidad hemodinámica o fracaso multiorgánico?
D17. Se recomienda el fentanilo como analgésico de elección en los pacientes con inestabilidad hemodinámica, asma bronquial o EPOC.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. El fentanilo no causa liberación de histamina, hecho que puede explicar su menor efecto sobre la presión arterial y el músculo liso bronquial3.
E. Pacientes en proceso de retirada del tubo endotraqueal y de la ventilación mecánica
¿Cuál debe ser la aproximación farmacológica para el paciente que está en proceso de retirada de la ventilación mecánica y del tubo oro/naso traqueal?
E1. Se recomienda que todo paciente con VM tenga prescrito un protocolo de retirada del ventilador, conocido y seguido por todo el equipo implicado en el manejo del paciente. Igualmente, se debe reevaluar el plan en la medida en que se modifica el estado del paciente.
Grado de recomendación fuerte. Nivel de evidencia alto (1A).
Justificación. El paciente en proceso de retirada de la VM y del tubo traqueal no debe estar sedado, ni relajado. En este momento, la prioridad número uno es aplicar medidas no farmacológicas para aliviar la ansiedad: explicar al paciente claramente la situación, la colaboración que se espera de él y los pasos a seguir. Igualmente, reducir al mínimo los ruidos, la intensidad de la iluminación y permitir un horario de visitas flexible, son medidas que ayudan al paciente en esta fase. Sin embargo, cuando el paciente se agita, presenta delirio, se torna ansioso o desarrolla un síndrome de abstinencia, es útil mantener un nivel de sedación mínimo, con fármacos de corta vida media144-147.
E2. Se recomienda contar con un protocolo definido de monitorización y ajuste de las dosis de sedación y analgesia, con suspensión diaria, cuando se prevea la retirada del ventilador, una vez esté resuelta la causa que llevó al paciente a la VM.
Grado de recomendación fuerte. Nivel de evidencia alto (1A).
Justificación. Durante el proceso de retirada de la VM y de la IT es necesario que el paciente esté lúcido y alerta. Si es preciso, se administrarán fármacos para controlar el dolor y la agitación psicomotora148-150.
La elección de los fármacos depende de factores relacionados con el paciente (comorbilidades, causa o indicación para VM, tiempo de VM), con la farmacología de los medicamentos y con sus efectos adversos y costes145.
El dolor puede ser una de las causas del fracaso de la retirada. Para garantizar la analgesia constante, se prefiere la infusión continua a las dosis en bolos, por permitir una titulación más efectiva, una dosis total más baja de fármacos y garantizar menos tiempo de VM. Las dosis en bolos se pueden utilizar en forma endovenosa como dosis de rescate130,151,152.
Se prefiere la morfina y la hidromorfona para el tratamiento intermitente, por la duración más prolongada de su efecto. En los pacientes con inestabilidad hemodinámica o insuficiencia renal se recomienda fentanilo o hidromorfona148-150.
¿Cuáles son los medicamentos que podrían estar contraindicados?
E3. Se recomienda no usar midazolam o loracepam en el proceso de retirada de la VM.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. La sedación prolongada, con midazolam o loracepam, se asocia a un aumento del tiempo de permanencia en VM, tiempo de retirada de la VM y del tubo orotraqueal y estancia en la UCI, ya que pueden acumularse y prolongar la sedación130,151-154.
¿Hay algunos medicamentos que podrían estar indicados?
E4. Se recomienda el propofol en pacientes posquirúrgicos.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. El propofol es el sedante de elección cuando se requiere que el paciente despierte rápidamente, debido al menor tiempo requerido para despertar. Esta diferencia es más acusada cuando el objetivo terapéutico es 4 o 5 en la escala de Ramsay. Además, el tiempo de despertar es más predecible en los que reciben propofol que en los que reciben midazolam130,151-153.
El uso secuencial del midazolam y del propofol reduce la incidencia de la agitación después de la sedación y mantiene la calidad de la sedación.
E5. Se sugiere el remifentanilo en dosis bajas en infusión continua para sedar a los pacientes con VM.
Grado de recomendación débil. Nivel de evidencia bajo (2C).
Justificación. El remifentanilo puede ser más eficaz que la morfina para la sedo-analgesia en la fase de retirada de la VM por su vida media más corta154,155.
E6. Se recomienda la dexmedetomidina, usada durante 24 horas, en pacientes posquirúrgicos.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
E7. Se sugiere la dexmedetomidina en pacientes en los que la retirada de VM sea difícil, y en pacientes con síndrome de abstinencia.
Grado de recomendación débil. Nivel de evidencia bajo (2C).
Justificación. La dexmedetomidina es un sedante eficaz y seguro para la mayoría de los pacientes postquirúrgicos en la UCI. Las ventajas de la dexmedetomidina son: el efecto agonista alfa, la sedación consciente, la reducción de las necesidades de opioides y la estabilidad respiratoria. No obstante, se asocia a hipotensión y a bradicardia, que generalmente se resuelven espontáneamente o con una mínima intervención: sobrecarga de volumen y, a veces, atropina y dosis bajas de fármacos vasoactivos153,156-158.
F. Poblaciones especiales: pacientes traumatizados, ancianos y embarazadas
¿Qué consideraciones especiales deben tenerse en cuenta y cuáles son las recomendaciones farmacológicas para el manejo de la sedación y la analgesia en cada uno de estos pacientes?
Pacientes traumatizados
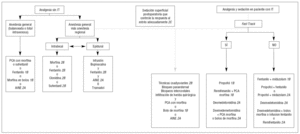
F1. Se recomienda el loracepam como sedante en pacientes traumatizados (fig. 5).
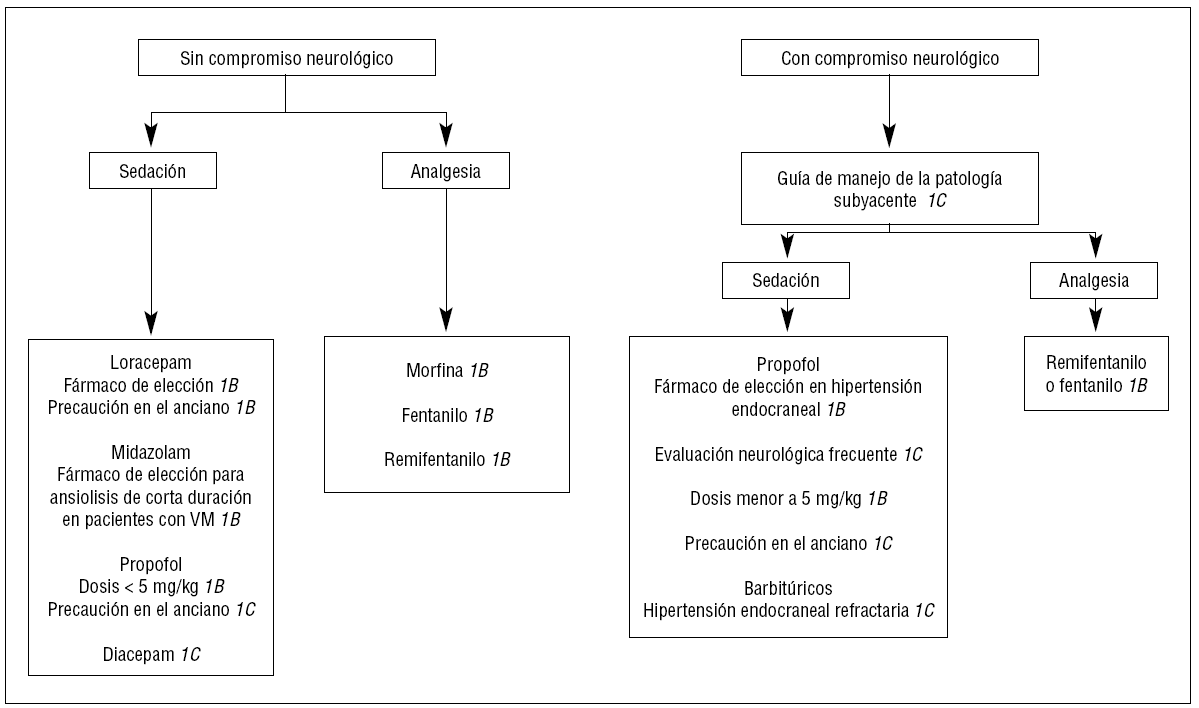
Figura 5. Algoritmo de sedación y analgesia en los pacientes traumatizados con o sin compromiso neurológico. VM: ventilación mecánica.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. Se ha comparado la efectividad de la sedación con loracepam, midazolam y propofol en el paciente traumatizado. Se ha encontrado que no existen diferencias significativas. Se recomienda el uso del primero como agente de elección, basándonos en su bajo coste de utilización, aunque se ha observado que existe una tendencia a administrar dosis excesivas159.
F2. Se recomienda el propofol para la sedación de pacientes traumatizados que requieren evaluaciones neurológicas frecuentes.
Grado de recomendación fuerte. Nivel de evidencia débil (1C).
Justificación. Las propiedades farmacocinéticas del propofol, en las que se observa una recuperación rápida del estado de conciencia del paciente en 10-15 minutos tras interrumpir su infusión, han sido mencionadas en varias publicaciones160,161.
Esta característica es de gran utilidad en pacientes que requieren de evaluaciones frecuentes de la función del SNC.
F3. Se recomienda usar el propofol en dosis menores de 5 mg/kg por hora, para evitar el «síndrome de infusión del propofol».
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. El «síndrome de infusión de propofol» se define como la presencia de insuficiencia miocárdica, acidosis metabólica y rabdomiolisis. Cremer et al comunicaron que los síntomas aparecieron después de 24 a 48 horas de iniciada la infusión. La mortalidad atribuida a este síndrome en los pacientes que recibieron propofol para el control de la hipertensión intracraneal fue del 10%. La probabilidad de aparición de este síndrome aumentó 1,93 por cada mg/kg de aumento sobre la dosis promedio de 5 mg/kg hora (equivalente a 83 µg/kg minuto). Ninguno de los pacientes que recibieron menos de esta dosis promedio desarrolló el síndrome162.
La recomendación subraya el evitar dosis de propofol mayores de 5 mg/kg por hora hasta que existan más datos al respecto.
F4. Se recomienda usar el diacepam, en pacientes traumatizados sin compromiso neurológico.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. El diacepam proporciona estabilidad en el nivel de sedación de los pacientes traumatizados sin compromiso neurológico. A pesar de su larga vida media, el uso de una escala de sedación previene la sedación excesiva, y disminuye los requerimientos de loracepam en los casos de agitación asociada a niveles de sedación menores mantenidos con fármacos de menor vida media.
Pacientes ancianos
F5. Se recomienda tener precaución con la utilización de propofol y midazolam.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. Los tiempos de recuperación inicial en pacientes sedados con propofol son indistintos en personas jóvenes (20 a 50 años) y ancianos (65 a 85 años); sin embargo, la recuperación total psicomotora es más lenta en el segundo grupo, y puede tardar hasta 120 minutos en pacientes sedados con índices de monitorización «biespectral» de 60 a 70.
Los tiempos de recuperación de la estabilidad postural en ancianos respecto a personas jóvenes son más lentos, pudiendo tardar hasta 120 minutos en recuperarse163.
El tiempo de despertar es más predecible en los enfermos que reciben propofol que en los que reciben midazolam130,151-153.
F6. Se recomienda tener precaución con la utilización de loracepam.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. La probabilidad de desarrollar delirio en los enfermos ancianos aumenta un 2% por año después de los 65 años, y se asocia un incremento de la morbi-mortalidad y de los costes de atención. Otros factores asociados independientemente a la aparición de delirio, en este grupo, son el valor de la escala de APACHE II y la utilización de loracepam164.
Pacientes embarazadas
F7. Para evaluar la administración de analgésicos y sedantes durante el embarazo, se recomienda seguir la clasificación de la FDA de EE. UU.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. En el manejo de la analgesia y la sedación de las pacientes embarazadas, deben tenerse en cuenta dos factores: a) la capacidad del fármaco de producir lesiones embrionarias y fetales y b) los posibles efectos fisiológicos reversibles del fármaco en el recién nacido (sedación, depresión respiratoria, síndrome de abstinencia) cuando se utiliza en situaciones periparto.
Las categorías propuestas por la FDA para el uso de medicamentos en el embarazo165 figuran en la tabla 7.
Los riesgos potenciales de la sedo-analgesia en las embarazadas son los siguientes:
1. Propofol: categoría B. Produce efectos fetales reversibles. Puede producir depresión del SNC neonatal en el período de periparto166. Puede utilizarse en dosis sub-hipnóticas para el control de la emesis asociada a cesáreas.
Durante el embarazo no se modifica ni la respuesta, ni el metabolismo del propofol167-169.
2. Fentanilo y remifentanilo: categoría C. Pueden producir depresión del SNC neonatal y deben usarse con precaución. El uso crónico en el embarazo se ha visto asociado a un síndrome de abstinencia en el neonato166.
3. Benzodiacepinas: categoría D. Producen efectos fetales reversibles, depresión del SNC neonatal e hipotonía166. Se ha observado una posible asociación estadísticamente significativa entre el uso de loracepam y malformaciones del tubo digestivo. En particular, durante la embriogénesis se ha asociado a atresia anal170,171.
4. Dexmedetomidina: categoría C. No ha sido estudiada su seguridad durante el parto. Por ello, no se recomienda su uso durante el parto, incluyendo la cesárea172.
G. Pacientes en el post-operatorio inmediato de cirugía cardiovascular
¿Hay beneficios al utilizar sedación y analgesia en el paciente en post-operatorio de cirugía cardíaca?
G1. Se recomienda que todos los pacientes en post-operatorio inmediato de cirugía cardíaca reciban analgesia y sedación adecuadas para disminuir la aparición de posibles complicaciones.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. La sedo-analgesia postoperatoria reduce la morbilidad en cirugía cardíaca. La taquicardia y la liberación de catecolaminas contribuyen a la presentación de hipertensión arterial, isquemia miocárdica y ruptura de la placa ateroesclerótica. En el momento del ingreso en la UCI, los pacientes se encuentran bajo efectos residuales de anestésicos, siendo la técnica anestésica empleada un factor importante para definir el grado de sedo-analgesia necesario.
Durante el post-operatorio inmediato, hay un lapso en el que se requiere de VM y, por lo tanto, es necesario el uso de sedo-analgesia mientras se logra la homeostasis térmica y la estabilidad hemodinámica. La sedación óptima en este período minimiza la respuesta cardiovascular a la estimulación, disminuye el tiempo necesario para despertar y, por ende, permite la retirada del tubo endotraqueal sin incrementar la incidencia de complicaciones cardiovasculares173.
Actualmente, debido al uso de sistemas de anestesia de fast-track, la elección de fármacos de acción corta permite una rápida recuperación post-anestésica174.
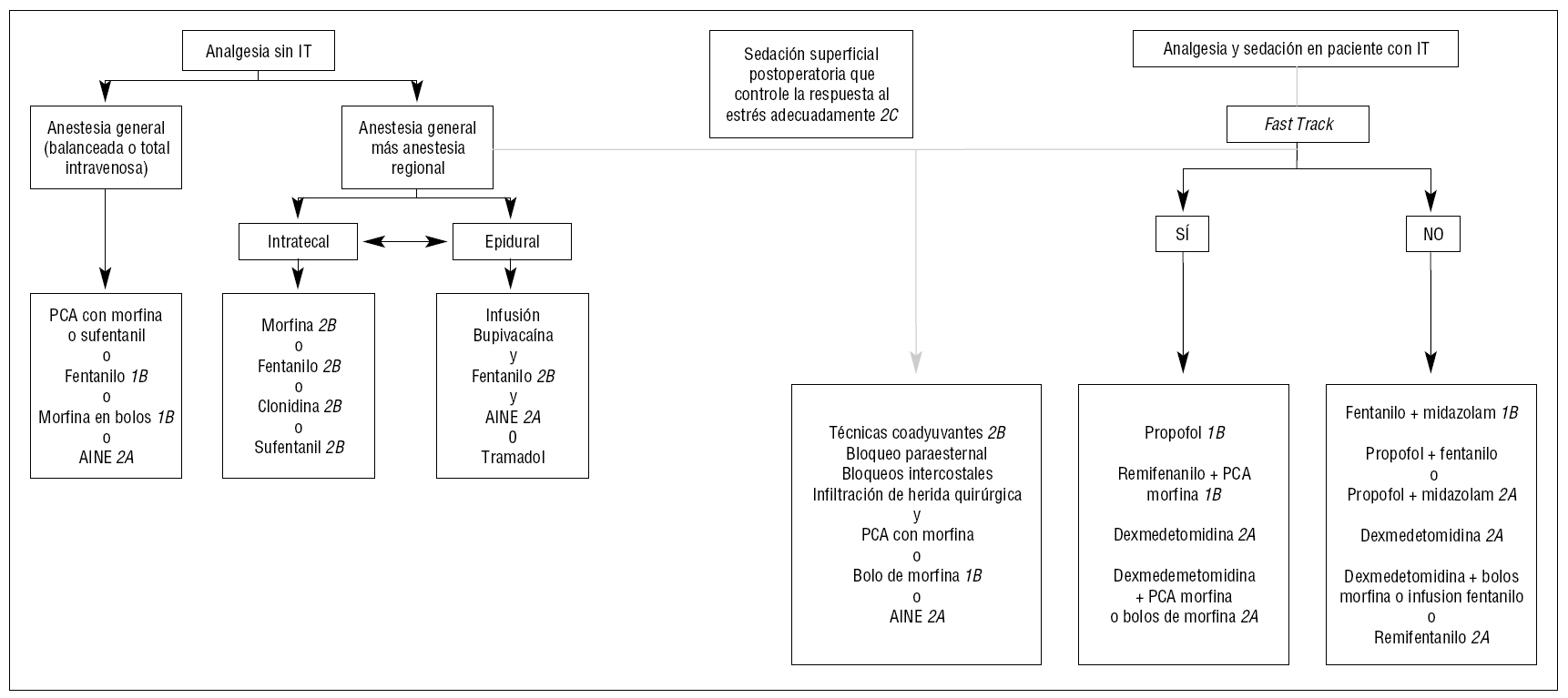
G2. Se sugiere una sedación superficial postoperatoria que controle la respuesta al estrés adecuadamente.
Grado de recomendación débil. Nivel de evidencia moderado (2B).
Justificación. Tradicionalmente se creía que los pacientes en post-operatorio de cirugía cardíaca requerían una sedación profunda para reducir la respuesta endocrina al estrés y prevenir la isquemia miocárdica173. Sin embargo, no existe diferencia estadísticamente significativa en los indicadores de la respuesta al estrés, como los niveles de catecolaminas y cortisol, entre la sedación superficial y la profunda. Por el contrario, aquellos pacientes con sedación profunda experimentan un mayor grado de isquemia miocárdica, niveles de dolor más elevados y prolongación del tiempo de asistencia ventilatoria respecto a aquellos con sedación leve175.
¿Cuáles son las recomendaciones para el manejo de la analgesia y la sedación en el paciente en post-operatorio de cirugía cardíaca?
G3. Se recomienda el uso de opiáceos y PCA en el manejo de la analgesia postoperatoria cardiovascular.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. Debido a su potencia, la analgesia con morfina o sus análogos sigue siendo el tratamiento de elección en el manejo del dolor del paciente en el post-operatorio de cirugía cardíaca, variando su forma de administración, ya sea en bolo, infusión continua o PCA.
No se han encontrado diferencias significativas cuando se compara el uso de la PCA con la analgesia suministrada por el personal de enfermería, debido a que se suele estar muy atento a la presencia de dolor en estos pacientes y a proporcionar el analgésico oportunamente176. Al comparar el uso de la PCA con la analgesia peridural, tampoco se encontraron diferencias en el nivel de sedo-analgesia alcanzado177,178.
G4. Se sugiere valorar el uso de la analgesia intratecal y peridural para el manejo del dolor post-operatorio.
Grado de recomendación débil. Nivel de evidencia moderado (2B).
Justificación. La combinación de anestesia general con anestesia regional ha mostrado una reducción del tiempo de retirada del tubo endotraqueal y un mejor control del dolor en los pacientes sometidos a cirugía cardíaca. La administración de sufentanilo, clonidina o morfina intratecales reduce la necesidad de analgesia postoperatoria y proporciona un mejor control del dolor. El uso de morfina intratecal es seguro, en comparación con los métodos de administración convencionales179-184. Sin embargo, la administración de morfina intratecal no reduce los tiempos de retirada de tubo endotraqueal en comparación con el placebo185. Por otro lado, la asociación de opiodes epi o subdurales, con los que se administran por vía endovenosa durante la cirugía, pueden producir depresión respiratoria y retardar la retirada del tubo endotraqueal186.
En los protocolos de fast-track en cirugía cardíaca la administración de dosis bajas de morfina intratecal se asocia a una disminución del consumo de morfina intravenosa en un 40% durante las primeras 24 horas posteriores a la retirada del tubo endotraqueal187. La dosis óptima de morfina intratecal que proporciona una analgesia postoperatoria significativa sin retardar el tiempo de retirada de tubo endotraqueal es de 250 µg188.
La anestesia peridural mejora la relación aporte/ demanda de oxígeno del miocardio, aumenta el flujo sanguíneo subendocárdico y reduce la hipercoagulabilidad postoperatoria; por lo que su empleo, en combinación con la anestesia general inhalada, se ha asociado a una reducción de la respuesta al estrés en los pacientes sometidos a cirugía coronaria189.
No se han comunicado hematomas secundarios al bloqueo neuroaxial. Sin embargo, el riesgo, aunque bajo, existe y debe ser considerado (1:150.000 para el bloqueo peridural y 1: 220.000 para el subdural)190.
En conjunto, por tanto, los riesgos y los beneficios del empleo de técnicas regionales de anestesia deben valorarse en cada paciente, considerando que no existe una literatura que apoye definitivamente su empleo para conseguir una retirada más rápida del tubo endotraqueal, al compararlas con la administración tradicional de opioides y AINE intravenosos.
Se ha sugerido que otras técnicas como el bloqueo paraesternal, la infiltración de la herida quirúrgica, el uso de bloqueos paravertebrales y el uso de infusiones continuas de anestésicos locales pueden ser de utilidad como analgésicos en los pacientes sometidos a cirugía cardíaca191-193.
G5. Se sugiere el uso de AINE para el manejo de dolor post-operatorio.
Grado de recomendación débil. Nivel de evidencia alto (2A).
Justificación. Los AINE permiten reducir la dosis de opioides, mantener o mejorar la analgesia y reducir los efectos secundarios indeseables de los opioides194,195.
El diclofenaco, la indometacina y el ketoprofeno han demostrado ser eficaces para el manejo del dolor post-operatorio195.
G6. Se sugiere la combinación de dosis bajas de propofol y midazolam, o la combinación de propofol y fentanilo para la sedación postoperatoria.
Grado de recomendación débil. Nivel de evidencia alto (2A).
Justificación. Actualmente se sabe que la combinación adecuada de agentes sedantes de corta acción puede reducir los requerimientos analgésicos y los efectos adversos de los opioides de larga duración175.
Existen diversos protocolos que evalúan la eficacia en la combinación de propofol con midazolam, así como de propofol y fentanilo.
La combinación de dosis bajas de propofol y midazolam ha tenido gran aceptación, ya que poseen un efecto sinérgico al actuar sobre el mismo receptor GABAA, lo que proporciona una mayor estabilidad hemodinámica que el uso de propofol como agente único174. Además, la combinación de estos fármacos ha demostrado ser una alternativa eficaz y segura en los pacientes que se encuentran en el post-operatorio de cirugía cardíaca, ya que tiene unos mínimos efectos sobre la presión arterial196.
No se ha demostrado la superioridad del propofol como agente único para la sedación en comparación con el midazolam, ya que no se asocia a una disminución significativa del tiempo de retirada del tubo endotraqueal, de la incidencia de reintubación, de la hipertensión y la hipotensión postoperatorias ni de los requerimientos197. No obstante, en la fase de retirada de la IT, cuando el paciente aún se encuentra sedado, la administración de propofol es segura y disminuye la incidencia de alteraciones hemodinámicas y de isquemia miocárdica.
No se han encontrado diferencias en la duración del período de despertar o del tiempo de sedación al comparar el uso de propofol como agente único frente a la combinación propofol-fentanilo. Sin embargo, la concentración de propofol, la tasa de infusión y la dosis total fue superior en el grupo donde se utilizó como agente único. Dentro de los parámetros hemodinámicos, la caída de la presión arterial media (superior al 20%) es mayor en el grupo de propofol como agente único que en el de propofol-fentanilo. Por lo tanto, la combinación de propofol-fentanilo es superior en términos de sedación, sobre todo para prevenir períodos de hipotensión en pacientes en post-operatorio195.
G7. Se sugiere la dexmedetomidina en los pacientes postoperados de cirugía cardiovascular, como agente único o asociado a analgésicos opiáceos.
Grado de recomendación débil. Nivel de evidencia alto (2A).
Justificación. Las características de la dexmedetomidina, ya comentadas anteriormente, le hacen un fármaco apropiado para la sedo-analgesia de corta duración. En los enfermos que se recuperan de cirugía cardíaca, la dexmedetomidina proporciona una sedo-analgesia efectiva. En un ensayo clínico realizado con 89 pacientes de cirugía coronaria prolongada, la dexmedetomidina en dosis de 1 µg/kg en dosis de carga, seguida de 0,4 µg/kg hora y propofol en dosis de 5 µg/kg hora, mostraron una eficacia similar en la sedo-analgesia28,198,199.
La prevención del temblor post-operatorio es un beneficio probable adicional de la dexmedetomidina200.
La figura 6 detalla el manejo de los pacientes en el post-operatorio de cirugía cardiovascular.
Figura 6. Algoritmo de analgesia y sedación en los pacientes de postoperatorio de cirugía cardiovascular. AINE: antiinflamatorios no esteroideos; IT: intubación traqueal; PCA: analgesia controlada por el paciente.
H. Paciente neurológico y neuroquirúrgico
¿Cuáles son las consideraciones médicas que hay que evaluar antes de iniciar algún tipo de sedación y analgesia?
H1. Se recomienda realizar una evaluación neurológica, reanimación inicial, resolver las lesiones quirúrgicas y contar con un protocolo o guía local.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. Como en otros enfermos ingresados en la UCI, en los enfermos neurocríticos la sedo-analgesia debe estar dirigida a controlar o disminuir la respuesta metabólica al estrés (taquicardia, hipertensión, aumento del catabolismo proteico, etc.), mantener la sincronización del paciente con el ventilador, disminuir el dolor, la ansiedad, y la agitación201-203.
No obstante, algunos objetivos específicos deben valorarse en el paciente neurocrítico con alteraciones del SNC, bien sea por un trauma craneal o lesiones del SNC: prevenir situaciones que produzcan aumentos de la PIC, disminuir y mantener los requerimientos metabólicos cerebrales, aumentar la captación de oxígeno, optimizando la hemodinámica sistémica y reduciendo las demandas metabólicas cerebrales de oxígeno202-205. Para ello se precisará: a) capacidad de monitorización del paciente en relación con los efectos hemodinámicos sistémicos y cerebrales (presión arterial sistémica, presión venosa central y PIC); b) capacidad de seguimiento de la sedación con escalas adecuadas, fáciles de llevar en la práctica, reproducibles y ampliamente aceptadas; c) protocolización y estandarización de los cuidados médicos.
En la sedo-analgesia de los pacientes neurocríticos debe tenerse en cuenta: a) no debe interferir con la valoración neurológica continua en las primeras horas, para poder detectar complicaciones intracraneales tratables que precisen una pronta intervención, las cuales pueden expresarse como agitación o incomodidad; b) se debe prevenir la lesión neurológica secundaria, asociada a hipoxemia e hipotensión, que deben ser corregidas sin pérdida de tiempo159,202,204.
Algunos factores deletéreos sistémicos deben ser corregidos o prevenidos antes de iniciar la sedación: la hipotensión arterial sistémica, manteniendo una tensión arterial superior a 90 mmHg, con una presión de perfusión cerebral superior a 70 mmHg; hipoxemia; fiebre o hipotermia e hiperglicemia202-204.
¿Cuáles serían los medicamentos indicados en caso de necesitar evaluaciones frecuentes del estado neurológico?
H2. Se recomienda un régimen de sedación basado en hipnóticos de acción corta como el propofol y en analgesia con opioide, como remifentanilo y fentanilo.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. El sedante ideal en el paciente neurocrítico es aquel que evite o prevenga elevaciones de la PIC, permita mantener estable hemodinámicamente al paciente y evite la sedación profunda (efecto rápido y acción corta). El agente ideal único con estas propiedades no existe, por lo que se debe utilizar una combinación de diferentes fármacos para acercarnos a este objetivo. Las benzodiacepinas siguen siendo las más utilizadas asociadas a analgésicos, donde los derivados morfínicos ocupan el primer lugar201.
El uso de hipnóticos como el propofol en combinación de un opioide como el fentanilo o el sufentanilo se considera adecuado para estos pacientes, donde la necesidad de interrupción diaria o, con mayor frecuencia, de la sedación es indispensable138,149.
El propofol, al igual que otros barbitúricos, disminuye el flujo sanguíneo cerebral y el consumo de oxígeno, de un modo proporcional a la dosis administrada hasta un 40 o 60%. Además, tiene un efecto vasoconstrictor sobre el sistema vascular cerebral. Cuando se administra en dosis suficientes para producir el coma, su actividad antiepiléptica es comparable a los barbitúricos, disminuye la PIC y, como efecto adverso, disminuye la presión de perfusión cerebral por hipotensión sistémica, en especial en pacientes hipovolémicos. Sus propiedades farmacocinéticas, por lo tanto, permiten recomendarlo como agente hipnótico ideal tanto en la inducción como en el mantenimiento de la sedación en los pacientes neurocríticos, inclusive en el tratamiento de la hipertensión endocraneal, debido a su fácil titulación y rápida reversibilidad una vez descontinuada la infusión, propiedades que permiten dar una sedación predecible. Otras propiedades potencialmente beneficiosas en pacientes con traumatismo cráneo-encefálico son la inhibición del sistema GABA y de los receptores NMDA, y el efecto antioxidante162,206.
La analgesia con opioides es la primera elección. Su efecto depresor respiratorio es suficiente para facilitar la adaptación del paciente a la VM. Deben ser utilizados para disminuir la ansiedad, el dolor y la angustia. Este grupo de fármacos, en general, no modifica en forma importante el consumo cerebral de O2.
En dosis analgésicas, los efectos hemodinámicos, respiratorios y neurológicos de las cuatro derivados (fentanilo, alfentanilo, sufentanilo y remifentanilo) son comparables. La elección entre ellos debe hacerse en función de las características farmacodinámicas.
En los pacientes con traumatismo cráneo-encefálico se ha observado que la administración de opioides puede disminuir la presión de perfusión cerebral, debido a una disminución de la presión arterial media y a un aumento de la PIC. Este efecto se ha descrito cuando se administran en bolos; no así en infusión continua. El aumento de la PIC observado es debido a la vasodilatación secundaria al mecanismo de autorregulación producida por un intento de mantener o de compensar los cambios de la hemodinámica cerebral ocurridos cuando hay una disminución de la presión arterial media207.
La morfina sigue siendo uno de los analgésicos más utilizados. Sin embargo, su utilización está limitada por su inicio de acción largo (promedio de 20 minutos), por el riesgo de acumularse en presencia de insuficiencia renal y por la liberación de histamina.
En un ensayo clínico149 de 161 enfermos con traumatismo cráneo-encefálico o tras neurocirugía, con un Glasgow Coma Score (GCS) medio de 8,4, se comparó un régimen de sedación basado en la analgesia con remifentanilo reforzado con propofol y midazolam, con un régimen de sedación basado en fármacos hipnóticos con propofol en los primeros 3 días y midazolam a partir del cuarto y quinto día, reforzado con otros analgésicos (morfina, fentanilo). Los resultados mostraron que el tiempo desde la interrupción del analgésico hasta la exploración neurológica fue 0,42 horas en los enfermos tratados con remifentanilo, 0,71 horas en los tratados con fentanilo y 0,82 horas en los tratados con morfina.
En la tabla 8 se detallan las propiedades de los medicamentos mencionados previamente.
¿Cuál sería el sedante para el paciente con hipertensión intracraneal y con ventilación mecánica?
H3. Se recomienda el uso de propofol y midazolam.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. Como se mencionó previamente, el propofol y el midazolam son igualmente efectivos en la sedación del paciente neurocrítico en función de sus efectos hemodinámicos sistémicos y cerebrales149,206.
H4. Se recomienda el tiopental sódico como una medida terapéutica reservada para los pacientes con traumatismo craneoencefálico grave con hipertensión intracraneal refractaria al tratamiento médico y donde no coexistan limitaciones hemodinámicas importantes.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. Los barbitúricos disminuyen el flujo sanguíneo cerebral y el metabolismo cerebral en una cuantía directamente proporcional a la dosis administrada, hasta lograr una abolición de la actividad cerebral. La disminución de la PIC es secundaria a su efecto sobre el flujo sanguíneo cerebral, la cual, a su vez, se produce por una reducción del metabolismo cerebral, siempre y cuando la hemodinámica cerebral y el acoplamiento al flujo sanguíneo cerebral/consumo de O2 se mantenga. Si el consumo de O2 disminuye por alteraciones isquémicas o por daño neurológico secundario, los barbitúricos aumentan el flujo sanguíneo por un mecanismo compensatorio, siempre que la presión arterial sistémica se mantenga por encima de los valores determinados para la autorregulación (presión arterial media superior a 90 mmHg). Sin embargo, es importante recordar que los barbitúricos, además de comprometer la situación hemodinámica, causan inmunosupresión y prolongación del coma tras suspenderse su administración, debido a su redistribución en los compartimientos adiposos208,209.
H5. Se recomienda no utilizar sistemáticamente la ketamina en pacientes con trauma craneal y en otras patologías neurocríticas.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. La ketamina es un antagonista no competitivo de los receptores NMDA, cuyo sitio de acción primario es la región neo-talámica cortical. La ketamina ha sido relacionada con un aumento de la presión parcial de CO2 en sangre arterial y de la PIC en pacientes sin VM. Sin embargo, recientemente se ha comunicado que en los pacientes con hipertensión endocraneal y VM controlada el uso de ketamina en infusión continua y de midazolam mantiene la hemodinámica cerebral y logra un control de la presión de perfusión cerebral comparable a los opiáceos. Algunos efectos adversos como el aumento de la frecuencia cardíaca y el mayor tiempo de recuperación neurológica al ser suspendida (relacionado con la presencia de un metabolito activo, la norketamina), la hacen no recomendada en pacientes neurocríticos cuando las evaluaciones neurológicas frecuentes sean necesarias210. En la figura 5 se resume el uso de sedantes y analgésicos en pacientes traumatizados con o sin compromiso neurológico.
I. Paciente con insuficiencia renal o hepática
¿Cuáles son las condiciones médicas a evaluar antes de iniciar algún tipo de sedación y analgesia?
I1. Se recomienda evaluar la situación hepato-renal de todo paciente que requiera sedo-analgesia en la UCI.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. La utilidad clínica de la mayoría de los hipnóticos, sedantes y analgésicos se ve afectada negativamente en los pacientes con insuficiencia hepática o renal o, en el peor de los casos, en ambas situaciones3. Estas alteraciones plantean un verdadero desafío a los clínicos que tienen que manejar dichos pacientes, balanceando constantemente la relación riesgo-beneficio de la intervención terapéutica, muchas veces sin el respaldo científico adecuado211. La insuficiencia hepática o renal produce cambios, no solamente en el aclaramiento, volumen de distribución, fracción libre o eliminación del medicamento original, sino también en la potencial acumulación de metabolitos activos, ya sean estos tóxicos o no.
En presencia de disfunción hepática, la mayoría de los medicamentos están sujetos a un aclaramiento disminuido, vida media aumentada y acumulación de metabolitos potencialmente tóxicos o con actividad metabólica, cuya repercusión clínica es poco conocida. Estudios experimentales han demostrado que en pacientes cirróticos la transmisión opiodérgica puede alterarse, aumentando la afinidad del receptor por los opioides. Además, estos pacientes tienen aumentada la sensibilidad al GABA, potenciando los efectos de las benzodiacepinas. Algunos cuadros de encefalopatía subclínica pueden precipitarse con la administración de sedantes y opioides. En pacientes con insuficiencia hepática la clasificación de Child-Pugh212,213 se utiliza como guía para la elección de fármaco y para establecer la dosis3,211,214-217 (tabla 9).
I2. Se recomienda evaluar el riesgo-beneficio del uso de la sedo-analgesia en los pacientes con insuficiencia renal crónica.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. En los pacientes con insuficiencia renal crónica, estén en diálisis o no, la predicción de los perfiles farmacocinéticos con fórmulas para calcular el FG no están bien establecidas para la mayoría de los medicamentos. La mayoría de los fármacos no han sido extensamente estudiados antes de su introducción en la práctica clínica en los enfermos críticos211,218-220. Debido a los cambios en el aclaramiento de los medicamentos y en la potencial acumulación de metabolitos activos, el clínico debe evaluar el balance riesgo-beneficio tomando en consideración otros factores de interacción farmacocinética y farmacodinámica, así como los efectos potencialmente adversos.
¿Qué medicamentos analgésicos y sedantes están contraindicados, y por qué, en este tipo de pacientes?
Insuficiencia renal
I3. Se recomienda no usar morfina en el paciente crítico con insuficiencia renal y en diálisis.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. La morfina sufre una biotransformación hepática por glucoronización a productos activos M6G y M3G, dializables que se excretan por el riñón. El metabolito M6G que se acumula durante la insuficiencia renal es el causante de la depresión respiratoria que se ha observado en pacientes con insuficiencia renal. A pesar de la diálisis, el efecto es prolongado, probablemente por la disminución de la difusión desde el SNC. En pacientes crónicos se ha demostrado que la morfina es menos tolerada que la hidromorfona211,214,216,217.
Dependiendo del grado de la insuficiencia renal se pueden ajustar las dosis según el aclaramiento de creatinina: entre 20-50 ml/minuto, 75% de la dosis; entre 10-20 ml/minuto, 50% de la dosis.
Insuficiencia hepática
I4. Se recomienda no usar midazolam en infusión continua en pacientes cirróticos.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. En los pacientes con insuficiencia hepática, la vida media de eliminación del midazolam aumenta entre 2 y 3 veces, y el aclaramiento disminuye en un 50%. Se ha demostrado encefalopatía hasta 6 horas después de su administración en pacientes cirróticos Child A o B, en infusión para la sedación en la endoscopia digestiva. Sin embargo, puede utilizarse como sedante en pacientes cirróticos, para endoscopia de vías digestivas altas, en dosis de 30 a 50 µg/kg en pacientes Child A o B3,218,219,221-223.
¿Cuáles son los medicamentos que se pueden utilizar?
Insuficiencia renal
I5. Se recomienda el uso de remifentanilo.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación: El remifentanilo se metaboliza rápidamente a través de las esterasas plasmáticas inespecíficas. El principal metabolito del remifentanilo, con un grupo ácido carboxílico, aparece en la orina en un 90%. La vida media de este metabolito es superior a la del remifentanilo, pero carece prácticamente de efecto. La vida media de eliminación y el aclaramiento están aumentados en la insuficiencia renal. En comparación con los enfermos sin insuficiencia renal, en los pacientes críticos la concentración plasmática es un 30% mayor después de una dosis de carga, pero el tiempo de recuperación es similar después de suspendida la infusión por 72 horas211,224,225.
I6. Se recomienda el uso de hidromorfona, reduciendo su dosis y monitorizando los signos de excitación del SNC y los estados confusionales.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. La hidromorfona se glucoroniza en el hígado a un metabolito activo de eliminación renal, que aumenta sus niveles plasmáticos hasta cuatro veces durante insuficiencia renal. Muy probablemente este metabolito es el responsable de los efectos adversos excitatorios sobre el SNC (mioclonías, agitación y confusión) que se han comunicado. Durante la diálisis se disminuye la concentración plasmática hasta en un 40%, pero se desconoce si el medicamento es dializable o no3,211,214,216,217,226.
I7. Se recomienda el uso de fentanilo, comenzando con una dosis de carga más baja en pacientes con FG inferior a 50 ml/minuto.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. El fentanilo sufre biotransformación hepática por oxidación a metabolitos inactivos. No se sabe si es dializable. En la insuficiencia renal disminuye su aclaramiento en relación con el aclaramiento de la creatinina, exhibiendo un perfil farmacológico más seguro que la morfina o la hidromorfona. Se han descrito casos de sedación prolongada y depresión respiratoria en pacientes con infusión continua de fentanilo3,211,214,216,217,226.
I8. Se recomienda el uso de dexmedetomidina, disminuyendo la dosis de carga y ajustando la infusión según la respuesta clínica.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. La dexmedetomidina tiene un metabolismo hepático por glucoronización y eliminación renal de sus metabolitos inactivos. Su vida media de eliminación es menor en la insuficiencia renal crónica. A pesar de esto, el tiempo de recuperación es mayor por el pico de concentración plasmática que ocurre con la dosis de carga o por la disminución de la difusión desde el SNC hacia el compartimiento central. El aclaramiento y el volumen de distribución son similares entre pacientes sanos y pacientes con insuficiencia renal crónica. No se sabe si es dializable211,227,228.
I9. Se recomienda el uso de midazolam sólo para períodos inferiores de 48 a 72 horas, reduciendo la dosis a un 50%.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. El midazolam tiene metabolismo hepático por oxidación a hidroxi-midazolam (equipotente), cuya eliminación es renal. Se acumula en pacientes con insuficiencia renal crónica e induce una sedación prolongada. El midazolam no es dializable pero sus metabolitos sí lo son. La depuración extrarrenal continua previene la acumulación de su metabolito activo. Puede usarse en pacientes con insuficiencia renal crónica disminuyendo la dosis3,217.
I10. Se recomienda el uso de loracepam, monitorizándose la concentración de propilenglicol, ácido láctico, osmolaridad sérica y la brecha (gap) osmolar, especialmente en infusiones de más de 72 horas.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. El loracepam tiene un metabolismo hepático por conjugación a metabolito inactivo, el cual es eliminado por el riñón. En la insuficiencia renal crónica la vida media de eliminación se prolonga, pero el aclaramiento es semejante al de los pacientes sanos. No es dializable ni ultrafiltrable. El propilenglicol (dializable), excipiente del vial del loracepam, es responsable de la acidosis metabólica y del empeoramiento de la función renal que se ha observado en pacientes con FG inferior a 50 ml/minuto3,98,217,229.
I11. Se recomienda el uso del propofol, aumentando su dosis al inicio de la diálisis y monitorizando los niveles séricos de triglicéridos después de 12 horas de infusión continua.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. El propofol tiene un metabolismo hepático y extrahepático por glucoronización y sulfuronización a metabolitos inactivos. No es dializable y su farmacocinética y farmacodinamia no se alteran significativamente en pacientes con insuficiencia renal crónica. Durante la diálisis se debe aumentar la dosis, debido a la disminución de la concentración plasmática por hemodilución y unión de la albúmina a los filtros. Igualmente, se requiere menos dosis en la infusión continua para sedación, la cual, si es superior a 12 horas, ocasiona un aumento significativo de triglicéridos, por lo cual está recomendada la monitorización estrecha3,230-232.
I12. Se recomienda el uso de haloperidol en pacientes con delirio, disminuyendo su dosis en un 30%.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. El haloperidol tiene un metabolismo hepático por oxidación. Su metabolito activo es responsable del extrapiramidalismo. Su vida media en sujetos sanos es de 18 a 54 horas, pero no se conoce su valor en pacientes con insuficiencia renal crónica, ya que no hay estudios de farmacocinética y farmacodinamia en esos pacientes. La hipomagnesemia y la hipocalemia resultantes después de la diálisis pueden aumentar el riesgo teórico de taquicardia ventricular polimorfa3,217,233,234.
Insuficiencia hepática
I13. Se recomienda el uso de remifentanilo, disminuyendo su dosis y con vigilancia de la ventilación.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. Debido a su metabolismo y eliminación, el remifentanilo es el opioide de elección en el paciente con disfunción hepática. Sin embargo, la ventana terapéutica entre la analgesia y la depresión respiratoria es estrecha, por lo cual se debe realizar un control estricto de la respiración, en los pacientes que no estén con VM3,224,235,236.
I14. Se recomienda el uso de fentanilo, reduciendo su dosis de mantenimiento.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. El aclaramiento y la vida media de eliminación del fentanilo están prolongadas, acumulándose, por lo que se debe disminuir su dosis. No tiene metabolitos activos Está indicado su uso en pacientes con insuficiencia hepática reduciendo su dosis, aunque no existen datos que guíen su dosificación en la insuficiencia hepática. Se ha utilizado en pacientes con varices esofágicas sangrantes, disminuyendo la respuesta hemodinámica a la IT3,237.
I15. Se sugiere el uso de morfina e hidromorfona en dosis reducidas y fraccionadas, con observación clínica estrecha.
Grado de recomendación débil. Nivel de evidencia bajo (2C).
Justificación. Estudios farmacológicos sobre la morfina en pacientes cirróticos han demostrado que su aclaramiento está disminuido, y su vida media de eliminación y el volumen de distribución aumentados. Este medicamento puede precipitar una encefalopatía hepática. Existen algunas comunicaciones de su uso por vía epidural única en pacientes cirróticos Child A sin coagulopatía (3-5 mg), para el control del dolor post-operatorio. También se han descrito algunos casos de infusión continua de 2 mg hora para el tratamiento del dolor post-operatorio3,215,220,223,238,239. No hay una clara recomendación para su uso, ya que no tiene un perfil farmacológico seguro y requiere de una vigilancia estrecha para su administración216.
La hidromorfona, por su gran metabolismo hepático, puede aumentar la biodisponibilidad en presencia de disfunción hepática, precipitar la aparición de encefalopatía hepática y de depresión respiratoria. Su perfil de seguridad no ha sido evaluado en pacientes con disfunción hepática3,226.
I16. Se sugiere el uso de dexmedetomidina, como terapia coadyuvante, en pacientes cirróticos con síndrome de abstinencia, cuando el manejo convencional fracasa. Se debe reducir la dosis.
Grado de recomendación débil. Nivel de evidencia bajo (2C).
Justificación. Un estudio en pacientes cirróticos demostró un aumento de la vida media y del volumen de distribución de la dexmedetomidina, con prolongación de su aclaramiento, en comparación con los sujetos sin insuficiencia hepática. Se ha comunicado su utilidad en los pacientes alcohólicos con síndrome de abstinencia, que no han respondido adecuadamente al tratamiento convencional3,228,240,241.
I17. Se sugiere el uso de loracepam en pacientes con síndrome de abstinencia alcohólica.
Grado de recomendación débil. Nivel de evidencia bajo (2C).
Justificación. El loracepam, como todas la benzodiacepinas, puede precipitar la aparición de encefalopatía hepática. Su aclaramiento está disminuido en pacientes cirróticos. Puede utilizarse en pacientes con síndrome de abstinencia alcohólica, como benzodiacepina de primera línea para la prevención de las convulsiones242-244.
I18. Se recomienda el propofol como hipnótico de elección en el manejo de pacientes con insuficiencia hepática en dosis de 50 µg/kg por minuto.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
I19. Se recomienda el propofol como hipnótico de elección en el manejo de pacientes con insuficiencia hepática fulminante que requieren IT y control de la hipertensión endocraneal.
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. La vida media de eliminación del propofol y su aclaramiento se ven poco afectados en la insuficiencia hepática, pero su volumen de distribución se incrementa al doble. Comparado con sujetos sanos, su tiempo de recuperación es más prolongado. Proporciona una mejor calidad de sedación que el midazolam y un despertar más rápido con menor disfunción psicomotora cuando se ha usado para sedación en la endoscopia digestiva alta. Se recomienda su uso para sedación en procedimientos de corta duración3,221,223. También se ha demostrado que disminuye la PIC en los pacientes con insuficiencia hepática fulminante245-247.
I20. Se recomienda el uso del haloperidol en los pacientes cirróticos con delirio. Se debe iniciar con dosis menores de las recomendadas en pacientes sin insuficiencia hepática, y se deben monitorizar las alteraciones electrolíticas y electrocardiográficas (específicamente el intervalo QT).
Grado de recomendación fuerte. Nivel de evidencia bajo (1C).
Justificación. No se conocen estudios farmacocinéticos del haloperidol en la insuficiencia hepática. Se ha utilizado en pacientes alcohólicos con delirio, utilizando dosis menores que en pacientes sin lesión hepática. Se han comunicado casos de taquicardia polimorfa en enfermos cirróticos, asociada a hipokalemia o hipomagnesemia234,248-250.
El la tabla 10 se detallan las dosis de medicamentos ajustadas al tratamiento de la insuficiencia renal y hepática.
J. Paciente que requiere procedimientos especiales (traqueostomía, tubos o sondas torácicas, lavado peritoneal, curas y desbridamiento de heridas o quemaduras)
¿Cuáles son los medicamentos indicados para efectuar estos procedimientos?
J1. Se sugiere un analgésico opiode (fentanilo o remifentanilo) asociado a un agente sedante (propofol, midazolam) para la realización de procedimientos especiales. Las dosis deben modificarse teniendo en cuenta el uso previo de otros sedantes y analgésicos.
Grado de recomendación débil. Nivel de evidencia bajo (2C).
Justificación. Ningún medicamento, o combinación de ellos, ha sido evaluado apropiadamente para la anestesia o analgesia en procedimientos especiales en la población de pacientes de UCI.
Para los procedimientos menores realizados en la UCI, hay que tener en cuenta qué sedantes, hipnóticos o analgésicos está recibiendo el paciente antes de practicar el procedimiento. Entre las alternativas se pueden considerar los bloqueos nerviosos o las infiltraciones de anestésicos locales, o administrar bolos del 25 al 50% de la dosis basal de opioide que el enfermo esté recibiendo.
Cuando se prevea una sedación corta (menos de 24 horas) se usará propofol en bolo. Si se prevé que la sedación posterior al procedimiento será prolongada (48 horas o más) se utilizará como primera elección midazolam o loracepam.
J2. Se sugiere no usar de forma rutinaria relajantes neuromusculares en la realización de procedimientos especiales en la UCI.
Grado de recomendación débil. Nivel de evidencia bajo (2C).
Justificación. Los relajantes neuromusculares sólo deben ser usados en casos especiales en los que el procedimiento lo precise para su ejecución correcta y segura (procedimientos abdominales, algunas traqueostomías, fibrobroncoscopia) o cuando los pacientes requieran protección cerebral (hipertensión endocraneal).
¿Cuándo están indicadas las técnicas de anestesia regional para el manejo del dolor en la Unidad de Cuidados Intensivos?
J3. Se recomienda el uso de la analgesia regional en el post-operatorio de la toracotomía y de la cirugía tóraco-abdominal mayor y en el trauma torácico.
Grado de recomendación fuerte. Nivel de evidencia alto (1A).
Justificación. La analgesia regional puede ser de utilidad en algunos pacientes seleccionados de la UCI para el manejo de trauma de tórax (fracturas costales múltiples, fracturas de esternón y contusión pulmonar), del dolor post-operatorio de la cirugía torácica y en intervenciones tóraco-abdominales mayores251,252.
¿Qué técnica de analgesia regional se recomienda para el manejo de dolor en la Unidad de Cuidados Intensivos?
J4. Se recomienda el abordaje peridural continuo, como la técnica de elección de analgesia regional en el post-operatorio de la toracotomía, cirugía tóraco-abdominal y trauma de tórax. El abordaje paravertebral con infusión continua es una alternativa a la vía peridural en los pacientes en post-operatorio de toracotomía.
Grado de recomendación fuerte. Nivel de evidencia alto (1A).
Justificación. La técnica más antigua y difundida es la analgesia peridural, que, en comparación con la analgesia endovenosa con opiodes en bolos o PCA, proporciona un adecuado control analgésico, facilidad para realizar fisioterapia respiratoria, disminución del tiempo de VM y de la incidencia de neumonía nosocomial251-253.
Los resultados de los ensayos que han comparado la técnica para-vertebral con la peridural muestran la equipotencia analgésica de los dos procedimientos, pero con menores tasas de efectos adversos como hipotensión, náusea, vómito y retención urinaria en el abordaje paravertebral254-257.
J5. Se sugiere el bloqueo intercostal en post-operatorio de toracotomía.
Grado de recomendación débil. Nivel de evidencia moderado (2B).
Justificación. Al comparar el bloqueo intercostal con la analgesia peridural, se observa una disminución del consumo de opiodes (PCA) y de la incidencia de retención urinaria cuando se utiliza la técnica intercostal en toracotomía programada258.
K. Estrategias no farmacológicas o terapias complementarias
¿Qué usar para modular las condiciones externas que pueden afectar la tranquilidad del paciente: ruido, vigilia-sueño, visitas, conversaciones inadecuadas?
K1. Se debe promover el sueño en la UCI, para lo que se tomarán todas las medidas necesarias, en especial las medidas no farmacológicas.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. El sueño es importante para la recuperación de los pacientes. Medidas objetivas y subjetivas de la calidad del sueño en la UCI muestran una importante alteración del sueño. Esta privación es un estrés adicional, que puede acarrear consecuencias adversas como el compromiso del sistema inmune, humoral y celular, el incremento del consumo de oxígeno y la producción de CO2 y la alteración de la termorregulación259,260.
Entre las causas que pueden producir la alteración del sueño en los pacientes que se encuentran en la UCI están las evaluaciones médico-enfermería, las pruebas diagnósticas, el ruido, la luz nocturna, el dolor, la incomodidad y los procedimientos invasivos261-263.
Es importante que, en lo posible, se respete el sueño de los pacientes que son admitidos en la UCI. Para ello se puede recurrir a medidas complementarias para promover el sueño como: control de la luz ambiental, masaje, musicoterapia264, sincronización de las actividades con ciclo circadiano, disminución de ruido265. Es importante la valoración de la enfermera o el uso de una escala para el control del sueño266.
K2. Se recomienda tomar todas las medidas necesarias para la disminución del ruido en la UCI. Una medida complementaria puede ser el uso de tapones auriculares, para así disminuir la percepción del ruido.
Grado de recomendación fuerte. Nivel de evidencia débil (1C).
Justificación. El ruido en la UCI proporciona un ambiente hostil para el paciente, con la consecuente alteración del sueño y la aparición de ansiedad260-263,265,267-269
El ruido en la UCI es producido por alarmas, ventiladores mecánicos, teléfonos y conversaciones del personal. Los niveles por encima de los 80 decibelios deben ser evitados y los niveles por debajo de 35 decibelios favorecen el sueño270. Una medida complementaria puede ser el uso de tapones auriculares para disminuir la percepción de ruido por parte del paciente3,260.
K3. Se recomienda respetar, en la medida de lo posible, el ritmo vigilia-sueño, disminuyendo la intensidad de la luz por la noche, así como las intervenciones de enfermería o los procedimientos.
Grado de recomendación fuerte. Nivel de evidencia débil (1C).
Justificación. El ritmo de vigilia-sueño debe ser respetado en la medida de lo posible, tratando de tener durante la noche la menor cantidad de alteraciones del sueño por procedimientos, así como brindar un ambiente con la menor cantidad de luz posible. El uso de una guía que promueva el control del ruido y de la luz nocturna en la UCI debería ser implementado271.
¿Cuándo y qué técnicas de relajación y masaje se pueden usar?
K4. Los masajes pueden ser usados como una alternativa o adyuvante de la terapia farmacológica.
Grado de recomendación fuerte. Nivel de evidencia débil (1C).
Justificación. Masajes en la espalda por un promedio de 5 a 10 minutos promueven la relajación y mejora del sueño272, al igual que los masajes en los pies durante 5 minutos273. La combinación de masajes con acupresión ha mostrado los mismos beneficios274.
¿Cuándo usar la musicoterapia?
K5. Se recomienda la musicoterapia en los pacientes admitidos en la UCI, en especial en los que reciben VM.
Grado de recomendación fuerte. Nivel de evidencia moderado (1B).
Justificación. La musicoterapia puede contribuir a la relajación y disminución del dolor de los pacientes en la UCI. La música puede enmascarar el ruido. En el postoperatorio de cirugía cardíaca la audición de música durante el primer día se asoció a una disminución de la sensación de molestia por el ruido, de la frecuencia cardíaca y de la presión arterial sistólica275. Un efecto similar se ha obtenido en pacientes oncológicos admitidos en la UCI276.
En los pacientes con VM, la musicoterapia se asocia a una disminución de la ansiedad, de la presión arterial sistólica y diastólica, y de la frecuencia cardíaca277-283. No obstante, se requieren mayores estudios para concluir que la musicoterapia es efectiva en todos los grupos de pacientes. Dado que la musicoterapia es una intervención sin efectos adversos, y tiene un bajo coste, debería ser considerada en las medidas de control de la ansiedad y el ruido en la UCI.
K6. Se recomienda informar al paciente sobre su enfermedad y los procedimientos que se le realizarán.
Grado de recomendación fuerte. Nivel de evidencia débil (1C).
Justificación. La falta de información o el manejo inadecuado de la información que recibe el paciente favorecen el incremento de la ansiedad284. No hay estudios apropiados sobre cómo informar a los enfermos en la UCI. Un mejor entendimiento de su enfermedad y de las intervenciones que se realizan puede mejorar su colaboración y disminuir la ansiedad. Asimismo, parece razonable evitar las conversaciones médicas o de enfermería inadecuadas que pueda escuchar el paciente.
Financiación
El desarrollo de la guía fue patrocinado por Hospira Latinoamérica.
Declaración de conflicto de intereses
Los miembros del grupo Consenso no han expresado ningún conflicto de intereses con el desarrollo de la presente guía.
El apoyo recibido de Hospira Latinoamérica para el desarrollo de esta guía no ha influido en las recomendaciones finales.
AGRADECIMIENTOS
Al Centro de Estudios e Investigación en Salud-CEIS, Fundación Santa Fe de Bogotá (Colombia), por haber facilitado sus dependencias y el tiempo necesario para la participación en el desarrollo de las guías.
A Ludovic Revaiz, MD. y a Martha Delgado, MD. (Colombia) por realizar la búsqueda de la bibliografía, además de brindar asesoría en la metodología.
A María Ximena Beltrán, MD por colaborar en la edición de la guía.
A Carlos Salas, MD (anestesiólogo-intensivista de la Fundación Valle de Lilli; Cali (Colombia) y a Ricardo Buitrago, MD (internista-cardiólogo de la Fundación Abood Shaio, Bogotá (Colombia) por su colaboración en la búsqueda de información para la sedoanalgesia de pacientes en post-operatorio de cirugía cardíaca.
A Robert Waite, Pharm D (Farmacología Clínica-Cuidados Intensivos del Orlando Regional Medical Center, Profesor Asistente de Medicina, Universidad de la Florida) y a Gail Gesin, Pharm D (Farmacología Clínica-Cuidados Intensivos del Orlando Regional Medical Center), por su colaboración en la búsqueda de información para elaborar las recomendaciones de la sedoanalgesia en pacientes con condiciones especiales.
Correspondencia: Dr. E. Celis-Rodríguez.
Transversal 5 C Nº 127-70.
Torre 5 Apto. 102.
Cerros de Country.
Bogotá-Colombia.
Correo electrónico: famcelis1@cable.net.co
Manuscrito aceptado el 23-VII-2007.