INTRODUCCIÓN
La implantación de stent se ha convertido en el tratamiento estándar de pacientes con estenosis coronarias susceptibles de angioplastia; sin embargo, la reestenosis intrastent (RIS) continúa siendo una limitación de su efectividad a largo plazo1,2. La proliferación neointimal es el principal mecanismo de la RIS3. Los stent liberadores de fármacos (SLF) intentan evitar esta proliferación liberando localmente fármacos que actúan en diferentes fases del ciclo celular4.
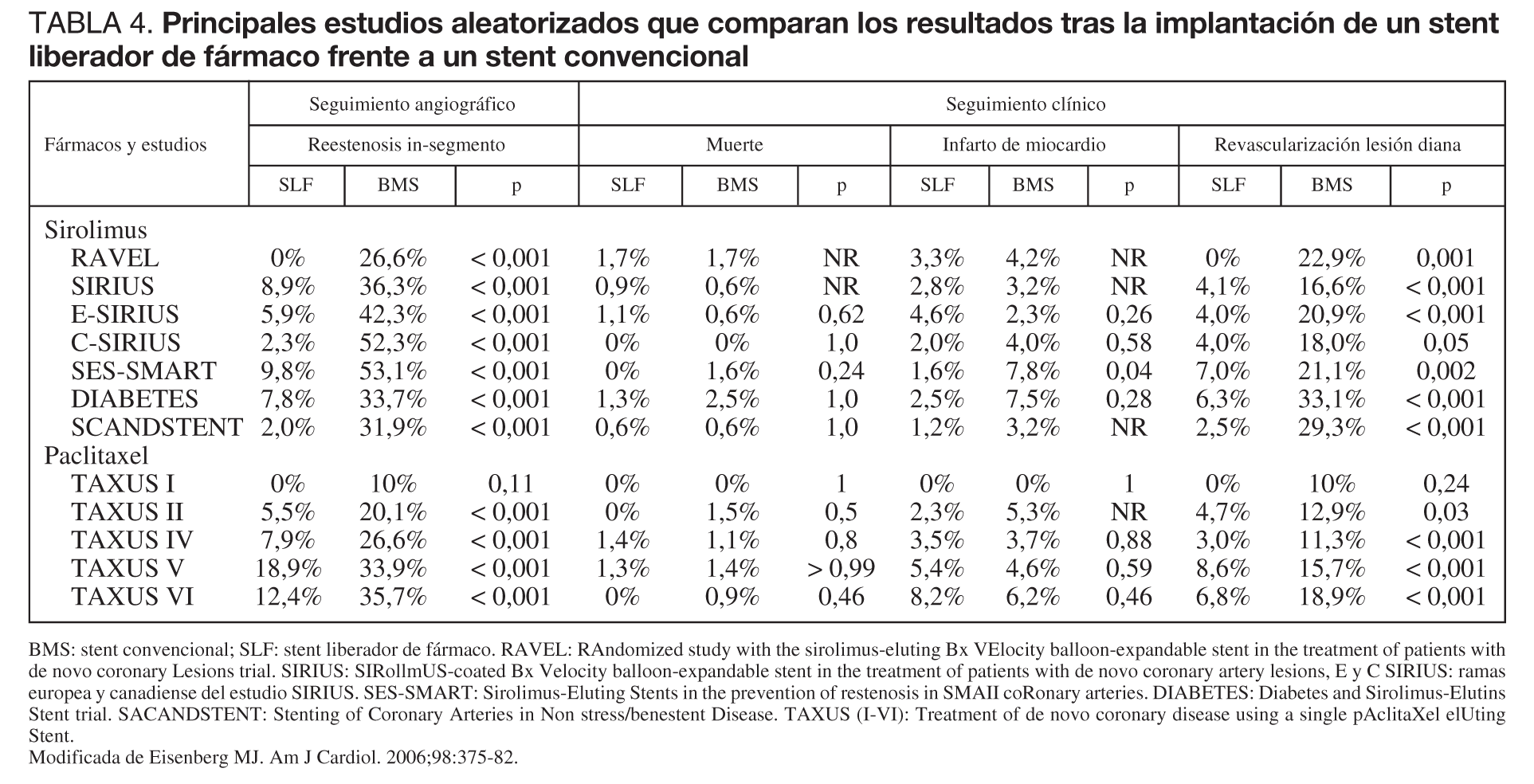
La efectividad, seguridad y superioridad de los stent recubiertos (frente a los convencionales) han sido probadas en múltiples ensayos clínicos (RAVEL, SIRIUS, E-SIRIUS, C-SIRIUS para stent recubiertos de rapamicina5-8 y TAXUS I, II, IV y VI para los recubiertos de paclitaxel9-11 por citar algunos de los estudios más relevantes) consiguiendo disminuir significativamente la tasa de reestenosis hasta un 0-18% según el tipo de lesión y el paciente sobre el que se actúa. En el estudio RESEARCH, con una tasa de reestenosis del 7,9% tras implantar stent recubiertos de rapamicina se describen como predictores angiográficos de reestenosis a los 6 meses: el tratamiento de RIS (19,6%); la lesión ostial (14,7%); la longitud del stent, más de 26 mm (13,9%); el diámetro de referencia, inferior a 2,17 mm (10,3%) y la arteria diferente a la descendente anterior (10,8%), como factor clínico la diabetes mellitus (14,3%)12.
Pero estos beneficios implican el éxito inicial en su implantación, y aunque en la práctica diaria la impresión subjetiva de los cardiólogos intervencionistas es que en determinadas circunstancias es más difícil implantar un SLF que uno convencional, no hemos encontrado en la literatura revisada hasta la fecha la tasa de éxito o fracaso en su implantación ni los factores relacionados con la misma in vivo.
Dado el elevado precio de los SLF, el intento fallido en su implantación tiene repercusiones económicas importantes. Por ello, tiene interés la identificación de los pacientes en los que es más probable que fracase la implantación de este tipo de stent.
El objetivo del estudio fue evaluar la proporción de procedimientos en los que fracasa la implantación de un SLF, así como identificar las variables asociadas con este hecho.
PACIENTES Y MÉTODOS
Población de estudio
Entre febrero de 2002 y marzo de 2005 se intentaron implantar SLF en 1.323 lesiones en el Hospital Clínico San Carlos de Madrid. Se evaluó la tasa de fracaso de su implantación y los factores relacionados. En nuestro centro, las indicaciones aceptadas para el uso de los stent recubiertos son: localización de la lesión en el tronco coronario izquierdo, descendente anterior proximal o en el injerto de la vena safena; longitud a tratar superior o igual a 20 mm, recanalización de una oclusión crónica, tratamiento del RIS y vaso pequeño (inferior a 2,5 mm de diámetro), pacientes diabéticos, y los incluidos en algún ensayo clínico. La intención de tratar con stent directo o predilatación depende de las preferencias del hemodinamista, pero en general se han evitado los stent directos en las lesiones complejas con calcificación severa, angulación excesiva, oclusiones crónicas, etc., por ser variables consideradas predictoras de fallo en la implantación de un stent directo13.
Procedimiento
El acceso en la mayoría de los casos (81%) fue por la arteria femoral (el resto se realizaron por radial o braquial), con catéter de 6F, salvo en los casos que se preveía la necesidad de utilizar dispositivos adicionales (rotablator, dispositivos de protección distal) o bifurcaciones en las que se pretendía un tratamiento con técnicas complejas (7 u 8F). A todos los pacientes se les administró una dosis de heparina ajustada a su peso de 70-100 UI/kg en función de que el tratamiento fuera concomitante o no con inhibidores de la glucoproteína IIb-IIIa (abciximab o tirofiban), y bolos adicionales de heparina si se precisaban en función del control del ACT (tiempo de activación del coágulo). Los pacientes estaban pretratados con ácido acetilsalicílico (AAS) y clopidogrel, en el caso de que no tomaran previamente clopidogrel se les administraba una dosis de carga de 300-600 mg periprocedimiento.
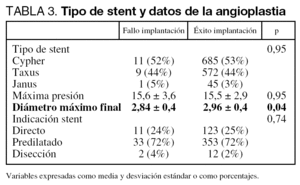
En cuanto al tipo de SLF utilizado, en la actualidad existen casi 20 tipos diferentes comercializados en Europa, pero en el período de estudio se utilizaron los siguientes tres tipos de SLF: Taxus Express (Boston Sci), Cypher (Cordis Corp.) y Janus (Sorin group), que liberan paclitaxel, rapamicina (sirolimus) y tacrolimus, respectivamente.
Análisis estadístico
El análisis estadístico se realizó con ayuda del programa SPSS 12.0 (Chicago, IL). Las variables continuas se han expresado como media ± desviación estándar, o mediana y rango intercuartílico. Las variables categóricas se expresan en porcentajes. Las variables continuas se han comparado mediante la prueba de la «t» de Student, o en los casos en que no presentaban distribución normal con la prueba de medianas. Las variables categóricas se comparan con la prueba de ji cuadrado o exacta de Fisher. El nivel de significación estadística se estableció en p < 0,05.
RESULTADOS
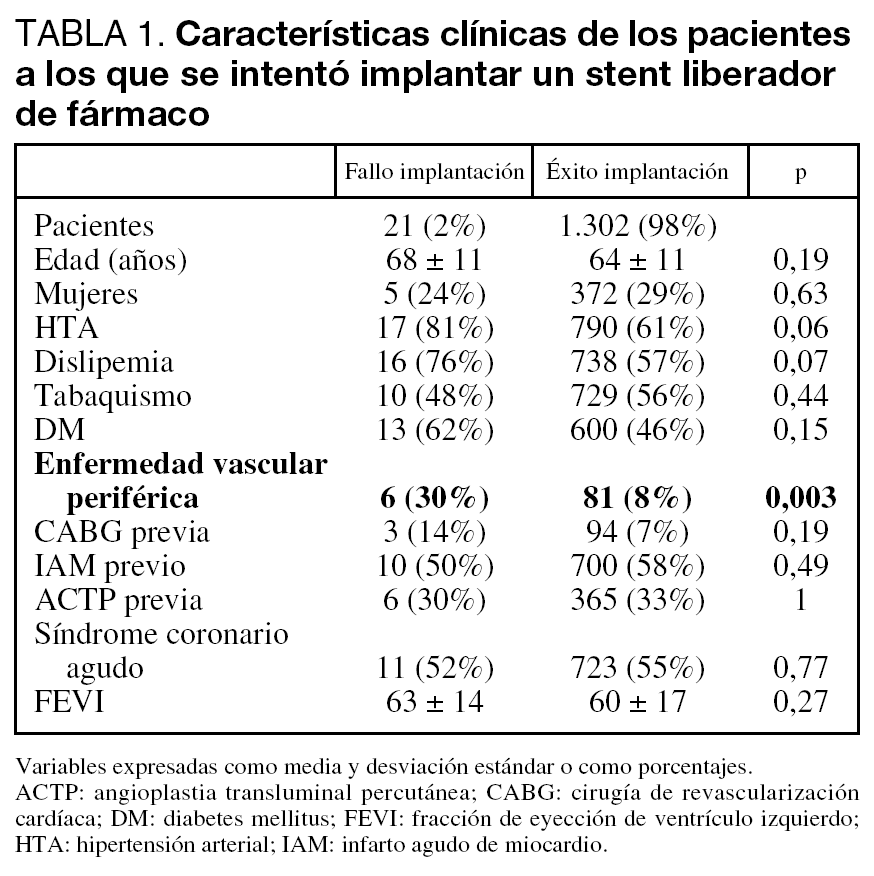
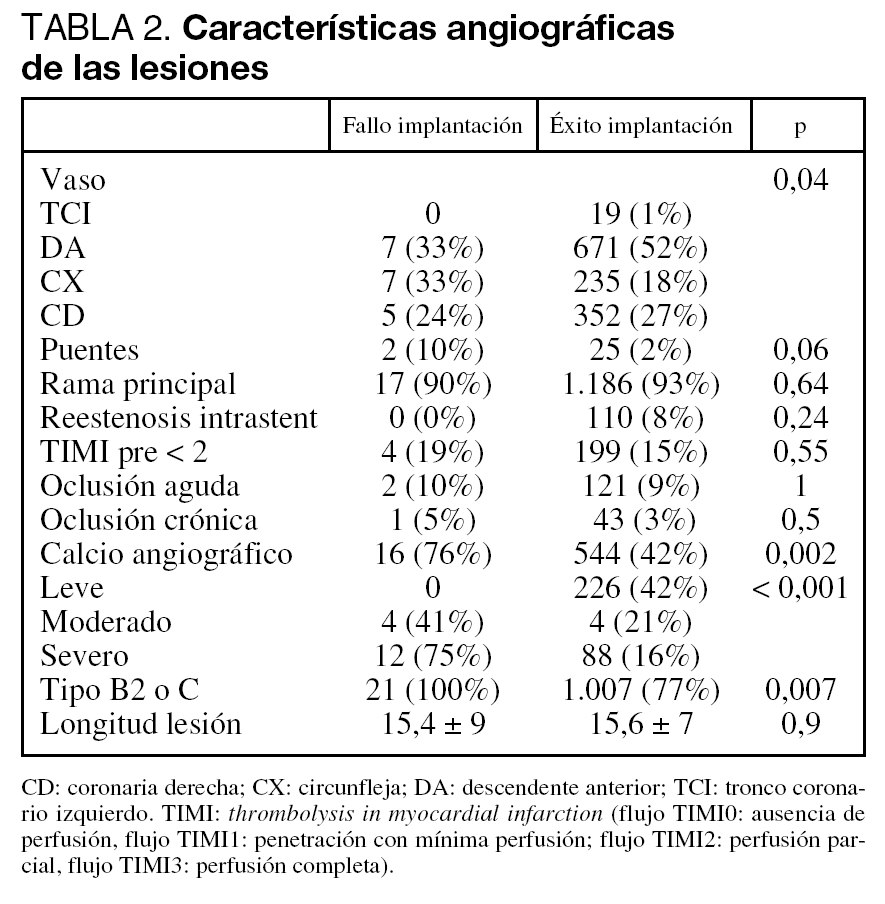
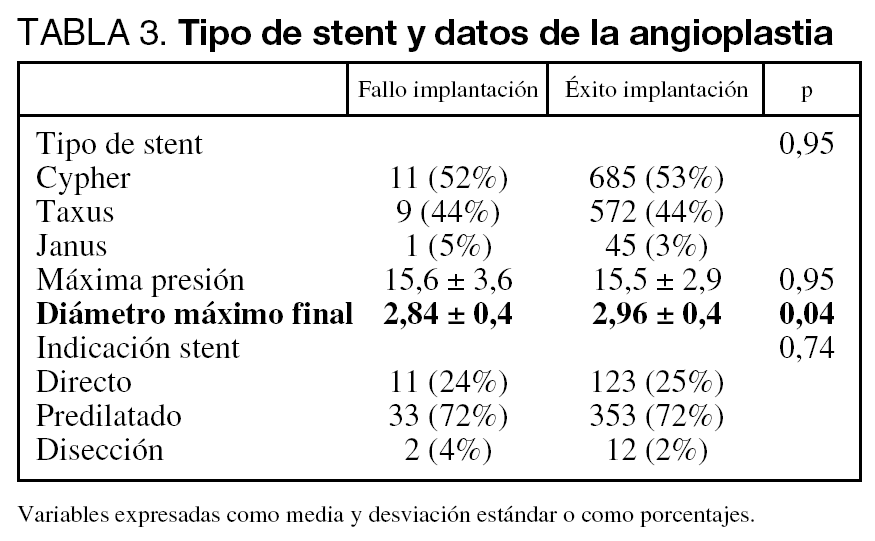
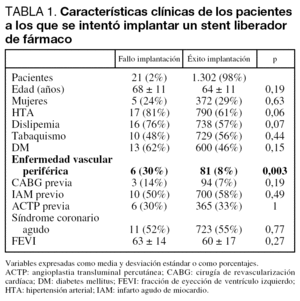
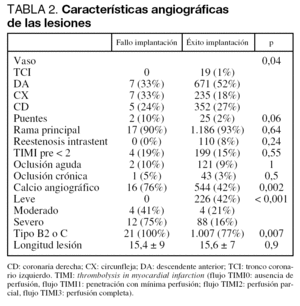
En la tabla 1 se recogen las características clínicas de los pacientes a los que se intentó implantar un SLF, en la tabla 2 las características angiográficas de las lesiones y en la tabla 3 el tipo de SLF y los datos del procedimiento.
Las diferencias en el porcentaje de uso de uno u otro tipo de stent recubierto se justifican por su introducción escalonada en nuestro hospital (los primeros disponibles fueron los Cypher, en segundo lugar los Taxus y finalmente los Janus; pero estos últimos únicamente para los pacientes incluidos en los ensayos JUPITER-II y DIABETES III).
De las 1.323 lesiones, en 21 (1,6%) no se consiguió implantar el SLF, debido a que no progresaba a nivel de la lesión (1,6%, 1,5% y 2,3% con Cypher, Taxus, y Janus, respectivamente; p = NS), en todos los casos el stent continuaba montado sobre el balón cuando se procedió a la retirada. En este mismo período hubo un fallo de implantación del 3,5% de stent convencionales (148 stent en 4.262 lesiones).
En comparación con el resto de los pacientes, aquéllos en los que fracasó la implantación del SLF tenían mayor frecuencia de arteriopatía periférica (30 frente a 8%; p = 0,003), calcio angiográfico (76 frente a 42%; p = 0,002), tortuosidad (71 frente a 20%, p < 0,01) y lesión de tipo B2/C de la American College of Cardiology/American Heart Association (ACC/ AHA) (100 frente a 77%; p = 0,007). Por otra parte, hubo una tendencia estadística a ser la arteria circunfleja el vaso a tratar (33 frente a 18%, p = 0,08). Los predictores independientes fueron: arteriopatía periférica (p = 0,004, odds ratio [OR] = 5,6 [intervalo de confianza (IC): 1,96-16,2]), calcio (p = 0,004, OR = 4,5 [IC: 1,45-14,14]) y tortuosidad de la arteria (p < 0,001, OR = 10,7 [IC: 3,97-28,7]).
En 17 de los 21 casos en los que no se pudo implantar el SLF se finalizó el procedimiento con un stent convencional (n = 9) o sólo con balón (n = 8), no consiguiéndose finalizar el procedimiento con éxito (procedimiento fallido) en los restantes 4 pacientes.
Durante el ingreso no hubo complicaciones cardíacas mayores (infarto de miocardio con o sin onda Q [considerándose parámetro diagnóstico de este último la elevación de creatincinasa (CK) y CK-MB al doble de los valores de referencia de nuestro laboratorio], muerte, o necesidad de nueva revascularización del vaso tratado) en ninguno de los pacientes en los que no se consiguió implantar el SLF, y tan sólo un paciente presentó una nefropatía inducida por contraste que prolongó el ingreso y se resolvió con fluidoterapia.
DISCUSIÓN
El fallo en la implantación de un stent puede ser más común en la práctica clínica de lo que generalmente suponemos, y este fracaso tiene lugar tanto con los stent convencionales como con los SLF (3,5 y 1,6% respectivamente según nuestra serie), pero es en estos últimos en los que tiene mayor trascendencia económica.
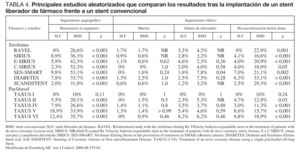
El coste de los SLF es, en España, casi 2 veces superior al de los stent convencionales1,2, si bien este coste se justifica en base a su menor tasa de reestenosis y de necesidad de revascularización posterior. La tasa de reestenosis tras la implantación de los stent convencionales supera el 20% y la necesidad de nuevos procedimientos de revascularización el 10%. En lesiones complejas y largas, vasos pequeños y pacientes diabéticos, la tasa de reestenosis con stent convencional es incluso superior al 50%4, hecho importante si tenemos en cuenta que es sobre estas últimas lesiones sobre las que actualmente tenemos que actuar en un gran número de pacientes, y por ello se centran en ellas las indicaciones de implantación de SLF aprobadas por la comunidad científica en base a los estudios multicéntricos. En la tabla 4 recogemos los datos de los estudios randomizados más relevantes que han comparado un SLF con un stent convencional (BMS) en diferentes escenarios, siendo favorable para los SLF la menor tasa de RIS y de necesidad de revascularización, pero llama la atención que no disminuyen la mortalidad ni la tasa de infarto. Si desglosamos los resultados obtenidos a los 6-12 meses cuando se comparan los dos principales stent recubiertos de «primera generación» (sirolimus frente a paclitaxel) entre sí, aún siendo muy buenos en ambos casos, parece haber una menor tasa de reestenosis con el sirolimus (6,2 frente a 10,8% p = 0,009), con un descenso del 40% de la necesidad de una nueva revascularización de la lesión diana, pero similar tasa de infarto agudo de miocardio (IAM) y muerte14. En un metaanálisis publicado por Kastrati también había una menor reestenosis en el grupo de sirolimus (9,3 frente a 13,1% p = 0,001) pero no se encontraron diferencias en la incidencia de eventos adversos en ambos grupos15. En cambio, en el REALITY, las diferencias no fueron estadísticamente significativas ni siquiera en cuanto a la tasa de reestenosis (9,6 frente a 11,1% p = 0,3116). Si además tenemos en cuenta que la presencia de estenosis binaria angiográfica no implica la necesidad de una nueva revascularización, salvo que haya indicación clínica, y que la tasa de reestenosis en ambos tipos de stent es muy baja, podemos decir que el debate continúa, avivado si cabe por la aparición en el mercado de una segunda generación de SLF.
Varios estudios muestran que aunque los costes intrahospitalarios fueron mucho mayores para el grupo de pacientes con SLF, la baja necesidad de revascularización posterior, ya en el primer año, hace que la relación coste-efectividad sea favorable2,3, incluso teniendo en cuenta el coste de la doble antiagregación más prolongada. Los análisis económicos de los estudios SIRIUS y TAXUS-IV han demostrado que gran parte del coste «extra» de los SLF se compensa con el ahorro derivado de la necesidad de nuevos procedimientos de revascularización17.
Nikolsky publica una serie con un 3,3% de fallo de implantación de stent convencionales por diferentes motivos (en el 81% de los casos no se consiguió que progresara el stent, en el 8,8% se liberó el stent del balón antes de llegar a la lesión y en el 0,3% hubo una embolización periférica del stent) registrando un 4% de complicaciones cardíacas mayores periprocedimiento en estos pacientes (IAM en 2 pacientes y necesidad de cirugía urgente en 3)18. En nuestra serie, la tasa de fallo es menor (1,6%), y afortunadamente no se han producido eventos cardíacos mayores periprocedimiento, el hecho de que no hayamos tenido ninguna "pérdida" de stent ni embolización distal puede atribuirse a los avances técnicos en el montaje de los stent. Una limitación probable, pero muy difícil de cuantificar, es que en base a la experiencia personal de cada hemodinamista se tienda a no elegir un determinado tipo de stent cuando se presenten circunstancias similares a las que había cuando el implante de un modelo concreto no progresó adecuadamente; esto podría justificar que incluso en nuestro propio centro sea mayor la tasa de fallo en la implantación de un stent convencional que en uno recubierto (3,5 frente a 1,6%).
Los stent a los que hacemos referencia en esta revisión son de la «primera generación» de stent recubiertos, con plataformas «más rígidas» que hacen difícil técnicamente su progresión en escenarios adversos (como son segmentos muy angulados y con calcificación importante), de hecho son precisamente estas variables las que han resultado predictoras de fallo de implantación. Probablemente con las nuevas generaciones de SLF (Taxus Liberté, Xcience V, Endeavor, etc.) consigamos una mayor tasa de implantación de SLF. Cabe esperar que en nuestra serie se hubiera podido implantar alguno de estos nuevos stent en los 9 casos en que no pudo progresar un SLF y sí se consiguió implantar un stent convencional "más flexible" sin otro cambio de material o estrategia que el propio stent (teóricamente podríamos reducir la tasa de fallo de implantación de SLF del 1,5 al 0,9%). Sólo en 9 de los 21 casos se pudo implantar otro stent "más flexible", por lo que probablemente en 12 casos era un problema de la arteria, y en 9 un problema del SLF. Por tanto, sólo en 9 casos (0,7%) se hubieran podido reducir los costes iniciales de haber intentado como primera opción otro tipo de stent.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
Correspondencia: Dra. M.C. Ferrer Gracia.
Sección de Hemodinámica y Cardiología Intervensionista.
Hospital Universitario Miguel Servet.
Paseo Isabel la Católica, 1-3.
50009 Zaragoza.
Correo electrónico: mcferrergracia@yahoo.es
Manuscrito aceptado el 21-II-2007.