INTRODUCCION
La pancreatitis aguda (PA) es una enfermedad de aparición frecuente pero, en general, de evolución benigna, que se resuelve de forma espontánea en la mayoría de los casos y con una mortalidad global inferior al 10%. Sin embargo, existe un número significativo de pacientes (hasta el 25% en algunas series) que desarrollan una pancreatitis necrosante (PN) caracterizada morfológicamente por una extensa inflamación en páncreas y retroperitoneo, con áreas de necrosis en la glándula y que evoluciona de forma progresiva (y en general sorprendentemente rápida) hacia un deterioro temprano de la función respiratoria, hemodinámica y renal, y acompañándose de una elevada morbimortalidad. Es este grupo de pacientes el que se verá beneficiado de su ingreso en la UCI para un tratamiento temprano y agresivo, siendo precisamente esta nueva tendencia en el tratamiento la que ha demostrado un mayor impacto sobre el pronóstico de la PN1.
FRACASO RENAL AGUDO Y PANCREATITIS AGUDA
El fracaso renal agudo (FRA) es un problema importante en la evolución de estos pacientes (es la causa de alrededor del 3% de episodios de necrosis tubular aguda)2 y uno de los que revisten mayor gravedad (la etiología pancreática es un factor de mal pronóstico en los pacientes con FRA ingresados en la UCI)3; y sin embargo, la incidencia de afectación renal en el seno de la PA se puede considerar baja (por debajo del 15%). No obstante, y pese a esta baja frecuencia de aparición, tiene una importante repercusión sobre el pronóstico del cuadro.
El hecho de que el tratamiento actual de la PN se base en una rehidratación agresiva (al ser el aumento de la permeabilidad del endotelio la alteración fisiopatológica inicial más relevante), debería haber supuesto un descenso en la aparición de FRA en estos pacientes al evitar la aparición de fracaso de origen prerrenal; sin embargo, esta expectativa no se ha cumplido.
Aunque la aparición aislada podría considerarse muy infrecuente (alrededor del 4% del total), se detecta una frecuencia relativamente elevada de aparición en el seno de un cuadro de disfunción orgánica múltiple (FMO) y en estas circunstancias implica un aumento alarmante de la mortalidad: del 70 al 80% frente al 8% en pacientes que no presentan afectación renal4. Un detalle que se debe tener en cuenta es lo infrecuente de que el riñón sea el primer órgano en fracasar (el 9% de los casos), presentando generalmente una afección más temprana y frecuente los sistemas respiratorio y hemodinámico5-7. Si distinguimos los casos en que el fracaso renal es moderado (con conservación de la diuresis y sin necesidad de tratamiento de depuración), la mortalidad se cifra alrededor del 30 al 40%, pero en los casos con fracaso renal establecido y con necesidad de tratamiento específico, esta cifra se eleva hasta el 95%4. Aparte de la repercusión en la morbilidad del cuadro, también afecta a su tratamiento (las técnicas de depuración son costosas en términos de economía y sobrecarga de trabajo) e implica un importante aumento de la estancia media de estos pacientes en la UCI8.
Otra característica del fracaso renal asociado con la PN es que no presenta un perfil definido que permita detectar a priori a los pacientes con mayor riesgo de desarrollar esta complicación; los únicos parámetros con capacidad de discriminación son los referidos a la gravedad del cuadro de PN (criterios de Ranson, APACHE II o número de fracaso de órganos) como una indicación más de la estrecha relación existente entre el fracaso renal y el cuadro de FMO que caracteriza la evolución de esta enfermedad4,8.
FISIOPATOLOGIA DEL FRACASO RENAL AGUDO
Esta estrecha relación se hace evidente si consideramos la fisiopatología de la PN. Sea cual sea el proceso patológico inicial que desencadena el cuadro, éste determina una inflamación local de la glándula que conlleva una hiperactividad leucocitaria y la activación de células endoteliales, que determi-nan la producción y la eliminación al plasma de concentraciones elevadas de interleucinas (IC) con desarrollo de un cuadro inflamatorio a distancia y, por tanto, aunque el proceso inicial es local, sus consecuencias se hacen rápidamente generalizadas9, y provocan el fracaso de los órganos mencionados, entre ellos el riñón. Las manifestaciones clínicas de esta afección (síndrome de respuesta inflamatoria sistémica [SRIS] y posterior desarrollo de FMO) son iguales a las de otros cuadros que tienen en común el provocar una activación y alteración del equilibrio en los sistemas orgánicos de respuesta inflamatoria (sepsis, quemaduras)10; de hecho esta evolución a FMO es la causa del 96% de las muertes causadas por la PN11. Toda esta cascada de episodios se desarrolla de forma muy temprana tras la agresión inicial (24-48 h), lo que dificulta seriamente cualquier intento terapéutico sobre estas alteraciones12.
Ya en los años ochenta, algunos autores definieron un patron hemodinámico en la PN muy similar al observado en pacientes con sepsis grave y lo atribuyeron al posible efecto de sustancias proinflamatorias liberadas por el páncreas necrótico13, aunque habría que esperar una década para empezar a conocer el papel de estas sustancias, las IL. Las sustancias clave en este proceso son la IL-1, 6 y 8 y el factor de necrosis tumoral alfa (TNF-α): inicialmente la activación de los leucocitos que infiltran la glándula provoca una producción elevada de IL-1 y TNF-α. Esta activación y posterior ampliación de la respuesta es la causa de las lesiones en diferentes órganos y de hecho, en fases más avanzadas, la producción se detecta también en órganos a distancia. Estos mediadores actúan sobre los macrófagos, activando la producción de IL-6 y 8 con ampliación del efecto sobre los neutrófilos, los cuales se agrupan en órganos diana y tras cualquier nuevo estímulo o agresión se activan en una segunda fase que es la que suele desencadenar el proceso evolutivo a FMO9,10,14.
Se ha descrito también una afectación vascular renal, explicable en parte por la hipovolemia, pero posiblemente también propiciada por un efecto patogénico directo sobre el árbol vascular renal. Ya en 1991, Satake en un estudio experimental en perros demostró que el líquido ascítico de animales afectados, al ser inyectado en animales sanos, provocaba una caída del flujo renal y el filtrado glomerular, concluyendo que este líquido debía contener sustancias nefrotóxicas15; este efecto sobre la circulación renal ha sido verificado posteriormente en repetidas ocasiones16,17. De forma reciente se han descrito fenómenos de apoptosis en células tubulares renales varias horas después de la inducción de PA, fenómeno que también es provocado mediante la infusión de líquido ascítico de animales afectados18. Otros factores que pueden contribuir al desarrollo de fracaso renal serían la hipovolemia inicial característica de estos pacientes y el hecho de que con relativa frecuencia puedan detectarse cuadros de rabdomiólisis y mioglobinuria complicando el curso de la PN19.
TRATAMIENTO DEL PACIENTE CON PANCREATITIS AGUDA NECROSANTE E IRA
Al valorar el tratamiento de la afección renal en estos pacientes, debemos considerar dos formas diferentes de presentación: una forma leve, con diuresis conservada y mejor pronóstico (posiblemente influenciada por la situación de hipovolemia) y una forma tardía, en relación a los fenómenos inflamatorios mencionados, que se presenta en el seno del cuadro de FMO y que presenta un pronóstico más sombrío.
En principio, el tratamiento del paciente con un cuadro leve no presenta ninguna característica diferencial, pero es importante tenerlo presente pues es quizá el único sobre el que nuestra actuación será rentable: un tratamiento temprano y agresivo, basado en la rehidratación temprana y la monitorización estrecha, podría detener el proceso a FRA establecido con lo que mejoraremos de forma significativa el pronóstico de estos pacientes.
Sin embargo, en los casos en que el cuadro se presenta como componente del FMO o evoluciona pese a nuestro tratamiento, generalmente será necesario realizar una terapia de sustitución renal, lo que complica de forma muy importante su tratamiento y ensombrece el pronóstico (la necesidad de tratamiento de depuración se acompaña de una mortalidad superior al 80%)4,20.
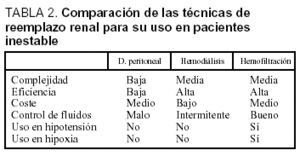
La decisión de realizar este tratamiento se ve afectada por una parte por el mal pronóstico que presentan, pero también como consecuencia de la dificultad de elegir la técnica de sustitución idónea. Se trata de pacientes con inestabilidad hemodinámica, hipoxia y con frecuencia alteraciones de la coagulación, lo que supone que en un porcentaje muy elevado de casos tanto la diálisis peritoneal como la hemodiálisis intermitente estén relativamente contraindicadas o bien no puedan usarse a pleno rendimiento, con el resultado de infradosificación o no tratamiento en absoluto (tabla 1)21. Otro punto muy importante que cabe considerar es que la hemodiálisis convencional no sólo es poco eficaz en estos pacientes o técnicamente poco factible (por el desequilibrio osmótico, hemodinámico y de la oxigenación que provoca), sino que se ha demostrado que el uso de las membranas de cuprofano usadas habitualmente condicionan una respuesta biológica intensa, con activación de fenómenos proinflamatorios en el huésped, lo que podría intensificar la cascada patológica del SRIS y empeorar el cuadro (incluso con aumento de la mortalidad)22-24.
La hemofiltración (HF) es una técnica de depuración que basa su funcionamiento en la eliminación de grandes cantidades de ultrafiltrado del plasma (de forma similar al funcionamiento del glomérulo renal) de modo que mediante el uso de membranas con gran capacidad de filtración y mediante aplicación de mecanismos de convección (la hemodiálisis intermitente basa su funcionamiento de forma preferente en la difusión), conseguimos un aclaramiento significativo de gran cantidad de sustancias (similar en determinadas circunstancias a la hemodiálisis intermitente y superior a la diálisis peritoneal)25-28.
Su principal ventaja radica en que al realizar una ultrafiltración, y por tanto un aclaramiento muy lento y mantenido, no provoca alteraciones hemodinámicas ni desequilibrio osmótico (y tampoco oxigenación), y por tanto es bien tolerada por pacientes muy inestables29. Por otra parte, las membranas usadas para HF presentan un perfil biológico mucho más neutro que las de celulosa; por tanto, no suponen un estímulo adicional para el sistema inflamatorio. Los tratamientos con técnicas de depuración continua y membranas biocompatibles han mejorado de hecho el pronóstico de otros grupos de pacientes, aunque no existen datos objetivos respecto su uso en la PN30. Por último, presenta menos requerimientos técnicos, lo que hace que sea fácilmente usada en las UCI sin necesidad de contar con medios sofisticados ni personal experimentado (tabla 2), por lo que se ha convertido en el tratamiento de sustitución renal de elección en estos servicios31.
Según estos argumentos, la HF se debe considerar el tratamiento de elección en los paciente inestables con PN que requieren sustitución renal: ha aumentado el espectro terapéutico, ha posibilitado el tratamiento de pacientes que antes de su desarrollo no hubieran podido ser tratados y ha hecho que este tratamiento pueda ser decidido y realizado por los mismos intensivistas que tratan al paciente, facilitando su prescripción.
LA HEMOFILTRACION EN EL TRATAMIENTO DE LA PANCREATITIS AGUDA NECROSANTE: INMUNOMODULACION E INTENTOS TERAPÉUTICOS DE CONTROL
Una vez determinado que el problema evolutivo más serio en la PN (y el factor patogénico causal de los cuadros más graves de FRA) es la aparición de una respuesta inflamatoria descontrolada, parece lógico que los esfuerzos terapéuticos se encaminen en esta dirección. Ya en los años setenta un grupo de pioneros sugirieron un cambio de estrategia en el planteamiento terapéutico de la PN: "disminuir o atenuar el proceso inflamatorio en el páncreas". Los primeros intentos se realizaron mediante el lavado peritoneal, que ha demostrado su utilidad en ensayos con animales (elimina mediadores de la inflamación pancreática a escala local, como la amilasa, la lipasa, la fosfolipasa A), pero no se ha visto refrendado de forma definitiva en la clínica32,33. Es gracias al desarrollo en el conocimiento de los mediadores inflamatorios (leucinas) y a la posibilidad de crear en el laboratorio anticuerpos específicos contra ellos o contra sus receptores biológicos que esta propuesta terapéutica ha comenzado a ser realmente prometedora. Hasta el momento se han ensayado actuaciones en anticuerpos anti-TNF-α, el uso de IL-1ra o IL-10, con buenos resultados en estudios con animales pero aún sin ensayos en humanos que puedan avalar su eficacia34,35.
La HF presenta algunas características que la hacen susceptible de ser usada para la eliminación de estas sustancias proinflamatorias. Las citocinas son sustancias de peso molecular medio (16-25.000 daltons) que se producen en cantidades extremadamente pequeñas y son estrechamente reguladas, por lo que concentraciones muy bajas en plasma presentan importantes efectos biológicos; por otra parte, son sustancias apocrinas, lo que supone que el exceso de producción descontrolado con salida de las mismas al plasma es el causante potencial de su efecto sobre órganos a distancia, por lo que un sistema de depuración plasmática eficaz podría neutralizar su efecto sistémico. Su peso molecular las hace susceptibles de ser eliminadas mediante convección (mecanismo básico de depuración de la hemofiltración); sin embargo, los sistemas de eliminación por difusión (diálisis convencional) son muy poco eficaces en su depuración, lo que explicaría el escaso éxito alcanzado con la hemodiálisis intermitente.
Existen datos contradictorios en la bibliografía respecto de la capacidad real de la hemofiltración para eliminar mediadores de la inflamación (TNF-α, IL-1, PAF [factor activador de las plaquetas], IL-6 y fracciones del complemento), pues aunque se ha demostrado aclaramiento de estas sustancias no siempre se ha podido demostrar que este aclaramiento tenga repercusión a escala sistémica. Esta eliminación no sólo se realiza mediante convección36-38 sino también mediante adsorción de estas sustancias a la membrana del sistema, donde quedan atrapadas de forma efectiva (este mecanismo podría de hecho ser más efectivo aún que la eliminación por convección)39. Sin embargo, existen datos a favor de un efecto beneficioso de la HF sobre la clínica y evolución de los pacientes con SRIS o FMO, contribuyendo de forma especial a la estabilización de los sistemas respiratorio y hemodinámico40-44, aunque no se han publicado datos referidos de forma concreta a pacientes con PN. Por último (aunque es un punto aún no probado) algunos autores sugieren que este tratamiento podría disminuir la mortalidad es pacientes con SRIS al detener el proceso evolutivo a FMO45,46.
LA HEMOFILTRACION EN EL TRATAMIENTO DE LA PANCREATITIS AGUDA NECROSANTE: EXPERIENCIA CLINICA Y EXPERIMENTAL
La experiencia acumulada hasta el momento con la depuración extrarrenal en el tratamiento de la PN es escasa. Miller et al47, en 1994, presentaron una serie retrospectiva de 7 casos a los cuales aplicaron hemofiltración veno-venosa continua (HFVVC) temprana (las primeras 24 horas tras la aparición de fracaso de 2 o más órganos) obteniendo unos resultados alentadores (supervivencia del 71%). Gebhardt et al48, este mismo año, hacen público un estudio en el que aplicaron HFVVC de alto flujo y balance cero a 11 pacientes con PN (APACHE II medio de 18) con supervivencia de 10 de ellos. Posteriormente no se han publicado nuevos resultados, pero en base a estos datos y a los argumentos fisiopatológicos en que se justifica el tratamiento, es cada vez más frecuente encontrar referencias a la HF como posible arma terapéutica en la PN4,10,49,50.
De forma reciente, Yekebas et al51 ha aplicado HFVVC en un modelo animal de PN demostrando un menor deterioro hemodinámico y gasométrico en los animales tratados frente al grupo control, así como una prolongación del tiempo de supervivencia de los mismos. Por otra parte, constatan una diferencia significativa en los valores séricos de TNF-α y fosfolipasa A en los diferentes grupos de animales, sugiriendo ésta como la causa más probable del efecto beneficioso del tratamiento. Para la realización del estudio, aplican una técnica de alto flujo y balance cero y es significativo el hecho de que los efectos son más evidentes en los animales tratados de forma temprana que en aquellos en que el tratamiento se inicia una vez aparece el deterioro clínico. Por otra parte, merece la pena mencionar que la capacidad de aclaramiento disminuyó de forma significativa durante el experimento, siendo un argumento más a favor de la existencia de fenómenos de saturación por adsorción en la membrana.
HEMOFILTRACION EN EL TRATAMIENTO DE LA PANCREATITIS AGUDA NECROSANTE
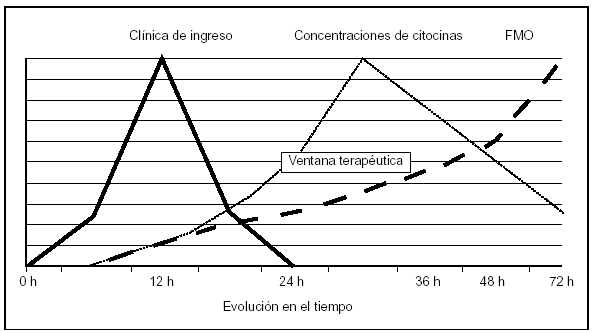
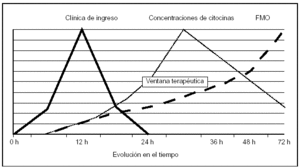
Es difícil hacer una indicación de tratamiento de la PN con HF en el momento actual. Existen argumentos de peso en favor del uso de esta técnica, pero son necesarios datos más concluyentes; sin embargo, estos estudios son de difícil diseño: por una parte, es complicado predecir qué pacientes desarrollarán una PN, ya que actualmente con los sistemas de evaluación de gravedad disponibles, catalogamos mal al 25% de los casos considerados graves; no es factible emplear un tratamiento agresivo y con algún riesgo si en el 25% de los casos la necesidad de su uso no está claramente establecida. Por otra parte, existen variaciones genéticas interindividuales que hacen imprevisible la respuesta del paciente al disbalance de los mediadores inflamatorios, lo que dificulta aún más la selección de pacientes. A favor del desarrollo de estudios está el hecho de que la TAC es un buen parámetro para cuantificar la necrosis (relacionada de forma directa con la aparición de respuesta inflamatoria)52 y que el inicio de la PN suele ser un episodio fácil de definir, haciendo factible el inicio de la terapia en el momento en que será más útil (fig. 1) circunstancia que no se presenta en los pacientes con respuesta inflamatoria alterada por otras causas (sepsis)10.
Figura 1. Efecto del tiempo sobre las posibilidades terapéuti cas en inmunomodulación. Relación con la evolución clínica, elevación sérica de mediadores y desarrollo de fracaso multior gánico. FMO: disfunción orgánica múltiple. (Adaptado de Norman12.)
Por este motivo, será necesario esperar la publicación de estudios concluyentes; no obstante, a la luz de los datos presentados podemos obtener conclusiones positivas. La HF es el tratamiento de elección para los pacientes con PN que presentan FRA y requieren tratamiento de sustitución y la mayoría de estos pacientes desarrollan el episodio de FRA en el seno de una respuesta inflamatoria descontrolada. Podemos, por tanto, optimizar su uso de forma que aumentemos al máximo la capacidad demostrada de la técnica para atenuar esta respuesta inflamatoria:
1. Aplicar el tratamiento en las etapas iniciales de la PN para disminuir el efecto nocivo de la respuesta inflamatoria alterada y no tras la aparición de fracaso multiorgánico, ya que en este momento la disminución de la respuesta sistémica no podrá detener la evolución y dificilmente afectará al pronóstico del cuadro.
2. Evitar el uso de membranas no biocompatibles (derivados de la celulosa), para no aumentar el estímulo inflamatorio.
3. Usar técnicas de hemofiltración (frente a dialfiltración) e intentar conseguir un volumen de ultrafiltrado elevado para mejorar la capacidad de aclaramiento convectivo de la depuración.
4. Hacer cambios frecuentes de los filtros para evitar el efecto de saturación de los mismos y optimizar la eliminación por adsorción en la membrana, ya que el uso prolongado de los filtros (más de 8 h) disminuye de forma significativa la capacidad de eliminación mediante adsorción.